Содержание
Введение
1. Осаждение
1.1 Высаливание
1.2 Изменение температуры и рН
1.3 Осаждение органическими растворителями
2. Коагуляция и флокуляция2.1 Цельные клетки
2.2 Остатки клеток и белки
3. Центрифугирование
3.1 Сигма-анализ
3.2 Центрифуги с роторами трубчатого типа
3.3 Многокамерные центрифуги
4. Хроматография
4.1 Адсорбция
4.2 Сорбция-десорбция
5. Электрофорез и центрифугирование
5.1 Электрофорез
5.2 Зональное ультрацентрифугирование
6. Отделочные операции
6.1 Обессоливание
6.2 Концентрирование
6.3 Сушка
7. Биологическая безопасность при промышленном производстве
7.1 Меры безопасности
7.2 Контроль окружающей среды
7.3 Обучение персонала и медицинская защита
7.4 Обработка отходов
7.5 Безопасность и безвредность продукта
8. Резюме по процессам выделения
8.1 Выделение внеклеточных ферментов
8.2 Выделение внутриклеточных ферментов
8.3 Непрерывное выделение ферментов
8.4 Одновременное выделение внеклеточных и внутриклеточных ферментов
Список использованных источников
Введение
Экстракты ферментов находили свое применение, вероятно, еще до того, как стала записываться история. Одним из примеров подобного применения является соложение ячменя и использование полученного экстракта для разжижения крахмала. В 1883 г. Рауеп и Persoz показали, что агент, ответственный за разжижение крахмала, который они назвали диастазой, подвергался разрушению под воздействием кипячения, действовал как катализатор и мог быть сконцентрирован и очищен путем осаждения спиртом. В 1878 г. для наименования подобных агентов Kuhn ввел термин «фермент». Blurnenthal в 1885 г. описал один из первых крупномасштабных процессов экстракции и очистки ферментов применительно к сычужному ферментов. Еще в 1902 г. Emmerich, Low и Korschun предложили применение бактериальных ферментов в клинической практике. В 1908 г. Wallenstein сообщил о стабилизации солодовой диастазы с помощью сульфата кальция, а в 1915 г. Rohm установил, что белье, подвергаемое стирке, может быть доведено до нужной степени чистоты более легко и при более низкой температуре воды, если его предварительно обработать липазами и протеазами. В 1926 г. впервые, фермент уреаза был получен Sumner в кристаллическом виде и была показана его белковая природа. К 1930 г. было охарактеризовано около 80 ферментов, к 1947 г. — примерно 200, а к 1968 г.— свыше 1300. Большинство из известных ферментов подвергалось выделению лишь несколько раз" и то в незначительных количествах.
Реклама

Почти все ферменты, выделяемые в настоящее время в промышленных масштабах, относятся к внеклеточным, т. е. к таким, которые выделяются клетками в окружающую среду. Выделение таких ферментов проще, чем внутриклеточных. Целевые ферменты, находящиеся внутри микробных клеток, не только имеют свойства, которые весьма похожи на свойства многих других внутриклеточных ферментов, но также сильно загрязнены различными контаминантами. У многих микроорганизмов внутриклеточные ферменты защищены исключительно плотной оболочкой. Однако, несмотря на это, за последние годы несколько внутриклеточных ферментов начали производиться в промышленных масштабах. К ним, в частности, относятся глюкозооксидаза для консервации пищевых продуктов, пенициллинацилаза для превращения антибиотиков и аспарагиназа для возможной терапии раковых заболеваний. Хотя процессы выделения внутриклеточных и внеклеточных ферментов существенно отличаются друг от друга, многие из применяемых для этого операций являются общими. Следует сделать особый акцент на указанной общности, поскольку именно в этом направлении усматриваются наибольшие надежды на то, что в будущем значительно больше ферментов станет производиться промышленностью на одних и тех же технологических линиях.
Подавляющее большинство применяемых в настоящее время ферментов относится к внутриклеточным. До тех пор, пока не будут найдены штаммы микроорганизмов, способные к выделению таких ферментов в культуральную жидкость, главная роль в прогрессе производства ферментов будет принадлежать технологической стадии выделения их из клеток. Есть основания полагать, что в ближайшее десятилетие многие из известных ферментов смогут выделяться из микробных клеток уже в промышленных масштабах, что создаст стимул для реализации на практике ряда процессов биосинтеза и биотрансформации в реакторах с изолированными биокатализаторами-ферментами.
1. Осаждение
Процесс при котором добавление некоторых реагентов или изменение условий вызывает выход белка из раствора с образованием осадка нерастворимых частиц называется преципитацией, или осаждением. В ферментологии этот термин не имеет того специфического сопутствующего значения, которое характерно для общей химии, где он означает химическое связывание за счет обмена связями-мостиками. В самом деле, круг методов осаждения ферментов чрезвычайно широк. Эти методы простираются от добавления нейтральных солей и спиртов или изменения рН до специфического химического действия ионов металлов и органических реагентов.
Реклама

1.1 Высаливание
Термином «высаливание» называют осаждение белков при высокой концентрации нейтральных солей. Этот метод является одним из старейших и наиболее широко применяемых 'при выделении или фракционировании белков. Среди применяемых солей предпочтение отдается сульфату аммония, так как он достаточно дешев и имеет высокую растворимость даже при пониженных температурах. При хранении сульфат аммония проявляет тенденцию к закислению, а при повышенных значениях рН — к выделению аммиака. Поскольку сульфат аммония в высшей степени коррозионно способен в отношении металлов и бетона серьезную проблему составляет нейтрализация его остатков.
Сульфат натрия не имеет указанных недостатков, но должен применяться с целью достижения адекватной растворимости при температуре 35—40 °С. Резкое снижение растворимости при повышении температуры позволяет достаточно просто обеспечить «восстановление» остаточной соли, но требует для этого предварительного нагревания любого производственного оборудования и осуществления строгого контроля температуры с тем, чтобы предотвратить преждевременную кристаллизацию и забивание оборудования, и коммуникаций. Наблюдаемое снижение растворимости белка при повышении концентрации соли может быть охарактеризовано уравнением
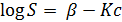
где 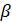 — растворимость белка; с — концентрация соли; — растворимость белка; с — концентрация соли; 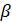 и К— константы, индивидуальные для каждой конкретной белковой системы ( и К— константы, индивидуальные для каждой конкретной белковой системы (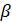 является также функцией температуры и рН). является также функцией температуры и рН).
Данное эмпирическое уравнение справедливо только для конкретного режима высаливания. Оно дает надлежащую основу для проведения в лабораториях операций фракционированного осаждения, благодаря которым ферменты с различными значениями (J3 и К частично, разделяются друг от друга. При проведении лабораторных экспериментов наблюдали, что усиление перемешивания оказалось выгодным при осуществлении периодического процесса осаждения пектиназы в том отношении, что оно позволяло увеличить скорость всего процесса осаждения и выделения фермента.
Все это уменьшало зависимость потерь фермента от продолжительности процессов обработки. При использовании сульфата аммония показано, что феномен осаждения критически зависит от примененного метода контактирования соли с обрабатываемой жидкостью.
Периодическое осаждение насыщенным раствором сульфата аммония повышало процент насыщения, при котором происходило высаливание, по сравнению со случаем, когда применялась та же соль, но в твердом состоянии. Очевидно, что непрерывное контактирование в потоке соли и белка с последующим уравновешиванием будет вести к дальнейшему изменению положения метода высаливания среди других методов выделения ферментов.
Для фумаразы и спиртовой дегидрогеназы, которые также подверглись изучению, уравнение скорости осаждения имеет такой порядок кинетики, который первоначально характеризуется весьма высокими значениями (до 3,1), но по мере завершения процесса приближается к единице. Образование твердой фазы завершалось примерно после 4-минутной экспозиции. Формирование осадка сопровождалось его ресуспендированием. Последний процесс характеризовался уравнением скорости первого порядка. Таким образом, различие между точкой завершения осаждения и конечным равновесием было эквивалентно примерно 4,5 % от насыщения.
1.2 Изменение температуры и рН
Зависимость величины 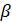 из уравнения от температуры и рН означает, по существу, что изменение растворимости может быть достигнуто или путем поддержания постоянства ионной силы раствора или же путем варьирования температурой или рН. Большинство белков проявляет нормальное увеличение растворимости при повышении температуры. Благодаря тому, что для ферментов наблюдается также обычная зависимость растворимости от температуры, температурные воздействия не часто применяются для интенсификации процесса фракционирующего осаждения. Однако различия в стабильности ферментов при повышенных температурах выражены довольно четко. Поэтому общепринятой процедурой для них служит селективная тепловая денатурация, которая ведет к необратимому осаждению. Причинами, по которым такая методика пользуется успехом у промышленников, являются ее простота и отсутствие необходимости иметь специальный, зачастую довольно дорогой реагент. Однако данный метод требует строгого контроля во избежание потерь продукта. Кроме того, зарастание теплообменников денатурированным белком может сделать метод трудно реализуемым. из уравнения от температуры и рН означает, по существу, что изменение растворимости может быть достигнуто или путем поддержания постоянства ионной силы раствора или же путем варьирования температурой или рН. Большинство белков проявляет нормальное увеличение растворимости при повышении температуры. Благодаря тому, что для ферментов наблюдается также обычная зависимость растворимости от температуры, температурные воздействия не часто применяются для интенсификации процесса фракционирующего осаждения. Однако различия в стабильности ферментов при повышенных температурах выражены довольно четко. Поэтому общепринятой процедурой для них служит селективная тепловая денатурация, которая ведет к необратимому осаждению. Причинами, по которым такая методика пользуется успехом у промышленников, являются ее простота и отсутствие необходимости иметь специальный, зачастую довольно дорогой реагент. Однако данный метод требует строгого контроля во избежание потерь продукта. Кроме того, зарастание теплообменников денатурированным белком может сделать метод трудно реализуемым.
Изменение рН также привлекает внимание как промышленный метод фракционированного осаждения, поскольку стоимость реагентов в этом случае невелика. Наличие широкого разнообразия соотношений между основными и кислыми группами в молекулах различных ферментов обусловливает широкий диапазон значений рН, при которых ферменты характеризуются изоэлектрическими свойствами или имеют пулевой заряд. Это согласуется с теорией растворимости, так как в указанной точке наблюдается самая низкая эффективная полярность, и фермент проявляет низкую растворимость в полярной водной среде.
Принципиальной трудностью в использовании диффepeнциaльнoгo осаждения под воздействием изменения рН является то, что диапазон рН, в котором многие ферменты остаются еще стабильными, весьма узок. Dunnill и другие исследователи, проводившие эксперименты с выделением пролил-t-PHK синтетазы из сои с применением Phaseolusaureus, попытались осуществить периодическое фракционирующее осаждение с помощью уксусной кислоты. Было установлено, что при рН 5,0 основная часть белка переходила в осадок, однако для перевода в осадок синтетазы оптимум рН находится на уровне 4,2. Из-за того, что стабильность фермента при низких значениях рН резко уменьшалась, процесс сопровождался значительными потерями материала. По этой причине было применено непрерывное осаждение в сочетании с непрерывной сепарацией при использовании дисковых центрифуг с периодической разгрузкой. Это снижает длительность процесса переработки 25 кг сои с 9,5 до 3 ч. Масштабирование указанного процесса возможно без изменения оборудования.
1.3 Осаждение органическими растворителями
Теперь уже вполне определенно известно, что большинство молекул ферментов имеют полярные группы, являющиеся внешними по отношению к молекуле. Добавление органических растворителей к водным растворам белков будет понижать диэлектрическую постоянную смеси, создавая среду, которая больше отличается от полярной поверхности молекул фермента. Как свидетельствует теория растворимости, это ведет к снижению растворимости белков. Однако, поскольку молекулы ферментов имеют внутренние гидрофобные аминокислотные остатки и поэтому относительно свободно могут свертываться, то альтернативно добавлению органических растворителей они принимают новую, неактивную форму с экспонированием в окружающую среду гидрофобных группировок. Повреждение таких молекул при изменении их формы и последующая денатурация тем больше, чем выше температура. Это приводит к необходимости использовать для фракционирования большинства ферментов с помощью органических осадителей низкие температуры (часто ниже 0° С).
2. Коагуляция и флокуляция
Слово «коагуляция» описывает в данном случае ситуацию, когда очень мелкие частицы вынуждены сцепляться друг с другом. Заряд на частицах нейтрализуется при добавлении поливалентных ионов, несущих противоположный заряд, вследствие чего наступает их коалесценция (слипание). Довольно долго в этих целях использовали неорганические соли. В последние годы получили распространение органические полиэлектролиты.
Термином «флокуляция» описывается образование значительно более рыхлых агрегатов, в которых флокулирующий агент выполняет роль мостикообразова- теля между частицами. Флокулирующие агенты включают в себя различные природные полимеры, такие, как желатина, и большое количество синтетических полимеров. Полимеры могут быть электролитами или неэлектролитами. Неорганические ионы не могут вызывать флокуляцию, хотя они могут быть использованы для нейтрализации зарядов частиц и в этом отношении способствовать флокуляции. Органические полиэлектролиты могут вызывать одновременноикоагуляцию и флокуляцию. Методы коагуляции и флокуляции применяют при работе с цельными микробными клетками, остатками клеток после лизиса и растворимыми белками.
2.1 Цельные клетки
При выделении ферментов флокулянт, если он присутствует в системе, не должен взаимодействовать с внеклеточными ферментами. При промышленном получении внеклеточной протеазы из Bacillussubtilis успешное применение нашли синтетические полиэлектролиты как вспомогательное средство, облегчающее отделение микробных клеток на фильтр-прессах. Поскольку флокулянт связывается с клетками, он может при последующем разрушении клеток для выделения ферментов войти в контакт с этими ферментами.
Проблеме коагуляции и флокуляции микробных клеток посвящено весьма мало исследований, за исключением работ, направленных на решение частных задач в пивоварении. Nakamura со ставил перечень основных требований, которые должны предъявлятьсяк реагентам, предназначенным для применения в качестве коагулянтов или флокулянтов микробных клеток. К ним относятся: низкая стоимость, низкая доза применения и отсутствие резкого влияния на изменение рН. Среди неорганических веществ в качестве потенциальных коагулянтов было испытано множество агентов, включая квасцы, соли железа и кальция. Хлорид кальция (0,1—0,5 %) применялся с гидроокисью натрия (0,2—0,8 %) для того, чтобы обеспечить поддержание рН смеси на уровне 8,0—9,5. Эффективным агентом при этом оказалась гидроокись кальция, вызывающая коагуляцию и копреципитацию (совместное осаждение). Кальций может быть удален из концентрированной клеточной массы путем добавления разбавленной кислоты. Особенно эффективными оказались титановые соли в концентрации около 0,01 % для дрожжей, бактерийи микроводорослей. Это связано с четырехвалентным зарядом иона титана.
Была изучена флокуляция различных бактерийкатионным полиамином и положительно заряженными микроскопическими волокнами алюминия. Количество алюминия, потребного для флокуляции Е. coli, составляло около одной десятой от того, что требовалось в случае Lactabacillusdeilbruckii. Эффективность флокуляции зависела от температуры, физиологического «возраста» культуры, характера суспендирующей средыи особенно от фактических усилий сдвига, воздействовавших; на клетки перед флокуляцией.
2.2 Остатки клеток и белки
Получающиеся после разрушения микробных клеток (для выделения внутриклеточных ферментов) остатки клеточной оболочки обычно подлежат удалению из смеси до того, как она будет подвергнута фракционированию с целью получения различных белковых компонентов. Остатки клеток при механическом разрушении последних колеблются в размерах от нескольких микрон до долей микрона и поэтому трудно подвергаются извлечению из смеси. На помощь в этом случае приходят флокуляция и коагуляция клеточных остатков. Однако весьма существенно, что такие методы обработки суспензий приводят к переводу в нерастворимое состояние также и внутриклеточных ферментов. В отношении седиментации клеточных остатков эффективными коагулянтами оказались квасцы. Однако они переводят белок в нерастворимое состояние с образованием мелких, медленно оседающих, нерастворимых флокул.
Флокуляция или коагуляция ферментов с целью получения нерастворимых белковых агрегатов представляет собой достойную альтернативу классическим методам осаждения, которые требуют высоких концентраций реагентов.
На протяжении ряда лет с целью выделения внеклеточных ферментов из культуральных жидкостей использовалась дубильная кислота. В концентрациях 0,1 —1,0 % она образует легко фильтрующиеся осадки. Флокулы содержат достаточно устойчивые ферменты и могут быть промыты ацетоном для удаления дубильной кислоты. В случае применения таких носителей, как крахмал (2— 5 %), при высушивании флокул может быть достигнуто 100-кратное увеличение концентрации ферментов. Непосредственное высушивание в отсутствии носителя обеспечивает 500- кратное увеличение концентрации. Флокулы обладают тем недостатком, что трудно подвергаются растворению.
3. Центрифугирование
Отделение твердых частиц от жидкостей представляет собой основную операцию в процессе выделения ферментов. Оно включает выделение клеток из культуральной жидкости, удаление клеточных остатков, сбор осадка и выделение адсорбентов белка из белоксодержащей надосадочной жидкости. Общепринято также включать в эту операцию отделение растворенных макромолекул от растворителя с помощью ультрацентрифугирования.
3.1 Сигма-анализ
Определенные трудности при сепарировании биологических частиц центрифугированием проистекают чаще всего из недостаточного понимания принципов процесса седиментации частиц в гравитационном поле. Эффективность центрифугирования повышается при увеличении диаметра частиц, разности между плотностями частицы и жидкости и при уменьшении вязкости жидкости. Эффективность также возрастает при повышении угловой скорости, увеличении радиуса центрифугирования, увеличении объема жидкости и уменьшении толщины слоя жидкости, подвергаемой центрифугированию. Однако биологические частицы характеризуются низкой плотностью и очень малыми размерами. Они также могут находиться в среде, которая благодаря присутствию растворенных твердых частиц обладает высокой вязкостью и повышенной плотностью.
В условиях лабораторий указанные неудобства могут быть преодолены путем применения центрифуг с высокой угловой скоростью. Однако эти центрифуги имеют очень малую производительность и работают периодически с точки зрения подачи в них суспензии и извлечения надосадочной жидкостиисконцентрированных твердых частиц.В случае центрифуг промышленного типа повышение производительностиза счет увеличении радиуса центрифугирования не может быть достигнуто, так как механические напряжения возрастают пропорционально квадрату радиуса. Поэтому конструкция машины при увеличении радиуса ротора быстро становится небезопасной для применения.
Увеличение вместимости корзины центрифуги и непрерывное пропускание через нее центрифугируемой жидкости ограничивает величину безопасной угловой скорости. Эта величина также ограничивается, если твердый осадок подлежит разгрузке непосредственно в ходе операции, поскольку значительное влияние на угловую скорость оказывает степень дебаланса. Исходя из этих ограничений, промышленность создала ряд центрифуг, применимых к переработке продуктов биологической природы. Но только лишь некоторые из них оказались пригодными для выделения ферментов, так как чрезвычайно ограничивающим фактором в этом отношении являются свойства системы жидкость — «твердая» частица. Для сепарации микробных клеток, остатков животных и микробных клеток и различных типов осадков применяются главным образом три типа центрифуг: трубчатые, многокамерные и дисковые. Меньшее, хотя и очень важное, применение находят спиральные центрифуги, центрифуги с твердой корзиной и ультрацентрифуги.
3.2 Центрифуги с роторами трубчатого типа
Цилиндрический ротор подвешивается при помощи гибкого вала к находящемуся в головке центрифуги мотору или воздушной турбине. Такая конструкция снижает нагревание ротора по сравнению с тем, что имеет место при нижнем расположении привода. Ротор установлен в подшипниках скольжения из мягкого металла. Для этой цели обычно применяется латунь, и хотя теоретически контакт между обрабатываемой жидкостью и подшипниками и данном типе машин не должен иметь места, тем не менее в тех случаях, когда обработке подвергаются растворы сульфата аммония, может происходить явная контаминация их медью. Подшипники скольжения из сплава Вууда являются в этом плане относительно надежной альтернативой при более высокой или более низкой частоте вращения в машинах небольших масштабов. Ослабление таких подшипников дает возможность ротору возвращаться в центрированное положение во время любого временного разбалансирования и обеспечивает более высокую частоту вращения по сравнению со всеми другими типами центрифуг, за исключением зональных ультрацентрифуг. В случае лабораторной модели центрифуги SharpiesIP (Pennwalt) с диаметром ротора 4,5 см и частотой вращения 50 ООО об/мин развивается усилие в 62 500 g, а в случае модели 6Р (диаметр ротора 10,8 см, частота вращения 15 500 об/мин) — 14 000 g. Модель IP оснащена воздушной турбиной, модель GP приводится в действие с помощью электродвигателя.
Жидкость перекачивается в ротор через донный штуцер, омывая при этом нижние подшипники. По море продвижения жидкости вверх по ротору происходит седиментация находящихся в ней твердых частиц на стенках ротора. Освобожденная от твердых включений жидкость отбрасывается центробежной силой из ротора в его верхней части и собирается в окружающую ротор чашу. Обе модели при обработке суспензий микробных, животных и растительных клеток, большинства суспензий остатков микробных клеток, а также суспензий твердых белковых адсорбентов дают прекрасное их осветление, а также прекрасное обезвоживание полученных твердых осадков. С помощью лабораторной модели можно также отделить от жидкой фазы белковую фракцию, осажденную солями или полимерами. Однако отделение невозможно, если плотность жидкости очень высока.
Применение пластиковых гильз ускоряет удаление осадка по сравнению с тем, как это происходит в случае извлечения из машины самого центрифужного ротора. Время оборачиваемости 15— 20 мин. Однако количество накапливаемого твердого осадка при этом незначительно — около 4 кг (по влажной массе).
Вывод жидкости из центрифуги влечет за собой ценообразование и генерирование аэрозоля. Последний может представлять опасность. Поэтому все машины, занятые в производстве ферментов, должны позволять осуществлять их монтаж внутри ограждающего кожуха. Аэрация жидкой фазы при разгрузке центрифуг может повреждать находящиеся в ней ферменты, особенно когда они содержат активные сульфгидрильные радикалы. В этих случаях может оказаться полезным применение противопенных и защитных в отношении сульфгидрильных групп агентов.
Следует иметь в виду, что при входе обрабатываемой суспензии в центрифугу очень высокое угловое ускорение может привести к дезагрегированию имеющихся в ней конгломератов и элементов осадка и, следовательно, к уменьшению вероятности удаления твердых частиц из жидкости. Когда двигатель выключается, жидкость, остающаяся в роторе центрифуги, будет вытекать из нее через донный штуцери может выносить с собой определенное количество твердых частиц. Поэтому не следует смешивать эту часть жидкости с уже осветленной.
Несмотря на указанные недостатки, такие простыеи доступные машины, как описанные центрифуги, являются наиболее пригодными и универсальными для разделения жидкой и твердой фаз при получении ферментов в полупромышленных условиях.
3.3 Многокамерные центрифуги
В машинах центробежного типа размеры ротора ограничиваются механическими усилиями. Альтернативой центрифугам с роторами большой вместимости являются многокамерные центрифуги, у которых серии концентрических камер монтируются внутри и снаружи ротора (рис. 3- б). Сложность такого ротора и его жесткое монтирование на донном подшипнике выше коробки передач и электродвигателя ограничивают возможную частоту его вращения (для ротора диаметром 46 см — 6500 об/мин).Жидкость вводится в центрифугу через центральную трубку, преодолевает зигзагообразный путь вверх и вниз между концентрически расположенными камерами и удаляется с помощью насоса центростремительного действия, расположенного концентрически относительно трубы, подводящей обрабатываемую жидкость. Твердые частицы собираются на внутренних поверхностях каждой камеры, а не осевшие во внутренних камерах движутся наружу, где подвергаются воздействию еще больших седиментационных сил. Однако для достижения необходимой степени обезвоживания осадок должен почти полностью заполнять весь ротор центрифуги.
В некоторых моделях многокамерных центрифуг, по мере того как ротор замедляет свой ход, жидкость приостанавливает движение по камерами проходит через отверстие вблизи центральной оси. В других моделях жидкость удаляется посредством сифонирования. Но в обеих из них твердый осадок может быть довольно легко вымыт из ротора центрифуги. Поэтому многокамерные центрифуги хорошо подходят для одноразового применения, когда размер ротора может быть выбран довольно точно и исходя из желательного объема партии получаемого материала. Они менее годятся для случаев, когда загрузка исходной суспензии твердой фазой может существенно изменяться. Разборка многокамерных центрифуг — операция довольно длительная, поскольку прокладки при разборке сохранить весьма затруднительно, твердый осадок должен соскабливаться со стенок осадительных камер без разборки машины. Квадратное поперечное сечение ротора центрифуги и ее расположение непосредственно над коробкой передач затрудняют отвод тепла от электродвигателя и шестерен коробки передач.
Стандартная многокамерная центрифуга может охлаждаться с помощью холодной воды, подаваемой через распылительную головку, смонтированную над центрифужной корзиной. Однако такой способ охлаждения не обеспечивает отвода тепла от центростремительного разгрузочного насоса, который является вторым источником генерации тепла (температура поднимается на 15 °С при производительности, не достигающей расчетного значения).
4. Хроматография
С процессами выделения ферментов в первую очередь связаны операции разрушения клеток, экстракции с помощью растворителей, осаждения, сепарации в фазах твердое вещество — жидкость. Возможности этих операций как средства для фракционирования ферментов в промышленных масштабах ограничены. Основной удельный вес в процессах фракционирования ферментов приходится на группу операций, построенных на феномене различной миграции ферментов. Наиболее важными из указанных операций являются хроматография и связанные с ней периодические операции сорбции-десорбции. Определенную роль в качестве операций (методов) дифференциальной миграции могут играть также электрофорез и зональное ультрацентрифугирование. Периодические процессы сорбции-десорбции являются специальным случаем дифференциальной миграции, при котором один или несколько компонентов не могут мигрировать или перемещаться под влиянием определенной движущей силы, в то время как другие компоненты к этому способны. Все другие методы дифференциальной миграции по сравнению с дистилляцией характеризуются как подлинно автоматические каскадные.
При каскадных операциях множество ступеней очистки материала располагается в определенной последовательности. Каждая ступень способна обеспечить лишь небольшое обогащение продукта целевым компонентом. Но при этом общая достигаемая мощность сепарирования может быть значительной. Некоторые каскадные системы для биологической сепарации, такие, как противоточные машины, включают автоматическое сопряжение дискретных стадий сепарации. Однако в большинстве систем, включая системы для хроматографии, электрофореза и ультрацентрифугирования, сочетание стадий производится непосредственно в пределах общей системы, а индивидуальные стадии обогащения не могут быть разделены ни в одном случае, кроме теоретических выкладок. В наиболее благоприятных случаях разделяющая способность каскадных методов, используемых при биологической сепарации, выражена настолько же сильно, как и при процессах дистилляции, но при очистке внутриклеточных ферментов она является критической из-за большой сложности подлежащей фракционированию смеси.
Периодические методы сорбции-десорбции по сепарирующей способности занимают промежуточное положение между методами осаждения и хроматографии. Однако их наиболее удобно обсуждать после рассмотрения возможностей таких процессов с сильно выраженной разделяющей способностью, как процессы хроматографии, т. с. когда механизм процессов сорбции-десорбции уже выяснен.
Хроматография определяется как равномерная перколяция, т. е. фильтрация через адсорбирующий слой зернистого материала,, жидкости, проходящей через колонку, заполненную определенным, более или менее тонко раздробленным веществом, которое селективно задерживает конкретные компоненты жидкости. Это пространное определение, сформулированное в 1950 г. A. J. P. Martin, охватывает широкий диапазон селективных методов задержания и элюирования (извлечения из адсорбента) уловленных жидкостей. Для выделения ферментов с применением методов хроматографической сепарации наиболее важными представляются их водные растворы. Ниже будут рассмотрены общие пути селективного задержания ферментов методами хроматографии с тем, чтобы на этой основе обсудить проблемы масштабирования соответствующих процессов.
4.1 Адсорбция
Первые операции хроматографической сепарации, связанные с получением ряда биохимикалиев, были проведены с применением веществ, которые адсорбируют их благодаря силам Ван-дер-Ваальса и пространственному взаимодействию. Указанные силы являются наиболее важными для веществ со сла- бовыраженной полярностью. В случае более полярных веществ серьезная проблема может возникнуть в связи с необратимым характером связывания всех компонентов.
При выделении ферментов применяется ограниченный круг адсорбентов. Широко используется в лабораторных работах фосфат кальция, особенно в кристаллической форме, известной как гидро- ксилапатит. Недостаточно совершенные его механические свойства и ограниченность размера гранул сдерживают применение гид- роксилапатита в колоннах крупных масштабов. Однако недавно проведенные работы свидетельствуют о прогрессе в данном вопросе. При лабораторных работах в определенной мере применяется также алюминий, особенно в форме у-алюмогеля. Однако его механические свойства неудовлетворительны, а текучесть выражена крайне слабо. Для адсорбции белков п редких случаях, но все же применяется диатомитовая земля.
Побочная адсорбция белка при применении диатомитовой земли в качестве основы грунтовочного слоя при фильтрации представляет серьезную проблему.
4.2. Фракционирование посредством ионного обмена.Раздробленные вещества с ионообменными свойствами предста- ляют собой наиболее важные твердофазные продукты для фракционирования ферментов. Широкое индустриальное применение нашли материалы, у которых ионообменные группы присоединены к гидрофобным остовам, как это имеет, например, место у сополимера дивинилстирола. Однако их применение к решению задач получения ферментов ограничивается случаями, когда идет речь об устойчивых ферментах, имеющих небольшие молекулы. Эти ограничения обусловлены слаборазвитой пористостью материалов, которые имеют требуемый размер пор. К тому же гидрофобные остовы молекул полимеров могут в потенции оказывать дестабилизирующее влияние на ферменты. Широко используются в лабораториях ионообменники на основе целлюлозных и декстрановых остовов. Как и в случае адсорбции, общепринято начинать хроматографическое разделение с добавления к системе белка, предполагая, что некоторые или все компоненты смеси прочно связаны друг с другом.
4.2 Сорбция-десорбция
Препаративная хроматография па границе фаз твердое вещество — жидкость представляет собой самую медленную операцию в общей технологической схеме выделения ферментов. Хотя этот метод не имеет равных по фракционирующей способности, известно множество примеров, когда этой способностью жертвуют ради достижения более высокой производительности. Как было показано для проведения процессов адсорбции, ионного обмена и аффинной хроматографии наиболее пригодны периодические методы. Периодические процессы сорбции-десорбции могут проводиться или в колонках насадочного типа, или путем перемешивания адсорбента с раствором фермента в аппарате емкостного типа с мешалкой с последующим применением метода сепарации и отделения твердой фазы от жидкой. Требования к конструкции насадочных колонок в этом случае могут быть менее строгими, чем в случае зональной хроматографии, так как в процессах сорбции-десорбции желательно использовать весь объем насадки. Однако и при этом следует обеспечить поршневое течение жидкости.
Альтернативный метод, включающий стадию отделения твердой фазы от жидкой, может быть реализован различными путями. При работе с плотными гидрофобными гелями осаждение в поле силы тяжести может быть адекватно стадии вторичной промывки. Для гидрофильных носителей желательно применение центрифугирования или фильтрации. При центрифугировании могут использоваться роторные центрифуги, центрифуги со сплошным ротором или сепараторы. Роторные центрифуги отличаются ограниченной производительностью, а разливающиеся на входе в эти машины суспензии срезающие усилия могут вызывать абразивное повреждение ее компонентов. Эта отличительная способность к повреждению присуща также и применяемым иногда спиральным центрифугам. Отвечают условиям процесса разделения фаз высокопроизводительные центрифуги со сплошным ротором. Но идеальными в этом отношении являются сепараторы, обеспечивающие эффективное обезвоживание и промывку осадка. Если необходимо, могут быть оборудованы автоматическим устройством для разгрузки твердой фазы с помощью приводного поршня.
Если структура осадка позволяет, процессы сорбции и десорбции могут осуществляться при применении адсорбента в движущемся роторе. Дополнительно возможно проведение стадии элюирования, что повышает эффективность разделения. Однако при осуществлении указанной стадии следует соблюдать особую осторожность, поскольку межповерхностные области между порциями растворителя для элюирования могут приводить к образованию ложных профилей процесса элюирования с неупорядоченным распределением в растворителе ферментов. Для решения проблем, связанных с обессоливанием вязких белковых растворов в насадочных колонках, соответствующая операция обессоливания посредством гельфильтрации может проводиться в барабанных центрифугах. Для удаления внешней влаги гель сначала обрабатывают при высоких частотах вращения центрифуги, а затем при малых частотах вращения в нее вводят белковый раствор. Соли и органические соединения с низкой молекулярной массой заполняют тонкие поры геля, в то время как белковые молекулы выбрасываются из него при высоких частотах вращения. Образующийся осадок затем промывают водой.
Выделение и очистка ферментов периодическими методами ионного обмена и адсорбции описаны во многих патентах и публикациях. Так, например, описано выделение стрептокиназы методом обессоливания осветленной культуральной жидкости (250 литров), содержавшей 40 млн. ед. фермента, с помощью смешанного катионо - и анионообменника. Полученный раствор обрабатывали ДЕАЕ-целлюлозой. В другом примере 100 л. мочи человека, содержащей урокиназу, обрабатывали 1 кг. фосфата целлюлозы - сильным катионным ионообменником основного характера. Значение рН снижалось с 8 до 3, и раствор фильтровали. После этого фермент элюировали с помощью 3%-ного аммиака.
5. Электрофорез и центрифугирование
5.1 Электрофорез
Термином «электрофорез» описывается процесс разделения ферментов на основе дифференциальной их миграции в электрическом поле. При проведении лабораторных работ в области аналитической биохимии электрофорез представляет собой метод, обеспечивающий высшую степень разделения ферментов на принципах физико-химической сепарации. Поэтому указанный метод изучался прежде всего с точки зрения препаративной сепарации. Именно для такого предназначения создано несколько специальных приборов. Однако необходимо иметь в виду, что на электрофоретическую подвижность ферментов решающим образом влияет ряд факторов; они могут быть ответственными за разочаровывающие результаты. Во-первых, электрофоретическая подвижность макромолекул низка, вследствие чего соответствующая операция разделения характеризуется малой скоростью и диффузия будет приводить к размыванию концентрационных зон, а ферменты — смешиваться с медленно движущимися продуктами электролиза. Подвижность молекул варьирует в обратном отношении к вязкости среды. Если отвод тепла от различных участков поперечного сечения сепарационной камеры происходит с разной интенсивностью, то подвижность молекул по поперечному сечению будет варьировать. Это обусловлено вариациями температуры по поперечному сечению и зависимостью вязкости от температуры. Наличие твердой фазы, хотя она сама по себе и не важна как объект для выделения, контролирует конвекционные возмущения потоков в сепарационной камере и вызывает гравитационные разрушения уплотненных зон. Твердая фаза также уменьшает подвижность молекул. Эти и другие проблемы осложняют применение методов перепаративного электрофореза. Капитальные затраты, относящиеся особенно к оформлению процессов охлаждения сепарационной камеры, удалению из нее продуктов электролиза и обеспечению безопасности эксплуатации, довольно высоки. Электрофорез может играть определенную роль только в процессах крупномасштабного выделения некоторых ферментов, особенно при сепарации ферментационных мультисубъединиц, которые подвержены разрушению в присутствии твердой фазы и требуются при хроматографии.
5.2 Зональное ультрацентрифугирование
Центрифугирование при очень высоких частотах вращения было рассмотрено ранее применительно к сепарации твердой и жидкой фаз.
Однако первоначально намечалось как метод высокоразделяющей сепарации частиц, находящихся в растворе. При использовании для целей дифференциальной миграции ротор ультрацентрифуги заполнялся жидкостью определенной плотности, и к оси ротора таким образом добавлялась некоторая кольцевая зона. Эта зона подвергалась воздействию центробежных сил, что заставляло частицы различной плотности мигрировать из нее наружу с различными скоростями. Метод приобрел большое значение при очистке вирусов, которые по своей величине, в общем, на один порядок крупнее молекул ферментов. Гравитационные поля, требующиеся для разделения молекул ферментов, слишком велики. Поэтому в настоящее время очевидно, что использование метода будет и впредь ограничиваться экстремально крупными ферментативными комплексами. Кроме того, даже при использовании наиболее подходящих по величине роторов эффективная вместимость, центрифуг незначительна. Как и в случае электрофореза, метод зонального ультрацентрифугирования имеет то преимущество, что он не связан с наличием в жидкости твердой фазы. Однако присутствующие в растворе химические вещества, создающие градиент плотности, могут повреждать структуру комплексов ферментов.
6. Отделочные операции
Общепринято к отделочным операциям относить такие, как стерилизация продукта, уменьшение его размеров в товарном виде, таблетирование и составление рецептур, а также обессиливание ферментов, их концентрирование, высушивание, хранение на складе и контроль чистоты. Хотя эти установленные конечные, или отделочные операции предшествуют непосредственному выпуску препаратов в продажу, они могут в ряде случаев иметь даже более важное значение, чем собственно операции очистки ферментов. Во всяком случае, для внеклеточных ферментов дело обстоит именно так. Для ряда практических применений внутриклеточных ферментов фракционирование требуется лишь для того, чтобы избавиться от некоторых контаминантов. Остальные требования определяются исключительно стремлением придать выпускаемому продукту надлежащую форму и внешний вид и необходимостью точной и воспроизводимой их специфичности. Большинство отделочных операций — это скорее обобщение результатов практических традиционных приемов работ внутри той пли иной компании, чем воплощенный в натуре итог исследований. Исследовательские учреждения обычно не интересует такое свойство продукта, как сохраняемость; их критерий чистоты часто отличается от критерия, каким руководствуется изготовитель.
6.1 Обессоливание
Многие ферментные препараты нуждаются в освобождении от неорганических солей, которые придают продуктам неприятный запах и нежелательны в клиническом отношении. Обессоливание ферментных препаратов может также играть важную роль как промежуточная стадия в технологическом процессе выделения химически чистых ферментов. В частности, эта стадия предшествует очистке ферментов с помощью ионообменной абсорбции. Термин «обессоливание» также широко применяется для описания процессов удаления любых низкомолекулярных соединений из ферментных препаратов с помощью операций, которые не учитывают различий между ионами и незаряженными низкомолекулярными соединениями.
Классический метод удаления из препаратов мелких ионов с использованием смешанной ионообменной насадки был применен к очистке некоторых наиболее устойчивых ферментов. Это применение основывается на наличии у гидрофобных углеводородно-основных ионообменников пор весьма малого размера. Такие ионообменники имеют очень низкую емкость по макромолекулам, но высокую емкость по ионам. Посредством применения смешанной насадки из катионных и анионных ионообменных смол становится возможным удалить из обрабатываемых препаратов как положительно, так и отрицательно заряженные ионы. К сожалению, гидрофобная природа указанных ионообменников и формирование на их поверхностях мощных зарядов приводят к возможности денатурации обрабатываемых ферментов. Данный метод имеет значительную конкуренцию со стороны второго хроматографического метода — метода гельфильтрации, который был описан выше. Возможности этого метода для осуществления, в промышленных масштабах операций удаления из ферментных препаратов различных ионов или мелких молекул доказаны вполне надежно. При этом неизбежно разбавление препаратов. В процесс вовлекаются только две фракции, а поскольку гельфильтрация не предполагает использования специфических сорбционных участков насадки, она может проводиться при высокой загрузке колонки, что ограничивает степень разбавления. Серьезно осложняет разделение ферментных препаратов высокая вязкость соответствующих растворов; не меньшую проблему составляет засорение геля белковыми материалами. Однако применение Сефадекса, который представляет собой декстран G-25 с поперечными связями, снимает последнюю проблему, так как он выдерживает очистку с помощью раствора гидроокиси натрия.
При удалении из ферментных препаратов всех низкомолекулярных соединений важную роль играют два мембранных метода — диализ и ультрафильтрация. Обычно ультрафильтрация будет позволять удалять низкомолекулярные соединения по существу с той же скоростью, как и воду. Обеспечив подпитку воды в ультрафильтрационную камеру, можно добиться достаточно эффективного удаления из системы и других молекул, помимо молекул воды. «Диафильтрация» обычно осуществляется при разбавлении на первой стадии препарата до необходимого уровня с тем, чтобы снизить до минимума концентрационную поляризацию.
Теоретически ультрафильтрация превосходит по своим возможностям диализ, так как ее реализация не требует преодоления предельной концентрации соли на фильтрующей стороне мембраны. Однако концентрация соли при диализе может поддерживаться на низком уровне благодаря быстрому пропусканию воды через фильтрующую сторону мембраны. Для этой цели может оказаться полезным применение деионизированной воды, позволяющее предотвратить контаминацию мембраны металлическими солями при промывке ее противотоком.
Серьезные ограничения, которые могли бы налагаться на процессы ультрафильтрации концентрационной поляризацией, в случае очистки диализом не выявлены, хотя это явление не теряет своей значимости с точки зрения достижения эффективного перемешивания потока продукта.
Фирмы, выпускающие оболочки для колбасных изделий," в качестве вторичных продуктов производят также трубки для диализа. При этом в процессе производства соответствующих мембран в них неизбежно остается определенное количество металлических ионов и соединений, содержащих серу. Металлические ионы могут вызывать денатурацию обрабатываемых ферментов. Поэтому мембраны перед их применением подвергаются обычно кипячению в несколько раз сменяемых порциях воды, куда может добавляться этилендиаминтетрауксусная кислота.
В результате исследований процесса ультрафильтрации разработано новое поколение микротрубчатых диализирующих мембран. Мембраны образуются из большого количества микротрубок, заделываемых вместе в так называемый модуль с общим входом и общим выходом. Соотношение площади поверхности модуля и его объема является очень высоким. Конструкция оказалась весьма эффективной, если не считать подверженности ее забиванию нерастворимыми твердыми веществами. Кроме того, изготовление модулей обходится довольно дешево. Есть основания надеяться, что высокая эффективность диализирующих мембран подобного рода и их модульная форма вновь пробудят интерес к практическому применению процессов диализа.
Подобно ультрафильтрации, диализ может привести к значительной утрате активности фермента, однако маловероятно, что эта утрата обязана наличию срезающих усилий. Скорее всего инактивация фермента при диализе происходит из-за наличия в мембранах каких-то контаминантов или межфазных границ, локально ограничивающих поток материала.
6.2 Концентрирование
Концентрирование — одна из основных стадий технологического процесса выделения внеклеточных ферментов. Как отделочная операция концентрирование обычно осуществляется методами сушки. При выделении внутриклеточных ферментов часто оказывается необходимым сконцентрировать жидкость во время промежуточной стадии очистки, поскольку высокая разделяющая способность соответствующих методов может приводить к избыточному разведению продукта. При низких уровнях содержания белка последний имеет выраженную тенденцию к покрытию рабочей поверхности плотным слоем. Твердые фазы, применяемые в хроматографии, обладают особенно большой площадью поверхности.
При концентрировании ферментов может применяться оборудование, обеспечивающее испарение влаги из материала при пониженных температурах, как это уже сделано применительно к технологии производства фруктовых соков могут быть использованы методы полного осаждения или полной адсорбции. Для изоляции внутриклеточных ферментов разумное применение соответствующей стадии обработки в определенные моменты процесса многостадийной очистки может в ряде случаев позволить исключить необходимость проведения собственно стадии концентрирования, которая по своей сути должна рассматриваться как непроизводительная. Такое построение процесса особенно важно в промышленных условиях, где концентрирование обходится довольно дорого, протекает медленно и может часто приводить к денатурации больших количеств продукта.
6.3 Сушка
Для сушки ферментов могут с успехом применяться промышленные методы, разработанные применительно к получению "пищевых и фармацевтических продуктов. Как и в случае других биологических материалов, наиболее устойчивые ферменты могут быть высушены в распылительных сушилках или тепловым способом под вакуумом; менее стойкие требуют сушки в за мороженном состоянии (сублимационная сушка).
Большинство внутриклеточных ферментов, поступающих в продажу от специализированных компаний в высушенном состоянии, производится методом сублимационной сушки. И, как правило, всегда велик соблазн, приняв, что все внутриклеточные ферменты являются в высшей степени лабильными, ориентироваться на их сушку толь ко сублимацией. Однако истинное положение дел требует не принимать подобного опрометчивого решения без предварительного испытания более дешевых и простых способов сушки.
Для получения сухих препаратов внеклеточных ферментов широко применяется распылительная сушка. Достигаемая при этом степень концентрации ферментов приводится ниже, при обсуждении результатов и подобных продуктов. Классические выпарные аппараты корпусного или трубчатого типов или типа падающей пленки для концентрирования ферментов находят ограниченное применение из-за трудностей контроля пенообразования и обрастания рабочих поверхностей осадком. Могут быть применены пластинчатые теплообменники. Выпарную установку лучше всего нагревать горячей водой под высоким давлением. Концентрирование жидкости осуществляется непосредственно из системы, находящейся в слое паров, по мере его расширения с большой скоростью. Подвергаемые обработке растворы ферментов должны иметь гомогенную консистенцию, быть хорошо отфильтрованными и свободными от воздуха и крупных инородных частиц. Для предотвращения кавитации следует применять насосы вытесняющего действия. Температура должна поддерживаться на уровне 40 °С или даже ниже. При типичном процессе растворы ферментов обычно концентрируются в две стадии: от 8 или 12 % содержания твердых веществ до 35%, а затем — до 65%.
В настоящее время основным применением ультрафильтрации является концентрирование, так как концентрационная поляризация существенно препятствует осуществлению многих процессов фракционирования с использованием этого метода, хотя в случае осветленных культуральных жидкостей он позволяет удалить из препарата большую долю низкомолекулярных составных частей. (Уровень сконцентрированного белка во внеклеточной культуральной жидкости будет обычно невысоким, вследствие чего поляризация будет носить ограниченный характер.) Представляется, что подобное применение ультрафильтрации будет быстро прогрессировать и расширяться по мере того, как будет возрастать надежность информации о свойствах системы, которая подлежит обработке.
Наиболее важными операциями концентрирования являются те, которые определяются как фракционирование. В частности, операции осаждения или преципитации и адсорбции служат одновременно и операциями концентрирования. Для выделения целевых продуктов из нативных внеклеточных ферментов пли из нативных внутриклеточных ферментных препаратов реальных процессов выделения соответствующих препаратов.
Бактериальная а-амилаза была получена в сухом состоянии на вакуумной сушильной установке. При этом из 5000 л фильтрата культуральной жидкости, подвергнутого фракционированию спиртом, за 8 ч работы было получено 73,5 кг продукта. При промышленном производстве аспарогеназы сублимационным методом было получено несколько килограммов готового продукта. Для сушки ферментных препаратов сублимацией весьма важно обеспечить максимально полное удаление влаги из обрабатываемого материала.
7. Биологическая безопасность при промышленном производстве
Безопасность производства и применения являются неотъемлемыми требованиями к любому технологическому процессу. Мерой безопасности на предприятии служит содержание в воздухе помещений и на поверхностях любых потенциально опасных материалов. Объектами наблюдения при решении проблем производственной безопасности являются как рабочая среда, так и персонал. Только при благополучном состоянии указанных объектов наблюдение можно гарантировать, что принимаемые меры эффективны. Сказанное в равной мере относится также и к контролю всех материальных потоков, поступающих с предприятия в окружающую среду.
7.1 Меры безопасности
Стандартные ферментаторы представляют собой адекватные системы обеспечения техники безопасности при работе с любыми микроорганизмами, исключая патогенные. Если применяемые микроорганизмы обладают потенциальной опасностью, то в конструкцию ферментаторов следует внести очень небольшие усовершенствования с тем, чтобы полностью изолировать их внутренние пространства от окружающей среды. В ходе культивирования основное внимание должно быть уделено обработке выходящего из ферментатора воздуха, который подлежит либо фильтрации, либо пропусканию через печи-инсинераторы. Технология последних процессов отработана весьма тщательно. Однако, несмотря на это, неисправность каких-либо элементов или фиттингов может свести принимаемые меры защиты окружающей: среды к нулю. Основные проблемы возникают при выгрузке культуральной жидкости из ферментаторов. При производстве внеклеточных ферментов влажные микробные клетки с примесью вспомогательных фильтровальных порошков или без них обычно подвергаются автоклавированию. Клетки, свободные от вспомогательных фильтровальных порошков, могут, если в этом есть необходимость, идти на корм скоту. Жидкость, из которой были удалены тем или1
иным путем ферменты, продолжает содержать определенные питательные вещества и поэтому имеет значительную биологическую потребность в кислороде. В качестве осадителя белков применяется сульфат аммония, который оказывает координирующее действие на бетон и на различные металлы. Поэтому жидкости, содержащие указанное химическое вещество, обычно сбрасываются на грунт в качестве удобрений.
Разрушение микроорганизмов в целях получения внутриклеточных ферментов выдвигает новую проблему техники безопасности. Фрагменты клеточных оболочек, получающиеся в результате механических воздействий на клетки, содержат целую серию биологически активных материалов. В случае непатогенных грамотрицательных организмов, таких, как Е. coli, в среду из клеточной оболочки высвобождаются эндотоксины. Последние при аэрозольной аппликации могут вызывать неприятные, хотя и кратковременные симптомы, например тошноту, головную боль и боль в грудной клетке, а также раздражение мочевых путей. Кроме того, эндотоксины сохраняются и в перерабатываемых материалах на протяжении всех стадий фракционирования после разрушения клеток. Биохимическая технология во многом использует оборудование, разработанное и разрабатываемое для химической промышленности. При этом предполагается, что уровни утечки, допустимые для неорганических химических веществ, могут также иметь место при высокоактивных биологических материалах. Так, в частности, рассматривается вопрос применительно к большинству промышленных центрифуг, работающих при довольно высоких частотах вращения роторов. При недостатке вполне совершенных модификаций центрифуг и в условиях, когда существующие центрифуги отличаются высокой стоимостью, единственно правильным решением является монтаж такого оборудования в боксах определенного вида, поскольку применение ламинарных воздушных потоков на протяжении всей операции, идущих от места проведения процесса к фильтрам, обходится дорого, а при реализации в промышленных масштабах недостаточно эффективно. Требование о работе операторов в специальных пневмокостюмах, питаемых воздухом от воздушных коммуникаций, встречается весьма неодобрительно, и, кроме того, не решает проблемы обезвреживания производственных выбросов и охраны воздушной окружающей среды.
Большинство из известных боксов безопасности представляет собой жесткие конструкции из нержавеющей стали, стекла и пластиков. Эти конструкции довольно дороги, а сами установки громоздки. Доступ в эти установки и особенно их обслуживание затруднительны", а последующие модификации производства могут легко нарушить целостность и герметичность созданных систем. Более многообещающим является применение боксов из гибких пленок, которые были ранее разработаны для использования при получении животных-гнотобитов, свободных от микроорганизмов.
Стенки подобных боксов выполняются из тонкого листового полиэтилена или из листового поливинилхлорида. Их соединение производится посредством электронной сварки. В нужных точках боксов могут размещаться (опять-таки с помощью электронной сварки) соответствующие перчатки и фильтры, а боксы могут работать под избыточным давлением и под разрежением.
Особенно полезным дополнением к боксам служит специальный полукостюм, заделываемый при помощи электронной сварки в боковую стенку секции. Он представляет собой верхнюю половину пластикатового костюма со шлемом и плечевыми перчатками. Жилетка полукостюма создает ламинарный поток воздуха и соединена с питающей воздушной линией; подпор воздуха под полукостюмом создает для оператора значительную свободу движений.
Если оператору требуется перемещаться от бокса па большие расстояния, то «юбка» полукостюма может быть сделана более длинной, так что образуется как бы тоннель, в котором может двигаться оператор. Работающий может покидать костюм практически мгновенно, не опасаясь быть при этом контаминированным. Исполнение им рабочих функций производится в комфортных условиях ламинарного воздушного потока.
Самый большой недостаток боксов является следствием неудобств, связанных с применением резиновых перчаток. Заделывание в бокс более толстых перчаток может лишь снизить вероятность контактной контаминации. Но это будет достигнуто ценой потери легкости манипуляций оператором. Однако, если основная опасность при работе в боксе связана с движением воздуха, то быстрая замена порвавшихся перчаток будет вполне допустима. Проведение такой операции может быть облегчено, если в боксах будет применяться конструкция, разработанная для хирургических операций через гибкие пленки.
7.2 Контроль окружающей среды
Аэрозолированные микроорганизмы обычно фракционируются путем применения щелевых пробоотборников, в которых находятся вращающиеся чашки Петри с соответствующей питательной средой на основе агара. В течение заданного времени над чашками прокачивается измеряемый объем воздуха. Затем чашки помешаются в термостат и находятся в нем при условиях, специфичных для развития отдельных микроорганизмов. Анализы воздуха с помощью подобных пробоотборников должны осуществляться при остановке предприятий и в ходе их работы с тем, чтобы установить нормальный уровень загрязненности и выявить любую утечку материала. После того как были получены данные о реакциях организма на попадание в него порошкообразных протеолитических ферментов, стали возможными разработка стандартов безопасности и контроль в соответствии с ними окружающего воздуха. В настоящее время аналогичные работы по стандартизации проводятся применительно и к другим ферментам в виде аэрозолей.
7.3 Обучение персонала и медицинская защита
После инженерных средств и методов обеспечения безопасности важнейшая роль в безаварийной работе принадлежит обучению персонала правильному обращению с соответствующими материалами и оборудованием. Прежде всего здесь важно подчеркнуть необходимость соблюдения общих правил безопасной работы. Например, на предприятиях по выделению ферментов применяются машины, оснащенные мощными электрическими двигателями и требующие больших расходов воды. В таких условиях крайне важно уделять особое внимание обеспечению безопасной электропроводки и электроизоляции. В дополнение к указанному следует иметь в виду, что высокая биологическая активность получаемых и обрабатываемых материалов ставит на особую ступень проблему личной гигиены работающего персонала. На предприятии следует пользоваться чистой защитной спецодеждой, не допуская работы персонала в домашней одежде. При выходе с предприятия каждый работающий обязан тщательно вымыть руки.
Прием пищи и курение внутри производственных помещений категорически запрещаются.
Желательно, чтобы все работающие с большими количествами: целевых и промежуточных продуктов подвергались первичному медицинскому освидетельствованию и проходили периодические медицинские проверки. Необходимо организовать дело так, чтобы по поводу любых симптомов, не объяснимых внешними причинами, все работающие давали немедленную информацию по службе. Медицинские освидетельствования и периодические проверки должны предусматривать функциональные исследования крови и органов дыхания, рентген грудной клетки, а при возможности и кожные пробы на аллергию. Не исключено, что отдельные лица, когда-то переболевшие сенной лихорадкой или другими аллергическими заболеваниями или имеющие в роду родственников с подобными заболеваниями, будут подвергаться при работах особому риску, в частности в отношении кожных раздражений. Оснований для отстранения таких лиц от участия в работах весьма мало, но возможность аллергии должна быть разъяснена им заранее.
7.4 Обработка отходов
Обязанность обеспечить безопасность персонала предприятий должна сопровождаться такими же мероприятиями в отношении зашиты всех других людей от какого бы то ни было влияния всех видов отходов, сбрасываемых с предприятий. Отводимый воздух должен подвергаться фильтрации и контролироваться на чистоту. Для замены фильтров и их обезвреживания должны быть разработаны безопасные процедуры. Твердые отходы подлежат автоклавированию, а затем обычно выбрасываются на свалку. Обработка жидких отходов отчасти определяется местоположением предприятия. Местные инструкции регламентируют главным образом такие факторы, как благоприятное биологическое потребление кислорода и меры по исключению из стоков солей, обладающих, например, коррозионным действием. Присутствие в сточных водах микробных клеток не обязательно будет представлять собой опасность, так как содержание их в обычных сточных водах бывает довольно высоким. Однако отдельные виды или даже штаммы микроорганизмов могут оказаться опасными или необычными для бытовых стоков данного района. Влияние же на характер стоков и на их безопасность (или опасность) таких факторов, как внутриклеточные материалы и эндотоксины, выяснено пока только частично.
7.5 Безопасность и безвредность продукта
Стандарты, относящиеся к безопасности и безвредности продуктов, различны в разных странах. Они основываются в большинстве случаев па долгосрочных наблюдениях за применением тех или иных продуктов. Американский перечень под кодовым названием GRAS (препараты, большей частью оцениваемые как безопасные) точно отражает то положение, что конкретный препарат, который в момент своего появления был отнесен к безопасным, в определенное время может оказаться небезопасным. Практическим выводом из законов о безопасности продуктов является тот факт, что лишь ограниченное число микробиологических источников ферментов допускается к применению в промышленности в том случае, если получаемые ферментные препараты предназначаются для использования в продуктах питания. Дополнения к перечню GRAS допускается вносить только после длительных испытаний соответствующих препаратов. Это означает, что большие капиталовложения в разработку того или иного продукта приходится делать без достаточных гарантий того, что этот продукт из нового сырьевого источника будет разрешен к использованию.
Принципы построения безопасных технологических процессов -в обобщенном виде представлены ниже. Ответственность за безопасность должна лежать в одинаковой степени на главе управления данного предприятия и на не зависящем от него работнике внешней инспекции.
Инженерные мероприятия
1. Ограждение предприятия.
2. Полная изоляция рабочего оборудования от внешней среды.
3. Контроль воздуха общего предназначения и отдельно воздуха, отходящего от рабочих установок и из рабочих помещений.
4. Строгий контроль входа персонала на предприятие и выхода из него.
5. Применение защитной одежды.
6. Санобработка и деконтаминация персонала.
7. Организация специальных зон приема пищи.
Контроль окружающей среды
1. Регулярная очистка предприятия.
2. Построение процессов со сведением к минимуму риска.
3. Первичное и периодические определения фона воздуха.
4. Первичное и периодические измерения величины воздушных потоков.
5. Контроль оборудования в ходе операций.
Наблюдения за персоналом
1. Первичные и периодические диспансерные осмотры.
2. Постоянная регистрация отсутствующих и больных.
3. Установление системы информации о несчастных случаях и о заболеваниях.
4. Постоянная связь и взаимодействие с медицинскими работниками.
8. Резюме по процессам выделения
8.1 Выделение внеклеточных ферментов
Число последовательных технологических стадий для выделения внеклеточных ферментов обычно меньше, чем для внутриклеточных. Однако существует широкий диапазон возможных операций и уровней фракционирования. В табл. 1 в обобщенном виде представлены некоторые альтернативные технологические стадии, а также приведены количественные данные о степени концентрирования продуктов на отдельных стадиях и в целом по процессу. Интерес представляет в первую очередь степень концентрирования фермента из культуральной жидкости, а не его чистота. Относительное совершенство каждого процесса и метода, а именно различных методов осаждения, процессов сепарации в системе твердое тело - жидкость, концентрирования и высушивания оценивается именно по показателю системы концентрирования.
Underkofler описал технологию выделения а-амилазы из В. subtilis с выходом 63 % следующим образом:
Исходная культура. В. subtilis на питательном агаре; инкубация при 32 °С; хранение при 0—5°; пересев каждые 2 мес.
Посевные колбы. Колбы вместимостью 2,2 л, содержащие 1 л среды; инкубация 12 ч при 32 °С па качалке с возвратно-поступательным движением.
Посевная емкость. 180 л среды; 10 ч при 32 °С; давление в емкости 0,2 кгс/см2
; подача воздуха 150 л/мин; частота вращения мешалки 150 об/мин.
Ферментация. Комплексная среда в составе: мука соевых бобов 1,85% с содержанием растворимых сухих веществ 0,76%; ферментативный гидролизат казеина 0,65%; лактоза 4,75%; MgS04
-7H2
0 0,04%; противопенный агент 0,05%. Количество среды 5000 л; температура 35°С; давление в ферментаторе 0,3 кгс/см ; частота вращения мешалки 170 об/мин; подача воздуха 3000 л/мин.
Выделение растворенного нативного фермента. 5500 л культуральной жидкости (2160 BAU/мл); 2% диатомита к объему культуральной жидкости, вакуумная предфильтрация с подвижным ножом; объем фильтрата с промывной водой 5000 л (2000 BAU/мл).
Осаждение. 13600* л денатурированного спирта добавлено при перемешивании; после выстаивания декантация надосадочной жидкости; добавлено 4500 л спирта; надосадочная жидкость вновь декантирована.
Сепарация в системе твердое вещество — жидкость. С помощью пластинчатого и рамного прессов. Высушивание. Вакуумная сушка в течение 8 ч.
Отделочные операции и составление композиции. Продукт— 73,5 кг (102000 BAU/r) смешан с 385 кг гипса (16800±5 BAU/r).
Данные более поздних разработок в нашем распоряжении отсутствуют. Однако не вызывает сомнения, что новейшие методы флокуляции, ультрафильтрации и высушивания оказали свое влияние на построение соответствующих процессов. Типовая схема производства внеклеточных ферментов показана на рис. 3.
8.2 Выделение внутриклеточных ферментов
Во введении в данную главу отмечалось, что выделение внутриклеточных ферментов требует фракционирования весьма сложной смеси продуктов по сравнению с простой обработкой внеклеточной культуральной жидкости при получении соответствующих ферментов. Это фракционирование за последние 50 лет закреплено во многих конкретных методах обработки. Среди работников лабораторий укоренилась тенденция рассматривать каждый метод выделения ферментов как уникальный. Несомненно справедливо, что каждый фермент отличается специфичностью, но мнение о том, что для каждого фермента метод выделения должен быть обязательно свой, ведет к замедлению создания технологии и отдельных ее операций. А фактически анализ любого набора практических рецептов для выделения ферментов показывает, что широко применяется в реальных условиях лишь относительно небольшое число процедур. Безусловно, промышленное выделение внутриклеточных ферментов требует большей гибкости при применении различных методов, чем выделение внеклеточных ферментов. Тем не менее, и для выделения внутриклеточных ферментов может быть разработана относительно стабильная технология и оборудованы производственные линии. Выделение аспарогеназы на промышленном уровне подтверждает дальнейшие возможности совершенствования этого процесса.
Ферментация. Вместимость встряхиваемых на качалке колб 250 мл, ферментаторов от 400 л до 75,7 м3
(выход снижается до 70%). Среда — настой пшеницы; критический питательный компонент—аминокислоты; мощность подводимой энергии 0,3—0,4 л. с./378,5 л.
Выделение клеток. Дисковая центрифуга с соплами (1300 g), производительность 26.5 л/мин. Концентрирование от 6 г/л до 120 г/л (по массе СВ).
Разрушение клеток. Гомогенизатор APV фирмы «MantonGaulin»,— 2- кратное пропускание (563 кг на см2
); при первом пропускании высвобождается 90% фермента, при втором —97%; подъем температуры до 30 °С; охлаждение рассолом.
Отделение остатков клеток и белка. Добавление 3 3% этанола (пол слои жидкости); удаление твердой фазы под давлением на ротационном фильтре (11,25 м2
); за время менее 2 ч получается 7570 л фильтрата. Осаждение фермента. 50 % метанола; пониженные значения рН.
Фильтрация. Фильтр-пресс (1,62 м); добавление кизельгура; ресуспендирование фермента в 946,25 л воды. Переосаждение фермента. 60% метанол.
Отделение твердой фазы: С помощью центрифуги Шарплес с трубчатой корзиной.
Концентрирование. Путем ультрафильтрации (выход 90 %).
Хроматография. Сефадекс DEAE-A50 (колонка: диаметр 29,48 см. высота 58.96 см); исходный буфер 0.025М до 0.12М; осаждение фермента; ресуспендирование; хроматография с помощью СМ-целлюлозы (0,11 г белка/г полимера); снижение содержания пирогенных веществ.
Кристаллизация. С помощью 0,6 объема этанола; рН 5. Сбор осадка с помощью центрифуги с твердой корзиной.
Стерилизация. Обработка углем, стерилизующая фильтрация; обработка маннитолом; сушка сублимацией.
Выход. 1 кг кристаллической аспарагиназы (30%—общий выход); длительность всего цикла —24 ч; многочисленные стадии обработки перед ультрафильтрацией; стерилизация, которая не полностью касается аспарагиназы; ламинарное движение воздуха; вода, свободная от пирогенных веществ.
8.3 Непрерывное выделение ферментов
При рассмотрении отдельных операций было показано, что осуществление, например, таких стадий, как осаждение, сепарация в системе твердая фаза — жидкость, классическими периодическими методами оказывается слишком сложным. Масштабирование периодических процессов при неизбежном увеличении продолжительности процесса часто сопровождается значительной потерей активности фермента. Непрерывные операции имеют еще то дополнительное преимущество, что они позволяют использовать оборудование в незначительных масштабах и в этом отношении в положительную сторону отличаются от периодических процессов, которые, как правило, имеют дело с крупногабаритным оборудованием. Непрерывное выделение ферментов осложняется требованием надежности применяемого оборудования и выбора его с таким расчетом, чтобы производительности на отдельных стадиях процессов были равны. Решение этих проблем может быть значительно упрощено благодаря внедрению небольших промежуточных емкостей, играющих роль буферных, и перевода полностью непрерывного режима в полунепрерывный.
8.4 Одновременное выделение внеклеточных и внутриклеточных ферментов
Подавляющее большинство схем выделения ферментов предусматривают регенерацию отдельных ферментов. В случае внеклеточных ферментов это может быть подтверждено на многих примерах, поскольку практически лишь один внеклеточный фермент в смеси различных продуктов имеет значительную концентрацию. Для дополнительного получения внутриклеточных ферментов или иных внутриклеточных продуктов требуется разрушить клетки и подвергнуть полученную смесь строгому фракционированию. Однако, если осуществлено выделение хотя бы одного внутриклеточного фермента, к стоимости процесса дополнительно добавляется стоимость разрушения клеток и удаления их остатков и значительно превосходящая ее стоимость осадителей и адсорбентов независимо от того, сколько ферментов и других продуктов фактически выделено из клеток. В этом отношении полезно проведение аналогии с фракционированием нефтяных продуктов.
Известно множество примеров одновременного выделения из субстрата ряда животных ферментов. Особенно хорошо разработан процесс выделения гликолитических ферментов из мышечной ткани. Последняя очень подходит для этой цели, так как различные ферменты содержатся в ней в достаточно высоких концентрациях. Одновременное выделение внутриклеточных микробных ферментов осуществляется пока крайне редко, является менее прямым процессом, изучение которого началось, по сути дела, только в самое последнее время. Есть основания полагать, что аффинная хроматография может существенно облегчить разработку технологии одновременного выделения внутриклеточных и внеклеточных микробных ферментов. Прогрессу указанных исследований и разработок будет также способствовать разработка более экс-прессных систем аналитического контроля, поскольку последний при процессах выделения нескольких ферментов является исключительно сложным, особенно во время разработки этих процессов.
Список использованных источников
1. Д. Уонг, Ч. Кооней. Ферментация и технология ферментов. М: Легкая и пищевая промышленность, 1983г.
2. Ред. коллегия М Ф. Гулый. Ферменты в медицине, пищевой промышленности и сельском хозяйстве. Киев, «Наукова думка», 1968г.
3. Ред. акад. А.А. Имшенецкий. Ферменты микроорганизмов. М.: «Наука», 1973г.
4. Ред. Я.М. Варшавского. Ферменты и синтез биополимеров. М.: «Мир», 1967г.
5. Н.П. Блинов. Основы биотехнологии. Для студентов институтов; аспирантов и практических работников. Издательская фирма «Наука». СПб| 1995г.
6. В.К. Акименко. Альтернативные оксидазы микроорганизмов. М., Наука, 1989г.
7. Бейли Дж., Оллис Д. Основы биохимической инженерии, в 2 частях. М., Мир, 1989г.
8. A.M. Егоров., А.П. Осипов., Б.Б. Дзаптиев., Е.М. Гаврилова. Теория и практика иммуноферментного анализа. М.. Высшая школа, 1991г.
9. Иммобилизованные клетки и ферменты. Методы. Под ред. Дж. Вудворда. М., Мир, 1988г
|