Новосибирский государственный аграрный университет
Агротехнологический факультет
Кафедра агроэкологии и микробиологии
Курсовая работа по сельскохозяйственной экологии на тему:
Состав атмосферы и его формирование в процессе эволюции биосферы.
Выполнила: Кириллова Ксения
студентка 1404 группы
Проверила: профессор,
к.б.н. Коробова Л. Н.
Новосибирск 2011
Введение
Атмосфера это внешняя газовая оболочка Земли, которая начинается у ее поверхности и простирается в космическое пространство приблизительно на 3000 км. История возникновения и развития атмосферы довольно сложная и продолжительная, она насчитывает близко 3 млрд лет. За этот период состав и свойства атмосферы неоднократно изменялись, но на протяжении последних 50 млн лет, как считают ученые, они стабилизировались.
Масса современной атмосферы составляет приблизительно одну миллионную часть массы Земли. С высотой резко уменьшаются плотность и давление атмосферы, а температура изменяется неравномерно и сложно, в том числе из-за влияния на атмосферу солнечной активности и магнитных бурь. Изменение температуры в границах атмосферы на разных высотах поясняется неодинаковым поглощением солнечной энергии газами. Наиболее интенсивнее тепловые процессы происходят в тропосфере, причем атмосфера нагревается снизу, от поверхности океана и суши. Следует отметить, что атмосфера имеет очень большое экологическое значение. Она защищает все живые организмы Земли от губительного влияния космических излучений и ударов метеоритов, регулирует сезонные температурные колебания, уравновешивает и выравнивает суточные. Если бы атмосферы не существовало, то колебание суточной температуры на Земле достигло бы ±200 °С. Атмосфера есть не только животворным «буфером» между космосом и поверхностью нашей планеты, носителем тепла и влаги, через нее происходят также фотосинтез и обмен энергии — главные процессы биосферы. Атмосфера влияет на характер и динамику всех экзогенных процессов, которые происходят в литосфере (физическое и химическое выветривания, деятельность ветра, природных вод, мерзлоты, ледников).
Развитие гидросферы также в значительной мере зависел от атмосферы из-за того, что водный баланс и режим поверхностных и подземных бассейнов и акваторий формировались под влиянием режима осадков и испарений. Процессы гидросферы и атмосферы тесно связанные между собою.
Реклама

К сожалению, приходиться констатировать, что атмосфера с каждым годом промышленной деятельности человека становиться всё меньше и меньше пригодной для нормальной жизнедеятельности живых организмов.
В своей работе я стремлюсь рассмотреть историю земной атмосферы, а именно её газового состава, начиная с момента образования и заканчивая нашим временем.
Главная задача работы – рассмотреть все компоненты биосферы, главные и второстепенные, выявить их источники появления.
Глобальная роль атмосферы определяет особую ответственность всех государств за сохранение ее состава и предотвращения загрязнения воздушной среды, которое может отрицательно сказаться на развитии биосферы в целом.
1.Появление атмосферы и ее первичный состав
Возраст атмосферы принято приравнивать к возрасту самой планеты Земля – примерно 5000 миллионов лет. На первоначальном этапе своего формирования Земля разогрелась до внушительных температур. «Если, как считает большинство ученых, только что образовавшаяся Земля была чрезвычайно горячей (имела температуру около 9000 C), то большинство газов, составляющих атмосферу, должны были бы покинуть её. По мере постепенного охлаждения и затвердевания Земли газы, растворенные в жидкой земной коре, выходили бы из неё». Из этих газов и сложилась первичная земная атмосфера, благодаря которой стало возможным зарождение жизни[2].
Как только Земля остыла, вокруг неё, из выделенных газов, сформировалась атмосфера. Точное процентное соотношение элементов химического состава первичной атмосферы, к сожалению, определить не представляется возможным, но можно с точностью предположить, что газы, входящие в её состав, были подобны тем, которые теперь выбрасываются вулканами – углекислый газ, водяной пар и азот. «Вулканические газы в виде перегретых паров воды, углекислого газа, азота, водорода, аммиака, кислых дымов, благородных газов и кислорода формировали праатмосферу. В это время накопление кислорода в атмосфере не происходило, поскольку он расходовался на окисление кислых дымов (HCl, 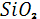 , ,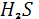 )[2]. )[2].
Существуют две теории происхождения самого важного для жизни химического элемента – кислорода. По мере охлаждения Земли температура упала примерно до 100 C, большая часть водяного пара сконденсировалась и выпала на земную поверхность первым дождем, вследствие, чего образовались реки, моря и океаны – гидросфера. «Водяная оболочка на Земле обеспечила возможность накопления эндогенного кислорода, став его аккумулятором и (при насыщении) поставщиком в атмосферу, к этому времени уже очищенную от воды, углекислоты, кислых дымов, и других газов в результате прошедших ливней»[4].
Реклама

Другая теория утверждает, что кислород образовался при фотосинтезе в результате жизнедеятельности примитивных клеточных организмов, когда растительные организмы расселились по всей Земле, количество кислорода в атмосфере стало быстро увеличиваться. Однако, многие учёные склонны рассматривать обе версии без взаимного исключения[4].
2.Слои атмосферы
Удерживаясь гравитационным полем Земли, атмосфера имеет зональное строение. Нижняя прилегающая к земной поверхности часть атмосферы до высоты 80 км носит название гомосферы. Гомосфера, в свою очередь, подразделяется на три оболочки, различающиеся по характеру температурного режима. Нижняя из них, называемая тропосферой, имеет основное значение для жизни на Земле. Её верхняя граница- тропопауза отделяет тропосферу от стратосферы. Тропопауза у полюсов располагается на высоте 8-10 км, а её высота увеличивается до 17 км. Выше стратосферы до высоты 80-90 км располагается верхний слой гомосферы – мезосфера, в пределах которого температура вновь уменьшается с высотой[2].
Оболочка атмосферы, располагающаяся над гомосферой, получила название гетеросферы. Она состоит из четырех газовых слоев различного химического состава. На высотах 90-200 км расположен слой молекулярного азота. За ним до высоты порядка 1100 км следует слой атомарного кислорода, в составе которого преобладают атомы кислорода. Далее, между 1100 и 3500 км, прослеживается гелиевый слой. Выше этого уровня он сменяется водородным слоем, в котором преимущественную роль играют атомы водорода. Условной границей водородного слоя считают высоту 10000 км, четкой верхней границы он не имеет.
В данной работе основное внимание будет уделено наиболее важной для биосферы зоне атмосферы – гомосфере и особенно ее нижнему слою – тропосфере[2].
3. Современный состав атмосферы.
Химический состав тропосферы определяется присутствием четырех главных компонентов, составляющих более 99,99% её массы – азота, кислорода, аргона и углекислого газа. Кроме того, постоянными газовыми составляющими атмосферы является так же ряд микрокомпонентов, представленных главным образом редкими инертными газами и водородом. Кроме постоянных составных частей в атмосфере обычно присутствуют в переменных количествах ксенокомпоненты, являющиеся временными примесями, поступление которых обязано вулканической деятельности, жизнедеятельности биосферы, а так же производственной и бытовой деятельности человека. Большая часть ксенокомпонентов атмосферы в повышенных концентрациях оказывает отрицательное влияние на развитие растительности и живых организмов и, таким образом, должна рассматриваться как загрязнитель окружающей среды. К числу ксенокомпенентов атмосферы относятся также поступающие в нее в результате различных процессов пылевые частицы, которые часто мигрируют в воздушной среде на большие расстояние[2].
Таблица 1.
Состав атмосферы Земли (без Н2О )
| Элементы и соединения |
Содержание |
Общая масса, г |
| Об. % |
Вес. % |
| Главные компоненты |
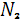
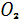
|
78,084
20,946
|
75,51
23,15
|
3,865*
1,184*
|
| Второстепенные компоненты |
Ar
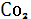
|
0,934
0,033
99,997
|
1,28
0,046
99,986
|
65,5*
2,33*
|
| Микрокомпоненты |
Ne
He
Kr
Xe
H2
|
182*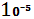
53*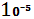
12*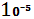
0,9*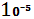
5*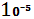
|
125*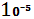
7,2*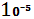
29*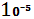
3,6*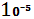
0,3*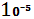
|
63,6*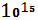
3,7*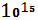
14,6*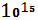
1,8*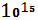
0,2*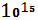
|
| Ксенокомпоненты |
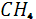
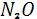
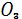
Rn
|
15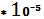
5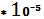
4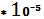
4,5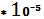
|
9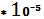
7,6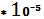
6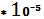
6
|
4,3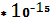
4,0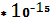
3,1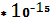
2,32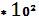
|
4. Главные компоненты атмосферы, их происхождение и источники поступления
4.1 Азот
Это главный химический элемент тропосферы, имеющий огромное значение для развития жизни на нашей планете. Из 16*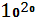 моль азота, присутствующих в земной коре, 2,7* моль азота, присутствующих в земной коре, 2,7*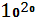 моль находится в виде моль находится в виде 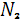 в атмосфере, 0,014* в атмосфере, 0,014*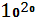 моль растворено в океанических водах и 10,3* моль растворено в океанических водах и 10,3*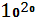 моль в той или иной форме заключены в горных породах литосферы[8]. моль в той или иной форме заключены в горных породах литосферы[8].
Азот постоянно поступает в атмосферу из глубин Земли с вулканическими эманациями, которые содержат от первых единиц до нескольких десятков процентов молекулярного азота (в газах лав гавайских вулканов, например, содержится 5,7 вес. % 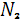 ). Еще более высокое содержание азота отмечается в газах горячих источников, получивших в связи с этим наименование азотных терм. Лишь около 0,0014* ). Еще более высокое содержание азота отмечается в газах горячих источников, получивших в связи с этим наименование азотных терм. Лишь около 0,0014*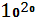 моль азота играют активную роль в круговороте этого элемента, однако роль эта весьма важна. В биосфере происходят широкая аккумуляция и фиксация азота из воздуха различными группами микроорганизмов, заключающаяся в превращении молекулярного азота моль азота играют активную роль в круговороте этого элемента, однако роль эта весьма важна. В биосфере происходят широкая аккумуляция и фиксация азота из воздуха различными группами микроорганизмов, заключающаяся в превращении молекулярного азота 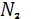 в в 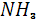 или или  . Процесс этот идет с поглощением энергии. Другие группы бактерий участвуют в окислении . Процесс этот идет с поглощением энергии. Другие группы бактерий участвуют в окислении 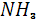 и и  до нитрит-иона до нитрит-иона 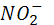 (Nitrosomonas) и далее до нитрат-иона (Nitrosomonas) и далее до нитрат-иона  ( Nitrobacter ) по общей схеме: ( Nitrobacter ) по общей схеме:
Окисление 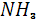 или или 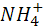 + +  → →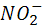 + + ; ;
Нитрификация 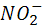 + + → → . .
Оба процесса идут с выделением энергии[2].
Нитраты и нитриты, накапливающиеся таким образом в почве, в свою очередь, ассимилируются растениями. При этом вновь происходит восстановление их до 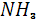 , который затем используется при построении аминогрупп. Важнейшим азотсодержащими соединениями животных и растений являются белки, которые содержат до 18% азота. Таким образом, органическое соединение азота, входящие в состав живого вещества, могут рассматриваться как аккумуляторы энергии[2]. , который затем используется при построении аминогрупп. Важнейшим азотсодержащими соединениями животных и растений являются белки, которые содержат до 18% азота. Таким образом, органическое соединение азота, входящие в состав живого вещества, могут рассматриваться как аккумуляторы энергии[2].
Помимо процессов накопления и связывания азота воздуха растениями в природе, правда, в более ограниченных масштабах, развивается и обратный процесс – денитрификация, осуществляемая в анаэробных условиях некоторыми видами бактерий. При этом процессе, также требующих затрат энергии, нитрат – или нитрит-ионы восстанавливаются до молекулярного азота или 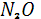 . Подсчитано, что в результате денитрификации с 1 га почвы в атмосферу ежегодно поступает 50-60 кг азота. Процесс этот идет с выделением энергии по следующей общей схеме: . Подсчитано, что в результате денитрификации с 1 га почвы в атмосферу ежегодно поступает 50-60 кг азота. Процесс этот идет с выделением энергии по следующей общей схеме:
COOH-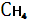 - -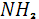 + +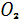 → →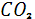 + + + +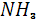 [2]. [2].
В отличие от биосферы, где миграция азота сопровождается образованием и распадом его соединений, для атмосферы образование окислов азота представляет собой хотя и закономерное, но редкое явление. Поэтому соединение азота с кислородом воздуха требует значительной энергии, в атмосфере такого рода реакции происходят только при вспышке молнии. Таким образом, содержание 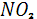 в тропосфере прямо зависит от числа и интенсивности гроз. Об этом можно судить по вариациям содержания нитратов в дождевых водах районов с различным климатом. Максимальное содержание нитрат-иона отмечается в дождевых водах, богатых нрозами тропических регионов, минимальное – в осадках влажных рацонов умеренного климата[2]. в тропосфере прямо зависит от числа и интенсивности гроз. Об этом можно судить по вариациям содержания нитратов в дождевых водах районов с различным климатом. Максимальное содержание нитрат-иона отмечается в дождевых водах, богатых нрозами тропических регионов, минимальное – в осадках влажных рацонов умеренного климата[2].
С азотом связан ряд важных проблем, непосредственно касающихся состояния окружающей среды:
1. Проблема загрязнения атмосферы окислами азота;
2. Эксценссивное использование азота атмосферы в процессах техногенеза;
3. Загрязнение гидросферы и почв продуктами переработки атмосферного азота.
Техногенное поступление окислов азота в тропосферу происходит при всех процессах сжигания твердого и жидкого топлива и для индустриально развитых стран измеряется десятками миллионов тонн в год. Повышая окислительную способность атмосферы и увеличивая кислотность метеорных осадков, а так же содержание нитратов в водах районов загрязнения , аномальные концентрации окислов азота воздухе могут привлечь нежелательные изменения развития экосистем, являясь отрицательным фактором для окружающей среды. В списке наиболее важных загрязнителей, рекомендуемых для международного контроля, окислы азота помещены на пятом месте.
Не менее, а может быть более серьезную проблему для окружающей среды представляют извлечение и использование азота воздуха человеком для разнообразных промышленных и главным образом сельскохозяйственных нужд (азотные удобрения). В результате количество неактивного азота, извлекаемого из атмосферы и преобразуемого в активные соединения азота с кислородом и водородом, в конечном итоге превышает поступление его в атмосферу в результате денирификации[2].
4.2 Кислород
Запасы кислорода в атмосфере составляют порядка 1,5*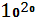 моль . Единственным источником поступления кислорода в окружающую среду являются процессы фотосинтеза. Зеленые растения биосферы ежегодно выделяют в атмосферу около 4,67* моль . Единственным источником поступления кислорода в окружающую среду являются процессы фотосинтеза. Зеленые растения биосферы ежегодно выделяют в атмосферу около 4,67*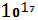 г кислорода. Из этого количества 11,3% производят наземные растения и 88,7% водные растения. Таким образом, растения и особенно растения океана играют исключительную роль в накоплении кислорода в атмосфере Земли. В процессах гипергенеза на поверхность земной коры происходит непрерывное связывание свободного кислорода атмосферы при окислении закисного железа ( с образованием окисного ), соединений двухвалентного марганца, сульфидов, органических остатков[3]. г кислорода. Из этого количества 11,3% производят наземные растения и 88,7% водные растения. Таким образом, растения и особенно растения океана играют исключительную роль в накоплении кислорода в атмосфере Земли. В процессах гипергенеза на поверхность земной коры происходит непрерывное связывание свободного кислорода атмосферы при окислении закисного железа ( с образованием окисного ), соединений двухвалентного марганца, сульфидов, органических остатков[3].
За всю историю существования нашей планеты в результате бактериального и растительного фотосинтеза выделилось 1,8-2,3* г г  . Эта величина получена на основе данных о количестве органического углерода, захороненного в осадках. Для окисления горных пород, находящихся на Земле, потребовалось бы почти на порядок большее количество кислорода. Следовательно, фотосинтезирующие организмы могли лишь частично сформировать кислородную атмосферу Земли[3]. . Эта величина получена на основе данных о количестве органического углерода, захороненного в осадках. Для окисления горных пород, находящихся на Земле, потребовалось бы почти на порядок большее количество кислорода. Следовательно, фотосинтезирующие организмы могли лишь частично сформировать кислородную атмосферу Земли[3].
На основе изучения изотопного состава 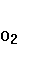 воздуха показано, что кислород атмосферы состоит на 2/3 из кислорода геологического происхождения и на 1/3 из кислорода, генерированного фотосинтезирующими организмами. Первичный кислород образовался в результате дегазации базальтовой магмы ( поступление воздуха показано, что кислород атмосферы состоит на 2/3 из кислорода геологического происхождения и на 1/3 из кислорода, генерированного фотосинтезирующими организмами. Первичный кислород образовался в результате дегазации базальтовой магмы ( поступление 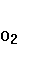 из земных недр продолжается и в настоящее время). Коллектором этого газа служат воды океана. Биогенный кислород появился позже. В итоге современная атмосфера формируется за счет как абиогенного, так и биогенного кислорода. из земных недр продолжается и в настоящее время). Коллектором этого газа служат воды океана. Биогенный кислород появился позже. В итоге современная атмосфера формируется за счет как абиогенного, так и биогенного кислорода.
Деятельность человека в основном направлена на уменьшение количества кислорода в атмосфере. В связывании свободного кислорода воздуха заключается сущность сжигания любого органического топлива. Ежегодно человеком в процессе сжигания из атмосферы извлекается около 9*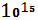 г кислорода, что составляет почти 2% его количества, вырабатываемого за этот период растениями биосферы. Отрицательное влияние деятельности человека на развитие лесов также вносит ощутимый «вклад» в уменьшение поступления кислорода в атмосферу вследствие фотосинтеза. Хотя эта отрицательная роль человека в некоторой степени компенсируется орошением и сельскохозяйственным озеленением засушливых земель, однако масштабы этих процессов до настоящего времени несоизмеримы[2]. г кислорода, что составляет почти 2% его количества, вырабатываемого за этот период растениями биосферы. Отрицательное влияние деятельности человека на развитие лесов также вносит ощутимый «вклад» в уменьшение поступления кислорода в атмосферу вследствие фотосинтеза. Хотя эта отрицательная роль человека в некоторой степени компенсируется орошением и сельскохозяйственным озеленением засушливых земель, однако масштабы этих процессов до настоящего времени несоизмеримы[2].
5. Второстепенные компоненты атмосферы
5.1 Аргон
Это наиболее распространенный инертный газ атмосферы, который почти полностью имеет радиогенное происхождение и образуется в результате распада радиоактивного изотопа калия-40 по схеме
 +е→ +е→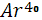 . .
Период полураспада 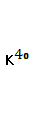 , который составляет 0,0119% природного калия, равен 1,3 млрд. лет. Таким образом, поступление аргона в воздушную оболочку Земли из литосферы происходит постоянно. Изотопный состав следующий: , который составляет 0,0119% природного калия, равен 1,3 млрд. лет. Таким образом, поступление аргона в воздушную оболочку Земли из литосферы происходит постоянно. Изотопный состав следующий: 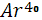 96,6%; 96,6%;  0,063%; 0,063%;  0,337%[2]. 0,337%[2].
5.2 Углекислый газ
В атмосфере содержится 58*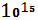 моль углерода в составе углекислого газа. В отличие от кислорода, основная масса которого заключена в атмосфере, лишь около 2% свободного моль углерода в составе углекислого газа. В отличие от кислорода, основная масса которого заключена в атмосфере, лишь около 2% свободного 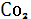 находится в газообразном состоянии в воздухе. Оставшиеся 98% углекислого газа ( 2943* находится в газообразном состоянии в воздухе. Оставшиеся 98% углекислого газа ( 2943*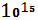 моль углерода) растворены в гидросфере и, таким образом, заключены в Мировом океане[3]. моль углерода) растворены в гидросфере и, таким образом, заключены в Мировом океане[3].
Зеленые растения в процессе фотосинтеза накапливают углерод из воздуха, превращая углекислый газ в сложные углеводороды, имеющие общую формулу –СООН-. Биологический цикл углерода в окружающей среде может быть изображен следующей схемой:
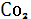 →-СООН-→ →-СООН-→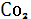
газ тв. вещ-во газ
Органическое вещество, являющееся аккумулятором солнечной энергии, в определенных условиях после гибели растений и живых организмов может быть преобразовано в ископаемые, обогащенные углеродом, твердые и жидкие органические продукты, концентрирующие энергию, аккумулированную живым веществом. Эти продукты – каменный уголь и нефть – являются в настоящее время главной энергетической базой человеческого общества и уже в течение ряда столетий повсеместно используются в качестве горючих полезных ископаемых. Образование последних происходило в результате захоронения органических остатков в осадочных породах, что преграждало доступ к ним свободного кислорода. В противном случае в процессе разложения весь углерод органического веществ был окислен до 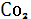 .Особенно благоприятные условия для захоронения отмерших растительных остатков в девонском и каменноугольном периодах палеозойской эры. Захоронение органических остатков в течение геологического времени сохранило в атмосфере значительное количество кислорода. На важную роль геохимическую роль захоронения углерода для формирования кислородной атмосферы земного шара указывал В. И. Вернадский. Однако в последнее столетие человек с поразительной быстротой использует горючие ископаемые, которые накапливались в земной коре в течение сотен миллионов лет. Ежегодно в атмосферу выводится порядка 0,42* .Особенно благоприятные условия для захоронения отмерших растительных остатков в девонском и каменноугольном периодах палеозойской эры. Захоронение органических остатков в течение геологического времени сохранило в атмосфере значительное количество кислорода. На важную роль геохимическую роль захоронения углерода для формирования кислородной атмосферы земного шара указывал В. И. Вернадский. Однако в последнее столетие человек с поразительной быстротой использует горючие ископаемые, которые накапливались в земной коре в течение сотен миллионов лет. Ежегодно в атмосферу выводится порядка 0,42*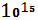 моль углерода. Столь значительные поступления техногенного углекислого газа в течение последнего столетия существенно увеличили его содержание в атмосфере. Эффект воздействия растущей концентрации моль углерода. Столь значительные поступления техногенного углекислого газа в течение последнего столетия существенно увеличили его содержание в атмосфере. Эффект воздействия растущей концентрации 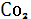 в атмосфере на окружающую среду в течение длительного времени обсуждается специалистами. Главную заботу при этом вызывает способность углекислого газа к абсорбции длинноволнового излучения, что может привести к так называемому парниковому эффекту, следствием которого должно быть постепенное потепление климата. При существующих масштабах накопления в атмосфере на окружающую среду в течение длительного времени обсуждается специалистами. Главную заботу при этом вызывает способность углекислого газа к абсорбции длинноволнового излучения, что может привести к так называемому парниковому эффекту, следствием которого должно быть постепенное потепление климата. При существующих масштабах накопления 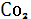 расчетный уровень потепления составляет 2ºС[3]. расчетный уровень потепления составляет 2ºС[3].
При переходе человечества на использование иных видов энергии ( ядерной, солнечной, геотермальной и т. д. приток 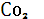 в атмосферу резко сократится. При сохранении существующих темпов роста потребления ископаемого топлива запасов каменного угля на Земле хватит на 150 лет, а нефти и газа соответственно на 50 и 49 лет. Таким образом, после 2020 г следует ожидать резкого уменьшения поступления техногенного в атмосферу резко сократится. При сохранении существующих темпов роста потребления ископаемого топлива запасов каменного угля на Земле хватит на 150 лет, а нефти и газа соответственно на 50 и 49 лет. Таким образом, после 2020 г следует ожидать резкого уменьшения поступления техногенного 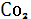 в атмосферу. В последующие несколько тысяч лет в результате регулирующего воздействия океана содержание углекислого газа в атмосфере будет понижено до уровня, соответствующего природному равновесию[1]. в атмосферу. В последующие несколько тысяч лет в результате регулирующего воздействия океана содержание углекислого газа в атмосфере будет понижено до уровня, соответствующего природному равновесию[1].
6.Микрокомпоненты атмосферы
6.1 Редкие инертные газы ( неон, криптон, гелий, ксенон, радон)
Инертные газы в условиях атмосферы Земли и в биосфере не вступают в какие-либо химические реакции, полностью оправдывая свое название. Наиболее распространенный из них – аргон – по массе составляет более 1% атмосферы, а наименее распространенный – радон – всего 6*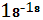 %[5]. %[5].
Происхождение основной массы неона 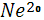 в атмосфере остается не вполне ясным. в атмосфере остается не вполне ясным. 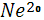 является самым распространенным, стабильным изотопом атмосферного неона ( 90,92% ). По всей вероятности, он освобождается и поступает в атмосферу в процессе разрушения магматических горных пород, а так же из вулканических источников. Два других стабильных изотопа является самым распространенным, стабильным изотопом атмосферного неона ( 90,92% ). По всей вероятности, он освобождается и поступает в атмосферу в процессе разрушения магматических горных пород, а так же из вулканических источников. Два других стабильных изотопа  (0,257%) и (0,257%) и 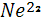 (8,82%), судя по имеющимся данным, имеют радиогенное происхождение. Считается, что основная масса неона в связи с легкостью этого газа ( неон легче в 1,5 раза воздуха) была потеряна атмосферой на ранних стадиях геологической эволюции Земли[6]. (8,82%), судя по имеющимся данным, имеют радиогенное происхождение. Считается, что основная масса неона в связи с легкостью этого газа ( неон легче в 1,5 раза воздуха) была потеряна атмосферой на ранних стадиях геологической эволюции Земли[6].
Криптон ксенон – весьма редкие инертные газы, находящиеся в атмосфере в состоянии крайнего рассеяния. Они поступают в атмосферу с вулканическими эманациями и газами термальных источников[3].
Гелий – наиболее легкий из инертных газов, являющийся конечным продуктом распада урана и тория. Каждый грамм урана, рассеянного в горных породах, в течение года выделяет 1,16* мл гелия, каждый грамм тория соответственно 2,43* мл гелия, каждый грамм тория соответственно 2,43* мл. В отличие от прочих инертных газов гелий, несмотря на крайне низкое его содержание в атмосфере, в ряде случаев накапливается в литосфере в значительных количествах, играя заметную роль в составе рудничных газов, а также в природных газах, богатых азотом. Обогащены гелием и газы некоторых термальных источников. Количество гелия, поступившего в атмосферу в процессе геологической эволюции литосферы, должно быть значительно больше его количества, присутствующего в настоящее время в тропосфере и стратосфере. В этой связи был сделан вывод о непрерывном уходе (диссипации) гелия из атмосферы Земли в космическое пространство. В космосе и атмосфере Солнца гелий в отличие от атмосферы Земли является вслед за водородом наиболее распространенным элементом[2]. мл. В отличие от прочих инертных газов гелий, несмотря на крайне низкое его содержание в атмосфере, в ряде случаев накапливается в литосфере в значительных количествах, играя заметную роль в составе рудничных газов, а также в природных газах, богатых азотом. Обогащены гелием и газы некоторых термальных источников. Количество гелия, поступившего в атмосферу в процессе геологической эволюции литосферы, должно быть значительно больше его количества, присутствующего в настоящее время в тропосфере и стратосфере. В этой связи был сделан вывод о непрерывном уходе (диссипации) гелия из атмосферы Земли в космическое пространство. В космосе и атмосфере Солнца гелий в отличие от атмосферы Земли является вслед за водородом наиболее распространенным элементом[2].
Радон – радиоактивный инертный газ – вследствие своей недолговечности не является постоянным компонентом атмосферы и поэтому рассматривается в группе ксенокомпонентов атмосферы[2].
6.2 Водород
Содержание свободного водорода в атмосфере ничтожно. Его источником являются вулканические процессы, многие магматические и осадочные горные породы, а так же биогенные процессы, идущие при участии водородообразующих бактерий[2].
В атмосфере водород неустойчив и легко соединяется с кислородом. Таким образом, его относительно постоянное на данный геологический период содержание в атмосфере может рассматриваться как динамическое равновесие, определяемое физико-химическими и гравитационными факторами. Большинство исследователей признает возможность ухода (диссипации) атомов водорода за пределы атмосферы в космическое пространство.
Из числа изотопов водорода в атмосфере присутствуют тритий 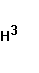 - Т, количество которого измеряется значением 4* - Т, количество которого измеряется значением 4*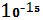 ат. %. Тритий образуется естественным путем в верхних слоях атмосферы в результате бомбардировки атомов азота нейтронами космических лучей по схеме ат. %. Тритий образуется естественным путем в верхних слоях атмосферы в результате бомбардировки атомов азота нейтронами космических лучей по схеме 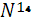 +n→ +n→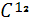 +T. Образование трития имеет место также при ядерных взрывах в атмосфере. Однако в связи с запрещением испытаний атомного оружия в атмосфере количество техногенного трития, имеющего сравнительно короткий период полураспада ( 12,262 лет ), в атмосфере значительно уменьшилось[2]. +T. Образование трития имеет место также при ядерных взрывах в атмосфере. Однако в связи с запрещением испытаний атомного оружия в атмосфере количество техногенного трития, имеющего сравнительно короткий период полураспада ( 12,262 лет ), в атмосфере значительно уменьшилось[2].
7.Ксенокомпоненты атмосферы, включая антропогенные загрязнители.
7.1 Метан и другие газообразные углероды
Незначительное количество метана 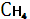 постоянно отмечается в земной атмосфере. Он образуется в процессе разложения органического вещества при условии недостатка кислорода почвах, особенно в болотах ( болотный газ ) и захороненных осадках. Процесс преобразования захороненного органического вещества в каменные угли и жидкие углеводороды сопровождается отделением значительного количества метана. Так, метан составляет около 90% массы газа в его месторождениях. Поступление метана из осадочных толщ, газовых, нефтяных и угольных месторождений, а также из разлагающихся в восстановительных условиях органических остатков является естественным источником этого наиболее простого углеводорода в атмосфере. Некоторая часть метана в биосфере окисляется особыми видами бактерий до углекислого газа и воды по схеме: постоянно отмечается в земной атмосфере. Он образуется в процессе разложения органического вещества при условии недостатка кислорода почвах, особенно в болотах ( болотный газ ) и захороненных осадках. Процесс преобразования захороненного органического вещества в каменные угли и жидкие углеводороды сопровождается отделением значительного количества метана. Так, метан составляет около 90% массы газа в его месторождениях. Поступление метана из осадочных толщ, газовых, нефтяных и угольных месторождений, а также из разлагающихся в восстановительных условиях органических остатков является естественным источником этого наиболее простого углеводорода в атмосфере. Некоторая часть метана в биосфере окисляется особыми видами бактерий до углекислого газа и воды по схеме:
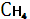 + 2 + 2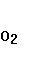 → →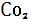 + 2 + 2 . .
Содержание более тяжелых, чем метан углеводородов в тропосфере ничтожно и практически не поддается определению. Тяжелыми углеводородами обогащены газы нефтяных месторождений ( 17% ), в то время как в месторождениях газа среднее содержание тяжелых углеводородов в среднем составляет около 3%[6].
7.2 Окись углерода
В отличие от углекислого газа, являющегося вместе с кислородом основой жизни на Земле. Окись углерода СО не характерна для природных процессов в окружающей среде. Обладая токсическими свойствами, окись углерода отрицательно действует на живые организмы. Концентрации СО, превышающие 10 мг на 1 м³ воздуха, опасны для здоровья человека[2].
Появление окиси углерода в тропосфере является полностью следствием деятельности человека, если исключить образование некоторого количества ее во время лесных пожаров. В этой связи содержание окиси углерода в воздухе может служить объективным показателем степени его загрязненности[2].
Исходя из годового потребления жидкого топлива различными странами, поступление техногенной окиси углерода в тропосферу может быть оценено в 230 млн. т/год[2].
Содержание окиси углерода в воздухе уже в настоящее время в ряде крупных городов (Нью-Йорк, Лос-Анджелес, Токио и др.) представляет угрозу для здоровья людей, особенно в жаркие и безветренные периоды года[2].
7.3 Сероводород
Поступление незначительных количеств природного сероводорода 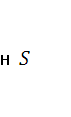 в атмосферу в основном обусловлено процессами бактериального разложения органического вещества в условиях резкого недостатка кислорода. Некоторое количество в атмосферу в основном обусловлено процессами бактериального разложения органического вещества в условиях резкого недостатка кислорода. Некоторое количество 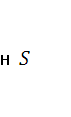 выбрасывается в атмосферу вместе с другими газами в результате вулканических процессов, а также поступает на поверхность с термальными источниками[1]. выбрасывается в атмосферу вместе с другими газами в результате вулканических процессов, а также поступает на поверхность с термальными источниками[1].
Бактерии-десульфузаторы, участвующие в процессах разложения органического вещества, проходящих без доступа воздуха, восстанавливают присутствующий в органических остатках сульфат-ион 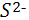 . При этом отработанный у сульфат-иона кислород используется для дальнейшего окисления органического вещества. Бактерии этой группы могут использовать в пищу не только разлагающиеся остатки растений и животных, но также и ископаемые углеводороды – различные битумы, нефть и т. д. По подсчетам, количество сероводорода, ежегодно выделяемого в результате деятельности бактерий-десульфуризаторов, измеряется ( в расчете на серу ) в 4,2* . При этом отработанный у сульфат-иона кислород используется для дальнейшего окисления органического вещества. Бактерии этой группы могут использовать в пищу не только разлагающиеся остатки растений и животных, но также и ископаемые углеводороды – различные битумы, нефть и т. д. По подсчетам, количество сероводорода, ежегодно выделяемого в результате деятельности бактерий-десульфуризаторов, измеряется ( в расчете на серу ) в 4,2*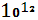 моль. Из них лишь 1,0* моль. Из них лишь 1,0*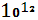 моль поступает с континентов, а остальная часть ( 3,2* моль поступает с континентов, а остальная часть ( 3,2*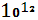 моль) поставляется океанами[1]. моль) поставляется океанами[1].
В тропосфере сероводород неустойчив и в результате реакции с кислородом воздуха преобразуется в S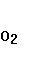 . Хотя эта реакция в изолированных условиях протекает достаточно медленно, однако присутствие в тропосфере аэрозолей и мельчайших капелек воды резко ускоряет ее прохождение[1]. . Хотя эта реакция в изолированных условиях протекает достаточно медленно, однако присутствие в тропосфере аэрозолей и мельчайших капелек воды резко ускоряет ее прохождение[1].
Повышение концентрации 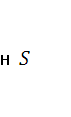 в воздухе представляет опасность для здоровья и даже жизни живых существ, в том числе и человека. В этой связи промышленные источники, выделяющие в составе отходов в воздухе представляет опасность для здоровья и даже жизни живых существ, в том числе и человека. В этой связи промышленные источники, выделяющие в составе отходов 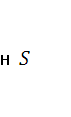 , должны строго контролироваться. К их числу относится ряд химических производств, в том числе процессы переработки каменных углей, осуществляемые без доступ воздуха, и т. д[1]. , должны строго контролироваться. К их числу относится ряд химических производств, в том числе процессы переработки каменных углей, осуществляемые без доступ воздуха, и т. д[1].
7.4 Сернистый газ
Содержание природного  в атмосфере ничтожно, его источниками являются вулканические процессы и окисление в воздухе сероводорода, поступающего в результате жизнедеятельности бактерий-десульфузаторов. Незначительные количества в атмосфере ничтожно, его источниками являются вулканические процессы и окисление в воздухе сероводорода, поступающего в результате жизнедеятельности бактерий-десульфузаторов. Незначительные количества  выделяются в воздух также в результате окисления с поверхности рудных месторождений, содержащих сульфиды. В почвенном воздухе над месторождениями сульфидных руд содержание сернистого газа составляет 25-50 частей на миллиард при фоновой концентрации от -15 до 10 частей на миллиард. Таким образом, источники природного выделяются в воздух также в результате окисления с поверхности рудных месторождений, содержащих сульфиды. В почвенном воздухе над месторождениями сульфидных руд содержание сернистого газа составляет 25-50 частей на миллиард при фоновой концентрации от -15 до 10 частей на миллиард. Таким образом, источники природного  ограничены в масштабах. Однако поступление в тропосферу значительных количеств техногенного сернистого газа уже в настоящее время представляет одну из наиболее серьезных проблем загрязнения окружающей среды[2]. ограничены в масштабах. Однако поступление в тропосферу значительных количеств техногенного сернистого газа уже в настоящее время представляет одну из наиболее серьезных проблем загрязнения окружающей среды[2].
Присутствие  в атмосфере оказывает не только прямое отрицательное воздействие на жизнедеятельность животных и растений. Взаимодействуя с кислородом воздуха, в атмосфере оказывает не только прямое отрицательное воздействие на жизнедеятельность животных и растений. Взаимодействуя с кислородом воздуха,  преобразуется в крайне реакционноспособный преобразуется в крайне реакционноспособный 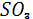 , который с водой атмосферы дает серную кислоту. Разрушительные свойства последней общеизвестны. Реакция окисления сернистого газа до , который с водой атмосферы дает серную кислоту. Разрушительные свойства последней общеизвестны. Реакция окисления сернистого газа до 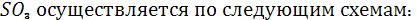
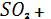 О +М → О +М →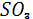 + + 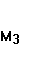 ; ;
2 + + 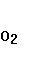 + окислители → + окислители → 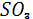 ; ;
 + +  → → 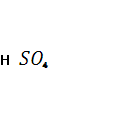 . .
Где М – любая молекула газа. Первая реакция требует одновременно столкновения молекулы  , атомарного газа и любой другой газообразной молекулы, которая служит для отвода образуемой в процессе столкновения и реакции энергии. Иначе этот процесс же пойдет в обратном направлении и , атомарного газа и любой другой газообразной молекулы, которая служит для отвода образуемой в процессе столкновения и реакции энергии. Иначе этот процесс же пойдет в обратном направлении и 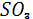 вновь будет преобразован в вновь будет преобразован в 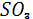 с отщеплением атома кислорода. Особенно благоприятные условия для прохождения этой реакции существуют в пределах озонового слоя атмосферы, где атомарный кислород непрерывно генерируется в процессе распада молекул на О и с отщеплением атома кислорода. Особенно благоприятные условия для прохождения этой реакции существуют в пределах озонового слоя атмосферы, где атомарный кислород непрерывно генерируется в процессе распада молекул на О и 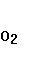 . В результате в стратосфере на высоте порядка 18 км существует слой с повышенной концентрацией . В результате в стратосфере на высоте порядка 18 км существует слой с повышенной концентрацией 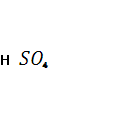 , поскольку , поскольку 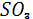 легко соединяется с присутствующей в атмосфере водой. Вторая реакция для быстрого осуществления требует присутствия окислителей. Последние всегда накапливаются в воздухе, загрязненном в результате производственной деятельности человека. Таким образом, окисление легко соединяется с присутствующей в атмосфере водой. Вторая реакция для быстрого осуществления требует присутствия окислителей. Последние всегда накапливаются в воздухе, загрязненном в результате производственной деятельности человека. Таким образом, окисление  до до 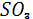 с последующим образованием серной кислоты особенно интенсивно происходит в атмосфере городов и в районах промышленных предприятий[2]. с последующим образованием серной кислоты особенно интенсивно происходит в атмосфере городов и в районах промышленных предприятий[2].
Высокая растворимость 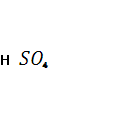 , образующейся в результате окисления сернистого газа, в воде определяет быстрое удаление серной кислоты из атмосферы с дождями. В результате проблема загрязнения атмосферы сернистым газом слилась с проблемой «кислых дождей». Возможные экологические последствия столь резкого окисления дождевых вод пока еще не вполне ясны. Беспокойство экологов, в частности, вызывает влияние кислых дождевых вод на растительность, связанное с интенсивным выщелачиванием почв. Было зафиксировано также резко отрицательное воздействие увеличения кислотности речной и озерной воды на рыбную фауну. Исследования по программе «Здоровье населения и система наблюдений за окружающей средой», выполнявшиеся в рамках ООН, показали, что вредное воздействие на здоровье населения в большой мере оказывают присутствующие в воздухе сульфаты, чем сернистый газ, не окисленный еще до состояния , образующейся в результате окисления сернистого газа, в воде определяет быстрое удаление серной кислоты из атмосферы с дождями. В результате проблема загрязнения атмосферы сернистым газом слилась с проблемой «кислых дождей». Возможные экологические последствия столь резкого окисления дождевых вод пока еще не вполне ясны. Беспокойство экологов, в частности, вызывает влияние кислых дождевых вод на растительность, связанное с интенсивным выщелачиванием почв. Было зафиксировано также резко отрицательное воздействие увеличения кислотности речной и озерной воды на рыбную фауну. Исследования по программе «Здоровье населения и система наблюдений за окружающей средой», выполнявшиеся в рамках ООН, показали, что вредное воздействие на здоровье населения в большой мере оказывают присутствующие в воздухе сульфаты, чем сернистый газ, не окисленный еще до состояния 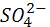 [2]. [2].
7.5 Галоиды
О распространении галоидов в атмосфере имеется очень мало данных. Исключением является хлор, присутствие которого в атмосфере находит отражение в варьирующих содержаниях хлор-иона в дождевых водах. Помимо ничтожной доли хлора, которая поступает в атмосферу с вулканическими газами, содержащими десятые доли процента этого элемента, весь хлор атмосферы является составной частью хлоридов, выдуваемых ветром с поверхностей морей и океана, и в меньшей степени из засоленных почв[6].
Присутствие фтора в атмосфере ничтожно. Некоторое увеличение его содержания ( в два – четыре раза превышающее геохимический фон ) отмечалось над рудными месторождениями, содержащими минералы фтора. Освобождение фтор-иона в данном случае, вероятно, является следствием взаимодействия серной кислоты, образующейся при окислении пирита с наиболее распространенным минералом фтора – флюоритом 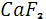 . Техногенное загрязнение воздуха газообразными соединениями фтора HFи . Техногенное загрязнение воздуха газообразными соединениями фтора HFи  обычно отмечается в радиусе нескольких километров от алюминиевых заводов и предприятий по производству суперфосфата. Содержание 1 обычно отмечается в радиусе нескольких километров от алюминиевых заводов и предприятий по производству суперфосфата. Содержание 1  фтора в воздухе губительно действует на некоторые растения. Предельно допустимыми максимальными концентрациями фтор-иона в воздухе являются 0,02 мг/м³ (разовая) и 0,005 мг/м³( среднесуточная)[6]. фтора в воздухе губительно действует на некоторые растения. Предельно допустимыми максимальными концентрациями фтор-иона в воздухе являются 0,02 мг/м³ (разовая) и 0,005 мг/м³( среднесуточная)[6].
7.6 Озон
Содержание озона 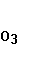 в атмосфере крайне незначительно. Подобно окислам азота озон образуется в атмосфере под действием электрических разрядов во время грозы ( молнии ), а так же синтезируются из кислорода под воздействием коротковолновой космической ультрафиолетовой радиации. В пределах атмосферы повышенные концентрации озона образуют так называемый озоновый слой, имеющий крайне важное значение для жизни на Земле. Нижняя граница озонового слоя располагается на высоте 15-25 км. Максимальная концентрация озона характерна для верхней приграничной зоны слоя, в пределах которой задерживается большая часть ультрафиолетового излучения и происходит синтез молекул озона. Если бы коротковолновое УФ-излучение в начальной его интенсивности достигло бы бисферы, то оно явилось бы губительным для жизни на Земле[3]. в атмосфере крайне незначительно. Подобно окислам азота озон образуется в атмосфере под действием электрических разрядов во время грозы ( молнии ), а так же синтезируются из кислорода под воздействием коротковолновой космической ультрафиолетовой радиации. В пределах атмосферы повышенные концентрации озона образуют так называемый озоновый слой, имеющий крайне важное значение для жизни на Земле. Нижняя граница озонового слоя располагается на высоте 15-25 км. Максимальная концентрация озона характерна для верхней приграничной зоны слоя, в пределах которой задерживается большая часть ультрафиолетового излучения и происходит синтез молекул озона. Если бы коротковолновое УФ-излучение в начальной его интенсивности достигло бы бисферы, то оно явилось бы губительным для жизни на Земле[3].
Играя столь важную для окружающей среды роль в стратосфере, повышенное содержание озона является крайне нежелательным на более низких уровнях, в тропосфере. Являясь сильнейшим окислителем, озон оказывает токсичное и разрушительное действие на живую материю. В тропосфере озон может возникать в результате превращения окислов азота и органического вещества. Таким образом, загрязнение тропосферы техногенными окислами азота в определенных условиях влечет за собой и нежелательное повышение содержания озона в окружающей среде[3].
7.7 Радон
Это инертный газ, являющийся продуктом распада изотопов радия, присутствующих в горных породах в крайне незначительном количестве. Период полураспада наиболее долгоживущего из изотопов радона 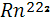 равен всего четырем дням, еще быстрее распадается два других изотопа равен всего четырем дням, еще быстрее распадается два других изотопа 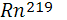 ( актинон) и ( актинон) и 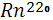 ( торон). Таким образом, изотопы радона, мигрируя из горных пород в атмосферу, быстро распадаются и не успевают достичь ее высоких слоев[6]. ( торон). Таким образом, изотопы радона, мигрируя из горных пород в атмосферу, быстро распадаются и не успевают достичь ее высоких слоев[6].
7.8 Ртуть
Ядовитые свойства ртути выделяют этот легколетучий металл в качестве опасного загрязнителя атмосферы. В результате естественных процессов на поверхность земного шара ежегодно поступает около 1000 т ртути. При этом считается, что поступление ртути в атмосферу из таких естественных источников, как вулканы ( в том числе грязевые ) и фумаролы, превышает количество техногенной ртути, выбрасываемой в воздух человеком, хотя имеющиеся данные недостаточны для такой оценки[5].
Как показали тщательные исследования, ртуть, поступающая в атмосферу, достаточно быстро удаляется из нее с дождевыми водами и просто гравитационным осаждением, обогащая таким образом почвы и гидросферу[5].
Источниками поступления техногенной ртути в атмосферу являются:
-сжигание твердого и жидкого органического топлива ( каменные угли содержат 0,05-13,3 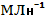 ; ;
-металлургическая переработка руд цветных металлов, как правило, содержащих примеси ртути;
- частичное испарение летучих органических соединений ртути, образованных бактериями, из почв и осадков.
Практически вся ртуть в процессах переработки этих руд возгоняется в воздух. В результате суммарное поступление техногенной ртути в атмосферу, по всей вероятности, несколько превышает 1100 т/год ( без учета частичного испарения органических соединений ртути из почв и осадков, которое количественно оценить невозможно )[5].
8. Атмосфера города Новосибирска
В рейтинге уровня загрязненности атмосферы среди городов –миллионеров Новосибирск занимает серединную строку. Наш город не сравнить с Норильском, где выбросы вредных веществ уже превалили за 2 млн. тонн, но и до Кисловодска ( 700 тонн загрязняющих веществ ) Новосибирску еще очень далеко[10].
Общее увеличение выбросов в 2006 году составило 4,154 тыс. тонн. Это обусловлено, в основном, увеличением парка автомобилей[10].
В 2006 году передвижными источниками выброшено в атмосферу 242,786 тыс. тонн загрязняющих веществ, по сравнению с 2005 годом произошло увеличение количества выбросов на 9,302 тыс. тонн, связанных с увеличением количества автотранспорта на улицах города[10].
В 2006 году стационарными источниками промышленных предприятий города выброшено в атмосферу 104,052 тыс. тонн загрязняющих веществ, в том числе:
-твердые частицы - 23,534 тыс. тонн;
-диоксиды серы – 38,451 тыс. тонн;
- оксид углерода – 11,843 тыс. тонн;
-оксиды азота – 24,457 тыс. тонн;
-углеводороды – 0,097 тыс. тонн;
-летучие органические соединения – 1,746 тыс. тонн;
- прочие газообразные и жидкие вещества – 3,924 тыс. т.
Отчиталось по статистической форме 2- ТП (воздух) за 2006 год 226 предприятий.
Наиболее существенный вклад в загрязнение атмосферы по отрасли электроэнергетики внесли такие предприятия как: подразделения ТЭЦ-2, ТЭЦ-3, ТЭЦ-4, ТЭЦ-5 ОАО «Новосибирскэнерго». По существу, к этому необходимо добавить и выбросы печей частных дмовладений[10].
Таблица 2.
Динамика выбросов загрязняющих веществ о Новосибирских ТЭЦ, тыс. тонн
| Загрязняющие вещества |
Годы |
| 2003 |
2004 |
2005 |
2006 |
| Зола угольная |
16,1 |
16,2 |
19,7 |
17,-15 |
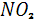 |
22,93 |
21,21 |
26,6 |
25,-15 |
 |
29,74 |
29,71 |
36,2 |
35,86 |
| CO |
1,89 |
1,50 |
1,70 |
1,58 |
| Всего |
74,4 |
72,13 |
84,22 |
81,93 |
Динамика выбросов напрямую зависит от количественного и качественного состава сожженного топлива. По сравнению с 2005 годом произошло снижение выбросов за счет снижения объемов сожженного угля – основного вида топлива ТЭЦ г. Новосибирска.
Предприятия, которые также оказывают влияние на состояние атмосферного воздуха, расположены по всей территории города.
По сравнению с 2005 годом выбросы загрязняющих веществ в атмосферу от стационарных источников уменьшилось на 5,148 тыс. тонн ( 4,7%), в основном, за счет уменьшения расходов сожженного топлива. Анализ порайонных выбросов показывает, что общее уменьшение выбросов по городу произошло за счет уменьшения выбросов в Калининском районе. Это, в свою очередь, обусловлено снижением выбросов от основного вкладчика предприятий Калининского района – ТЭЦ – 4[7].
По показателям выбросов о стационарных источников самые неблагоприятные районы: Октябрьский, Ленинский и Калининский (районы расположения ТЭЦ города ). По остальным районам разница валовых выбросов в 2005 и 2006 годах незначительная, как в сторону увеличения, так и в сторону уменьшения выбросов[7].
Вследствие функционирования большого количества промышленных предприятий, предприятий теплоэнергетического комплекса, а также увеличения количества автотранспорта на автомагистралях Новосибирска, воздух города загрязнен специфическими примесями: метаном, ксилолом, толуолом, аммиаком, сажей[10].
Таблица 3.
Валовый выброс загрязняющих веществ от различных источников
| Годы |
Новосибирские ТЭЦ, т/га |
% |
Котельные
т/г
|
% |
Технологические, т/г |
% |
Автомобили, т/г |
% |
| 2000 |
74942 |
24,7 |
14100 |
4,5 |
12692 |
4,2 |
201131 |
66,4 |
| 2001 |
63301,7 |
21,4 |
10547,7 |
3,6 |
12692 |
4,3 |
209617 |
70,8 |
| 2002 |
67996,6 |
22 |
14359,4 |
5 |
11788 |
4 |
21438 |
69 |
| 2003 |
74402,7 |
23 |
12593,2 |
3,9 |
13058,1 |
4,1 |
219400 |
69 |
| 2004 |
72131,6 |
21,8 |
16959,4 |
5,1 |
9333 |
2,8 |
232351 |
70,3 |
| 2005 |
84223 |
24,6 |
14988 |
4,4 |
9992 |
2,9 |
233484 |
68,1 |
| 2006 |
81930 |
23,6 |
9543 |
2,8 |
12579 |
3,6 |
242786 |
70,0 |
В 206 году наблюдается значительный рост технологических выбросов по сравнению с 2005 годом за счет увеличения объемов производства в городе. Произошло снижение выбросов от источников энергоснабжения города за счет снижения расхода топлива из-за теплой зимы в 2006 г.
Загрязнение атмосферы в городе осталось на прежнем уровне, изменились лишь структура источников загрязнения: если в 2005 году выбросы Нвосибирских ТЭЦ составляли 25%, то в 2006 году – 23,6%, технологические выбросы увеличились в 2006 г. по сравнению с 2005 г. с 2,9% до 3,6% за счет роста производства, выбросы от автотранспорта увеличились с 68% до 70%[10].
Заключение
Оценка и прогноз химического состояния приземной атмосферы, связанного с природными процессами ее загрязнения, существенно отличается от оценки и прогноза качества этой природной среды, обусловленного антропогенными процессами. Вулканической и флюидной активностью Земли, другими природными феноменами нельзя управлять. Речь может идти только о минимизации последствий негативного воздействия, которое возможно лишь в случае глубокого понимания особенностей функционирования природных систем разного иерархического уровня, и, прежде всего, Земли как планеты. Необходим учет взаимодействия многочисленных факторов, изменчивых во времени и пространстве, К главным факторам относятся не только внутренняя активность Земли, но и ее связи с Солнцем, космосом. Поэтому мышление «простыми образами» при оценке и прогнозе состояния приземной атмосферы недопустимо и опасно.
Как уже отмечалось выше, на территории города произошло незначительное уменьшение выбросов загрязняющих веществ в атмосферу от стационарных источников на 5,151 тыс. тонн ( 4,7%), в основном за счет уменьшения расходов сожженного угля ( основного энергетического топлива ТЭЦ г. Новосибирска ). Общее увеличение выбросов вредных веществ в атмосферу в 2006 г. по сравнению с 2005 г. произошло за счет увеличения автотранспорта на 9,302 тыс. тонн (3,8%).
Список используемой литературы.
1) Батчер А. Введение в химию биосферы. –Издательство «Мир», Москва 1977 г.
2) Беус А.А. Геохимия окружающей среды. –Издательство «Недра», Москва 1976 г.
3) Бримблкумб П. Состав и химия атмосферы.- Издательство «Мир», Москва 1988 г.
4) Галимов Э.М. Проблема зарождения и эволюции биосферы.- Москва 2008 г.
5) Исидоров В.А. Органическая химия атмосферы.- «Химиздат», С.-Петербург 2001 г.
6) Мак-Ивел М., Филлипс Л. Химия атмосферы.-Издательство «Мир», Москва 1978 г.
7) Селегей Т.С. Формирование уровня загрязнения атмосферного воздуха в городах Западной Сибири. –Издательство «Наука», Новосибирск 2005 г.
8) Суркова Г.В. Химия атмосферы.- Издательство «Москва Университет» 2007 г.
9) Тарасова Н.П. Химия окружающей среды.- «ИКЦ Академкнига», Москва 2007 г.
10)Журнал о состоянии атмосферного воздуха г.Новосибирска, 2006 г.
Содержание
Введение
1. Появление атмосферы и ее первичный состав………………..5
2. Слои атмосферы…………………………………………………7
3. Современный состав атмосферы………………………………8
4. Главные компоненты атмосферы, их происхождение и источники поступления………………………………………..10
4.1 Азот…………………………………………………………10
4.2 Кислород…………………………………………………..14
5. Второстепенные компоненты атмосферы……………………..16
5.1 Аргон……………………………………………………....16
5.2 Углекислый газ……………………………………………17
6. Микрокомпоненты атмосферы…………………………………20
6.1 Редкие инертные газы……………………………………20
6.2 Водород……………………………………………………22
7.Ксенокомпоненты атмосферы, включая антропогенные загрязнители………………………………………………………..23
7.1 Метан и другие газообразные углероды…………………23
7.2 Окись углерода……………………………………………..24
7.3 Сероводород………………………………………………..25
7.4 Сернистый газ………………………………………………27
7.5 Галоиды……………………………………………………..30
7.6 Озон………………………………………………………….31
7.7 Радон………………………………………………………...32
7.8 Ртуть…………………………………………………………33
8.Атмосфера г. Новосибирска……………………………………..34
Заключение………………………………………………………….38
|