Министерство Образования Российской Федерации
ГОУ ВПО «Уральский Государственный Технический Университет-УПИ»
Кафедра технологии органического синтеза
Реферат
по микробиологии
«Получение газообразного и жидкого топлива. Получение биогаза, метана, спиртов, тепловой энергии и молекулярного водорода»
Преподаватель:
Студентка гр.
Екатеринбург
2005
Содержание
Введение 3
1. Получение газообразного и жидкого топлива 4
2. Биогаз 5
2.1 Свойства метанобразующих бактерий 7
2.2 Технология получения метана 10
3. Получение спиртов 14
4. Получение тепловой энергии при бактериальном окислении 16
5. Получение молекулярного водорода 17
5.1 Образование молекулярного водорода хемотрофами 18
5.2 Образование молекулярного водорода фототрофами 19
Заключение 23
Список литературы 24
Введение
В наше время все острее становится вопрос об изыскании надежных, альтернативных, экологически чистых, постоянно возобновляемых источников энергии и создании энергосберегающих технологий. С проблемами современной энергетики тесно смыкается решение задач по проблеме охраны окружающей среды. Необходимо разработать научные методы и технологии получения энергии при одновременном решении вопросов, связанных с защитой окружающей среды от непрерывно поступающих в биосфер загрязнений.
Последние два десятилетия характеризуются выдающимися достижениями биотехнологии, являющейся междисциплинарной областью знаний, базирующейся на микробиологии, биохимии, молекулярной биологии, биоорганической химии, биофизике, вирусологии, иммунологии, генетике, инженерных науках и электронике.
В настоящее время достижения биотехнологии перспективны во многих отраслях:
в промышленности, в экологии, в медицине, в сельском хозяйстве и в энергетике.
В частности, в энергетике – это применение новых источников биоэнергии, полученных на основе микробиологического синтеза и моделированных фотосинтетических процессов, биоконверсии биомассы в биогаз.
Развитие биотехнологии позволяет существенно интенсифицировать производство, повышать эффективность использования природных ресурсов, решать экологические проблемы, создавать новые источники энергии.
Все возрастающий дефицит ископаемых топливных ресурсов выдвигает на первый план острую проблему создания и внедрения возобновляемых источников энергиии сырья за счет биосистем: растений и фототрофных микроорганизмов, конвертирующих с высокой эффективностью солнечную энергию в энергию химических связей.
Реклама

Экологически чистую энергию можно получать также путем преобразования солнечной энергии в электрическую с помощью солнечных коллекторов, а также из биогаза и микробного этанола.
П
ОЛУЧЕНИЕ ГАЗООБРАЗНОГО
И ЖИДКОГО ТОПЛИВА
В качестве одного из основных источников энергии будущего рассматривают конверсию энергии Солнца. Благодаря прямому использованию различных форм солнечной энергии (тепловой, фотоэлектрической, энергии ветра и биомассы, образуемой в результате фотосинтеза) можно избежать теплового загрязнения, твердых и газообразных выбросов в биосферу, сохранить тепловой и углекислотный баланс в атмосфере и существенно уменьшить потребление ископаемых топлив. В последнее время серьезное внимание уделяется биологическим методам конверсии солнечной энергии, среди которых фотосинтез занимает ведущее место.
В процессе фотосинтеза ежегодно конвертируется 3×1024
Дж солнечной радиации. Это позволяет только в континентальных лесах накапливать до 70 млрд. т биомассы, что по своему энергосодержанию втрое превышает современное потребление энергии в мире. Использование биомассы в качестве источника топлива открывает определенные перспективы решения проблемы энергетики и охраны окружающей среды. Наиболее реальными являются два основных метода получения топлива из биомассы: биологическая конверсия и термохимическая конверсия.
Биологическая конверсия
включает анаэробные микробиологические процессы: получение метана (биогаза), молекулярного водорода, этилового спирта, бутанола, ацетона и других растворителей, а также органических кислот. Несколько в сторонеот этих процессов стоит метод получения тепловой энергии при аэробной микробиологической деструкции твердой биомассы.
Основную часть воспроизводимой биомассы составляет древесина (лигноцеллюлоза), которая из-за особенностей своего строения с большим трудом поддаётся биологической конверсии. Поэтому в ближайшие годы основным сырьем для производства топлив методом биоконверсии будут служить легко трансформируемые органические соединения — отходы, образовавшиеся в результате промышленных и других переработок первичной биомассы. В развитых странах в год на одного человека приходится до 5 т органических отходов по сухому веществу. Многие из них представляют серьезную экологическую опасность и требуют незамедлительного обеззараживания, утилизации и уничтожения. С ростом производств и урбанизацией происходит концентрация этих отходов, что требует, с одной стороны, применения неотложных мер с целью их обезвреживания, с другой — позволяет применить прогрессивные технологии переработки с возможным вторичным получением топлива.
Реклама

Для решения этих задач в ближайшее время будут использованы в основном два метода биологической конверсии органических отходов в топливо: 1) так называемое метановое брожение с получением биогаза; 2) спиртовое брожение с получением этанола. Это определено, во-первых, физическими характеристиками получаемых топлив, во-вторых, относительной простотой и низкой стоимостью технологий, конкурентоспособных с технологиями получения обычных топлив и, в-третьих, особенностями процессов, позволяющих эффективно обезвреживать и утилизировать отходы.
БИОГАЗ
Биогаз — это смесь из 65 % метана, 30 % СО2
, 1 % сероводорода и незначительных примесей азота, кислорода, водорода и угарного газа. Энергия, заключенная в 28 м3
биогаза, эквивалентна энергии: 16,8 м3
природного газа; 20,8 л нефти; 18,4 л дизельного топлива. В основе получения биогаза лежит процесс метанового брожения, или биометаногенез — процесс превращения биомассы в энергию.
Биометаногенез
— сложный микробиологический процесс, в котором органическое вещество разлагается до диоксида углерода и метана в анаэробных условиях. Микробиологическому анаэробному разложению поддаются практически все соединения природного происхождения, а также значительная часть ксенобиотиков органической природы. В анаэробном процессе биометаногенеза выделяют три последовательные стадии, в которых участвуют свыше 190 различных микроорганизмов. На первой стадии
под влиянием экстрацеллюлярных ферментов ферментативному гидролизу подвергаются сложные многоуглеродные соединения — белки, липиды и полисахариды. Вместе с гидролитическими бактериями функционируют и микроорганизмы — бродильщики, которые ферментируют моносахариды, органические кислоты.
На второй стадии
(ацидогенез) в процессе ферментации участвуют две группы микроорганизмов: ацетогенные и гомоацетатные. Ацетогенные Н2
-продуцирующие микроорганизмы ферментируют моносахариды, спирты и органические кислоты с образованием Н2
, СО2
, низших жирных кислот, в основном ацетата, спиртов и некоторых других низкомолекулярных соединений. Деградация бутирата, пропионата, лактата с образованием ацетата происходит при совместном действии ацетогенных Н2
-продуцирующих и Н2
-утилизирующих бактерий. Гомоацетатные микроорганизмы усваивают Н2
и СО2
, а также некоторые одноуглеродные соединения через стадию образования ацетил-КоА и превращения его в низкомолекулярные кислоты, в основном в ацетат.
На заключительной третьей стадии
анаэробного разложения отходов образуется метан. Он может синтезироваться через стадию восстановления СО2
молекулярным водородом, а также из метильной группы ацетата. Некоторые метановые бактерии способны использовать в качестве субстрата формиат, СО2
, метанол, метиламин и ароматические соединения (рис. 1)
Органические кислоты, спирты,
NH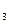 ,СО2
и Н2 ,СО2
и Н2
|
|
 Углеводы, белки и другие биополимеры Углеводы, белки и другие биополимеры |
     СО2
+ СН4 СО2
+ СН4
Рис. 1 Деструкция биополимеров до метана природными ассоциациями микроорганизмов, протекающая в 3 стадии
В зависимости от температуры протекания процесса метановые бактерии разделяют на мезо- и термофильные. Оптимальная температура для мезофильных бактерий от 30 до 40°С, а для термофильных от 50 до 60°С. В целом термофильный процесс метаногенеза идет интенсивнее мезофильного, притом в этих условиях анаэробной переработки отходов субстрат обеззараживается от патогенной микрофлоры и гельминтов. При анаэробной переработке отходов животноводческих ферм микрофлора метантенков (анаэробных ферментеров) формируется преимущественно из микрофлоры желудочно-кишечного тракта данного вида животных и микрофлоры окружающей среды. Из наиболее часто встречающихся культур следует отметить Lactobacillus
acidophilus,
Butyrivibrio
fibrisolvens,
Peptostreptococcus
productus,
Bacteroides
uniformis,
Eubacterium
aerofaciens.
К числу целлюлозоразлагающих бактерий микрофлоры жвачных относятся Bacteroides
succinoqenes
и Ruminococcus
flavefaciens.
Из рубца и навоза жвачных были изолированы такие метанообразующие бактерии, как Methanobacterium
mobile,
Methanobrevibacter
rumi-
nantium
и Methanosarcina
ssp
. После определенного срока работы метантенка при установленном температурном режиме и на постоянном субстрате образуется сравнительно стабильный консорциум микроорганизмов. В ходе изучения микрофлоры свиного навоза при метановом брожении выделено около 130 различных бактерий.
Первую стадию разрушения сложных органических полимеров осуществляют бактерии семейств Enterobacteriaceae,
Lactobacillaceae,
Streptococcaceae,
атакже представители родов Clostridium,
Butyrivibrio,
Bacteroides,
Rumino
coccus
и некоторых других способных к брожению.Главные продукты ферментации — ацетат, пропионат, сукцинат, Н2
и СО2
. Конечными продуктами ферментации целлюлозы и гемицеллюлозы под действием бактерий, выделенных из рубца жвачных и кишечника свиней, являются различные летучие жирные кислоты.
Бактерии второй, или ацетогенной, фазы, относящиеся к родам Syntrophobacter,
Syntrophomonas
и Desulfovibrio,
вызывают разложение пропионата, бутирата, лактата и пирувата до ацетата, Н2
и СО2
— предшественников метана. Ряд микроорганизмов способны синтезировать ацетат из СО2
в термофильных условиях, к их числу принадлежат Clostridium
formicoaceticum,
Acetobacterium
woodii,
метановые бактерии из родов Methanothrix,
Methanosarcina,
Methanococcus,
Methanogenium
и Methanospirillum.
Свойства метанобразующих бактерий
Полагают, что метанобразующие бактерии, или метаногены, возникли около 3,0—3,5 млрд. лет тому назад и достигли своего расцвета в архее.
Сейчас эти микроорганизмы имеют достаточно широкое распространение, приуроченное к анаэробным условиям. Вместе с другими бактериями они активно участвуют в деструкции органических веществ в различных экологических нишах: в болотном, речном и озерном иле, в осадках морей и океанов, в искусственных технических сооружениях — метантенках, в рубце жвачных и пищеварительном тракте ряда других животных.
Среди этих бактерий есть организмы, клетки которых близки к сферическим, образующие агрегаты, похожие на сарцин, ланцетовидные, палочковидные и нитевидные формы. Большинство неподвижны, но отдельные виды проявляют способность к движению в результате наличия жгутиков.
Как и другие архебактерии, метаногены отличаются от остальных прокариот (эубактерий) составом ряда компонентов клеток, в том числе клеточной стенкой, не содержащей муреина, а также характером липидов, в которые не входят жирные кислоты. Большую часть нейтральных липидов составляют простые эфиры глицерина и длинноцепочечного спирта фитанола. В метаболизме метанобразующих бактерий участвует кофермент М (2-меркаптоэтансульфоновая кислота), факторF420
, представляющий собой особый флавин, и ряд других соединений, которые у остальных организмов не обнаружены или встречаются крайне редко. Но главное, что отличает метаногенов, как и других архебактерий, от остальных организмов, — это нуклеотидная последовательность в 16S рРНК, о чем свидетельствует изучение состава получаемых из нее олигонуклеотидов.
В то же время отдельные виды метанобразующих бактерий по этому показателю, а также содержанию ГЦ в ДНК (от 30,7 до 61,0 мол. %) могут отличаться весьма значительно. На этом основании их подразделяют на три порядка, включающих несколько семейств и родов. Наиболее изученными видами являются Methanobacterium
thermoautotrophicum,
Methanosarcina
barkeri,
Methanobrevibacter
ruminantium.
Все метанобразующие бактерии — строгие анаэробы. Как уже говорилось выше, они делятся на мезо- и термофилов. К числу термофилов относится, например, М.
thermoautotrophicum.
Оптимальное значение рН для роста разных видов 6,5—8,0. Некоторые штаммы способны расти при наличии в среде до 5—7 % и более NaCl.
Как источник серы бактерии чаще всего используют сульфид, а как источник азота — аммоний. Некоторые виды нуждаются для роста в наличии дрожжевого автолизата или смеси витаминов. Известны также метанобразующие бактерии, для роста которых необходимо присутствие ацетата и (или) других органических веществ.
Но довольно многие из этих микроорганизмов могут расти в автотрофных условиях (при наличии в качестве единственного источника углерода углекислоты).
Ассимиляция углекислоты в автотрофных условиях, как показано для М.
thermoautotrophicum,
происходит особым нециклическим путем. Началом его является образование из углекислоты С2
-соединения в виде, ацетил-кофермента А (КоА). Дальнейшее превращение ацетил-КоА включает следующие реакции:
ацетил-КоА пируват пируват фосфоенолпируват фосфоенолпируват  оксалоацетат оксалоацетат малат малат фумарат фумарат сукцинат сукцинат
 сукцинил-КоА сукцинил-КоА α-кетоглутарат. α-кетоглутарат.
Образующиеся пируват, оксалоацетат, 2-кетоглутарат используются частично для синтеза аминокислот, а фосфоенолпируват — углеводов.
Субстратами, из которых большинство известных видов метаногенов образуют метан, служат молекулярный водород и углекислота:
4Н2
+ СО2
 СН4
+ 2Н2
О СН4
+ 2Н2
О
Ряд видов синтезируют метан из окиси углерода:
4СО + 2Н2
О  СН4
+ ЗСО2 СН4
+ ЗСО2
Некоторые виды образуют метан из муравьиной кислоты:
4НСООН  СН4
+ ЗСО2
+ 2Н2
О СН4
+ ЗСО2
+ 2Н2
О
Известны метанобразующие бактерии, образующие метан из метанола, метиламина, диметиламина, триметиламина и (или) ацетата:
4СН3
ОН ЗСН4
+ СО2
+ 2Н2
О ЗСН4
+ СО2
+ 2Н2
О
4CH3
NH2
+ 2Н2
О ЗСН4
+ CO2
+ 4NH3 ЗСН4
+ CO2
+ 4NH3
СНзСООН СН4
+ СО2 СН4
+ СО2
При превращении метилированных аминов, метанола и ацетата в метан в него переходит метильная группа субстрата.
Еще в 1956 г. известным биохимиком И. X. Баркером предложена схема восстановления СО2
в метан, которая сейчас детализирована (рис. 2). Эта схема послужила отправной точкой для формулирования гипотезы о том, что метанобразующие бактерии могут аккумулировать энергию в процессе окислительного фосфорилирования.
В исследованиях, проведенных с чистыми культурами разных видов метаногенов, установлено, что синтез метана протекает в мембранах, причем этот процесс сопряжен с генерацией трансмембранного потенциала, энергия которого трансформируется в АТФ.
Таким образом, метанобразующие бактерии, видимо, осуществляют (во всяком случае, когда окисляют Н2
) не брожение, а анаэробное дыхание, используя СО2
в качестве акцептора электронов. Но выход энергии на каждый образованный моль метана у метаногенов не превышает двух молей АТФ. Поэтому для обеспечения своего роста метанобразующие бактерии должны синтезировать значительные количества метана. Из 100 % метаболизированного соединения углерода они трансформируют в клеточный материал только 5-10 %, остальное конвертируется в метан.

Рис. 2. Схема образования метана из СО2
и других соединений
Важная особенность метаногенов — способность активно развиваться в анаэробных условиях в тесном симбиозе с другими группами бактерии, создающими для них благоприятные условия и обеспечивающих необходимыми субстратами для роста и синтеза метана. К микроорганизмам, образующим ассоциации с метаногенами, относится ряд представителей облигатных и факультативных анаэробов, осуществляющих брожение различных высокомолекулярных и низкомолекулярных веществ. Такие ассоциации функционируют в природных условиях, а также широко используются в практических целях.
Процесс разложения органических веществ смешанными культурами микроорганизмов в анаэробных условиях, заканчивающийся образованием СН4
, часто называют «метановым брожением», хотя этот термин не совсем правилен, поскольку сами метанобразующие бактерии многоуглеродные субстраты не сбраживают.
Технология получения метана
Технологически метановое брожение подразделяют на два этапа: созревание метанового биоценоза и ферментацию. В течение первого этапа развиваются бактерии, участвующие в анаэробном разложении исходных органических веществ и продуктов их распада. В результате деятельности этих микроорганизмов создаются оптимальные условия для активного биосинтеза метана.
Несмотря на сложность и далеко неполную изученность, такая биологическая система достаточно надежна и проста для получения биогаза в промышленных масштабах.
Метановое брожение жидких органических веществ осуществляется в строго анаэробных условиях при 30—40 °С (мезофильный процесс) или 52-60 °С (термофильный процесс). Ферментацию проводят в реакторах (метантенках) объемом от одного до нескольких тысяч кубических метров. Метантенки выполняются из железобетона или металла. Они могут иметь разную форму и конструкцию, от кубической до цилиндрической, расположеныгоризонтально или вертикально. Лучшей признается яйцеобразная конструкция. Ферментация протекает непрерывно, полупериодически и периодически. Схема биогазовых установок для переработки жидких субстратов представлена на рис. 3.

Рис. 3. Схема биогазовой установки
Сырье, содержащее 2—12% органических веществ, подается в метантенк через теплообменник, где оно подогревается илиохлаждается до температуры ферментации в метантенке. Место введения сырья в реактор и отбора сброженной массы зависит от конструкции метантенка. Реакторы снабжаются мешалками для перемешивания бродящей массы с целью ускорения процессов и теплообменниками для поддержания необходимой температуры внутри реактора. Образующиеся газы удаляются через газовый колпак, расположенный в верхней части метантенка. Газ, содержащий 50—85 % метана и 15—50 % СО2
, по газопроводу поступает в газохранилище — газгольдер, откуда подается в газовую сеть.
Скорость процесса определяется температурой ферментации (в термофильных условиях она в 2—3 раза выше, чем в мезофильных), химическим составом сырья, его вязкостью, плотностью бактериальной ассоциации и степенью перемешивания. Ферментация протекает при значениях рН среды, равных 7,0—8,5. При более низком или высоком значении рН она обычно тормозится или прекращается совсем. Снижение величины рН среды («прокисание») связано с нарушением равновесия скоростей образования летучих жирных кислот (муравьиной, уксусной, особенно пропионовой, а также масляной) и дальнейшим их превращением, заканчивающимся образованием метана. Подобные дефекты вызываются, как правило, увеличением поступления в реактор легкосбраживаемых углеводов, а также нарушением соотношения углерода и азота в субстрате. Оптимальные значения соотношений C:N находятся в пределах 11 —16:1. Повышение значений рН среды (> 8,5) связано либо с высокой концентрацией азотсодержащих органических веществ в субстрате и образованием из них в процессе брожения больших количеств аммония, либо наличием в среде значительных концентраций щелочно-земельных металлов.
Указанные нарушения процесса обычно устраняются остановкой загрузки ферментера новыми порциями сырья. В результате избыток образовавшихся жирных кислот постепенно конвертируется в метан, рН среды повышается до необходимых оптимальных значений, и процесс продолжается. В некоторых случаях уменьшают объем загрузки сырья в реактор.
Важным моментом промышленной технологии получения метана является скорость поступления сырья в реактор или время выдерживания сырья в реакторе. Указанные параметры зависят прежде всего от скорости конверсии органических веществ в метан. Чем интенсивнее процесс брожения, тем выше скорость загрузки сырья в реактор, меньше время выдерживания сырья в реакторе и рентабельнее сам процесс. Существующие в настоящее время нормы скорости загрузки сырья находятся в пределе 7—20 % объема субстрата от рабочего объема ферментера в сутки. Следовательно, цикличность процесса равна 5—14 сут. Однако разработаны технологии, в которых цикличность сокращена до 5—15 ч, или скорость загрузки в пределах 150—400 % в сутки. С большей скоростью происходит образование метана при наличии хорошо растворимых и легко разлагаемых бактериями органических соединений (некоторые виды жидких отходов пищевой, микробиологической и других отраслей промышленности, перерабатывающих сельскохозяйственное сырье). Медленнее сбраживаются отходы сельскохозяйственного производства (животноводства и растениеводства), содержащие твердые органические включения.
Применяемые широко в настоящее время в практике метантенки относятся к реакторам первого поколения. В них все процессы протекают в одной емкости без разделения на стадии или фазы, бактериальные клетки находятся во взвешенном состоянии и по мере нарастания удаляются вместе со сброженной массой. Важным условием нормального функционирования таких реакторов является необходимость поддержания равенства скоростей размножения бактерий и поступления сырья в реактор при условии, что концентрация органического вещества в сырье составляет не менее 2 %.
При меньших концентрациях органического вещества плотность бактериальных клеток на единицу объема реактора резко падает, и процесс практически останавливается.
Этот недостаток реакторов первого поколения полностью устраняется при использовании реакторов второго поколения, в которых бактерии при необходимой для процесса плотности находятся в закрепленном (иммобилизованном) состоянии. В реакторах второго поколения можно сбраживать субстраты с низким содержанием органических соединений (0,5 % сухих веществ) при высокой скорости пропускания через: реактор (такие реакторы часто называют «анаэробными фильтрами»). В качестве носителей для закрепления бактерий широко используются галька, керамические, полихлорвиниловые, полиуретановые кольца и стекловолокно. Применение реакторов второго поколения позволяет резко повысить процессы деструкции и соответственно снизить их объемы, что имеет важное значение при их широком производстве и эксплуатации.
В последние годы в практику внедряются технологии, основанные на разделении процесса метанового брожения на стадии—фазы: кислотную и метановую. Двухфазный процесс осуществляется в двух реакторах, соединенных последовательно. Скорость поступления сырья и объемы реакторов рассчитываются так, чтобы в первом протекала только стадия образования кислот, значение рН среды не должно быть выше 6,5. Такая бражка подается во второй реактор, в котором с большой скоростью протекает непосредственно образование метана. Двухфазный процесс позволяет увеличить его общую скорость в два-три раза. Иногда в практике при использовании двухфазного процесса с целью дополнительного получения товарного биогаза процесс брожения в первом ферментере проводят при 35—37 °С, во втором — при 55 °С. При нормальных условиях ферментации на каждую тонну сброженного органического вещества образуется до 300—600 м3
биогаза. Процент разложения органических веществ до метана зависит от скорости процесса и времени выдерживания сырья в реакторе, обычно эта величина равна 30—60 %.
Концентрация метана в образующемся биогазе зависит от химического состава субстрата: углеводы дают больше углекислоготаза, жиры — больше метана (до 85%). Чем больше восстановлен субстрат, тем выше концентрация метана.
Метановое брожение — процесс эндотермический, требует постоянного подогрева для поддержания необходимой температуры ферментации. Как правило, метантенки и сырье подогреваются за счет сжигания образующегося биогаза. В среднем на поддержание требуемой температуры ферментации расходуется от 15— 20 % (мезофильный процесс) до 30—50 % (термофильный процесс) биогаза. Поэтому одним из важных моментов эксплуатации метантенков является их хорошая теплоизоляция.
Рассмотренный выше процесс метанового брожения касался использования только жидких субстратов. В последние годы широкое развитие имеет технология твердофазной метангенерации, или получение биогаза, при деструкции органических веществ с влажностью 30—40 %. Такие процессы уже имеют практическое применение в США и некоторых странах Западной Европы, например, при переработке городского твердого мусора. Основное условие такого процесса — анаэробиоз и необходимая влажность.
Кроме этого для получения биогаза можно использовать отходы сельского хозяйства, испорченные продукты, стоки крахмалперерабатывающих предприятий, жидкие отходы сахарных заводов, бытовые отходы, сточные воды городов и спиртовых заводов. Процесс ведется при температуре 30 — 60°С и рН 6 — 8. Этот способ получения биогаза широко применяют в Индии, Китае, Японии. В настоящее время для производства биогаза чаще используют вторичные отходы (отходы животноводства и сточные воды городов), чем первичные (отходы зерноводства, полеводства, хлопководства, пищевой, легкой, микробиологической, лесной и других отраслей), обладающие сравнительно низкой реакционной способностью и нуждающиеся в предварительной обработке.
Биогаз кроме метана и углекислого газа может содержать примеси сероводорода (до 2%), что требует его соответствующей очистки.
Теплотворная способность биогаза составляет 5—7 ккал/м3
и зависит от концентрации в нем СО2
. Один кубический метр биогаза эквивалентен 4 кВт/ч электроэнергии, 0,62 л керосина, 1,5 кг угля, 3,5 кг дров, 0,43 кг бутана. Он может быть использован для получения тепловой энергии, электроэнергии, заменить моторное топливо. Из биогаза можно получить «синтез-газ» (смесь угарного газа и молекулярного водорода), из которого синтезируют метанол, или искусственный бензин.
Образующийся в процессе метанового брожения шлам (жидкий или твердый) является хорошим органо-минеральным удобрением. Он может также использоваться для производства ценных биологически активных соединений, применяемых в медицине и сельском хозяйстве.
Перечисленные выше физические особенности биогаза и относительная простота его получения, возможность использования в качестве сырья для его производства разнообразных отходов положительным образом отразились на создании и развитии биогазовой промышленности в ряде стран. В России метановое брожение широко применяется в системе биологической очистки городских сточных вод на станциях аэрации. В метантенках сбраживают осадки сточных вод и активный ил, образующийся в аэротенках. Две станции, обслуживающие город с населением 8 млн. человек, дают в год 110 млн. м3
биогаза. Термофильное метановое брожение отходов микробиологической промышленности используют в нашей стране для производства биогаза и кормового препарата витамина B12
. Два цеха, перерабатывающие жидкие стоки ацетоно-бутиловой промышленности, производят в год до 7 млн. м3
биогаза и до 1 т витамина B12
. В Венгрии мезофильное метановое брожение применяется для промышленного производства кристаллического препарата витамина B12
медицинского назначения.
В США широкое развитие получает производство биогаза при переработке городского твердого мусора. Например, в пригородах Нью-Йорка действует станция, производящая в год 100 млн. м3
биогаза.
Современное состояние проблем и перспектив в области получения биогаза свидетельствует о том, что анаэробная конверсия органических отходов в метан — наиболее конкурентоспособная область биоэнергетики. Основное преимущество биогаза состоит в том, что он является возобновляемым источником энергии. Его производство будет так же длительно, как существование жизни на Земле.
ПОЛУЧЕНИЕ СПИРТОВ
Возможность широкого использования, низших спиртов: метанола, этанола, бутанола, бутандиола, а также ацетона и другихрастворителей— в качестве моторного топлива для двигателей внутреннего сгорания и дизельных двигателей вновь вызвала большой интерес к получению перечисленных соединений биоконверсией из растительной биомассы.
Смесь этилового или метилового спиртов с бензином в отношении 10:90 или 20:80 под коммерческим названием «газохол» уже широко применяется в ряде стран для автомобильного транспорта. В свете вышесказанного стоит конкретная задача по разработке, конкурентоспособной промышленной технологии производства этанола для технических целей методами биоконверсии. Метиловый спирт предполагается производить из биомассы методом термохимической конверсии. Бутанол и бутандиол — хорошие заменители мазута, их также необходимо добавлять в качестве присадок к спиртово-бензиновым смесям для лучшего смешивания спиртов и углеводородов.
Микробиологическое получение этилового, бутилового спиртов и бутандиола из углеводов достаточно хорошо изучено и имеет многолетний промышленный опыт.
Этиловый спирт обычно получают из гексоз с помощью брожения, вызываемого дрожжами:
С6
Н12
О6  2СН3
СН2
ОН + 2СО2
2СН3
СН2
ОН + 2СО2
В качестве сырья используются меласса (отходы сахарного производства), зерновой, картофельный, кукурузный крахмал, который предварительно осахаривается.
Этиловый спирт образуют также в большом количестве бактерии, например из рода Zymomonas (
Z.
mobilis,
Z.
anaerobica),
Sarcina
ventriculi
и Erwinia
amylovora.
Среди продуцентов этанола имеются и клостридии, к их числу относятся Clostridium
thermocellum
и Cl.
thermohydrosulphuricum.
В последнее время эти микроорганизмы интенсивно изучают, так как некоторые из них способны использовать в качестве сбраживаемого субстрата не только крахмал, но такой непищевой и дешевый продукт, как целлюлоза. Бутиловый спирт и ацетон в промышленности также получают с помощью клостридий.
Использование этанола и бутанола как моторных топлив требует их промышленного производства в объеме десятков миллионов тонн. Первая задача, которую необходимо решать в связи с поставленной целью, — это выбор непищевого, дешевого, массового и легкоконвертируемого сырья.
В некоторых странах (например, в Бразилии) для производства технического этанола используют отходы сахарного тростника багассу, в других странах — маниок, батат, сладкое сорго, топинамбур (земляная груша). Указанные культуры являются представителями южных растений. Для стран с умеренным климатом и обладающими большими лесными массивами дешевым сырьем, для крупнотоннажного производства спиртов служит древесина.
Древесина может использоваться как сырье при условии разрушения структурных связей лигнина с целлюлозой и гидролизом последней до гексоз, т.е. требуется определенная химическая или биохимическая предобработка. Это сдерживает широкое использование древесины для получения спиртов, хотя в ряде стран в течение многих лет существует промышленное производство этилового спирта путем брожения гидролизатов древесины. Такой способ основан на кислотном или щелочном гидролизе древесины до гексоз, которые далее сбраживаются дрожжами до этанола. Но такая технология достаточно энергоемкая и требует использования коррозионно-устойчивого оборудования (основное препятствие ее широкого использования в практике).
Для возможного применения древесины в целях получения биопродуктов в настоящее время интенсивно разрабатываются различные технологии деструкции лигноцеллюлоз: механические (размалывание), физические (гамма-облучение), физико-химические (паровой взрыв, или парокрекинг), химические (гидролиз), биологические (ферментативный гидролиз) и различные комбинации перечисленных методов. К наиболее перспективным следует отнести сочетание «парокрекинга» с ферментативным гидролизом— это предварительная обработка лигноцеллюлоз или гемицеллюлоз паром при высокой температуре и высоком давлении, при котором происходит взрыв кристаллических структур указанных субстратов и отделение лигнина от целлюлозы с последующим гидролизом клетчатки целлюлозолитическими ферментами.
К растительным материалам, используемым для гидролитического получения сахара с последующей их биоконверсией в спирты, относят различные виды отходов лесопиления и деревообработки, сельскохозяйственного производства (солома, хлопчатник, кукурузная кочерыжка, подсолнечная лузга, костра льна, конопли, кенафа, тростник, малоразложившийся торф).
Из одной тонны древесины можно получить до 170—180 л этанола и 40 кг биомассы дрожжей, из тонны картофеля — 100 л этанола, из тонны зерна ржи — до 270 л этилового спирта.
Следовательно, одна тонна древесины при производстве этанола заменяет около 0,6 т зерна или 1,7 т картофеля.
Большие перспективы для использования целлюлозы в качестве сырья для получения самых разных продуктов открывает ферментативный гидролиз, осуществляемый комплексами целлюлаз и гемицеллюлаз, продуцируемых некоторыми грибами и бактериями. Гидролиз протекает при 40—60°С и рН 4,0—7,0, не требует больших энергозатрат и коррозионностойкого оборудования.
Перспективы использования лигноцеллюлозы для получения этанола и других спиртов, а также иных органических соединений открывают широкие возможности не только для производства моторных топлив, но и для создания важной сырьевой базы для промышленного органо-химического синтеза, например для получения .искусственного каучука по методу Лебедева.
ПОЛУЧЕНИЕ ТЕПЛОВОЙ ЭНЕРГИИ ПРИ БАКТЕРИАЛЬНОМ ОКИСЛЕНИИ.
Несколько в стороне от вышеописанных методов анаэробной биоконверсии биомассы в топливо стоит еще один микробиологический процесс получения энергии — аэробное окисление твердой биомассы (отходов) с выделением больших количеств тепла.
Твердое органическое сырье погружается в шахту, снизу подается воздух. В результате окислительных процессов, осуществляемых микроорганизмами, происходит интенсивное выделение тепловой энергии и проходящие газы нагреваются до 80 °С. С помощью компрессии температуру газов можно увеличить до 100—110 °С и получаемую энергию аккумулировать в виде горячей воды или пара. Коэффициент полезного действия установок с учетом затрат электроэнергии на эксплуатацию воздуходувок составляет 95%. Такие установки промышленного типа работают в Японии. Образующийся шлам используется в качестве высокоэффективного органо-минерального удобрения.
Таким образом, биомасса при ее рациональном использовании может стать эффективным источником возобновления энергетических ресурсов с использованием микробиологических процессов. Однако вклад биомассы в общую энергетику большинства развитых стран не превысит 10 %, в отдельных странах он может составить 25—30 %, но не более, так как в противном случае она перестает быть возобновляемым источником. Более перспективным способом использования солнечной энергии является ее прямая конверсия в молекулярный водород при фотолизе воды.
ПОЛУЧЕНИЕ МОЛЕКУЛЯРНОГО ВОДОРОДА
Молекулярный водород считается наиболее перспективным видом топлива. По энергоемкости (в расчете на единицу массы) он превосходит все другие соединения, которые можно использовать в этих целях. Сжигание молекулярного водорода не сопровождается загрязнением среды большим количеством вредных веществ и, более того, ведет к регенерации воды. Водород может храниться, транспортироваться и легко преобразуется в электроэнергию с помощью топливных элементов.
В настоящее время молекулярный водород используется в ряде областей химической промышленности. Особенно много его расходуется при переработке нефти, синтезе метанола, а также аммиака, соединения которого используются в качестве удобрений. Кроме того, молекулярный водород может обеспечивать как источник энергии рост ряда бактерий, некоторые из которых являются перспективными продуцентами биомассы, богатой белком, а также других практически важных продуктов. Среди микроорганизмов, способных использовать Н2
, имеются аэробные и анаэробные виды, к последним, как уже говорилось, относятся многие метанобразующие бактерии.
Производство молекулярного водорода в развитых странах ежегодно составляет около 30 млн. т и продолжает увеличиваться.
Большую часть молекулярного водорода получают химическим путем, главным образом из природного газа (метана). Используют, кроме того, продукты газификации жидких и твердых топлив. Предложены также разные способы получения Н2
из воды. К ним относятся методы паровой конверсии природного газа и электролиза Н2
, имеющие практическое применение. Но все эти способы производства молекулярного водорода требуют большой затраты энергии и достаточно дороги. Помимо этого масштабы получения Н2
из метана и ряда других веществ ограничиваются их запасами. Поэтому изыскание других, более дешевых способов получения молекулярного водорода и расширения на их основе его производства, а также областей применения является актуальной проблемой.
В последние годы большое внимание привлекают к себе микроорганизмы, способные к образованию Н2
в процессе своей жизнедеятельности. Таких микроорганизмов известно довольно много, обнаруживаются все новые виды, выделяющие молекулярный водород. Среди них есть и хемотрофы, и фототрофы.
Образование молекулярного водорода хемотрофами
К числу хемотрофов, образующих в значительном количестве молекулярный водород, относится прежде всего ряд облигатных и факультативных анаэробных бактерий. Кроме того, Н2
выделяют некоторые простейшие (главным образом из числа трипанозом), растущие в анаэробных условиях. Показана также возможность образования молекулярного водорода азотфиксирующими аэробами, например азотобактером.
В наибольшем количестве молекулярный водород выделяют бактерии, осуществляющие брожение разных органических веществ, но чаще всего углеводов.
Фермент, катализирующий выделение хемотрофами при брожениях Н2
гидрогеназа осуществляет следующую обратимую реакцию:
RН2
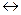 Н2
+ R
Н2
+ R
где R — переносчик электронов, взаимодействующий с гидрогеназой. Переносчиком может быть ферредоксин или другое соединение.
К числу наиболее активных продуцентов Н2
относятся отдельные виды клостридий (например, Clostridium
butyrlcum, С.
perfringens),
энтеробактерий (
Escherichia
coli,
Citrobacter
freundii)
, Ruminococcus
и некоторых других родов. Однако даже у самых активных продуцентов Н2
его количество не превышает 4 молей на моль сброженного сахара:
глюкоза  2 ацетат + 2СO2
+ 4Н2 2 ацетат + 2СO2
+ 4Н2
КПД преобразования энергии в этом случае составляет не более 33 %, а практически бывает еще ниже, тогда как при переработке органических веществ в метан он может достигать 85 %.
Поэтому получение молекулярного водорода в результате брожения вряд ли найдет широкое применение даже в тех странах, где много дешевого растительного сырья. Однако если выделение хемотрофами Н2
сочетается с образованием двух полезных продуктов, то такой способ его получения может использоваться. Примером является ацетоно-бутиловое брожение, сопровождающееся выделением Н2
, давно имеющее практическое применение. Возможно также использование водородобразующих бактерий для разложения некоторых вредных веществ, попадающих в стоки, например формиата, до СО2
и Н2.
Кроме того, хемотрофные бактерии, выделяющие Н2
, входят в состав ассоциаций микроорганизмов, которые разлагают разные органические субстраты с образованием метана. В связи с этим важно знать их особенности, для того чтобы повысить активность и соответственно скорость выделения Н2
, так как он служит одним из субстратов для образования метана.
Образование молекулярного водорода фототрофами
Из фототрофных организмов способность к выделению Н2
проявляют многие пурпурные бактерии, цианобактерии и ряд водорослей. Среди последних есть не только микро-, но и макроформы. Есть данные о выделении в небольшом количестве Н2
и высшими растениями.
Пурпурные бактерии осуществляют так называемый аноксигенный фотосинтез (фотосинтез без выделения молекулярного кислорода). Объясняется это тем, что они не могут использовать воду при фотоассимиляции СО2
и в других конструктивных процессах в качестве исходного донора электронов; такую функцию у них выполняют сульфид, сера, тиосульфат, органические вещества или Н2
.
Анаэробное окисление многими пурпурными бактериями органических веществ и неорганических соединений серы в определенных условиях ведет к образованию ими Н2
. Особенно в большом количестве эти микроорганизмы выделяют молекулярный водород в присутствии света. Поэтому данный процесс часто называют фотовыделением водорода. В отличие от образования Н2
при брожении фотовыделение Н2
пурпурными бактериями катализирует обычно не гидрогеназа, а нитрогеназа — фермент, главная функция которого заключается в превращении N2
в аммиак. Но даже при наличии N2
часть электронов, поступающих к нитрогеназе, расходуется на восстановление протонов, что ведет к выделению H2
:
N2
+ 8е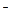 + 8Н+ + 8Н+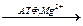 2NH3
+ Н2
2NH3
+ Н2
К фотовыделению Н2
способны растущие культуры, суспензии клеток, а также иммобилизованные клетки пурпурных бактерий. Некоторые субстраты, например ацетат, лактат, малат, глюкоза, могут полностью разлагаться клетками этих микроорганизмов до СО2
и Н2
.
К числу наиболее активных продуцентов Н2
относятся некоторые штаммы Rhodobacter
capsulatus.
Растущие культуры этой бактерии, используя лактат, выделяют в некоторых условиях Н2
со скоростью 300—500 мл ч ∙г ∙г сухой биомассы. При использовании клетками пурпурных бактерий 1 кг лактата можно получить до 1350 л Н2
. КПД конверсии энергии света при образовании пурпурными бактериями Н2
достигает 2,0—2,8 %. сухой биомассы. При использовании клетками пурпурных бактерий 1 кг лактата можно получить до 1350 л Н2
. КПД конверсии энергии света при образовании пурпурными бактериями Н2
достигает 2,0—2,8 %.
Среди цианобактерий также обнаружены штаммы, выделяющие при наличии света Н2
в довольно большом количестве и созначительной скоростью (30—40 мл ч ∙г ∙г сухой биомассы). К таким организмам относятся в основном нитчатые формы, образующие особые клетки — гетероцисты (например, Anabaena
cylindrica,
A.
varidbilis,
Mastlgocladus
thermophilus,
M.
laminosus). сухой биомассы). К таким организмам относятся в основном нитчатые формы, образующие особые клетки — гетероцисты (например, Anabaena
cylindrica,
A.
varidbilis,
Mastlgocladus
thermophilus,
M.
laminosus).
Выделение Н2
чаще всего отмечается у суспензий клеток, причем может продолжаться 30 сут и более. Такую жеспособность проявляют иммобилизованные клетки микроорганизмов. В отличие от пурпурных бактерий для образования Н2
цианобактериями не требуется каких-либо экзогенных доноров электронов, кроме воды. Важно также, что нитчатые формы бактерий, образующие гетероцисты, и некоторые одноклеточные виды способны выделять Н2
не только в анаэробных, но и в аэробных условиях.
Фотообразование цианобактериями Н2
, как и у пурпурных бактерий (за редким исключением) катализирует нитрогеназа. Этот фермент очень чувствителен к молекулярному кислороду, но у цианобактерий, выделяющих Н2
в аэробных условиях, он защищен от инактивирующего действия О2
разными способами. У нитчатых форм, образующих гетероцисты, нитрогеназа локализуется в основном в этих специализированных клетках, которые в процессе фотосинтеза молекулярный кислород не выделяют.
КПД преобразования энергии света в Н2
у цианобактерий по имеющимся расчетам может достигать около 10 %.
Выделение молекулярного водорода водорослями обнаружено лишь у суспензий клеток и в небольшом количестве, кроме того, процесс не стабилен. Одной из главных причин этого является инактивация гидрогеназы, катализирующей образование водорослями Н2
, под действием молекулярного кислорода, который они выделяют при фотосинтезе.
Из вышесказанного следует, что из разных фототрофов наиболее просто использовать в качестве продуцентов водорода пурпурные бактерии. Но масштабность процесса получения с их помощью Н2
ограничивается запасами и ценой тех субстратов (органических веществ или неорганических соединений серы), которые могут разлагаться с выделением молекулярного водорода.
Более перспективны в данном отношении цианобактерии, поскольку выделение ими Н2
связано с биофотолизом воды, которая пока остается наиболее дешевым и доступным субстратом. Не прекращаются работы и с водорослями, так как они также способны выделять Н2
при разложении воды. Предлагается, кроме того, использовать комплексные системы, образующие Н2
, в которые входят разные фототрофы или фототрофы и хемотрофы. Известно, что хлоропласты (например, из шпината) в присутствии искусственного донора электронов и бактериального экстракта, содержащего фермент гидрогеназу, способны продуцировать водород:
донор электронов фотосистема I фотосистема I переносчик e переносчик e  гидрогеназа гидрогеназа  Н2 Н2
Гидрогеназа получает электроны от ферредоксина. В качестве доноров электронов используются различные органические соединения. Процесс сопровождается облучением видимым светом. Эта форма получения энергии имеет ряд достоинств: избыток субстрата фотолиза (воды); нелимитированный источник энергии (солнечный свет); не загрязняющий атмосферу водород. Водород обладает более высокой теплотворной способностью по сравнению с углеводородами, кроме того, процесс получения водорода — возобновляемый процесс, зависящий в основном от стабильности выделенных хлоропластов. Водород можно получать в присутствии искусственного донора e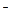 (вместо воды) и поглощающих свет пигментов, а не мембран хлоропластов. Его способны выделять и некоторые микроорганизмы, например цианобактерии (аэробные фототрофы) и др. При этом микробиологическое образование водорода может идти из соединений углеводного характера, включая крахмал и целлюлозу, а также из амино- и кетокислот. (вместо воды) и поглощающих свет пигментов, а не мембран хлоропластов. Его способны выделять и некоторые микроорганизмы, например цианобактерии (аэробные фототрофы) и др. При этом микробиологическое образование водорода может идти из соединений углеводного характера, включая крахмал и целлюлозу, а также из амино- и кетокислот.
Основная проблема создания систем конверсии энергии биомассы в водород связана с превращением этих метаболитов в топливную форму. Для биотехнологии можно было бы воспользоваться и другими механизмами превращения энергии, выявленными у микроорганизмов. Например, галофильная бактерия Halobacterium
halobium
способна использовать световую энергию, улавливаемую пурпурным пигментом (бактериородопсином), вмонтированным в мембрану клетки. Молекула пигмента состоит из одной полипептидной цепи, к которой прикреплена молекула ретиналя, являющегося светочувствительной частью пигмента. Под влиянием солнечного света изменяется конформация пигмента, приводящая к переносу ионов водорода(H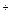 ) через мембрану. Пигмент является как бы протонным насосом. Молекулы бактериородопсина располагаются в мембране триадами, и перекачивание протонов через мембрану обеспечивает градиент концентрации H ) через мембрану. Пигмент является как бы протонным насосом. Молекулы бактериородопсина располагаются в мембране триадами, и перекачивание протонов через мембрану обеспечивает градиент концентрации H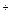 (Δ H (Δ H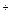 ), вследствие чего они движутся к наружной cтенке, у которой пространство подкисляется и возникает электрохимический градиент (Δ ), вследствие чего они движутся к наружной cтенке, у которой пространство подкисляется и возникает электрохимический градиент (Δ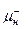 ). Предприняты попытки ). Предприняты попытки встраивания молекул пигмента в искусственные системы повышения эффективности их использования. В частности, растущие бактерии H. halobium
переносят в мелкие водоемы с высокой концентрацией NaCl и других минеральных солей, в которых исключается загрязнение. У некоторых штаммов половина клеточной мембраны покрыта пурпурным пигментом, и из 10 л бактериальной культуры можно получить 0,5 г пурпурных мембран. В таких биомембранах содержится до 100 000 молекул родопсина. Биомембраны фиксируют на особой подложке, которая должна обладать всеми свойствами, необходимыми для обеспечения тока протонов, а не других ионов. В частности, для этих целей вполне пригодны пористые подложки, пропитанные липидами, которые, сливаясь с мембраной, сплошным слоем покрывают поверхность фильтра. Мембранные фрагменты можно смешивать и с акриламидом с образованием геля. Вместо создания плотных слоев молекул бактериородопсин и липиды могут создавать протеолипосомы, которые встраивают в структуры, обеспечивающие эффективное перекачивание протонов. встраивания молекул пигмента в искусственные системы повышения эффективности их использования. В частности, растущие бактерии H. halobium
переносят в мелкие водоемы с высокой концентрацией NaCl и других минеральных солей, в которых исключается загрязнение. У некоторых штаммов половина клеточной мембраны покрыта пурпурным пигментом, и из 10 л бактериальной культуры можно получить 0,5 г пурпурных мембран. В таких биомембранах содержится до 100 000 молекул родопсина. Биомембраны фиксируют на особой подложке, которая должна обладать всеми свойствами, необходимыми для обеспечения тока протонов, а не других ионов. В частности, для этих целей вполне пригодны пористые подложки, пропитанные липидами, которые, сливаясь с мембраной, сплошным слоем покрывают поверхность фильтра. Мембранные фрагменты можно смешивать и с акриламидом с образованием геля. Вместо создания плотных слоев молекул бактериородопсин и липиды могут создавать протеолипосомы, которые встраивают в структуры, обеспечивающие эффективное перекачивание протонов.
У H. Halobium
имеется и другой тип насоса, который обеспечивает галородопсин, использующий световую энергию непосредственно для перекачивания ионов. Изучение систем энергоконверсии чрезвычайно перспективно с точки зрения разработки искусственных устройств, более эффективных, чем естественные.
Наконец, следует отметить интерес к некоторым ферментам, образуемым фототрофами и хемотрофами, выделяющими Н2
, прежде всего к гидрогеназам. Помимо использования для получения Н2
, гидрогеназы могут быть применены в других практически важных целях, включая восстановление кофакторов, например НАД, требующихся в некоторых производственных процессах, при синтезе соединений, меченных дейтерием и тритием, а также в топливных элементах.
Таким образом, хотя микробиологический способ получения молекулярного водорода еще не реализован, но работы в данном направлении развиваются и аспекты исследований водородобразующих видов микроорганизмов достаточно широки.
Заключение
Круг вопросов, к решению которых привлекают биотехнологические методы и достижения, достаточно широк. Большинство из них прямо или косвенно связано с глобальными проблемами, стоящими перед современной цивилизацией, такими, как загрязнение окружающей среды, угроза экологического кризиса, истощение запасов полезных ископаемых, опасность мирового энергетического кризиса, нехватка продовольствия, борьба с болезнями.
Повышение цен на традиционные источники энергии(природный газ, нефть, уголь) и угроза их исчерпания побудили ученых обратиться к альтернативным путям получения энергии. Роль биотехнологии в создании экономичных возобновляемых энергетических источников (спиртов, биогенных углеводородов, водорода) чрезвычайно велика. Эти экологически чистые виды топлива можно получать путем биоконверсии отходов промышленного и сельскохозяйственного производства. Перспективно продолжение исследований по усовершествованию и внедрению процессов производства метана, этанола, созданию на основе микроорганизмов (и ферментов) элементов, эффективно производящих электричество, а также по организации искусственного фотосинтеза, в частности, биофотолиза воды, при котором можно получать богатые энергией водород и кислород.
Список литературы
1. Промышленная микробиология. Под ред. Н.С.Егорова. М.: Высшая школа, 1989 – 688 с.
2. Т.А. Егорова, С.М. Клунова. Основы биотехнологии. М.: Академия, 2003 – 207с.
|