Реферат на тему:
К
аталізаційні
та
електрохемічні процеси.
Каталізними
називають такі технологічні процеси, в ході яких головним рушієм є каталізатор.
1.1. Поняттяпро каталіз та його види
Каталізом
(від грецьк. - руйнування) називають зміну швидкості хімічних реакцій у присутності каталізаторів.
Каталізаторами
називають речовини, які змінюють швидкість хемічних реакцій, а самі (хемічно та кількісно) залишаються незмінними.
У наш час каталізні процеси становлять основу багатьох технологій. При використанні каталізаторів швидкість хемічних реакцій збільшується в тисячі й навіть мільйони разів. Каталізні процеси лежать в основі виробництва бензину, амоніаку, сірчаної й азотної кислот, спиртів, альдегідів тощо. Каталіз широко використовують у процесі виробництва лікарських речовин, мийних засобів.
Каталіз лежить в основі перспективних способів виробництва рідинного палива з вугілля, сланців, торфу.
Усе ширше використовують каталіз для охорони довкілля від забруднення стічними водами, шкідливими промисловими газами.
У більшості каталізні процеси є безперервними, замкненими, безвідходними, енергоощадними, дуже продуктивними. Каталізні процеси за техніко-економічними показниками не мають собі рівних.
Каталіз - явище своєрідне: для отримання кожного окремого виду продукції використовують свій каталізатор.
Роль каталізаторів виконують тверді, рідинні та газові речовини.
Тверді каталізатори
-
це метали (мідь, срібло, платина, хром та ін.) й оксиди (V
2
O
5
,
Si
02
,
Al
2
03
, алюмосілікати тощо).
Рідинні каталізатори
-
це кислоти та луги, наприклад сірчана кислота (
H
2
S
04
)
,
фосфорна кислота (Н3
РО4
).
Газові каталізатори
використовують дуже рідко.
Залежно від агрегатного стану каталізатора та реагуючих речовин (сировини) каталізні процеси поділяють на гомогенні та гетерогенні. Між ними не можна провести чіткої межі.
1. Гомогенний каталіз. Гомогенним
каталізом називають такий каталіз, у ході якого складові сировини та каталізатор перебувають в одному агрегатному стані, найчастіше це газ або рідина.
Наприклад, виробництво етилового спирту з етилену гідратацією (від грецьк. - вода).
Реклама

Гідратацією
називають приєднання води до різних речовин.
Роль каталізатора виконує сірчана кислота (
H
2
S
04
).
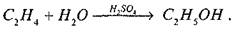
Гомогенний каталіз відбувається з великою швидкістю. Проте він має такі недоліки:
-складно відділити каталізатор від готової продукції;
-забруднення отриманої продукції каталізатором,
-втрати каталізатора.
2.
Гетерогенний каталіз. Гетерогенним каталізом
називають такий каталіз, в ході якого складові сировини та каталізатор перебувають у різних агрегатних станах.
Каталізна реакція проходить на межі фаз. каталізатор - реагуючі речовини.
Процес гетерогенного каталізу, що проходить на поверхні твердого каталізатора складається з кількох стадій.
1) дифузія складових сировини до поверхні каталізатора;
2) адсорбція їх на поверхні каталізатора з утворенням нестійких комплексів (сировина ↔каталізатор);
3) перегрупування атомів з утворенням нових комплексів (утворена продукція ↔ каталізатор);
4) десорбція продукції з поверхні каталізатора;
5) дифузія продукції від поверхні каталізатора в зону виходу.
Швидкість кожної стадії залежить від багатьох чинників температури, тиску, концентрації, часу контактування, швидкості перемішування суміші тощо. Залежно від того, яка з цих стадій лімітуюча, цю і використовують для збільшення швидкості процесу. Наприклад, якщо лімітуючою стадією є дифузія, то для збільшення швидкості процесу треба змінити швидкість перемішування сировини.
Гетерогенний каталіз позбавлений недоліків, які має гомогенний.
1.2. Тверді контакти, їх склад і властивості
1. Склад твердих контактів.
Тверді контакти складаються з підкладки, каталізатора й активатора їх виробляють у вигляді зерен, гранул, таблеток чи сітки з тонкого металевого дроту. Надалі тверді контакти називатимемо просто каталізатори.
Підкладкою
наливають термостійку пористу речовину, на поверхню якої наносять каталізатор і активатор.
Підкладки виготовляють з пемзи, каоліну, активованого вугілля, алюмосілікатів та інших речовин. Підкладка збільшує поверхню каталізатора Разом з тим підкладка збільшує міцність твердого контакту.
Каталізатори
- це в основному метали й оксиди (
Си,
Ag
,
Pt
,
С
r
,
Mo
,
Fe
V
2
0
5
,
SiOz
,
At
2
03
та ін.).
Активаторами
називають речовини, які збільшують активність каталізаторів.
Реклама

Кожен каталізатор потребує свого активатора. Так, для платинового каталізатора найкращими активаторами є залізо, алюміній.
2. Властивості каталізаторів.
До них належать активність, продуктивність, температура запалення (температура початку роботи), твердість, міцність, селективність.
Активність
каталізатора залежить від хемічного складу та структури. Велика активність каталізатора збільшує його продуктивність, поліпшує якість продукції, зменшує витрати сировини, палива та енергії.
Продуктивність
каталізатора визначаються кількістю продукції, яку отримують з одиниці об'єму каталізатора за час його роботи
Температура запалення
каталізатора - це найнижча температура, при якій починає працювати каталізатор. Це - економічно вигідно, оскільки менші затрати на паливо та енергію. Чим активніший каталізатор, тим нижча температура запалення. Наприклад, для хромового каталізатора температура запалення становить 200°С, а для каталізатора, виготовленого з V
2
0
5
вона становить 450°С.
Селективність
(вибірковість) каталізатора - це його здатність з множини реакцій, які відбуваються одночасно, вибрати потрібну в даний час.
Наприклад, реакція окиснення амоніаку (
NH
3
)
може відбуватися до різних стадій окиснення з утворенням різної продукції:
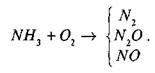
Проте у присутності платинового каталізатора процес окиснення амоніаку йтиме лише до утворення NO
.
Міцність
твердих каталізаторів залежить від пористості структури, із збільшенням пористості, особливо великих пор, міцність твердих каталізаторів зменшується. Це дуже важлива характеристика, оскільки в процесі роботи каталізатор стирається і утвореним пилом забруднюється продукція.
Під час тривалої роботи каталізатори «отруюються».
Це відбувається за рахунок домішок, які є у сировині. Наприклад, платиновий каталізатор, який використовують у процесі виробництва якісного бензину, «отруюється» сполуками сірки й арсену. Те саме спостерігається з алюмосілікатами, які використовують під час каталізного крекінгу нафтопродуктів. Тому сировину перед подаванням у контактний апарат очищають. Для цього використовують електрофільтри або циклони. В електрофільтрах порошкові домішки осідають під дією електричного поля, а в циклонах - під дією відцентрових сил. «Отруєні» каталізатори регенерують (від лат. «
regeneration
-відновлення).
1.3. Контактні апарати
Основним обладнанням для проведення каталізних процесів є контактні апарати. В апаратах каталізатори можуть перебувати в нерухомому, рухомому або в «псевдокиплячому» (завислому) станах. Наразі у більшості випадків використовують контактні апарати з нерухомим каталізатором, який можна розмістити на поличках або в трубках.
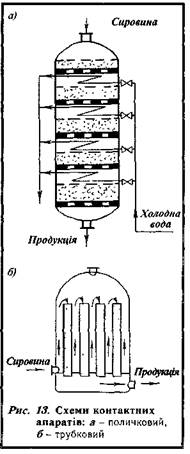
1. Поличкові апарати
(рис. 13, а) мають від однієї до кількох поличок. Товщина шару каталізатора на поличках збільшується в напрямі виходу продукції, а товщина теплообмінника, навпаки, зменшується, оскільки із зменшенням швидкості реакції зменшується кількість теплоти, яка виділяється в процесі реакції. У поличкових апаратах теплообмінювання відбувається за принципом зустрічних потоків.
Недолік
поличкових апаратів полягає в тому, що теплота відводиться ступінчасто, а тому каталізна реакція та теплообмінювання відбуваються одночасно.
2.
Трубкові апарати.
У трубкових апаратах (рис. 13,б) сировина (газ) і теплоносій (під час ендотермічних реакцій) або охолодник (під час екзотермічних реакцій) рухаються назустріч один одному. Нагрівання або охолодження відбуваються безперервно протягом усього каталізного процесу.
Недоліки
трубкових апаратів: непостійний температурний режим та охолодження каталізатора, великі розміри теплообмінника.
Комбіновані контактні апарати
частково позбавлені цих недоліків. Проте це не вирішує проблеми, оскільки контактні апарати з нерухомим каталізатором мають ще такі загальні недоліки:
незадовільне відведення теплоти від каталізатора, мала продуктивність, періодичність заміни каталізатора в апаратах тощо.
Останнім часом у промисловості почали успішно використовувати апарати, в яких каталізатор постійно рухається.
3.
Апарати з рухомим каталізатором.
У таких апаратах каталізатор у вигляді порошку знаходиться на поличках або його подають зверху назустріч сировині.
Поличкові апарати працюють за таким принципом: газова сировина під тиском надходить в апарат знизу.
Частинки каталізатора, що знаходяться на поличках під тиском сировини переходять у завислий стан, що нагадує кипіння рідини (звідси і походить назва «псевдокиплячий шар»). Утворена продукція виходить через отвір у верхній частині апарата. Теплообмінники розташовані всередині шарів каталізатора.
Є апарати іншої конструкції. У таких апаратах каталізатор та газова сировина рухаються назустріч один одному, сировина-газ знизу, а каталізатор-порошок – зверху. Каталізатор падає на дно апарату, звідки надходить у регенератор. Після регенерації каталізатор знов подають у апарат зверху, і так безперервно.
Переваги
контактних апаратів, з рухомим «псевдокиплячим шаром» каталізатора, порівняно з тими, де каталізатор нерухомий, такі: менший розмір частинок каталізатора, а відповідно більша поверхня контакту; точніша температура в апараті; більша продуктивність апарата, безперервна заміна каталізатора.
Основний недолік,
полягає в тому, що в процесі роботи каталізатор стирається (до 10% за рік) і забруднює отриману продукцію пилом.
2.1. Суть і значення електрохемічних процесів
Електрохемічними
процесами називають такі технологічні процеси., у ході яких електрична енергія перетворюється в хемічну і, навпаки, хемічна в електричну.
Перетворення хемічної енергії в електричну має місце в гальванічних елементах. У наслідок такого переходу гальванічний елемент стає джерелом постійного струму.
Якщо електричну енергію ввести в хемічну систему (розчин чи розплав) у вигляді постійного струму за допомогою електродів, то виникнуть хемічні процеси, які називають електролізом.
У 30-х роках XIXст. англійський фізик Майкл Фарадей відкрив закони електролізу. Уже з перших дослідів з'ясувалося, що електроліз має велике практичне значення. Проте відсутність потужних джерел постійного струму сповільнили його розвиток. Після винайдення потужної динамомашини в 1870 p., яка виробляла постійний струм, почали будувати електрохемічні підприємства, на яких рафінували мідь. З часом почали будувати заводи для виробництва алюмінію, хлору, лугів тощо.
Сьогодні електроліз водних розчинів, розплавлених солей і лугів широко застосовують у хемічній, металургійній і металообробній промисловості.
Електролізом водних розчинів отримують продукцію неорганічної хемії: водень, кисень, хлор, їдкий натр та ін.
Електроліз розплавлених солей використовують для виробництва легких, трудноплавких металів, рафінування металів і отримання сплавів. Такі метали, як алюміній, магній, натрій, літій, отримують лише електрохемічним способом.
Металообробна промисловість використовує електрохемічні процеси для виготовлення виробів із твердих металів і сплавів, виготовлення та розмноження металевих копій (гальванопластика) і нанесення покрить із чистих металів і сплавів на поверхні металевих виробів.
Головним недоліком
електрохемічних процесів є великі витрати електроенергії, вартість якої становить основну частину собівартості продукції. Саме тому на підприємствах, де використовують електрохемічні процеси необхідно раціонально використовувати електричну енергію.
2.2. Основні закономірності електрохемічних процесів
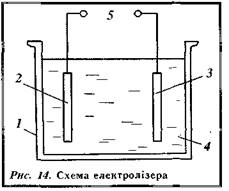
1. Будова електролізера.
Електрохемічні процеси відбуваються у агрегатах, які називають електролізерами.
Електролізер (рис. 14) складається з ванни 1
, викладеної з середини кислотостійкими матеріалами, електродів (анода 2
й катода 3),
допоміжних механізмів і пристроїв. Через електроліт (розчин або розплав) 4,
яким заповнюють ванну, від позитивного електрода (анода) до негативного (катода) проходить постійний електричний струм від джерела струму 5.
Електроди можуть бути твердими (наприклад, виготовлені з міді, заліза, графіту тощо) та рідинними (з ртуті).
На аноді
відбуваються реакції розчинення або окиснення металу, на катоді
- його виділення або відновлення. Наприклад, у процесі електролізу водного розчину хлориду натрію (
NaCl
)
на аноді виділяється хлор, а на катоді - водень; у процесі рафінування міді анод, виготовлений з чорнової міді, розчиняється, а на катоді виділяється чиста мідь. Внаслідок чого розміри анода зменшуються, а катода збільшуються. Домішки переходять в електроліт.
2.
Закони М. Фарадея.
Кількість речовини, яка виділяється на електродах під час електролізу залежить від кількості електричного струму, який пройшов через електроліт. Ця залежність визначається законами Майкла Фарадея.
Перший закон
:
кількість речовини (
m
),
яка виділилась на електродах, прямо пропорційна до сили струму (І)
і часу (
t
)
його проходження через електроліт.
Другий закон
:
при проходженні однієї й тієї самої кількості електрики через різні електроліти кількість речовини, яка виділяється на електродах, прямо пропорційна до хемічних еквівалентів цих речовин.
3.
Критерії раціонального використання електричної енергії.
Основними критеріями використання електричної енергії в процесі електролізу є вихід за струмом та енергією.
Вихідза струмом.
Цей показник обчислюють за формулою:
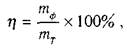 (1) (1)
де
m
Ф
- кількість речовини, що фактично (ф)
виділилась у процесі електролізу;
тТ
- кількість речовини теоретично (Т)
обчисленої за законом Фарадея.
Кількість речовини ( тТ
),
яка мала б виділитись у процесі електролізу (тобто за законом Фарадея) визначають за формулою:
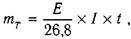 (2) (2)
де Е
- хемічний еквівалент речовини,
І
- сила струму, А,
t
- час проходження струму через електроліт,
год.
Формулу (2) підставимо у формулу (1) і отримаємо формулу для визначення виходу за струмом:
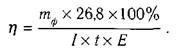
Значення η
завжди менше ста відсотків, оскільки частина електричної енергії витрачається на розрядження йонів інших елементів, які є в електроліті. Для збільшення виходу речовини необхідно зменшити побічні процеси, які відбувається в електроліті.
Вихід за енергією.
Цей показник визначають відношенням витрат електроенергії на одиницю продукції, теоретично (Т
)
необхідних для проведення електролізу – W
Т
,
до фактично (ф)
затрачених, у цьому процесі - W
Ф
.
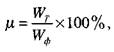
Фактичні витрати електричної енергії на одиницю продукції, отриманої в процесі електролізу, визначають за формулою:
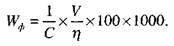
де
С
- електрохемічшш еквівалент даної речовини,
V
- середня напруга,
η
- вихід за струмом.
|