Введение
1. Литературный обзор
1.1 Общие методы получения амидов органических кислот
1.2 Методы получения N, N-диэтил-м-толуамида
2. Экспериментальная часть
3. Обсуждение результатов. Исследование гетерогенных катализаторов амидирования м-толуиловой кислоты
3.1 Термодинамика процесса
3.2 Испытание традиционных и модифицированных катализаторов амидирования алифатических кислот
3.3 Механизм амидирования как метод предсказания путей интенсификации реакции
3.4 Выбор и изучение эффективного катализатора амидирования м-толуиловой кислоты
4. Производственная безопасность
4.1 Токсилогические характеристики используемого сырья и конечных продуктов на человека
4.2 Санитарно-гигиенические условия в лаборатории
4.3 Экологическая безопасность
4.4 Безопасность в случае чрезвычайной ситуации
4.5 Защита объектов народного хозяйства в условиях чрезвычайных ситуации мирного и военного времени
5. Экономическая часть
5.1 Расчёт стоимости материалов
5.2 Расчёт заработной платы
5.3 Сводная смета затрат
6. Выводы
Литература
Введение
Проблема получения репеллентов представляет большой интерес, т.к. они отличаются от других пестицидов высокой специфичностью действия, вызывая отрицательный хемотаксис одноклеточных организмов и воздействуя на дистантные или на контактные хеморецепторы животных, преимущественно – насекомых. Потребность в отпугивании москитокровососущих насекомых возрастает в России с каждым годом, а активный антифидинг должен начинаться с ранней весны и продолжаться до наступления холодов, а в странах с тропическим климатом - круглый год.
Используемый арсенал репеллентов (ДЭТА, диметил фталат, бензимин, индалон, дибутилсукцинат, N- бутилацетанилид, бензилбензоат и др.), как правило, представлен азотсодержащими соединениями, из которых высокой эффективностью и изученностью токсилогических свойств выделяется N,N-диэтил-м-толуамид (м-ДЭТА).
Первые сведения об активности этого препарата появились в 1955 году [1], поэтому отечественными учеными он был синтезирован уже в 1956 году [2]. Препарат отличался малой токсичностью для теплокровных (ЛД50
для мышей 2500 мг на 1 кг живого веса), но отпугивал клещей, комаров и москитов, причем эффективность его действия против комаров при работе, не связанной с физической нагрузкой, достигала 10ч. Продолжительность защитного действия ДЭТА в 3 раза превосходила таковую диметилфталата и в 1,6 раза – препарат ДИД (смесь, состоящая из 75% диметилфталата, 20% индалона и 5% диметилкарбата).
Реклама

Впервые ДЭТА был синтезирован в 1929 году [3], и метод базировался на получении хлорангидрида м-толуиловой кислоты, что достигалось при действии на кислоту галоидирующих агентов (PCl5
, PCl3
или SOCl2
), а реакция сопровождалась выделением агрессивных газов (HCl, SO2
). Все последующие синтезы [4-6] также включали стадию получения хлорангидридов и только, по-видимому, в 1960 г. начались первые попытки использовать метиловые эфиры толуиловой кислоты или проводит синтезы с применением традиционных для процессов амидирования алифатических кислот катализаторов (Al2
O3
, SiO2
) [7]. Однако стабильность таких катализаторов, несмотря на возможность восстановления их активности после регенерации, не превышала 10-12 ч, хотя селективность могла достигать 80-90%.
Однако, в силу указанной причины, а также трудно на сегодня устанавливаемых факторов, организация производств ДЭТА как в России, так и за рубежом была осуществлена по следующей схеме: м-ксилол – м-толуиловая кислота – хлорангидрид м-толуиловой кислоты – ДЭТА. Однако данный метод является морально устаревшим. Однако до настоящего времени не предложен удовлетворительный катализатор для промышленного синтеза ДЭТА, независимо от природы исходного сырья (м-толуилоая кислота, её сложные эфиры, нитрилы и т.д.).
Несмотря на то, что ДЭТА является ингибитором некоторых полимеризационных процессов [8], катализатором в производстве силиконового каучука [9], растворителей гербицидов [10], основное его назначение, как отмечалось выше, - это бытовая химия [11] и эпидемиология [12]. Сказанное диктует жесткие требования к чистоте и цветности продукта, что вынуждает проводить определенные исследования, как по материалу оборудования, так и по поиску эффективных путей отделения м-ДЭТА от параизомеров и м-толуиловой кислоты.
Решение указанной задачи в связи со всеобщим потеплением климата и активизацией, таким образом, насекомых – переносчиком трансмиссивных болезней – является своевременными и актуальными.
Цель работы: выбор катализатора амидирования и изучение в его присутствии превращения м-толуиловой кислоты в N,N-диэтил-м-толуамид.
Реклама

1. Литературный обзор
Амиды кислот - класс органических соединений, представляющих совершенно определенный интерес как с практической, так и с теоретической точек зрения. Практическая ценность в первую очередь определяется их биологической активностью (гормоны, нейропептиды, антибиотики, токсины, ингибиторы ферментов; вещества, вызывающие хемотаксис микроорганизмов и т.п.) и, во-вторых, наличием пептидной группировки -СО-NH-, присутствующей как в шерсти, так и в некоторых искусственных волокнах в определяющей их теплофизические свойства. Интерес к амидам для фундаментальных химических исследований связан с наличием сопряжения между неподеленной парой электронов атома азота и π-электронами карбонильной группы.
1.1 Общие методы получения амидов органических кислот
Одним из наиболее доступных и в то же время промышленно значимым является метод получения амидов через аммонийные соли карбоновых кислот [13]. Последние подвергают сухой перегонке (пиролизу), при этом выход целевого продукта достигает 87-90%.
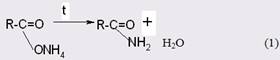
Прямое взаимодействие кислот с аминами в силу обратимости реакции проводят в присутствии избытка одного из реагентов, причем реакция легко протекает только с алифатическими кислотами с неразветвленной цепью, но с трудом - с ароматическими и пространственно затрудненными кислотами или с менее основными аминами [14].

В реакции принимают участие также вторичные амины, процесс катализируется кислотами. Механизм кислотного катализа относят к типу AAC
2 [15] и он близок к перегруппировке Бекмана [16].
Возможность получения замещенных амидов по Бекману в присутствии серной или полифосфорной кислот, PCl5
или других катализаторов характерна для Е-диастереомеров. На примере кетоксимов доказано, что имеет место анти-перегруппировка: группа ОН меняется местами с остатком, находящемся в транс-положении по отношению к ней.
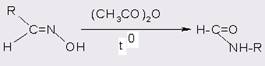
В том случае, когда субстратом выступают сложные эфиры, лактоны или фталиды, в качестве амидирующих агентов можно использовать аммиак или пространственно незатрудненные амины [17]. Реакция сложных эфиров с аммиаком катализируется водой, гликолями и другими подобными соединениями [18]; аналогичная реакция с аминами промотируется солями, например, NH4
Cl[19].

В зависимости от типа катализатора, используемого при реакции, аминолиз протекает по механизмам AAC
2 или BAC
2.
Естественно, лактоны и фталиды аналогичным образом превращаются в имиды без раскрытия кольца [20].
В свою очередь действие на ангидриды карбоновых кислот амидирующих агентов (в том числе мочевины и уретанов) протекает обычно без катализаторов
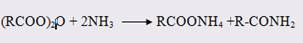
В случае менее реакционноспособных реагентов (например, дифенил-амина или 2,4-динитроанилина) ацетилирование уксусным ангидридом проводят в присутствии кислотного катализатора [14].
Однако синтезы на основе ангидридов более широко применяются для получения имидов, чем амидов, при этом циклические ангидриды могут давать только имиды, кислые имиды или диимиды в зависимости от реагента и условий эксперимента [21].
Упомянутая несколько выше мочевина может реагировать напрямую с карбоновыми кислотами (синтез по Шербулье [16]).

Следующий метод - один из наиболее широко применяемых способов получения амидов, по которому выходы последних обычно составляют 80-90%. Отрицательным свойством данной реакции является потеря одного эквивалента амина на связывание высвобождающегося хлористого водорода
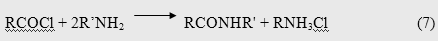
Реакция сильно экзотермична [22], поэтому зачастую ее проводят в растворителях, например, в дихлорэтане [23], четыреххлористом углероде [24], хлороформе [25], толуоле [26] и т.п. Количественному протеканию конденсации способствует присутствие водного раствора гидроксида натрия [27]. Механизм ацилирования, как правило, соответствует типу SN
2 [28], а реакционная способность агентов симбатна ряду кислотностей соответствующих кислот и убывает в последовательности RCOHal >(RCO)2
O ≈ RCOOR > RCONR2
> RCOR. Кроме того, скорость реакция увеличивается с ростом нуклеофильности амина и может осуществляться основной и даже кислотный автокатализ [29].
Целесообразно упомянуть и другие, представляющие синтетический интерес, ацилирующие агенты: кетены, диктены, кетонитрилы, карбамоилхлориды [14]. В последнем случае в реакцию могут вступать арены, но в присутствии кислот Льюиса (реакция Гаттермана-Хопфа [16]).

Представляет интерес путь через нитрилы - вполне доступный класс соединений [16]:

Реакцию проводят с осторожностью, т.к. первичный амид часто подвергается дальнейшему гидролизу до соответствующей карбоновой кислоты и аммиака. Кислоты и щелочи сильно ускоряют реакцию. При кислотном катализе процесс протекает за счет атаки воды на протонированную форму нитрила, в то время как при основном катализе ион гидроксила взаимодействует со свободным нитрилом. В последнем случае в качестве реагента применяют водный раствор NaOH, содержащий 6-12% перекиси водорода, т.к. гидропероксид-анион в несколько тысяч раз активнее гидроксид-иона [14]. Ароматические нитрилы дают почти количественные выходы, хотя для о-замещенных нитрилов необходимо применять пергидроль.
Гидролиз до амидов в безводных условиях при комнатной температуре можно проводить в присутствии метилсульфинил метида натрия с выходом 75-95% [30]. Альтернативный вариант - это реакция Риттера [31], когда нитрил реагирует с алкенами или спиртами [32]:
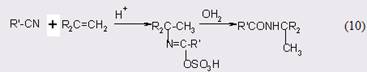
Механизмы реакций превращения нитрилов в амиды достаточно подробно изучены [33], но в данном случае нет необходимости подвергать их анализу.
Таким образом, краткий обзор общих методов получения амидов позволяет сделать некоторые выводы. Все основные методы получения амидов, как правило, могут быть применимы как для алифатических, так и для ароматических членов гомологических рядов. Во всех случаях кроме тех, где реакции принципиально могут протекать чисто термически, процессы катализируют кислотные или основные катализаторы; применяемые гетерогенные контакты также содержат кислотные центры, но преимущественно Льюисовского типа.
1.2 Методы получения N, N-диэтил-м-толуамида
Как указано во введении, до настоящего времени ДЭТА производят по классическому методу, который основан на окислении м-ксилола в м-то-луиловую кислоту, превращении последней в хлорангидрид и последующем ацилировании им N,N-диэтиламина [2].
Из методов модифицирования указанного варианта следует упомянуть работы по совместному получению бензилхлоридов и амидов ароматических кислот [34], когда обрабатывают полностью замещенные бензиламины общей формулы RR’NCH2
Ar (R, R’- алкил) хлорангидридом ароматической кислоты ArCOCl, получая при этом ArCONRR’ и ArCH2
Cl с выходом 83,5 и 80% соответственно. Преимуществом данного способа является минимальное образование сточных вод и экологически опасных выбросов и получение двух целевых продуктов одновременно. Однако не устранены отрицательные факторы: многостадийность, периодичность и использование хлорпроизводных (фосгена или хлористого тионила).
К новым методам получения ДЭТА относятся следующие: амидирование эфиров м-толуиловой кислоты; совместное с гидролизом амидирование нитрила м-толуиловой кислоты; прямое амидирование м-толуиловой кислоты диэтиламином в жидкой или газообразной фазе.
Амидирование эфиров м-толуиловой кислоты подразумевает предварительную стадию получения эфиров этерификацией кислоты спиртами в присутствии серной, фосфорной или соляной кислот с одновременной отгонкой азеотропа спирт-вода. После нейтрализация кислоты и отмывки полученный катализат подвергают вакуумной ректификации. Таким образом, по сравнению с классическим методом получения ДЭТА, включающим стадию синтеза хлорангидрида м-толуиловой кислоты, синтез алкилового эфира имеет неоспоримое преимущество, но вопросы экологии и очистки сточных вод остаются. Само амидирование диэтиламином проводят в присутствии водоотнимающих катализаторов [35], а в качестве сырья используют метиловый эфир м-толуиловой кислоты в соотношении с диэтиламином 1:3-7 мольн., которые нагревают в автоклаве при температуре 270-280°С в течение 2-8 ч. Избыточное количество амина отгоняют, соль ароматической кислоты с диэтиламином разрушают 30%-ной серной кислотой и после стадии отмывки и нейтрализации извлекают целевой продукт экстракцией толуолом (выход 55%). В тех случаях, когда используют нитрил м-толуиловой кислоты [36]. ДЭТА получают с выходом более 90%. Процесс реализуют в автоклаве при температуре 230°С и мольном соотношении реагентов нитрил: алкиламин: вода равном 1:1-1,5:1-2, времени реакции 2-12 ч. В качестве катализаторов используют перекиси, неорганические и органические кислоты и их соли, например, ацетат свинца. В катализатах обнаружены также N-этилтолуамид и м-толуамид при конверсии нитрила 90%, однако процесс многостадиен и не обеспечен сырьевой базой. Наибольшее внимание исследователей посвящено разработке метода синтеза ДЭТА прямым амидированием м-толуиловой кислоты диэтиламином. Действительно, метод прямого амидирования привлекателен уже тем, что это одностадийный процесс, который может быть осуществлен как в периодическом, так и в непрерывном вариантах. Реакция протекает при повышенных температурах в присутствия гомогенного или гетерогенного катализаторов.
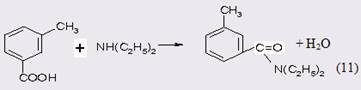
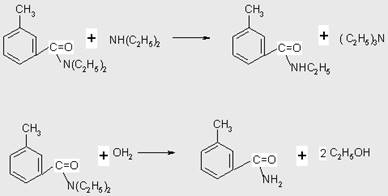
В качестве побочных процессов следует отметить переаминирование и гидролиз:
Все процессы прямого амидирования можно разделить на жидкофазные, проводимые в аппаратах периодического действия в присутствии катализаторов на основе титансодержащих соединений [37], фосфорных, полифосфорных, надфосфорных кислот и их солей, фосфорного ангидрида или галогенидов фосфора [38] и комплексных соединений типа [PON(R)R’]3
(R и R’- C1
-C4
ал-килы) [39]; и газофазные, проводимые в проточных реакторах над гетеро-генными катализаторами типа оксидов алюминия или силикагеля [35], фосфата бора [40] и т.д.
Получение ДЭТА согласно патенту [37] осуществляют при температурах 150-3000
C в отгонно-реакционном режиме. В качестве катализатора используют ТiCl4
, Ti(OR)4
, в частности Ti (OBu)4
, а также катализаторы фирмы Tizor марок ТЕ, АА, OG, LA, представляющие собой внутрикомплексные соединения, например, с триэтаноламином (марка ТЕ) или аммонийную соль лактата титана (марка LA):
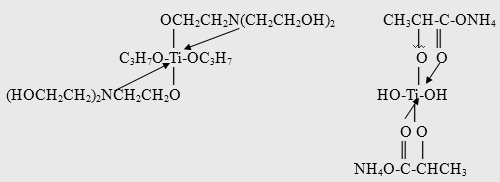
Катализатор вводят в бензольный раствор диэтиламмонийной соли м-толуиловой кислоты в количестве 0,001-0,2 г на 1 г кислоты при мольном соотношении реагентов 1-2:0,5-1 соответственно. Реакция протекает в отгонно-реакционном режиме при 220-240°С в течение 16-24 ч. Реакционную массу обрабатывают горячим щелочным раствором и для улучшения расслоения органического слоя вводят некоторое количество хлорида натрия. Бензольный раствор ДЭТА подвергают ректификации (выход 75%), конверсия кислоты 90-93%; продукт характеризуется чистотой в 95%.
По данным работы [41], лучшие результаты по синтезу ДЭТА достигаются не при использовании хелатных комплексов, а при введении в растворы тетрахлорида или тетрабутоксититана, при этом требуется применение повышенного давления и температуры 150-300°С.
Недостатками этих методов являются низкая конверсия м-толуиловой кислоты, что требует ее нейтрализации, применение растворителей, сложность отделения гомогенных катализаторов. Кроме того, титанаты достаточно коррозионно агрессивны и токсичны.
Применение в качестве катализаторов фосфорных кислот и хлорпроизводных фосфора [38] позволяет достичь 98%-ного выхода ДЭТА при температуре синтеза 250°С и давлении 1 МПа, процесс протекает в автоклаве в течении 6 ч. Катализаторы вводят в количестве 0,01 моля на 1 моль м-толуиловой кислоты, мольное отношение последней к диэтиламину 1:1,5. Применение алкиламидов фосфорной кислоты [39] в отношении к толуиловой кислоте 1-2:3 при 180-200°С к времени реакции 2 ч позволяет достичь выхода ДЭТА в 84%. В данном процессе реакция автокаталазируется фосфорной кислотой, которая образуется в результате разложения катализатора по схеме:
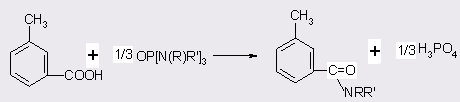
После отгонки органических продуктов H3
PO4
может быть выделена и возвращена на стадию получения алкиламидов фосфорной кислоты. Непрореагированная м-толуиловая кислота также легко выделяется кристаллизацией и может повторно использоваться. Недостатком процесса в целом является его двухстадийностъ: синтез катализатора, сопровождающийся образованием кислых сточных вод, и синтез ДЭТА. Использование PCl3
[3] для синтеза алкиламидов не решает указанных проблем: отходами процесса являются солянокислый диэтиламин, кислые сточные воды и моноэтиламид фосфорной кислоты. Реакция протекает при 115-120°С в течение 3-4 ч, в среде толуола. Целевой продукт выделяют из предварительно нейтрализованной реакционной массы перегонкой (выход 89%).
Представляет интерес метод поучения ДЭТА обработкой м-толуиловой кислоты диэтиламином в присутствии солей вольфрамовой кислоты, например, гидровольфрамата аммония [3] В процессе не требуется проводить одновременную отгонку воды, т.к. разлагающаяся при температуре синтеза соль вольфрама уводит воду, превращаясь в нерастворимую H2
WO4
. При температуре 200-2200
C за 8 ч конверсия м-толуиловой кислоты достигает 75% при селективности образования ДЭТА 96%.
Осуществление синтеза в газовой фазе над гетерогенными катализаторами позволяет перейти от периодических аппаратов смешения к непрерывно работающим установкам. В вертикальный реактор, заполненный гетерогенным катализатором, подают раствор диэтиламмонийной соли м-толуиловой кислоты. Катализат, собираемый снизу, подвергают, если необходимо, нейтрализации, далее перегоняют или ректификуют для выделения целевого продукта. В качестве катализаторов используют традиционные системы типа оксидов алюминия или силикагель [3] В этом случае процесс проводят температуре 250-350°С, мольном соотношении м-толуиловая кислота: диэтиламин 1:2-6, времени контакта 0,4-0,8 мин; выход ДЭТА 92-97%. Побочными продуктами являются: этиламин, моноэтилтолуамид, нитрил толуиловой кислоты и другие. Катализаторы этого типа работают эффективно в течение 10-12 ч, после чего необходим отжиг при 400-4500
С в токе воздуха. Иногда предусматривают узел испарения м-толуиловой кислоты [42] при 285°С для предварительной очистки кислоты от смол и изомеров, получающихся при ее синтезе. Для извлечения целевого продукта из катализата используют экстракцию и ректификацию.
Для нивелирования направлений реакции, приводящих к образованию побочных продуктов, предлагают применять катализатор под общим названием "фосфат бора" [40] при температуре синтеза 280-290°С, времени контакта 0,5-1 мин (выход ДЭТА 83-84% при конверсии кислоты 80-82%). Способ предусматривает извлечение м-толуиловой кислоты из катализата и возврат ее в цикл.
Из нетрадиционных методов получения ДЭТА достойно упоминания электрохимическое окисление производных бензола общей формулы R1
C6
H4
R2
[R1
и R2
- Me или CH(OR)2
] в присутствии спирта [43] и триалкиламина, а в качестве электролита применяют 1-70%-ные растворы исходного производного бензола в спирте. Выделенный ректификацией эфир электрохимически амидируют [44]. Особенностями таких процессов являются новейшее технологическое оформление химических процессов, повышенная чистота исходных продуктов, возможность создания непрерывного процесса по всей технологической нитке. Однако применение электрохимических методов требует больших энергозатрат и производственных площадей.
Методам аналитического контроля ДЭТА также посвящено несколько работ [45]; значительно больший акцент сделан на токсикологических испытаниях, из которых следует упомянуть исследования ориентированные на изучение его действия на организм человека [46].
2. Экспериментальная часть
Спектры ЯМР регистрировали на приборе марки BS 567 А. Рабочая частота для 1
Н 100 МГц, 10%-ный раствор м-ДЭТА в CDCL3
, внутренний стандарт ГМДС, δ: 1.13 (ушир. Сигнал. 6Н – 2CH3
), 2.32 (о, ЗН-CH3
-Ar), 3.23, 3.50 (у.с., 4Н – CH2
N), 7.16 (м, 4Н - аром. Н). Рабочая частота для 13C 25.142 МГц, 50%-ный раствор м-ДЭТА в CD3
CN, расчет относительно известных сигналов растворителя. Спектры снимали в условиях полного подавления спин-спинового взаимодействия [13
С – 1
Н] и в условиях "off-резонанса", δ: 13.6 (у.к. СН3
-СН2
), 20.8 (к. CH3
-Ar), 40.0, 43.3 (т, CH2
N), 123.4, 127.0, 128.5, 129.8 (д.аром. С-Н), 138.4, 139.0 (с, аром.третичн. С), 171.0 (с, С=С-N).
Продукты реакции анализировали методом ГЖХ на приборе ЛХМ-8МД-5 с пламенно-ионизационным детектором, колонка 3 м х 3 мм, заполнена 15% Апиозона L на хроматоне N-AW-DMCS. Температура хроматографирования от 80 до 240°С с программой 8 К/мин, скорость газа-носителя (азот) 20 см3
/мин. Стандартная хроматограмма приведена на рис. 2.1. Воду, содержащуюся в катализате, анализировали на приборе ЛХМ-80 с катарометром, колонка 2 м х 3 мм, заполнена 20% ПЭГ 20М на хроматоне, импрегнированном 2,5% КОН. Температура хроматографирования 150°С, скорость газа-носителя (гелий) 40-45 см3
/мин, внутренний стандарт – диметилацетамид. Реакцию амидирования изучали в лабораторном проточном интегральном реакторе стандартной конструкции. Раствор м-толуиловой кислоты в диэтиламине (мольное соотношение 1:1-1:7) насосом-дозатором подавали в верхнюю часть реактора, послойно заполненного кварцевой насадкой и катализатором. Обогрев осуществляли электропечью, контроль температуры проводили в трех точках по высоте слоя катализатора хромелъ-копелевыми термопарами. Охлажденные продукты реакции собирались в ловушке, откуда отбирались на анализ. При обработке оксида алюминия минеральными кислотами выявлено, что катализаторы должны эксплуатироваться сразу после стадии сушки. Предварительная прокалка приводит к потере активности либо до уровня немодифицированного Al2
O3
, либо снижается в еще более значительной степени. Эксплуатация выбранного гидроксилапатита кальция не требует после стадии приготовления дополнительных активационных обработок. Физико-химические характеристики КФ-70: насыпной вес 0,60 г/см3
, прочность 1,0 кг/мм, удельная поверхность 80 м2
/г, объем пор 0,65 см3
/г, кислотность 5 мг-экв./г; структура - широкопористая (сдвиг кривой распределения пор по эквивалентным радиусам до 150 Å). Активность кальцийфосфатных катализаторов в реакциях кислотного катализа пропорциональна количеству групп HPO4
2-
, содержание которых в исследованном нами образце контакта достигало 30%, что близко к теоретически возможному (33,3%). При необходимости проверки кислотности катализаторов на основе оксидов алюминия порошок контакта суспендировали в ацетонитриле и титровали н-бутиламином, за ходом процесса следили потенциометически. Применение Н0
-индикаторов не дает лучших результатов.
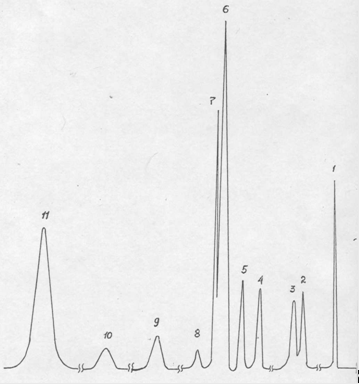
Рис. 2.1. Хроматограмма основных продуктов катализата синтеза м-ДЭТА на катализаторе КФ-70.
1 – диэтиламин, 2,3,8,9,10 – неидентифицированные продукты, 4 – диэтилбензамид, 5- о-ДЭТА, 6 – м-ДЭТА, 11 – тетраэтилизофталамид.
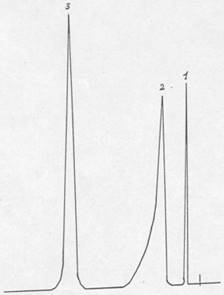
Рис. 2.2. Хроматограмма водных погонов синтеза м-ДЭТА
1 – диэтиламин, 2 – вода, 3 – диэтилацетат (внутренний стандарт)
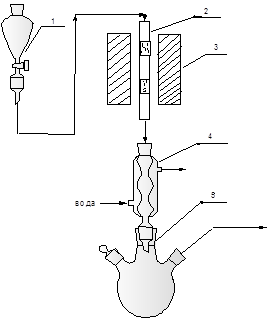
Рис. 2.3. Схема лабораторной установки амидирования в присутствии гетерогенных катализаторов. 1 – бюретка с насос-дозатором, 2 - реактор, 3 – электропечь, 4 - холодильник, 5 – приёмник.
3. Обсуждение результатов. Исследование гетерогенных катализаторов амидирования м-толуиловой кислоты
3.1 Термодинамика процесса
Поскольку реакция амидирования м-толуиловой кислоты (МТК) является обратимой, на первом этапе исследований были изучены термодинамические характеристики процесса. С целью определения состава равновесной смеси и условий, при которых могут быть сняты термодинамические ограничения, на первых порах был проведен расчет констант равновесия при различных температурах в диапазоне 260-320°С для реакции (табл. 3.1).
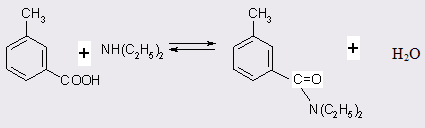
толуамид катализатор кислота токсикологический
Расчет констант равновесия проводился по экспериментальным данным после достижения в статических условиях устойчивых равновесных концентраций компонент [51]. В качестве катализатора реакции в данном случае использовали 0,5 мас.% хлорной кислоты. Достижение равновесия при любых температурах определялось только с одной стороны (опыты по гидролизу диэтилтолуамида не проводились).
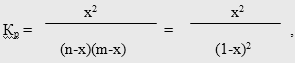
где х - степень превращения МТК или ее мольная доля [52]; n и m - мольные доли исходных компонентов (для простоты принято, что n = m = 1).
Обработка полученных значений Кр
по методу наименьших квадратов [53] позволила аппроксимировать их следующим эмпирическим уравнением:
Кр
= exp(8,81 – 3019,25/Т),
которое, в частности, может быть использовано при синтезе химико-технологических систем на стадии проектирования.
Расчет термодинамически возможной степени превращения при различных температурах и мольных отношениях реагентов осуществлялся по формуле [51]
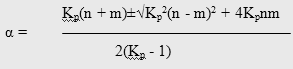
Таблица 3.1 Расчетные значения констант равновесия и термодинамически возможные степени превращения м-толуиловой кислоты при различных условиях синтеза м-ДЭТА
| t, 0
С |
К |
Соотношение МТК:диэтиламин |
Кр
|
Степень превращения МТК (α) |
| 260 |
533 |
1:1
1:5
|
21,49 |
0,549
0,880
|
| 280 |
553 |
1:1
1:2
1:5
|
27,96 |
0,840
0,967
0,990
|
| 300 |
573 |
1:1
1:3
1:5
|
36,00 |
0,857
0,986
0,990
|
| 320 |
593 |
1:1
1:2
1:3
1:5
|
40,35 |
0,860
0,970
0,988
0,990
|
Анализ данных, представленных в табл. 3.1, позволяет сделать вывод, что при соотношении МТК: диэтиламин 1:1 мольн. и при 2600
С термодинамически возможная степень превращения составляет 0,55, а при 320 0
С - 0,86. При температуре 280 0
С и мольном соотношении реагентов 1:2 термодинамические ограничения практически снимаются.
Отметим, что небольшие значения констант равновесия свидетельствуют о том, что, несмотря на снятие термодинамических ограничений, реакция по-прежнему остается равновесной. Поэтому дальнейшее увеличение концентрации диэтиламина и повышение температуры максимально благоприятствуют процессу.
Следующей важной характеристикой процесса является тепловой эффект реакции, который из-за отсутствия в литературе термодинамических характеристик исходных и конечных компонент (кроме диэтиламина и воды) был оценен по теплотам сгорания органических соединений в газообразном состоянии, и его величина составила ΔНо
298
= -20±5 кДж/моль. В свою очередь теплоты сгорания веществ, принимающих участие в реакции, рассчитаны по формуле [54]:
ΔНсгор
= - (204,2n + 44,4m + Σх),
где n - число атомов кислорода, необходимое для полного сгорания вещества; m - число молей образующейся воды; х - поправка (термическая характеристика), постоянная в пределах гомологического ряда.
Термическая характеристика (х) - это фактически инкремент численных значений группы атомов или типа связи. Так, например, для МТК х = 100,4 кДж/моль [54]. Таким образом, выполненный термодинамический расчет показал возможность количественного превращения м-толуиловой кислоты в м-ДЭТА и позволил определить область режимов проведения реакции, соответствующих достижению поставленной цели.
3.2 Испытание традиционных и модифицированных катализаторов амидирования алифатических кислот
Выявив термодинамически наиболее благоприятные условия проведениия исследуемой реакции, мы испытали некоторые традиционные (γ-Al2
O3
, SiO2
) [55] и модифицированные (Zn/SiO2
, Sn/SiO2
– силикагель типа МСК[56]) катализаторы амидирования, используемые в промышленных процессах получения алифатических амидов.
Общая тенденция роста конверсии и уменьшения селективности процесса при увеличении температуры реакции сохраняется для всех катализаторов (рис. 3.1, 3.2). Однако при использования немодифицированного SiO2
типа МСК скорость реакции с повышением температуры увеличивается в большей степени, чем для Al2
O3
, поэтому силикагель был выбран в качестве носителя при приготовлении систем Sn/SiO2
и Zn/SiO2
. Тем не менее модифицированные системы не показали каких-либо аномальных свойств.
Полученные данные (табл. 3.2) свидетельствуют о том, что применение, например, γ – Al2
O3
позволяет достичь 42-59%-ной конверсии МТК при 260-3200
С (31-34%-ный выход ДЭТА - идентифицирован методом ЯМР, см. гл. 1). Однако лучшие результаты получены на катализаторе Sn/SiO2
(1 мас.%): в этом случае конверсия МТК в том же температурном диапазоне достигает 78-90% (выход ДЭТА 71%) [57].
Таким образом, даже когда удается достичь высокой конверсии субстрата (90%), выход ДЭТА достаточно низкий (71%) из-за невысокой селективности процесса. Другим, безусловно более существенным отрицательным свойством указанных катализаторов является их низкая стабильность работы - 10-12 ч.
Также обращает на себя внимание факт, что активность испытанных катализаторов не связана с их удельной поверхностью, которая находятся в пределах 230-560 м2
/г. Это может свидетельствовать о том, что амидирование протекает поверхностно. По-видимому, это связано с большим объемом реагирующих молекул, который либо соизмерим с объемом пор катализаторов, либо превышает его. Кроме того, следует иметь в виду, что при высоких температурах увеличивается не только колебательный размер молекул (их пульсация - критический объем), но и снижается вероятность вхождения реактантов в поры контакта.

Рис. 3.1 Зависимость конверсии МТК от температуры реакции амидирования на различных катализаторах.
1 – 1% Sn/SiO2
, 2 – SiO2
, 3 – 5% Sn/SiO2
, 4 – 5% Zn/SiO2
, 5 – 1% Zn/SiO2
, 6 – Al2
O3
.
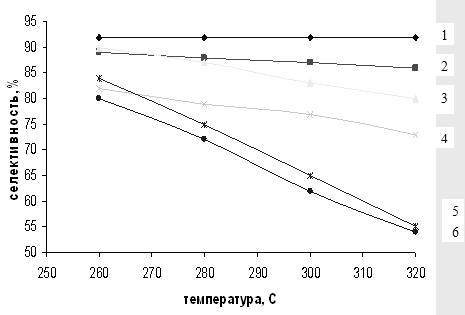
Рис. 3.2 Зависимость селективности образования м-ДЭТА от температуры на различных катализаторах.
1 – 1% Sn/SiO2
, 2 – SiO2
, 3 – 5% Sn/SiO2
, 4 – 5% Zn/SiO2
, 5 – 1% Zn/SiO2
, 6 – Al2
O3
.
Таблица 3.2 Амидирование м-толуиловой кислоты диэтиламином (1:5 мольн.) на различных гетерогенных катализаторах при объемной нагрузке по сырью 0,2 ч-1
| Катализатор (удельная поверхность, м2
/г) |
Температура, 0
С |
Конверсия МТК, % |
Селективность образования ДЭТА, % |
Фторированная
γ- Al2
O3
(230)
|
260
280
300
320
|
42,1
47,3
54,8
59,4
|
80,8
68,1
59,8
52,5
|
SiO2
типа МСК
(560)
|
260
280
300
320
|
55,2
61,5
74,3
82,9
|
92,6
92,0
91,8
91,0
|
1 масс.% Zn
на SiO2
(555)
|
260
280
300
320
|
53,2
55,0
58,7
66,4
|
84,4
72,3
63,1
53,0
|
5 масс.% Zn
на SiO2
(552)
|
260
280
300
320
|
66,7
70,6
73,4
76,6
|
83,4
79,8
74,3
70,1
|
1 масс.% Sn
на SiO2
(556)
|
260
280
300
320
|
78,6
87,8
87,9
90,0
|
90,4
88,0
82,8
79,2
|
5 масс.% Sn
на SiO2
(552)
|
260
280
300
320
|
73,8
75,5
77,6
80,9
|
89,3
87,1
87,0
84,6
|
В свете изложенного в данном разделе материала дальнейшие исследования были ориентированы на поиск приемов, способствующих более быстрому протеканию основной реакции (попытка увеличить селективность процесса) с одновременным рассмотрением при необходимости вопроса о стабилизации работы контакта.
Решение такой задачи, по нашему мнению, могло быть осуществлено в ходе или после изучения механистических аспектов данной проблемы.
3.3 Механизм амидирования как метод предсказания путей интенсификации реакции
Данные, представленные в разделе 3.2, свидетельствуют о том, что гетерогенные катализаторы, традиционно используемые даже в промышленных масштабах при амидировании алифатических кислот, оказались нестабильными и быстро теряли селективность при получении ароматических амидов. Причина неудовлетворительной работы оксидов алюминия и кремния в основном обусловлена быстрым закоксовыванием поверхности, что, по нашему мнению, связано с наличием на Al2
O3
преимущественно льюисовских (слабых) кислотных центров. Повышение силы последних на фторированном оксиде алюминия больше сказывается на увеличении скорости реакции, чем на повышении стабильности катализатора, которая могла быть увеличена не более чем на 2-3 ч. Усиление каталитических свойств оксида кремния, как и незначительное, но тем не менее имевшее место пролонгирование его эффективной работы, по-видимому, обусловлено присутствием наряду с льюисовскими также и бренстедовских кислотных центров. Хорошо известно, что амидирование ускоряется в присутствии кислотных или щелочных агентов, т.е. имеет место кислотный или основной катализ. В последнем случае можно рассчитывать, что взаимодействие МТК с диэтиламином, по крайней мере в незначительной степени, должно наблюдаться invitro. Тем не менее смесь двух реагентов не претерпевала видимых изменений даже при повышенных температурах в течение нескольких дней, т.е. не наблюдался общий основной катализ. Последнее, в частности, подтверждается тем, что порядок реакции по диэтиламину, когда его избыток не превышает 1,5 мольн. по отношению к МТК, составляет единицу. В тех случаях, когда реакция может катализироваться самим реагентом, порядок реакции по нему, как правило, равен 2, и в состав переходного состояния должна входить вторая молекула амина. Изложенное побудило нас ввести в реакцию "независимый" основной катализатор, а именно – Al2
O3
, обработанный гидроксидами щелочных и щелочноземельных металлов (Li, Na, K и Ba). Такой контакт безусловно катализировал реакцию, но продолжительность его активной работы определялась временем увода щелочи толуиловой кислотой (во всяком случае в катализатах присутствовали толуилаты соответствующих металлов). Любопытен факт отсутствия сравнительной активности у различных щелочных агентов, т.е. сила щелочи, нанесенной на Al2
O3
, не имела принципиального значения. Однако при использовании гидроксида бария первоначальная активность контакта (первые 2-3 часа работы) была ниже, чем наблюдалось нами для других случаев. Этот эффект, скорее всего, можно приписать тормозящему действию катиона Ba2+
. Другим отрицательным свойством основных катализаторов являлось их более быстрое, чем в случае необработанного Al2
O3
, закоксовывание. Теперь рассмотрим вариант кислотно-катализируемого амидирования МТК. В данном случае оксид алюминия пропитывали растворами и ортофосфорной, соляной, иодноватой, борной или хлорной кислот. Обнаружено, что в общем случае, чем больше сила кислоты, тем активнее катализатор, однако для очень сильных кислот (HCl, HJO3
, HClO4
) эта разница практически отсутствует. Однако скорость реакции зависела от концентрации нанесенной на Al2
O3
сильной кислоты, причем характер зависимости экстремальный (ранее подобное явление было отмечено для гидролиза амидов в водно-кислотных растворах). Такая картина является обычной для механизма AAC
2 в концентрированных водных растворах кислот. Этот факт, с учетом выявленной нами, зависимости скорости реакции от концентраций обеих реагирующих молекул и протона, позволяет с большей уверенностью говорить о том, что и в случае гетерогенно-катализируемой реакции общий вид механизма не может отличаться от типа А 2. Вопрос о том, ацильный или алкильный маршрут включает данный механизм, не имеет принципиального значения для решаемой нами задачи, и в общем виде он может быть представлен следующим образом (рассмотрение стадий протонирования амина или солеобразования вносит дополнительные сложности в описание механизма реакции и их обычно опускают. В общем-то, предполагают, что активные частицы кинетически неразличимы):
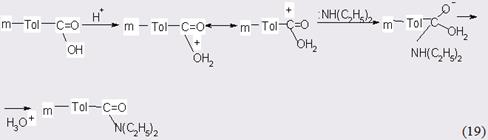
К лимитирующей, по-видимому, следует отнести стадию присоеинения диэтиламина, что не противоречит мнению других исследователей, изучавших аналогичные системы. В силу того, что процесс протекает на гетерогенном катализаторе при достаточно высокой температуре, не исключено, что протонированная молекула м-толуиловой кислоты отщепляет воду с генерацией карбаниона, на который в свою очередь может осуществляться электрофильная атака протонированного амина:
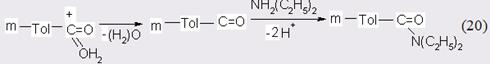
Хотя такой маршрут реакции, возможно, более заманчив, для его реализации требуется участие в переходном состоянии еще одной молекулы диэтиламина, что, как было показано в начале данного раздела, маловероятно. Однако главный с практической точки зрения вывод остается прежним: процесс необходимо катализировать кислотами Бренстеда-Лоури [65]. Во-первых, активность катализатора связана с силой и концентрацией кислоты, во-вторых, увеличение концентрации кислоты может тормозить коксообразовательные процессы и, наконец, в-третьих, имеется возможность найти оптимум между силой кислоты и полезными функциями катализатора.
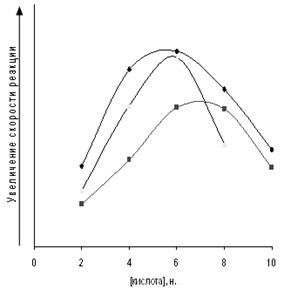
Рис. 3.3. Тенденция изменения скорости реакции амидирования МКТ от концентрации минеральных кислот. 1 − HClO4
, 2 − HCl, 3 −HIO3
.
Тогда требования к контакту можно сформулировать предельно просто - это должен быть достаточно стабильный катализатор, несущий протонсодержащую функцию. Такие катализаторы, по-видимому, следовало искать среди солеподобных контактов с двух- или трехосновными кислотами.
В заключение рассмотрения теоретических вопросов следует отметить, что поскольку м-толуиловая кислота по условиям ее синтеза содержит орто- и пара-изомеры, а также бензойную кислоту, для выявления реакционной способности всей гаммы продуктов были проведены оценочные опыты на фторированном γ-Al2
O3
. Полученные результаты сведены в таблицу 3.3.
Таблица 3.3 Относительные скорости амидирования производных бензойной кислоты диэтиламином (мольное отношение реагентов 1:5, t° = 300°С)
| Положение заместителя в субстрате |
H |
CH3
|
| Орто |
1 |
0,35 |
| Мета |
1 |
0,90 |
| Пара |
1 |
0,85 |
Таким образом, метильная группа в орто-положении стерически препятствует подходу диэтиламина к карбоксильной группе. В свою очередь группа СН3
в мета- и пара-положении в силу эффекта гиперконъюгации тоже тормозит процесс амидирования из-за нагнетания избыточной электронной плотности на атом углерода карбоксильной группы, понижая ее реакционную способность по отношению к диэтиламину. Этот факт вполне согласуется с предложенным выше механизмом и его аутентичностью для водно-кислотных растворов в части участия в процессе карбокатиона. Однако близость относительных скоростей реакций для м- и п-изомеров не исключает возможности генерации карбанионов, о чем говорилось выше.
3.4 Выбор и изучение эффективного катализатора амидирования м-толуиловой кислоты
На основании полученных и представленных выше данных по исследованию катализаторов амидирования МТК, изучению механизм реакции и обнаруженной существенной роли в катализе, в первую очередь, поверхностно закрепленных протонов был проведен поиск контактов, которые в первом приближении могли способствовать решению поставленной задачи.
Поиск такого катализатора осуществлялся целенаправленным путем пропитки нейтрального оксида алюминия неорганическими двух- и трехосновными кислотами с различными значениями pKa
= - lgK2
(для H3
BO3
– K1
, т.к. дальнейшая ионизация затруднена). Количество импрегнируемых кислот расчетно соответствовало одинаковой концентрации атомов водорода (ок. 0,1% на носитель).
Полученные таким образом катализаторы после стандартной обработки испытывали в реакции амидирования МТК при 320°С в течение 1 ч. Обнаружено, что активность контактов связана с силой кислоты (рис. 3.4), т.е. ее способностью диссоциировать; лучшие результаты были достигнуты при использовании о-мышьяковой и о-фосфорной кислот с рКа
соответственно 6,98 и 7,21. По-видимому, именно диапазон рКа
исходных кислот 6,5-7,5 является оптимальным для решения поставленной задачи. Дополнительные расчеты показывают, что активность катализаторов напрямую не связана с процентной долей атомов водорода в самих кислотах (так, например, [Н] в H3
PO4
- 3,1%, в H2
TeO3
- 1,1%, в H2
SeO3
- 1,6%, в H3
BO3
– 4,4%).
Проведенные контрольные опыты по влиянию элементов, входящих в состав кислотных остатков (в этом случае на Al2
O3
наносили преимущественно оксиды в количестве до 0,5 мас.% в расчете на соответствующий металл), позволили обнаружить их некоторое катализирующее (B, As, P, Te) или ингибирующее (Mo, Se) действие. Однако при переходе к димолибденовой и селенистой кислотам их каталитический эффект выражен значительно сильнее, чем у нейтрального оксида алюминия.
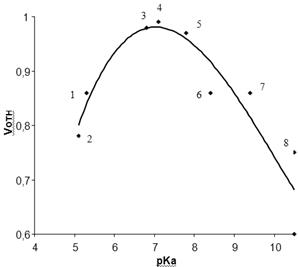
Рис. 3.4. Зависимость относительно скорости амидирования МКТ от величины рКа
кислот, нанесенных на нейтральный оксид алюминия (Vотн
для Al2
O3
ок. 0,45): 1 − H2
B4
O7
, 2 − H2
Mo2
O7
, 3 − H3
AsO4
, 4 − H3
PO4
, 5 − H2
TeO3
, 6 − H2
SeO3
, 7 − H3
BO3
, 8 − H2TeO4
.
На основании изложенных данных был проведен анализ ряда промышленных катализаторов, что позволило нам выбрать для испытаний системы, применяющиеся для разложения 4,4-диметил-1,3-диоксана в изопрен (производство СКИ). Наибольший интерес представляли марки катализаторов КФ-70, КФ-83 (содержит 0,3 мас.% MnO) и КБФ-76у (дополнительно содержит 0,02 мас.% о-борной кислоты) [66]. Как и следовало ожидать, несколько большую активность (на 3-4%) и особенно селективность (на 8%) проявил гидроксилапатит кальция (КФ-70) общей формулы:
Ca10-
х
-
у
Hx+y
(PO4
)6
(OH)2-x-y
(x+y ≤ 2).
Дальнейшие испытания катализатора были проведены по обычной схеме, а часть результатов представлена в таблице 3.4. Анализ этих данных свидетельствует о том, что оптимальной температурой синтеза м-ДЭТА является 300-320°С, объемной нагрузкой по сырью - 0,2 ч-1
. В этих условиях синтеза достигается 85-86%-ный выход целевого продукта. При соотношении МТК: диэтиламин 1:5 при прочих равных условиях выход ДЭТА имеет оптимум (табл. 3.4, 3.5), а конверсия и селективность процесса превышают 90% (92,4 и 94,5, 92,8 и 91,4 соответственно при 300 и 320°С).
Для дополнительной иллюстрации изложенного материала на рис. 3.5 и 3.6 представлены зависимости степени превращения МТК и селективности образования ДЭТА от условного времени контакта при различных температурах. Независимо от температуры, степень превращения МТК достигает максимума при τ 20 г∙мин/моль, однако селективность процесса по истечении этого периода начинает уменьшаться, что вызвано вторичным превращением целевого продукта, в первую очередь, увеличением скорости реакции переаминирования:
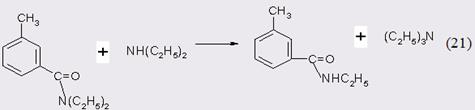
Таблица 3.4 Сводные эксперементальные результаты по синтезу м-ДЭТА (соотношение МТК-диэтилмин 1:5 мольн.)
| t, 0
С |
Объемная нагрузка по сырью,
ч-1
|
Состав катализата, масс.% |
Конверсия
МТК, %
|
Селективность
по
м-ДЭТА, %
|
Выход
м-ДЭТА
масс.%
|
| МТК |
диэтил-
амин
|
ДЭТА |
Вода |
Неиден-тифицир.
соедин.
|
| 260 |
0,2 |
12,2 |
61,4 |
23,4 |
3,0 |
- |
55,5 |
99,1 |
55,0 |
| 280 |
0,2
0,4
0,7
1,0
|
2,9
8,8
11,6
11,8
|
57,7
60,5
61,5
61,4
|
36,8
28,5
24,5
24,3
|
2,6
2,1
1,9
1,8
|
-
0,1
0,5
0,7
|
90,0
69,7
60,1
59,4
|
93,4
92,7
91,6
90,4
|
84,1
64,6
55,1
53,7
|
| 300 |
0,2
0,4
0,7
1,0
|
2,2
5,1
7,9
8,5
|
57,1
58,3
59,3
59,4
|
37,8
33,7
29,7
28,9
|
2,9
2,6
2,4
2,1
|
-
0,3
0,7
1,1
|
92,4
82,5
72,8
70,8
|
92,8
91,9
90,5
90,0
|
85,7
75,8
65,9
63,7
|
| 320 |
0,2
0,4
0,7
1,0
|
1,6
3,8
4,7
5,9
|
56,0
57,1
57,4
57,9
|
38,6
35,5
34,2
32,5
|
3,6
3,0
2,8
2,3
|
0,2
0,6
0,9
1,4
|
94,5
86,9
83,8
79,7
|
91,4
90,8
90,2
89,7
|
86,4
78,9
75,6
71,5
|
Таблица 3.5 Влияние отношения МТК:диэтиламин на процесс амидирования на гидроксилапатите кальция (F = 0,2 ч-1
)
Отношение
МТК:диэтиламин,мольн.
|
t, 0
С |
Конверсия МТК, % |
Селективность по м-ДЭТА, % |
Выход м-ДЭТА, масс.% |
| 1:3 |
280
300
320
|
73,6
80,3
85,0
|
91,5
90,8
90,0
|
67,3
72,9
76,5
|
| 1:7 |
280
300
320
|
86,7
88,2
92,6
|
88,2
86,9
86,5
|
76,4
76,6
80,1
|
Обращает на себя внимание факт, что при мольном отношении 1:7 начинает уменьшаться конверсия и селективность процесса. Изменение селективности реакции связано с тем, что возрастает условное время контакта МТК (см. рис. 3.5), следовательно, появляется большая возможность для протекания побочных процессов, и в этом случае в катализате обнаружены в том числе и продукты гидролиза (см. раздел 3.2). Причина снижения конверсии МТК становится понятной после изучения реальных областей протекания реакции.
В заключение следует отметить, что производительность выбранного контакта в процессе получения м-ДЭТА составляет 0,3 г целевого продукта с 1 г катализатора в час.
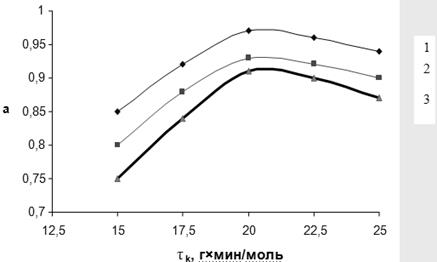
Рис. 3.5. Зависимость степени превращения МТК (α) от условного времени контакта (τ) при различных температурах:
1 – 320˚С, 2 – 300˚С, 3 – 280˚С
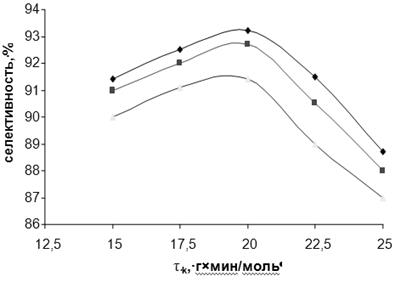
Рис. 3.6. Зависимость селективности (S) образования м-ДЭТА от условного времени контакта при различных температурах.
4. Производственная безопасность
Данная научно-исследовательская работа выполнялась в химической лаборатории при использовании веществ, имеющих класс опасности с 2-ого по 4-ый. Лаборатория относится к взрывоопасной категории "В" (соответствует ГОСТу 12.01.004-91 "Пожарная безопасность. Общие требования").
Вещества, применяемые в синтезах и анализах: м-диэтилтолуамид, N,N-диэтиламид, м-толуиловая кислота, н-бутиламин, соляная кислота, хлорная и ортофосфорная кислота.
Все работы с химическими реактивами проводились в вытяжном шкафу с использованием средств индивидуальной защиты (резиновые перчатки, защитные очки), согласно "Правилу по охране труда при использовании химических веществ ПОТ Р М-004-97".
4.1 Токсилогические характеристики используемого сырья и конечных продуктов на человека
м-Диэтилтолуамид – CH3
C6
H4
CON(C2
H5
)2
, М=191,28, т. плавл. <25°, т. разл. 288—292°, 111° (1 мм рт. ст.), плотн. 1,0095 (20°), nD
20
= 1,5206. Практически не растворяется в воде, ПДК=0,005 мг/м3
. Класс опасности – 4.
Применяется в качестве репеллента под названием ДЭТА.
ДЭТА - наркотик, наиболее токсично о-производное. При введении в желудок крысам м-Д. ЛД50
= 2 г/кг. Смертельные дозы вызывали кратковременное возбуждение, нарушение координации движений, дрожание, судороги, боковое положение.
Действие на кожу: Однократное нанесение на кожу 5 человек 83,3—84 мг/кг м-Д. при плотности слоя 16,6—17 мг/см2
не оказывало побочного действия. Первое нанесение вызвало незначительное покраснение, при последующих не было изменений на коже или общего состояния. При обследовании 85 лесозаготовителей, ежедневно применявших 40% спиртовый раствор репеллента, отмечена хорошая переносимость кожей этого препарата; лишь у 2 человек развился контактный дерматит и у одного угреподобные высыпания на лице.
Поступление в организм, распределение и выделение. Проникает через ге-мато-энцефалический и плацентарный барьеры. Распределяется во всех органах, особенно — в богатых липидами. Выделяется с мочой в течение длительного времени.
N,N-Диэтиламид - NH(C2
H5
)2
, M = 73,05, т. вспышки -25°, т. кип. 56°. Растворяется в воде, этаноле и диэтиловом эфире, плотн. 0,7056, т.плав. -50˚. ПДК =30 мг/м3
. Класс опасности 2.
Действие на кожу и глаза. При нанесении Д. на кожу белых мышей и кроликов вызывает воспаление. Капля Д., введенная в глаз, приводит к конъюнктивиту с помутнением роговицы.
Неотложная терапия. При попадании брызг в глаза — немедленно обильное промывание широко раскрытых глаз водой. Закапать 2% раствор новокаина или 0,5% раствор дикаина с адреналином (1 : 1000), затем ввести в глаза стерильное вазелиновое или оливковое масло. Надеть защитные очки. В дальнейшем до срочной консультации окулиста — закапывать в глаза 30% раствор альбуцида. При попадании на кожу — обмывание чистой водой, примочки из 2% раствора уксусной, лимонной или борной кислоты.
Индивидуальная защита. Меры предупреждения. Фильтрующий промышленный противогаз марки А. Защита рук (перчатки) и глаз (защитные очки), Герметизация аппаратуры. Вентиляция помещений.
м-Толуиловая кислота – C6
H5
(CH3
)COOH, М=137, бесцветная жидкость, т. кип. 249,2, плотн. 0,9846.
Порог ощущения запаха для паров и смеси аэрозоля и паров 1,49 мг/м3
. При вдыхание паров сильно нагретой м-толуиловой кислоты вызывает судорожный кашель, насморк, иногда тошноту и рвоту. м-Толуиловая кислота раздрожает кожу. При введении в желудок белым мышам ЛД50
= 1,63 г/кг. Изменение функционального состояния нервной системы у крыс, а также функции печени возникало от разовой дозы 0,244 г/кг в течение 2 месяцев.
н-Бутиламин – CH3
(CH2
)3
NH2
, М=73,14, бесцветная жидкость, d= 0,740120
4
, т. кип. 77,8°, n20
Д
= 1,4010
Порог восприятия запаха 0,0025 мг/л; порог раздражающего действия 0,1 мг/л. ПДК= 10 мг/м3
. Превращения в организме человека – в основном метаболизируется, выделение неизменного бутиламина незначительно..
Действие на кожу и глаза. В жидком виде раздражает кожу и конъюнктиву.
Соляная кислота – HCl, M = 36,461, бц. г. с резким запахом; при -85,1° - бц. подвижная ж.; при -115° - бц. кубич крист.; ниже -174,15° - бц. ромб. крист., 0,0016391 (0); 1,1870 (-85,1); 1,469 (-166), т. плав. -114,22°, т. кип. -85,1°. Растворяется в воде и пентан = 0,47 мол.%; гексан = 1,12 мол.%; гептан = 1,47 мол.%; октан = 1,63 мол.%; хлорбутан = 0,07 моль/моль; спирты = примерно 1 моль/моль; эфиры карбоновых кислот = примерно 0,6 моль/моль; карбоновые кислоты = примерно 0,2 моль/моль; расплав хлорида калия (800°С) = 0,000251 моль/моль; расплав хлорида натрия (900°С) = 0,000190 моль/моль. Во влажном воздухе дымит. С водой дает азеотропную смесь (20,222% HCl, т. кип. 108,584°С, плотность = 1,0959 г/мл). Водный раствор - соляная кислота - значительно более едкое вещество, сильная кислота. Длина связи H-Cl 0,1274 нм, энергия диссоциации = 427,77 кДж/моль.
При высоких концентрациях — раздражение слизистых, в особенности носа; конъюнктивит; помутнение роговицы. Охриплость, чувство удушья, "покалывание в груди, насморк, кашель, иногда кровь в мокроте. Концентрации 0,05—0,075 мг/л переносятся с трудом, хотя "привычные" люди выносят в течение нескольких минут даже концентрации 1—2 мг/л. Хроническое отравление вызывает катары дыхательных путей; разрушение зубов; изъязвления слизистой носа и даже прободение носовой перегородки; желудочно-кишечные расстройства; возможны воспалительные заболевания кожи. Описан случай тяжелого отравления: сильное исхудание, слабость; горячая, сухая, землистая кожа; кашель, учащенное дыхание, мелкопузырчатые хрипы; мокрота отхаркивается а большим трудом; сердечная деятельность нормальная, но по нескольку раз в день сильные сердцебиения. Пульс — 70—80. Острые боли в области желудка, рвота желтоватой слизью. По весьма совпадающим данным разных авторов, предельная безвредная при постоянной работе концентрация — 0,015 мг/д.* Наблюдается якобы привыкание к X. В., причина которого пока неясна. "
Действие на кожу. Ожоги в большинстве случаев не столь тяжелы, как при действии H2
SO4
и HNO3
. Обычно возникает чисто серозное воспаление с пузырями. Изъязвления развиваются лишь при более длительном воздействии (если, например, после попадания на кожу кислота сразу не отмыта).
Хлорная кислота – HClO4
, М = 100,46, бесцветная жидкость, плотн. 1,768 (22) г/см3
, т. плав. -112°С, т. кип. 16°С (18 ммHg), растворяется в воде, этаноле, уксусной кислоте, при нагревании взрывается из-за разложения на перхлорат гидроксония и семиокись хлора.
Неотложная терапия. Немедленно вынести пострадавшего на свежий воздух, освободить от стесняющей дыхание одежды. Ингаляция кислорода. Промывание глаз, носа, полоскание 2% раствором соды. При затруднении дыхания через нос — 2—3% раствор эфедрина 3—4 раза в день по 4—5 капель, подкожно атропин (1 мл 0,1% раствора). Тепло на область шеи. При кашле—кодеин, дионин, тепловлажные ингаляции 2—3% раствора соды (2—3 раза в день по 10 мин). В дальнейшем — отхаркивающие средства, горчичники на область трахеи, теплое молоко с боржомом или содой, маслом или медом. В более тяжелых случаях для профилактики и лечения пневмонии — ингаляции аэрозолей антибиотиков, курс лечения антибиотиками и сульфаниламидами.
При поражении глаз после промывания, впустить в глаза по 1 капле 2% раствора новокаина или персикового масла в конъюнктивальный мешок. Очки-консервы. В дальнейшем — 30% раствор альбуцида, гидрокортизоновая мазь. При попадании кислоты в глаза промывать их водой, а не нейтрализующими (щелочными) растворами.
При попадании крепкой кислоты на кожу — немедленное обмывание ее водой, лучше под давлением (например, из' гидранта) в течение 5—10 мин. В здравпункте наложить на обожженную поверхность кашицу из соды.
Ортофосфорная кислота - Н3
РО4
, М = 98,00, бесцветные расплывающиеся кристаллы. Т. плавл, 42,35°; плотн. 1,834 (18°). Раств. в воде 548 г/100 г (20°), с горячей водой вмешивается во всех отношениях.
Пары вызывают атрофические процессы в слизистой носа, приводящие в отдельных случаях к раздражению крыльев носа и прободению носовой перегородки. Характерны носовые кровотечения, сухость в носу и глотке, образование в носу сухих корочек, крошение зубов. При длительном отравлении концентрацией 10,6 мг/м3
увеличение содержания белка в сыворотке и снижение — гликогена в печени. Через месяц восстановительного периода лишь частичная нормализация сдвигов. Ингаляция 2,3 мг/м3
патологических изменений и сдвигов не вызывает.
Действие на кожу. Оказывает значительное прижигающее действие, вызывает воспалительные заболевания кожи. Приводит к общетоксическим явлениям.
Предельно допустимая концентрация 1.
Индивидуальная защита. Защита органов дыхания и. кожи.
4.2 Санитарно-гигиенические условия в лаборатории
1. Шум и вибрация
Постоянного шума и вибрации в лаборатории нет. Он возникает только при включении тяги. Эквивалентный уровень шума не превышает 80 дБА (ГОСТ 12.1.029-80 "Шум. Средства и методы защиты от шума").
2. Освещённость
Предусмотрено естественное и искусственное освещение. Естественное – через оконные проемы, искусственное – в виде ламп.
По проведенным исследованиям естественное освещенности:
Результат измерения – 42лк. КЕО – 3,8%. Значение показателя по НД – не менее 1%. НД на методы испытания – ГОСТ 24940-96, СНиП – 23-05-95.
По проведенным исследованиям искусственного освещения:
Результат общего освещения – 124 лк. Значение показателя по НД – не более 300 лк.
3. Яркость: блики от освещения - ‹ 15 (значение показателя по НД – не более 40); показатель дискомфорта - ‹ 25 (НД – не более 40).
Дополнительная информация: система естественного освещения – боковое одностороннее. Измерения искусственной освещенности производились – при закрытых шторах. Уровень освещенности соответствует норме.
4. Характеристики микроклимата:
Температура воздуха: в начале смены – 20,3
в середине смены – 20,0
в конце смены – 19,8
Относительная влажность: в начале смены – 31,0
в середине смены – 31,0
в конце смены – 31,0
Скорость движения воздуха: в начале смены – 0,21
в середине смены – 0,23
в конце смены – 0,21
Значения по показателям НТД: температура воздуха – 16-22°С. Относительная влажность – 15-75 %. Скорость движения воздуха – не более 0,4.
5.Электробезопасность:
В лаборатории имеется много электроприборов, которые работают от общей сети с напряжением 220 В: сушильные шкафы, аналитические весы, плитки, мешалки, регистрирующие устройства. Всё, кроме электроплиток и аналитических весов, заземлено согласно ПУЭ и ГОСТам 12.1.030-81 и 12.1.038-82 "Электробезопасность" и "Электробезопасность. Защитное зануление. Защитное заземление", "Предельно допустимые значения напряжений". При работе с такими приборами существует опасность поражения электрическим током. К мероприятиям, предупреждающим поражение электрическим током, относятся:
- Применение безопасного напряжения (менее 42В).
- Ограждение токоведущих частей оборудования и расположение пускателей, щитов, рубильников в местах недоступных для случайного включения.
- Заземление, зануление, отключение.
- Применение средств индивидуальноц защиты.
- Применение оборудования в соответствии с условиями окружающей среды.
- Использование для работы на электроустановках специально подготовленного персонала.
6. Пожаровзрывоопасность
Так как в лаборатории одновременно находятся и используются нагревательные приборы и легковоспламеняющиеся и взрывоопасные вещества, то существует опасность возгорания и взрывов. Органические жидкости являются горючими и, загораясь, растекаются, распространяя огонь. Органические вещества тушат согласно ГОСТу 15968-70, а также согласно "Указанию по тушению пожаров химических веществ". Лаборатория соответствует НПБ 201-96 и НПБ 107-97 "Пожарная охрана предприятий. Общие требования" и "Определение категорий установок по пожарной безопасности".
4.3 Экологическая безопасность
Лаборатория оборудована вытяжным шкафом с местной искусственной вентиляцией, включение которой осуществляется отдельным рубильником. Для улучшения состояния воздуха в помещении предусмотрена вытяжная и приточная вентиляция. Вытяжной шкаф имеет объём 3×3м, часовая кратность воздухообмена 324. Данное значение попадает в интервал 250-350 по ГОСТу 12.1.005-83 и соответствует классу опасности 2, по данному ГОСТу [92]. В лабораторном вытяжном шкафу можно работать со всеми указанными выше веществами. Помещение лаборатории обеспечено приточно-вытяжной вентиляцией, дополняемой естественной вентиляцией через окно. Для уничтожения химических отходов разработано несколько вариантов в зависимости от химических и физических свойств вещества.
Операции по уничтожению отходов выполняются путём сжигания горючих материалов в специальном химическом вытяжном шкафу в соответствующей химической посуде. Разложение реактивов может протекать довольно бурно, поэтому необходимо применять такие средства защиты, как очки, респиратор, перчатки. Первоначально процедура уничтожения выполняется на небольшом количестве, не превышающем 5-10 г. Водную часть струёй выливают в канализацию, смывая большим количеством воды. Реакции гидролиза и нейтрализации могут сопровождаться большим выделением тепла и едких газов, что необходимо контролировать скоростью давления. Отработанные химические реагенты отвозятся на "Красный бор", где их уничтожают.
4.4 Безопасность в случае чрезвычайной ситуации
Так как при выполнении дипломной работы использовались электрические приборы, вредные и пожароопасные вещества, то в ходе синтезов могут возникнуть следующие чрезвычайные ситуации.
1. Химические ожоги
При попадании на кожу концентрированного раствора щёлочи кожу промывают струёй воды и слабым раствором уксусной кислоты.
2. Возгорание
При возгорании электроприборов и органических веществ необходимо немедленно выключить все электронагревательные приборы, вентиляцию, обесточить комнату общим рубильником, вынести из помещения все сосуды с пожароопасными веществами, соблюдая правила личной безопасности, для тушения легковоспламеняющихся и горючих жидкостей использовать пенные или углекислотные огнетушители, песок, асбестовое полотно.
3. Ожоги и отравление органическими веществами
При попадании органических веществ на кожу немедленно обработать её 5 – 10 %-м раствором нашатырного спирта или 2 – 5%-м раствором хлорамина. При попадании органических соединений в глаза необходимо обильно промыть их водой. При попадании органических соединений в организм через рот нужно немедленно дать выпить потерпевшему несколько стаканов воды, а затем вызвать рвоту. После этого дать выпить полстакана 2 %-го раствора питьевой соды, в котором размешаны 2 – 3 столовые ложки активированного угля, промывание желудка.
Первая помощь при отравление через дыхательные пути. Пострадавшего необходимо вывести (вынести) на свежий воздух, создать ему абсолютный покой, уложить на спину, расстегнуть стесняющую одежду, укрыть одеялом, одеждой и т.п. (но не сдавливать), особенно тепло укутать шею и вызвать врача. После удаления из зоны загазованности, независимо от самочувствия пострадавшего, не разрешать ему подниматься до прихода врача. Транспортировать пострадавшего в лежачем положении.
Другие техногенные чрезвычайные ситуации (обвал потолков, прорыв водопроводных и канализационных труб) решаются в присутствии инженерно-технического персонала кафедры.
4. Поражение электрическим током
Необходимо как можно скорее освободить пострадавшего от воздействия тока, так как от продолжительности этого действия зависит тяжесть электротравмы.
Первым действием оказывающего помощь должно быть немедленное отключение той части электроустановки, которой касается пострадавший. Отключение производится с помощью выключателей, рубильника или другого отключающего аппарата, а также путем снятия или вывертывания предохранителей (пробок), разъема штепсельного соединения. Если отключить установку достаточно быстро нельзя, необходимо принять меры к освобождению пострадавшего от действия тока. Во всех случаях оказывающий помощь не должен прикасаться к пострадавшему без надлежащих мер предосторожности, так как это опасно для жизни. Он должен следить за тем, чтобы самому не оказаться в контакте с токоведущей частью и под напряжением. Для отделения пострадавшего от токоведущих частей или провода напряжением до 1000 в следует воспользоваться канатом, палкой, доской или каким-либо другим сухим предметом, не проводящим электрический ток. Можно также оттянуть его за одежду, если она сухая и отстает от тела (например, за полы пиджака или пальто, воротник), избегая при этом прикосновения к окружающим металлическим предметам и частям тела пострадавшего, неприкрытым одеждой. При отделении пострадавшего от токоведущих частей рекомендуется действовать одной рукой, держа вторую в кармане или за спиной.
Если у пострадавшего отсутствуют сознание, дыхание, пульс, кожный покров синюшный, а зрачки широкие (0,5 см в диаметре), можно считать, что он находится в состоянии клинической смерти, и немедленно следует приступать к оживлению организма с помощью искусственного дыхания по способу "изо рта в рот" или "изо рта нос" и наружного массажа сердца.
Искусственное дыхание проводится в тех случаях, когда пострадавший не дышит или дышит очень плохо (редко, судорожно, как бы со всхлипыванием), а также, если его дыхание постоянно ухудшается, независимо от того, чем это вызвано: поражением электрическим током, отравлением и т.д.
Прекращают искусственное дыхание после восстановления у пострадавшего достаточно глубокого и ритмичного самостоятельного дыхания. В случае отсутствия не только дыхания, но и пульса на сонной артерии, делают подряд два искусственных вдоха и приступают к наружному массажу сердца.
Если надавливать на грудину, то сердце будет сжиматься между грудиной и позвоночником, и из его полостей кровь будет выжиматься в сосуды. Если надавливать на грудину толчкообразными движениями, то кровь будет выталкиваться из полостей сердца почти так же, как это происходит при его естественном сокращении. Это называется наружным (непрямым, закрытым) массажем сердца, при котором искусственно восстанавливается кровообращение. После того, как восстановится сердечная деятельность, и будет хорошо определяться пульс, массаж сердца немедленно прекращают, продолжая искусственное дыхание при слабом дыхании пострадавшего и стараясь, чтобы естественный и искусственный вдохи совпали. При восстановлении самостоятельного дыхания искусственное дыхание также прекращают. Если сердечная деятельность или самостоятельное дыхание еще не восстановились, но реанимационные мероприятия эффективны, то их можно прекратить только при передаче пострадавшего в руки медицинского работника.
4.5
Защита объектов народного хозяйства в условиях чрезвычайных ситуаций мирного и военного времени
Обеспечение устойчивости работы ВНИИНефтехим объектов народного хозяйства в условиях чрезвычайных ситуаций мирного и военного времени является одной из основных задач ГО.
Под устойчивостью функционирования объекта народного хозяйства понимают способность его в чрезвычайных ситуациях выпускать продукцию в запланированном объёме и номенклатуре (для объектов, непосредственно не производящих материальные ценности, - выполнять свои функции в соответствии с предназначением), а в случае аварии (повреждения) восстанавливать производство в минимально короткие сроки. На устойчивость функционирования Объекта народного хозяйства в чрезвычайных ситуациях влияют следующие факторы: надёжность защиты рабочих и служащих от последствий стихийных бедствий, аварий (катастроф), а также воздействия первичных и вторичных поражающих факторов оружия массового поражения и других современных средств нападения; способность инженерно-технического комплекса объекта противостоять в определённой степени этим воздействиям; надёжность системы снабжения объекта всем необходимым для производства продукции (сырьём, топливом, электроэнергией, газом, водой и т. п.); устойчивость и непрерывность управления производством и ГО; подготовка объекта к ведению спасательных и аварийно-восстановительных работ и работ по восстановлению нарушенного производства.
Перечисленные факторы определяют основные требования к устойчивому функционированию объекта народного хозяйства в условиях чрезвычайных ситуаций и пути его повышения.
Эти требования заложены в нормах проектирования инженерно-технических мероприятий (ИТМ) ГО, а также в разработанных на их основе ведомственных нормативных документах, дополняющих и развивающих требования действующих норм применительно к отрасли.
Гражданская оборона организуется по территориально-производственному принципу. Территориальный принцип заключается в организации ГО на территории автономных республик, краев, областей, городов, районов, поселковых и сельских Советов согласно административному делению территории нашей страны.
Производственный принцип заключается в организации ГО в каждом министерстве, ведомстве, учреждении, на объекте. Начальниками ГО предприятий, организаций, учреждений, учебных заведений являются их руководители.
Полную ответственность за организацию и состояние ГО, за постоянную готовность ее сил и средств к проведению спасательных и неотложных аварийно-восстановительных работ несет начальник ГО объекта — руководитель предприятия.
При начальнике ГО объекта создается штаб ГО — орган управления начальника гражданской обороны. Состав штаба зависит от значимости объекта. Он комплектуется как штатными работниками ГО, так и за счет должностных лиц, неосвобожденных от основных обязанностей, и состоит из начальника штаба, его заместителей (помощников) по оперативно-разведывательной части, боевой подготовке, а также других специалистов по усмотрению начальника ГО.
Работа штаба организуется на основании приказов, распоряжений и указаний начальника ГО объекта, вышестоящего штаба. Начальник штаба является первым заместителем начальника ГО объекта. Ему предоставляется право от имени начальника ГО отдавать приказы и распоряжения по вопросам гражданской обороны на объекте.
Штаб ГО осуществляет мероприятия по защите рабочих, служащих и населения подведомственных рабочих поселков от оружия массового поражения и обеспечивает своевременное оповещение их об угрозе нападения; организует и обеспечивает непрерывное управление ГО; разрабатывает план ГО объекта, периодически корректирует и организует его выполнение; организует и контролирует обучение рабочих и служащих по гражданской обороне и подготовку невоенизированных формирований объекта. На объекте в зависимости от характера его производственной деятельности создаются службы ГО: оповещения и связи, медицинская, противорадиационной и противохимической защиты, охраны общественного порядка, противопожарная, энергоснабжения и светомаскировки, аварийно-техническая, убежищ и укрытий, транспортная, материально-технического снабжения и др. На них возлагается выполнение специальных мероприятий и обеспечение действий формирований при проведении спасательных и неотложных аварийно-восстановительных работ.
Служба оповещения и связи обычно создается на базе узла связи объекта. На службу возлагается организация своевременного оповещения руководящего состава, рабочих, служащих и населения рабочих поселков объекта об угрозе нападения противника; организация связи и поддержание её в состоянии постоянной готовности. Кроме того, служба устраняет аварии на сетях и сооружениях связи, находящихся в очагах поражения.
Медицинская служба организуется на базе медсанчасти (здравпункта, поликлиники) объекта. Начальник службы — главный врач. Служба обеспечивает комплектование, обучение и поддержание в готовности медицинских формирований; накопление запасов медицинского имущества и медицинских средств индивидуальной защиты; медицинскую разведку и санитарно-эпидемиологическое наблюдение; оказывает медицинскую помощь пораженным людям и эвакуирует их в лечебные учреждения, осуществляет медицинское обеспечение рабочих, служащих и членов их семей в местах рассредоточения и эвакуации.
Служба противорадиационной и противохимической защиты разрабатывает и осуществляет мероприятия по защите людей, пищеблоков, складов продовольствия от воздействия радиоактивных и отправляющих веществ; организует и подготавливает противорадиационные и противохимические формирования и учреждения; осуществляет контроль за состоянием средств индивидуальной защиты и специальной техники. В условиях ядерного и химического нападения противника ведет радиационную и химическую разведку, осуществляет контроль за облучением и заражением личного состава, проводит мероприятия по ликвидации радиоактивного и химического заражения.
Противопожарная служба организуется на базе подразделений ведомственной пожарной охраны. Служба разрабатывает противопожарные профилактические мероприятия и осуществляет контроль за их проведением; обеспечивает постоянную готовность сил и средств службы, локализует и тушит пожары; оказывает помощь службе противорадиационной и противохимической защиты в дезактивации и дегазации участков заражения.
Служба энергоснабжения и светомаскировки создается на базе отдела главного энергетика. Начальник службы — главный энергетик объекта. Служба разрабатывает мероприятия, обеспечивающие бесперебойную подачу газа, топлива или электроэнергии на объект. Проводит оснащение уязвимых участков энергетических сетей различного рода системами и средствами защиты. Планирует проведение мероприятий по светомаскировке и подготовительные мероприятия первоочередных восстановительных работ. Проводит неотложные аварийно-восстановительные работы на энергосетях.
Аварийно-техническая служба организуется на базе производственного, технического отделов или отдела главного механика. Она разрабатывает и проводит мероприятия по защите уникального оборудования, повышению устойчивости основных сооружений, специальных инженерных сетей и коммуникаций; проводит неотложные работы по разборке завалов, локализации и ликвидации аварий на коммуникациях и сооружениях объекта.
Служба убежищ и укрытий организуется на базе отдела капитального строительства, жилищно-коммунального отдела, строительных цехов. Она занимается: разработкой расчетов укрытия рабочих, служащих, населения рабочих поселков объекта; обеспечением готовности убежищ и укрытий и контролем за правильностью их эксплуатации; организацией строительства защитных сооружений. На ее личный состав возлагается обеспечение своевременного заполнения убежищ и укрытий по сигналам оповещения гражданской обороны. Кроме того, эта служба участвует в спасательных работах при вскрытии заваленных убежищ и укрытий.
Транспортная служба создается на базе транспортного отдела, транспортного цеха (гаража). Она разрабатывает и осуществляет мероприятия по обеспечению перевозок, связанных с рассредоточением рабочих, служащих и доставкой их к месту работы; организует подвоз сил и средств к очагу поражения; подготавливает транспорт для перевозок рабочих, служащих, эвакуации пораженных, а также для других целей гражданской обороны; проводит работы по обеззараживанию транспорта.
Служба материально-технического снабжения организуется на базе отдела материально-технического снабжения объекта. Она разрабатывает план материально-технического снабжения; своевременно снабжает формирования всеми видами оснащения и продовольствия; организует ремонт техники и различного имущества, подвоз его к участкам работ, хранение и учет; обеспечивает продовольствием и предметами первой необходимости рабочих и служащих как на самом предприятии, так и в местах рассредоточения.
Структура и функции службы ГО на предприятии
Основными задачами комиссии комбината по чрезвычайным ситуациям являются:
— руководство разработкой и осуществлением мероприятий по предупреждению ЧС, повышению надежности работы объекта, обеспечению устойчивости его функционирования при возникновении ЧС;
— организация работ по созданию локальной системы оповещения, поддержание ее в постоянной готовности;
— обеспечение готовности органов управления, сил и средств к действиям при чрезвычайных ситуациях, руководство их ликвидацией и эвакуацией персонала;
— руководство созданием и использованием резервов финансовых и материальных ресурсов для ликвидации чрезвычайных ситуаций;
— организация подготовки руководящего состава, сил и средств, а также всего остального персонала комбината к действиям при ЧС.
КЧС создается на объекте решением руководителя — начальника гражданской обороны (ГО) комбината. Положение о комиссии и ее состав объявляются приказом. Численность комиссии и ее персональный состав определяет руководитель объекта. При этом учитывается, что состав комиссии должен обеспечить качественное проведение в полном объеме мероприятий по предупреждению, а также ликвидации ЧС, устойчивое управление силами при проведении аварийно-спасательных и других неотложных работ (АС и ДНР).
Работа комиссии по чрезвычайным ситуациям объекта
а) Режимы деятельности КЧС
Деятельность КЧС по предупреждению и ликвидации ЧС на комбинатах в зависимости от обстановки осуществляется в трех режимах функционирования системы предупреждения и ликвидации ЧС.
Режим повседневной деятельности — функционирование системы в мирное время при нормальной производственно-промышленной, радиационной, химической, биологической (бактериологической), сейсмической и гидрометеорологической обстановке, при отсутствии эпидемий, эпизоотии и эпифитотий — это планомерное осуществление мер по предупреждению ЧС и повышению готовности органов управления, сил и средств к ликвидации возможных аварий, катастроф, стихийных и экологических бедствий.
Режим чрезвычайной ситуации — функционирование системы при возникновении и во время ликвидации ЧС. Основная деятельность КЧС в этом режиме — непосредственное руководство ликвидацией ЧС и защита персонала от возникающих (ожидаемых) опасностей.
б) Планирование мероприятий по предупреждению и ликвидации ЧС.
Планирование мероприятий по предупреждению и ликвидации ЧС организует председатель КЧС комбината. При планировании предусматривается решение основных вопросов организации действий по предупреждению и ликвидации ЧС на комбинате, главными из которых являются:
— выполнение всего комплекса мероприятий по защите персонала, зданий, сооружений и территории комбината от ЧС природного и техногенного характера;
— обеспечение защиты персонала при различных видах ЧС;
— выделение необходимых сил и средств для проведения мероприятий по предупреждению и ликвидации ЧС.
На основе прогнозирования и анализа обстановки, которая может сложиться на территории объекта при возникновении ЧС, определяются способы защиты и комплекс мероприятий, которые необходимо спланировать для надежной защиты персонала и территории объекта.
При этом в обязательном порядке учитываются:
— наличие потенциально опасных участков непосредственно на объекте, возможные сценарии развития аварийных ситуаций в процессе их эксплуатации;
— потенциально опасные объекты на территории района (региона), аварии на которых могут оказать влияние на объект;
— возможные стихийные бедствия в районе расположения объекта;
— силы и средства объекта, возможные варианты усиления для проведения мероприятий по защите персонала и ликвидации ЧС;
— ориентировочный объем, порядок и сроки выполнения мероприятий по предупреждению или снижению ущерба от ЧС, защите персонала и проведению АС и ДНР;
— другие исходные данные для планирования; определяемые местными условиями и спецификой деятельности объекта.
в) Организация подготовки к действиям при ЧС
г) Организация работы по созданию и совершенствованию материально-технической базы
д) Осуществление мероприятий по защите персонала объекта при угрозе и возникновении ЧС
С получением информации об угрозе возникновения чрезвычайной ситуации КЧС объекта начинает функционировать в режиме повышенной готовности и принимает на себя непосредственное руководство всей деятельностью объектового звена РСЧС. Дежурная служба докладывает обстановку председателю КЧС и оповещает членов комиссии. Председатель КЧС принимает меры по проверке достоверности полученных данных и дополнительных сведений об обстановке. При необходимости срочно высылает оперативную группу непосредственно на место, где создалась угроза ЧС.
5. Экономическая часть
Смета затрат на проведение исследовательской работы "Получение N,N–м-диэтилтолуамида в присутствии гидроксилапатита кальция". Поиск устойчивого, стабильно работающего катализатора, который обеспечил высокий выход продукта с хорошей чистотой и селективность процесса.
5.1 Расчёт стоимости материалов
| Используемые материалы |
Розничная единица |
Затраченное количество |
Розничная цена, руб. |
Общая стоимость, руб. |
| м-толуиловая кислота |
литр |
2 |
830 |
1660 |
| N,N-Диэтиламид |
кг |
5,5 |
380 |
2090 |
| Соляная кислота |
литр |
0.1 |
9,1 |
0,91 |
| Ортофосфорная кислота |
литр |
0.1 |
29,7 |
2,97 |
| н-бутиламин |
литр |
0.3 |
360 |
108 |
| Хлорная кислота |
литр |
0.1 |
575 |
57,5 |
| Йодновая кислота |
литр |
0.1 |
3500 |
350 |
| Итого |
4269,38 |
5.2 Расчёт заработной платы
| Должность |
Количество часов |
Часовая тарифная ставка, руб. |
Общая сумма, руб. |
| Научный сотрудник-руководитель работ |
480 |
28,1 |
13500 |
| Инженер |
480 |
20 |
9600 |
| Старший лаборант |
480 |
15,6 |
7500 |
| Лаборант |
480 |
12,5 |
6000 |
| Итого |
36600 |
5.3 Сводная смета затрат
| Затраты |
Стоимость, руб. |
| Материалы |
4269,38 |
| Заработная плата |
36600 |
| Отчисления на социальные нужды (26,5%) |
9699 |
| Накладные расходы (140%) |
51240 |
| Итого |
101808,38 |
Вывод: Исследовательская работа проведена в течение 3-х месяцев. Затраты на ее выполнение составили 101808,38 рублей. На 10 мл. выхода готового продукта пришлось 40 рублей реактивов.
Выводы
1. Проведена оценка термодинамических параметров и изучена каталитическая активность некоторых традиционных и модифицированных гетерогенных катализаторов при амидировании м-толуиловой кислоты диэтиламином. Показано, что лучший результат достигается на контакте 1 мас.% Sn на SiO2
, при этом выход N, N-диэтил-м-толуамида не превышает 71%.
2. При изучении зависимости скорости амидирования м-толуиловой кислоты в присутствии неорганических кислот установлен оптимум значений их рКа
(6,5-7,5).
3. Полученные экспериментальные данные по влиянию кислотности катализаторов и их стабильности в процессе амидирования позволили предложить новые для таких реакций катализатор — гидроксилапатита кальция, конверсия сырья и селективность реакции на котором достигают соответственно 94,5 и 91,4%.
катализатор диэтиламин амидирование толуиловый
Литература
1.Мандельбаум Я.А., Сафьянова В.М., Ломакина В.И. Средства, отпугивающие насекомых//Ж. ВХО им. Д.И. Менделеева. 1960. Т. 5, №3. С. 307-312.
2.Мандельбаум Я.А., Сафьянова В.М., Ломакина В.И. Средства, отпугивающие насекомых//Ж. ВХО им. Д.И. Менделеева. 1960. Т. 5, №3. С. 307-312.
3.Maxim N.N. Structure of Benzene Derivatives//Bull.Soc.Chim.Romania.- 1929. Vol.11. P. 29-36.
4.Geigy R., Utzinger G.E. Konstitution und insektenabhaltende Wirkung neuer Amide und die verwendaten Testmethoden//Acta Tropica, 1953. Bd. 10, Nr. 4. S. 349-360.
5.Insect Repellents. III. N, N-Diethylamides/ E.T. McCabe, W.F. Barthel, S.I. Gertler, S.A. Hall// J.Org.Chem. 1954. Vol. 19, No. 4. Р. 493-498.
6.Иглицына Л. С., Феддер М.Л., Синтез диэтилтолуамида - нового репеллента// Мед. пром. СССР. 1959. №8. С. 20-22.
7.Лейтман Я.И., Певзнер М.С. Разработка методов получения репеллента - диэтилтолуамида//Ж. прикл. химии. 1963. Т. 36, №3. С. 632-639.
8.Gaylord N.G., Mehta R. Peroxide-Catalyzed Grafting of Maleic Anhydride onto Molten Polyethylene in the Presence of Polar Organic Compounds //J.Polym.Sci. (A). 1988. Vol. 26, No. 4. P. 1189-1198.
9.Jiang C.Y., Mark J.E. The Effects of Various Catalysts in the in-situ Precipitation of Reinforcing Silica in Poly (dimethylsiloxane) Networks//Makromol. Chem. 1984. Vol. 185, No. 12. Р. 2609-2617.
10.Eur. Pat. Appl. EP 44955, Cl. A 01 N 25/02. Liquid Herbicide Mixtures/ D. Kleuser, J.B. Pawliczek, H.Q. Oeser// 1982; Chem. Ab. 1982. Vol. 96. P. 277. 157436b.
11.Гладких С.Г. Средства, отпугивающие кровососущих насекомых и клещей. М.: Медицина, 1964. 115 с.
12.Pat. 59-164706 Japan, Cl. А 01 N 47/18. Insect Repellent Carbamates/Mitsubishi Chem. Ind. Co., Ltd.// 1984; Chem. Ab. 1985. Vol. 102. Р. 195. 74222v.
13.Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. М.: Химия, 1974. Т. I. С. 168.
14.Бюлер К., Пирсон Д. Органические синтезы. М.: Мир, 1973. Т. 2. С. 384.
15.Ингольд К. Теоретические основы органической химии. М.: Мир, 1973. С. 963.
16.Гауптман 3., Грефе Ю., Ремане X. Органическая химия. М.: Химия, 1979. С. 353.
17.Моури Д., Бэтлер Д. Синтезы органических препаратов. М.: ИЛ, 1953. Сб. 4. С. 364.
18.Gordon M., Miller J.G., Day A.R. Effect of Structure on Reactivity. II. Influence of Solvents on Ammonolysis of Esters// J. Amer. Chem. Soc. 1949. Vol. 71, No. 4. P. 1245-1250.
19.Dermer O.C., King J. N-Benzylamides as Derivatives for Identifying the Acyl Group in Esters//J. Org. Chem. 1943. Vol. 8, No. 2.P. 168-173.
20.Blair J., Brown J.J., Newbold G.T. Lactones. Part I. A Novel Method for the Conversion of Phtalides into Phtalaldehydic Acids//J. Chem. Soc. 1955. March. P. 708-712.
21.Нойес В., Портер П. Синтезы органических препаратов. М.: ИЛ, 1949. Сб. 1. С. 448.
22.Fujisawa T., Sugasawa S. Extension of Rischler-Napieralski Reaction. IV. Synthesis of some Pyridine Derivatives//Tetrahedron. 1959. Vol. 7, No. ¾. P. 185-188.
23.Weaver W.B., Whalay W.M. Organic Fungicides. I. The Preparation of Some α-Bromoacetamides//J. Amer. Chem. Soc. 1947. Vol. 69, No. 3. P. 515-516.
24.Schlesinger A.H., Prill E.J. N-Substituted Amides//J. Amer. Chem. Soc. – 1956. Vol. 78, No. 23. P. 6123-6127.
25.Newbold G.T., Spring F.S., Sweeny W. Pyrazine Derivatives. Part V. A General Method for the Synthesis of Aminopyrazine Derivatives//J. Chem. Soc. 1948. Nov. P. 1855-1859.
26.Kyrides L.P., Meyer F.C., Zienty F.B. Thiophene-Containing Antihistaminic Agents//J. Amer. Chem. Soc. 1947. Vol. 69, No. 9. P. 2239-2240.
27.Steiger R.F. Benzoylation of Amino Acids//J. Org. Chem. 1944. Vol. 9, No. 5. P. 396-400.
28.Satchell D.P.N. An Outline of Acylation//Quart. Rev. 1963. Vol. 17, No. 2. P. 160-203.
29Общая органическая химия/Под ред. Д.Бартона, Д.0ллиса//М.: Химия, 1983. Т. 4. С. 388-536.
30.Roberts W., Whiting M.C. Anhydrous Hydrolysis in Dimethyl Sulphoxide//J. Chem. Soc. 1965. Febr. P. 1290-1293.
31.Робертс Д., Касерио М. Основы органической химии. М.: Мир, 1978. Т. 1. С. 572.
32.Ritter J.J., Minieri P.P. A New Reaction of Nitriles. I. Amides from Alkenes and Mononitriles//J. Amer. Chem. Soc. 1948. Vol. 70, No. 12. P. 4045-4048.
33.Wiberg K.B. The Mechanisms of Hydrogen Peroxide Reactios. I. The Conversion of Benzonitrile to Benzamide//J. Amer. Chem. Soc. 1953. Vol. 75, No. 16. P. 3961-3964.
34.Заявка 53-31629 Япония, 1978, МКИ3
с 07 с 25/14. Способ совместного получения амидов ароматической кислоты и бензилхлоридов/С. Такеути, М. Киёмидзу, С. Мацуи//РЖХим. 1979. 7Н229.
35.Каталитические свойства веществ. Справочник /Под общей ред. В.А.Ройтера. – Киев: Наукова думка, 1968. 1462 с.
36.Pat. 3825596 US, 1974, МКИ3
с 07 с 103/22. Process for Preparation of N, N-Dialkyl Toluamide/N. Taketosi, I. Masatome//РЖХим. 1975. 130422П.
37.Pat. 4133833 US, 1979, МКИ3
с 07 с 103/76. Production of N,N-di(ethyl)-meta-toluamide from meta-toluic acid by liquid phase catalytic reaction with diethylamine/E.H.Hull//РЖХим. 1979. 18 0 393.
38.Заявка 54-5931 Япония, 1979, МКИ3
с 07 с 103/76. Получение N,N-диалкилтолуамидов/Й.Хасэгава, Н.Сирата//РЖХим. 1979. 20Н141П.
39.Pat. 124237 ČSSR, 1967. МКИ3
с 07 С.ZpůsobvýrobuN,N-dialkylamidů mono- nebodikarbonovýckkyselin/J.Kopeckỷ, J.Šmejkal//РЖХим. 1969. 24Н91П.
40.Pat. 3198831 US, 1965, МКИ3
c 07 c. Process for the production of N,N-diethyltoluamides/F.G. van Stryk//РЖХим. 1967. 2Н578П.
41.Кульчицкая Т.Ю., де Веки А.В., Мозжухина Т.Н. Перспективные методы получения N,N-диэтилтолуамида//Нефтепереработка и нефтехимия. 1994. №7. С. 46-49.
42.Pat. 2991310 US, 1961, МКИ3
с 07 с. Preparation of N,N-diethyltoluamides/W.L.Phalen, Jr.//РЖХим. 1962. 17Л333.
43.Ger. Offen. 3435388 BRD, 1986, МКИ3
с 25 в 3/02. Verfahren zur Herstellung von aromatischen Carbonsäureestern/D.Degner, E.Steckhan, B.Grosse//РЖХим. 1986. 22Н12ОП.
44.Electrochemical Amidation of Esters/Arai K., Shaw C.-H., Norawa K. et al.//Tetrahedron Lett. 1987. Vol. 28, No. 4. P. 441-442.
45.Schwartz R.D., Mathews R.G., Pedro N.A. High-Temperature Gas-Liquid Chromatography with a Dendritic Salt Support//J. Checmatogr. 1977. Vol. 142. P. 103-107.
46.Хайрулина Х.Х., Тимофеевская Л.А., Говорченков В.И. Клинические изучения репеллентов, полученных из ДЭТА/В сб.: Совершенствование производства товаров бытовой химии. М.: 1984. С. 95-99.
47.Эксперементальные методы исследования катализа/Под ред. Р. Андерсона. М.: Мир, 1972. С. 13.
48.Bett J.A.S., Christner L.C., Hall W.K. Studies of the Hydrogen Held by Solids. XII. Hydroxyapatite Catalysis//J. Amer. Chem. Soc. 1967. Vol. 89, No. 22. P. 5535-5541.
49.Экспресс-методика определения кислотности кальцийфосфатных катализаторов/А.С. Дыкман, О.Е. Баталин, В.М. Евграшин, Г.И. Семенов//Пром. Синтетич. Каучука. М..: ЦНИИТЭНефтехим, 1977. №8. С. 3-5.
50.Clark R.O., Ballou E.V., Barth R.T. The Relation of Catalyst Acidity to the Electrode Potential Recorded in an Automatic Titration//Anal. Chem. Acta. 1960, Vol. 23, No. 2. P. 189-195.
51.Введенский А.А. Термодинамические расчеты процессов топливной промышленности. Л.-М.: ГНТИН и ГТЛ, 1949. С. 143.
52.Руководство по курсу физической химии/В.П.Машавец, Э.И.Квят, А.М. Пономарева, В.П. Деревягина//Росвузиздат, 1963. С. 68.
53.Гордон А., Форд Р. Спутник химика. – М.: Мир, 1976. С. 519.
54.Краткий справочник физико-химических величин/Под ред. К.П. Мищенко, А.А. Равделя//Л.: Химия, 1974. С. 84.
56.Краткий справочник нефтехимика/Под ред. В.А. Рыбакова//СПб: Химия, 1993. С. 281.
57.Каталитический способ получения N,N-диэтилтолуамида/Т.Н. Мозжухина, А.В. де Веки, Т.Ю. Кульчицкая, Т.Н. Саватеева//Нефтепереработка и нефтехимия. – М.: ЦНИИТЭНефтехим, 1994. №1. С. 20-23.
58.Строение и свойства адсорбентов и катализаторов/Под. Ред. Б.Г. Линсена//М.: Мир, 1973. 653 с.
59.Bunnett J.F., Davis G.T. Mechanism of Aminolysis of Esters//J. Amer. Chem. Soc. 1960. Vol. 82, No. 3. P. 665-674.
60.Krieble V.K., Holst K.A. Amide Hydrolysis with High Concentrations of Mineral Acids//J. Amer. Chem. Soc. 1938. Vol. 60, No. 12. P. 2976-2980.
61.Meloche I., Laidler K.J. Substituent Effects in the Acid and Base Hydrolysis of Aromatic Amides//J. Amer. Chem. Soc. 1951. Vol. 73, No. 4. P. 1712-1714.
62.Yates K., Stevens J.B., Katritzki A.R. The Ionization Behavior of Amides in Concentrated Silphuric Acids//Can. J. Chem. 1964. Vol. 42, No. 8. P. 1957-1970.
63.Morawetz H., Otaki P.S. Kinetics and Equilibria of Amide Formation in Aqueous Media//J. Amer. Chem. Soc. 1963. Vol. 85, No. 4. P. 463-468.
64.Betts R.L., Hammett L.P. A Kinetic Study of the Ammonolysis of Phenylacetic Esters in Methanol Solution//J. Amer. Chem. Soc. 1937. Vol. 59, No. 8. P. 1568-1572.
65.Дей К., Селбин Д. Теоретическая неорганическая химия. М.: Химия, 1976. С. 352.
66.Мозжухина Т.Н., де Векки А.В., Кульчицкая Т.Ю. Одностадийное амидирование мета-толуиловой кислоты в N,N-диэтилтолуамид//Тез. Докл. 3-й Республ. Конф. По интенсификации нефтехимических процессов "Нефтехимия-94". – Нижнекамск, 1994. С. 64-65.
67.Вредные вещества в промышленности. Справочник /Под ред. проф. Н.В. Лазарева и д.м.н. Э.Н. Левиной. Л.: Химия, 1976. Т. 2. С. 624.
68.Вредные вещества в промышленности. Справочник /Под ред. проф. Н.В. Лазарева и д.б.н. проф. Н.Д. Гаданской. Л.: Химия, 1977. Т. 3. С. 608.
69.Рабинович В.А., Хавин З.Я.. Краткий химический справочник. Л.: Химия, 1978. С. 392.
|