Контрольная работа
Сравнение изотермического реактора идеального вытеснения и реактора полного смешения в зависимости от степени превращения
Введение
Серная кислота является одним из крупнотоннажных продуктов химической технологии. Серная кислота относиться к числу сильных кислот и является самой дешёвой. Она реагирует почти со всеми металлами, вступает в реакции обменного разложения. Почти половину всей вырабатываемой кислоты используют для производства минеральных удобрений. Также серную кислоту применяют в нефтехимической, металлургической отраслях промышленности, для производства химических волокон, красителей, взрывчатых веществ и других продуктов.
Окисление оксида серы (IV) является второй стадией производства cерной кислоты. По методу окисления оксида серы (IV) различают контактный и нитрозный способы производства серной кислоты. В современных производствах окисление проводят в присутствии твердого катализатора, и способ производства называют контактным. При нитрозном способе катализатором служат оксиды азота. Окисление проводят в жидкой фазе с помощью нитрозы, выполняющей функции передатчика кислорода.
Окисление оксида серы (IV) в оксид серы (VI) – основной процесс в производстве серной кислоты. Окисление проводят после тщательной очистки газа от пыли, тумана серной кислоты, контактных ядов и осушки.
Равновесие реакции окисления SO2
в соответствии с принципом Ле-Шателье сдвигается в сторону образования SO3
при понижении температуры и повышении давления. Равновесная степень превращения реагентов зависит также от соотношения SO2
и O2
в газе. Некаталитическое окисление оксида серы (IV) протекает столь медленно, что в производственных масштабах его проводить нецелесообразно. Поэтому процесс проводят в присутствии катализаторов. В сернокислой промышленности в разное время применяли лишь три вида катализаторов, основу которых составляли металлическая платина, оксиды железа и оксид ванадия (V). Самыми активными катализаторами являются платиновые. Однако из-за высокой чувствительности к контактным ядам, в частности к мышьяковистым соединениям, эти катализаторы уже давно не применяются.
Реклама

Катализаторы на основе оксидов железа практически не отравляются, но достаточную активность он проявляет лишь при температуре выше 625С. При такой температуре равновесная степень превращения не превышает 70%, и использование таких катализаторов возможно лишь для так называемого предварительного окисления сернистого газа со степенью превращения 50-60%.
Ванадиевые катализаторы в условиях работы представляют собой пористый носитель, внутренняя поверхность которого смочена пленкой раствора V2
O5
в расплаве пиросульфата калия.
В рамках данной работы мы рассматриваем 2 типа реакторов: реактор идеального вытеснения и реактор полного смешения.
Реактор идеального вытеснения.
При прохождении потока через данный реактор все частицы движутся с одной скоростью, не перемешиваясь друг с другом, то есть исходные реагенты не смешиваются с продуктами реакции. В каждом поперечном сечении потока концентрации их выровнены, но плавно изменяются по длине реакционной зоны. Аналогично изменяется скорость процесса.
По условию задания мы используем изотермический температурный режим, который характеризуется постоянством температуры по всей длине реакционной зоны. Данный режим в реакторе идеального вытеснения наблюдается в случае протекания химико-технологического процесса без теплового эффекта или когда скорость тепловыделения (теплопоглощения) мала, а теплопроводность среды в реакционной зоне высока.
Необходимое время пребывания реагентов в реакционной зоне рассчитывают по уравнению:
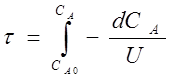 , ,
называемому характеристическим уравнением реактора идеального вытеснения.
Реактор полного смешения.
При прохождении потока через данный реактор частица, поступающая в реакционную зону, мгновенно смешиваются с частицами, уже находящимися в этой зоне, то есть равномерно распределяются по всей длине и во всем объёме зоны. В результате во всех точках реакционной зоны мгновенно выравниваются все параметры, характеризующие химико-технологический процесс.
Вследствие полного перемешивания выравнивается и температура во всём объёме реакционной зоны. Таким образом, химико-технологический процесс в потоке полного смешения может протекать только при изотермическом температурном режиме, независимо от значения теплового эффекта, концентрации и степени превращения исходных веществ.
Время пребывания частиц в реакционной зоне распределено не равномерно. Смешение исходных реагентов с продуктами реакции и неравномерность времени пребывания частиц в реакционной зоне приводит к уменьшению движущей силы процесса по сравнению с проведением его в потоке идеального вытеснения.
Реклама

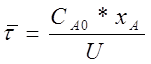 , ,
это выражение называют характеристическим уравнением реактора полного смешения.
Целью данной работы является сравнение изотермического реактора идеального вытеснения и реактора полного смешения в зависимости от степени превращения, а также рассчитать производительность по исходному компоненту SO2
.
Исходные данные
SO2
+ 0,5O2
= SO3
- ∆H0
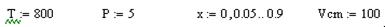
Исходные концентрации реагентов (мольная доля):

Скорость реакции рассчитывается по выражению:
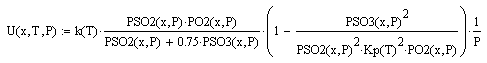
константа равновесия:
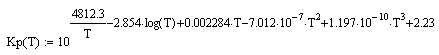
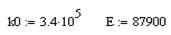
Расчетная часть
реактор идеальный вытеснение смешение


Вывод
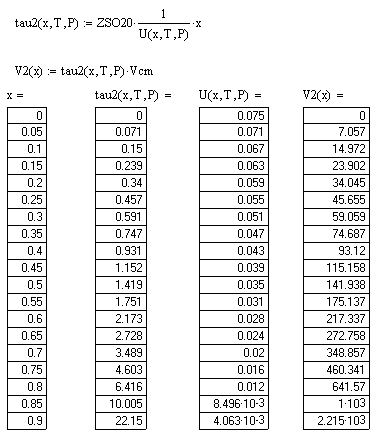
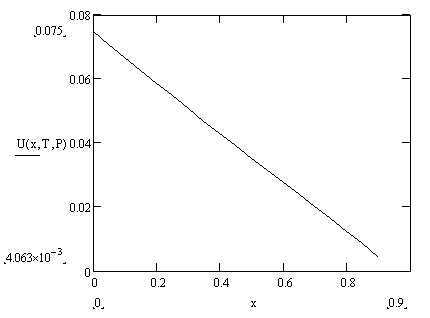
В результате проделанной работы мы выяснили, что объём реактора идеального вытеснения меньше объёма реактора полного смешения при одной и той же степени превращения, то есть при одинаковой скорости реакции.
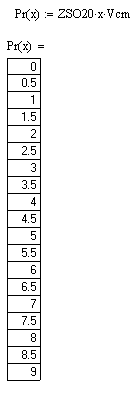
Производительность реакторов изменяется от 0 до 9 м3
/с с шагом 0,5 при соответственном изменении степени превращения SO2
от 0 до 0,9 с шагом 0,05.
При увеличении степени превращения SO2
скорость реакции падает.
|