ЗМІСТ
ВСТУП
1.ЗАГАЛЬНА ЧАСТИНА
1.1 Характеристика стічної води за якісним та кількісним складом
1.2 Хімічні та фізичні властивості сульфатної кислоти таїї сполук
2.СПЕЦІАЛЬНА ЧАСТИНА
2.1 Теоретичні основи визначення сульфатів
2.1.1Титриметричним методом аналізу
2.1.2 Турбидиметричним методом аналізу
2.2 Обладнання методів визначення сульфатів у стічній воді
3.ЕКСПЕРЕМЕНТАЛЬНА ЧАСТИНА
3.1 Методики визначення сульфатів у стічній воді
3.1.1 Комплексонометричним методом аналізу
3.1.2 Турбидиметричним методом аналізу
3.2 Експеримент по визначенню сульфатів у стічній воді
3.2.1 Комплексонометричним методом аналізу
3.2.2 Турбидиметричним методом аналізу
3.3 Математична обробка отриманих результатів аналізупо визначенню сульфатів у стічній воді
3.3.1 Комплексонометричним методом аналізу
3.3.2 Турбидиметричним методом аналізу
4. СТАТИСТИЧНО – МАТЕМАТИЧНА ОБРОБКА РЕЗУЛЬТАТІВ АНАЛІЗУ
5. ТЕХНІКА БЕЗПЕКИ ТА ОХОРОНАНАВКОЛИШНЬОГО СЕРЕДОВИЩА
5.1 Загальні вимоги техніки безпеки у хімічній лабораторії
5.2 Протипожежні заходи безпеки
5.3 Міри безпеки при роботі з електричним струмом
5.4 Заходи під час нещасних випадків
5.5 Гігієна праці лаборанта
5.6 Охорона природи та навколишнього середовища
ПЕРЕЛІК ПОСИЛАНЬ
ВСТУП
Згідно вимог ГОСТ у складі властивості стічної води повинні забезпечувати безпечність її в епідеміологічному відношенні та не шкідливість хімічного складу.
До складу коксохімічного виробництва входять багато цехів, які виконують різні функції.
Опис основних цехів коксохімічного виробництва:
1) Вуглепідготовчий цех (продукція – вугільна шихта, сировина – різні марки вугілля), який складається з:
- відділу вуглепідготовки, який забезпечує прийом, зберігання та підготовку вугільних концентратів для коксування, а також подачу
вугільної шихти в коксові цехи.
- відділу приготування зв′язуючого та брикетування в складі 5 брикетних агрегатів японської фірми „Ніплон – Стілно"
В теперішній час відділ прийому, зберігання, приготування зв′язуючого та відділ брикетування виведені з експлуатації та потребують відновлення.
2) Коксовий цех №1 (продукція – кокс, сировина – вугільна шихта) – забезпечує виробництво коксу та коксового газу з вугільної шихти. З 6 коксових батарей – 4 діючих, батареї №3, №4 – виведені з експлуатації.
Реклама

3) Коксовий цех №2 (продукція – кокс, сировина - вугільна шихта) – виробляє кокс та коксовий газ з вугільної шихти. В складі цеху 2 робочі батареї - №7 і №9, батареї №8, №10 виведені з експлуатації.
4) Цех улавлювання хімічних продуктів коксування (продукт – очищений газ, сировина – прямий неочищений коксовий газ) –забезпечує охолодження коксового газу і виділення з нього хімічних продуктів. Частина обладнення підлягає капітальному ремонту і заміні.
5) Цех сіроочистки (сировина – очищений коксовий газ, продукція – чистий гаг) – виконує очистку коксового газу від сірководню та отримання сірчаної кислоти.
6) В складі коксохімічного виробництва також входять допоміжні цехи:цех по ремонту та експлуатації електрообладнання, ремонтно – механічний цех, спеціалізований цех по ремонту коксохімічного обладнання (АСУП) та цех енергозабезпечення.
Цех енергозабезпечення має 2 відділи:
- відділ очистки аміачних і фенольних стічних вод;
- відділ, де відбувається виробництво пару для технологічних потреб
цехів коксохімічного виробництва, здійснюється на піковій котельні.
У відділі очистки аміачних і фенольних стічних вод проводиться очистка стічної води коксохімічного виробництва. У лабораторії постійно аналізують воду яка надходить на очистку, воду яка подається на дільницю №3 БХУ, воду яка подається у реактор та очищена вода на БХУ, яка подається на башти тушіння. Контролюється, згідно ГОСТ, вміст таких речовин у стічних водах як: феноли, родоніти, ціаніди, аміак загальний та летючий, смоли і масла, фосфор, ХПК, хлориди, вміст ілу, зважені речовини та сульфати. Вміст цих речовин суворо контролюється лабораторією.
У лабораторії цеху енергозабезпечення визначення сульфатів проводять комплексонометричним (одним із різновидів титриметричного методу аналізу) та турбидиметричним методами аналізу.
Тому тема моєї курсової роботи і є визначення сульфатів у стічній воді комплексонометричним та турбидиметричним методами аналізу.
1.ЗАГАЛЬНА ЧАСТИНА
1.1 Характеристика стічної води за якісним та кількісним складом
Стічні води – це будь-які води і атмосферні опади, що відводять у водойми з територій промислових підприємств і населених місць через систему каналізації або самопливом, властивості яких виявилися погіршеними в результаті діяльності людини.
Стічні води можуть бути класифіковані за наступними ознаками:
Реклама

По джерелу походження стічні води можуть бути класифіковані на:
а) виробничі (промислові) стічні води ( що утворяться в технологічних процесах при виробництві або видобутку корисних копалин), приділяються через систему промислової каналізації;
б) побутові (господарсько – фекальні) стічні води ( що утворяться в житлових приміщеннях, а також у побутових приміщеннях на виробництві, наприклад, душові кабіни, туалети), відводяться крізь систему господарсько – побутової каналізації;
в) атмосферні стічні води (діляться на дощові й талі, тобто сніги, що утворяться при таненні, льоду, граду), відводяться як правило через систему ливневої каналізації. Так само можуть називатися "ливневі стоки".
Виробничі стічні води, на відміну від атмосферн і побутових, не мають постійної складу й можуть бути розділені:
1) по складу забруднювачів на:
- забруднені по перевазі мінеральними домішками;
- забруднені по перевазі органічними домішками;
- забруднені як мінеральними, так й органічними домішками.
2) по концентрації забруднюючих речовин:
- с змістом домішок 1-500 мг/л
- с змістом домішок 500-5000 мг/л
- с змістом домішок 5000-30000 мг/л
- с змістом домішок більше 30000 мг/л
3) по властивостях забруднювачів
4) по кислотності:
- неагресивні (p 6,5-8)
- слабоагресивні (слаболужні – pН 8 – 9 і слабокислі – pН 6-6,5)
- сильноагресивні (сильнолужні – pН > 9 і сильнокислі – pН <6)
- по токсичній дії і дії забруднювачів на водні об'єкти:
- утримуючі речовини, що впливають на загальсанітарний стан водойми(наприклад, на швидкість процесів самоочищення)
- утримуючі речовини, що змінюють органолептичні властивості (смак,запах та ін.)
- утримуючі речовини, токсичні для людини і які містяться у водоймахтварин і рослин
У складі стічних вод виділяють дві основних групи забруднювачів - консервативні, тобто такі, які важко вступають у хімічні реакції й практично не піддаються біологічному розкладанню (приклади таких забруднювачів солі важких металів, феноли, пестициди) і неконсервативні, тобто такі, які можуть піддаватися процесам самоочищення водойм.
До складу стічних вод входять як неорганічні (частки ґрунту, руди й порожньої породи, шлаків, неорганічні солі, кислоти, луги); так й органічні (нафтопродукти, органічні кислоти), у тому числі біологічні об'єкти (грибки, бактерії, дріжджі, у тому числі хвороботворні).
Очищення стічних вод - це руйнування або видалення з них певних речовин, знезаражування й видалення патогенних організмів.
Вода яка надходить на очистку постійно перевіряється на вміст наступних показників:
Фенольна вода:
- рН 6,5 – 8,0;
- феноли не менше 400;
- родоніти 600 мг/дм3
;
- ціаніди 100 мг/дм3
;
- аміак летючий 200 мг/дм3
;
- аміак загальний 2200 мг/дм3
;
- смоли і масла 500 мг/дм3
;
- іон сульфату 2200 мг/дм3
;
- ХПК 3000 мг/дм3
.
Аміачна вода:
- рН 7,8 – 8,8;
- феноли не менше 850;
- родоніти 150 мг/дм3
;
- ціаніди 6 мг/дм3
;
- аміак летючий 100 мг/дм3
;
- аміак загальний 600 мг/дм3
;
- смоли і масла 100 мг/дм3
;
- ХПК 3200 мг/дм3
.
Вода, яка подається на дільницю БХУ №3 постійно перевіряється на міст наступних показників:
Фенольна вода:
- рН 6,5 – 8,0;
- феноли не менше 400;
- родоніти 450 мг/дм3
;
- ціаніди 50 мг/дм3
;
- аміак летючий 200 мг/дм3
;
- аміак загальний 2200 мг/дм3
;
- смоли і масла 30 мг/дм3
;
- іон сульфату 2500 мг/дм3
;
- ХПК 3000 мг/дм3
;
- фосфор15 мг/дм3
.
Аміачна вода:
- рН 7,8 – 8,8;
- феноли не менше 850;
- родоніти 150 мг/дм3
;
- ціаніди 6 мг/дм3
;
- аміак летючий 100 мг/дм3
;
- аміак загальний 550 мг/дм3
;
- смоли і масла 30 мг/дм3
;
- ХПК 3200 мг/дм3
;
- фосфор 15 мг/дм3
.
Аміачна вода і фенольна очищена на БХУ вода, яка подається на башти тушіння постійно перевіряється на вміст наступних показників:
- рН 6,8 – 8,0;
- феноли не менше 1,0;
- родоніти 5,0 мг/дм3
;
- ціаніди 1,0 мг/дм3
;
- аміак летючий 100 мг/дм3
;
- хлориди 2000 мг/дм3
;
- смоли і масла 10 мг/дм3
;
- ХПК 400 мг/дм3
;
- сульфати 2500 мг/дм3
;
- зважені речовини 600мг/дм3
.
Саме по всім цим показникам і аналізують стіну воду на очистку абоперед тим, як випустити її на дільницю №3 БХУ, чи на башти тушіння.
1.2 Хімічні та фізичні властивості сульфатної кислоти та її сполук
Безводна сульфатна кислота – безбарвна оліїста речовина, з густиною 1,84 г/см3
.
Під час взаємодії оксиду сірки ( VI ) ( SO3
)з водою виділяється теплота і утворюється сульфатна кислота за реакцією:
SO3
+ H2
O = H2
SO4
+ 88 кДж
Добування сульфатної кислоти з оксиду сірки ( VI ) є основним способом виробництва сульфатної кислоти ( H2
SO4
)( контактний спосіб ). Розчин оксиду сірки ( VI ) ( в концентрованому розчині H2
SO4
розчиняють SO3
) в сульфатній кислоті має технічну назву олеум. У промисловості добувають олеум, що містить від 20 до 65 % SO3
.
Сульфатна кислота – сильна кислота, яка дисоціює ступінчасто:
H2
SO4
↔ Н+
+ HSO4
К1
= 1 · 10 3
H2
SO4
↔ Н+
+ SO4
-2
К2
= 1,2 · 10 -2
У реакціях сульфатна кислота утворює кислі та середні солі:
NaCl + H2
SO4
= NaHSO4
+ HCl
2 NaCl + H2
SO4
= Na2
SO4
+ 2 HCl
Нагрівання гідросульфатів приводить до утворення піросульфатів:
NaHSO4
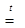 Na2
S2
O7
+ H2
O Na2
S2
O7
+ H2
O
Сульфатна кислота витісняє менш сильні або леткі кислоти :
2 Na2
SO3
+ 2 H2
SO4
= 2 NaHSO4
+ SO2
↑ + H2
O
Концентрована сульфатна кислота – сильний окисник. Так, активні метали ( Mg, Zn тощо ) здатні відновити концентровану сульфатну кислоту до сірководню; вільної сірки і оксиду сірки ( ІV ):
4 Zn0
+ 5 H2
S+6
O4
( конц. ) = 4 Zn+2
SO4
+ H2
S -2
↑ + 4 H2
O
3 Zn0
+ 5 H2
S+6
O4
( конц. ) = 3 Zn2+
SO4
+ S0
+ 4 H2
O
Zn0
+ 2 H2
SO4
( конц. ) = Zn+2
SO4
+ S+4
O2
+ 2 H2
O
Такі метали, як Cu, Ag і Hg під час взаємодії з концентрованою соляною кислотою утворюють відповідні солі та оксид сірки ( VI ):
Cu + 2 H2
SO4
= CuSO4
+ SO2
↑ + 2 H2
O
Концентрована сульфатна кислота за звичайних умов пасивує алюміній, хром, залізо, тому її транспортують у залізних цистернах. Концентрована H2
SO4
здатна окислювати вуглець, фосфор, сірку:
2 H2
S+6
O4
+ C0
= C+4
O2
+ 2 S+4
O2
↑ + 2 H2
O
5H2
S+6
O4
+ 2 P0
= 2 H3
P+5
O4
+ 5 S+4
O2
↑ + 2 H2
O
2 H2
S+6
O4
+ S0
= 3 S+4
O2
↑ + 2 H2
O
Гідроген бромід і гідроген йодид ( але не гідроген хлорид! ) окислюються концентрованою H2
SO4
до вільних галогенів:
2 HBr -1
+ 2 H2
S6+
O4
( конц. ) = Br2
0
+ S+4
O2
+ 2 H2
O
8 HI -1
+ H2
S6+
O4
= 4 I2
0
+ H2
S -2
+ 4 H2
O
6 NaBr -1
+ 4 H2
S6+
O4
= 3 Br2
0
+ 3 Na2
SO4
+ S0
+ 4 H2
O
H2
S2
-
+ 3 H2
S6+
O4
= 4 S+4
O2
↑ + 4 H2
O
У розведених розчинах сульфатна кислота втрачає властивості кислоти – окисника. У розведеному розчині H2
SO4
окисником є йон гідрогену, тому вона взаємодіє тільки з металами, які стоять у ряду електрохімічних потенціалів до гідрогену, наприклад:
Zn0
+ H2
1+
SO4
( розв. ) = Zn2
+
SO4
+ H2
0
↑
стічний вода сульфатний турбидиметричний
Розведена сульфатна кислота не пасивує залізо, хром і алюміній, а також не взаємодіє з неметалами. На сульфат аніон якісною реакцією є утворення білого осаду BaSO4
, який не розчиняється у мінеральних кислотах:
Ba2+
+ SO4
2-
= BaSO4
↓
Важливими солями сульфатної кислоти є купороси: мідний купорос CuSO4
· 5 H2
0 і нікелевий купорос NiSO4
· 7 H2
O, гіпс CaSO4
· 2 H2
O, залізний купорос FeSO4
· 7 H2
O, алюмо – калієвий галун KAl(SO4
)2
· 12 H2
O.
Сульфатна кислота інтенсивно поглинає пару води і тому її часто застосовують для осушування газів. Зневоджування багатьох органічних речовин, наприклад, вуглеводів ( клітковина, цукор та ін. ) пояснюється здатністю сульфатної кислоти ( H2
SO4
) поглинати воду.
Якщо сульфатну кислоту розчинити у воді, то утворюються гідрати і виділяється дуже велика кількість теплоти. Тому змішувати концентровану сульфатну кислоту з водою слід дуже обережно. Для приготування водного розчину H2
SO4
кислоту слід обережно лити у воду тонким струменем, інтенсивно перемішуючи. Ні в якому разі не можна лити воду в концентровану сульфатну кислоту – відбувається бурхливе – подібне до вибуху, закипання рідини, що супроводжується розбризкуванням.
2.СПЕЦІАЛЬНА ЧАСТИНА
2.1 Теоретичні основи визначення сульфатів
2.1.1Титриметричним методом аналізу
Титриметричний метод аналізу заснований на точному вимірі кількості реактиву, витраченого на реакцію з обумовленою речовиною. Ще недавно цей метод аналізу називали об'ємним у зв'язку з тим, що найпоширенішим у практиці способом виміру кількості реактиву був вимір об'єму розчину, витраченого на реакцію. Однак останнім часом його називають титриметричним аналізом, тому що поряд з виміром об'ємів широко використаються інші методи ( зважування, електрохімічне перетворення та інше ).
Основним видом концентрації у титриметричному аналізі є титр. В аналітичній хімії титр — один із способів вираження концентрації розчину. Титр показує число грамів розчиненої речовини в 1 моль розчину. Титрований, або стандартний, розчин - розчин, концентрація якого відома з високою точністю. Титрування – додавання титрованного розчину до аналізованого для визначення точно еквівалентної кількості. Розчин, яким титрують, часто називають робочим розчином або титрантом. Наприклад, якщо кислота титрується лугом, розчин лугу називається титрантом. Момент титрування, коли кількість доданого титранта хімічно еквівалентно кількості титруємої речовини, називається точкою еквівалентності.
У титриметричному аналізі не може бути використана будь-яка хімічна реакція. Реакції, які застосовують в титриметрії, повинні задовольняти наступним основним вимогам:
1) Реакція повинна протікати кількісно, тобто константа рівноваги реакції повинна бути досить велика;
2) Реакція повинна протікати з великою швидкістю;
3) Реакція не повинна ускладнюватися протіканням побічних реакцій;
4) Повинен існувати спосіб визначення закінчення реакції.
Якщо реакція не задовольняє хоча б одному із цих вимог, вона не може бути використана в титриметричному аналізі.
У титриметричному аналізі використовують реакції різного типу: кислотно-основної взаємодії, комплексоутворення та інші, що задовольняють тим вимогам, які ставляться до титриметричних реакцій. Окремі титриметричні методи одержали назву по типу основної реакції, що протікає при титруванні або за назвою титранта (наприклад, в аргентометричних методах титрантом є розчин AgNO3
, у перманганатометричних - розчин КМпО4
і т.д.). По способу фіксування точки еквівалентності виділяють методи титрування з кольоровими індикаторами, методи потенціометричного титрування, кондуктометричного, фотометричного та інші. В даній курсовій роботі я використовую один із методів титриметричного аналізу – комплексонометричний методом аналізу.
Комплексонометричний метод аналізу заснований на тому, що речовина, яка міститься у робочому розчині, утворює з аналізуючим катіоном міцнну комплексну сполуку, яке розчиняється у воді. Хоча у ході титрування осад не утворюється, концентрація визначаємого іона по мірі титрування зменшиться, так як все більша кількість його зв’язується в комплекс. В цьому відношені процес комплексоутворення аналогічний процесу осадження. Осадження відбувається тим повніше, чим менше розчинність утворюючегося осаду. Визначаємий іон зв’язується у комплекс тим повніше , чим прочніше цей комплекс, тобто чим менша константа його нестійкості.
В наш час для хімічного аналізу широко приміняють групу органічних реактивів, об’єднаних під загальною назвою – комплексони. Найбільш широкого використовують комплексон під назвою трилон Б, з якого готують робочий розчин для титрування методом комплексоутворення. Трилон Б (скорочено Na2
H2
Tr) – кисла двунатрієва сіль етилендіамінотетраоцтова кислота.
Трилон Б, як і інші комплексони, утворює міцні, розчинні у воді комплексні сполуки з іонами магнію, барію, марганцю, лужноземельних металів, рідко земельних і інших металів. Наприклад:

2.1.2 Турбидиметричним методом аналізу
При проходженні пучка світла крізь суспензію дрібних твердих часток у розчиннику (дисперсна система) відбувається бічне розсіювання світла (візуально спостерігається мутність). Якщо довжина хвилі менше лінійних розмірів часток, то розсіювання обумовлене заломленням на границі розділу частка — розчинник і відбиттям його частками. Якщо довжина хвилі більше лінійних розмірів часток, то відбувається дифракція світлової хвилі; виникає ефект Тиндаля. Інтенсивність розсіювання зростає зі збільшенням числа часток, що розсіюють. На цьому засновані два подібних аналітичних методів визначення концентрації речовини: нефелометрія й турбидиметрія. При турбидиметричних визначеннях вимірюють потужність світла W, що виходить із кювети в напрямку падаючого світлового проміню. При нефелометричних визначеннях вимірюють потужність розсіювання світла (WP
) у напрямку, перпендикулярному напрямку первинного пучка (рис. 2.1). Турбидиметричною (нефелометричною) суспензією називають суспензії малорозчинних речовин при їхньому вмісті 100 мг на 1 л і менше. Частки відбивають постійну частку світла протягом проміжку часу, достатнього для виміру. Потужність світлового потоку, що розсіює дрібними Частками суспензії, описується рівнянням Релея, формула 2.1:
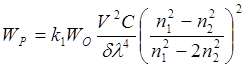 (2.1) (2.1)
де k1
— коефіцієнт;
V — середній об'єм частки суспензії;
C— концентрація часток;
δ — густина речовини частки;
λ — довжина хвилі падаючого світла;
n1
— показник заломлення часток суспензії;
n2
— показник заломлення розчинника.

Рисунок 2.1. Схема виміру світлових потоків у нефелометрії і турбидиметрії.
Значення V, δ, n залежать для даної суспензії від умов її одержання й виміру: швидкості змішування реагентів, швидкості перемішування, температури, кислотності середовища, присутності сторонніх іонів, довжини хвилі падаючого світла. При сталості умов величини n1
, n2
, λ, α, V; поєднуючи всі постійні величини в рівнянні (2.1) в одну константу, можемо записати формулу 2.2:
Wp
=kC(2.2)
тобто потужність розсіяного світлового проміню прямопропорційна концентрації часток суспензії. Для двох мутних середовищ із частками однакової форми й розмірів відношення потужностей розсіяного світла пропорційно відношенню концентрацій часток:
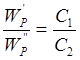
Звідки
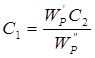 (2.3) (2.3)
Формулу 2.3 використовують при нефелометричних визначеннях.
При турбидиметричних вимірах зв'язок між потужністю світлового променю, що пройшов крізь суспензію і розміром часток суспензії описується наближеним рівнянням 2.4:
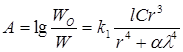 (2.4) (2.4)
де А — здатність, що розсіює (величина, аналогічна оптичному поглинанню) ;
W0
- потужність падаючого на суспензію світлового проміню;
W - потужність пройшовшого через суспензію світлового потоку;
l - товщина поглинаючого шару;
r - середній діаметр часток;
λ – довжина хвилі падаючого світла;
k1
— коефіцієнт пропорційності, що залежить від природи суспензії і методу виміру;
α - константа, що залежить тільки від методу виміру. Рівняння (2.4) справедливо тільки для сильно розведених суспензій.
При турбидиметричному визначенні користуються тим самим приладом, суспензії готують строго по певному прописі, тобто всі виміри проводять при певних значеннях k1
, r, α і λ.
Об’єднуючи в рівнянні (2.4) всі постійні величини в одну, одержимо більш просте рівняння 2.5:
A = kLC (2.5)
Це відношення аналогічно рівнянню Бугера-Ламберта-Бера для поглинання світла кольоровими розчинами. З рівнянь (2.1) і (2.4) ми бачимо, що інтенсивність розсіяного й поглиненого світла залежить від розміру часток суспензії.
Для запобігання коагуляції часток у суспензії часто вводять стабілізуючі колоїди (желатину, крохмалю та ін.).
Нефелометричні й турбидиметричні визначення в практиці виробничих лабораторій застосовують обмежено, тому що важко одержати однакові по розмірах частки суспензії, осади повинні мати дуже малу розчинність. Отримання правильних результатів у турбидиметричному методі аналізу залежить від: порядку змішання реактивів, швидкості перемішування розчинів, часу отримання дисперсної системи, співвідношення концентрації осаджуваної речовини і осаджувача, температури, а також зміна струму в мережі дає помилку при вимірюванні аналітичного сигналу, що призводить до недостатньо точних результатів.Нефелометричні й турбидиметричні визначення заміняють, коли це можливо, іншими методами (фотометричними, електрометричними).
2.2 Обладнання методів визначення сульфатів у стічній воді
Двопроменеві фотоколориметри типу ФЕК
Фотоелектроколориметр використовують для визначення концентрації речовини у розчині по величині поглинання монохроматичного світла. Його використовують для кількісного та якісного аналізів. На рисунку 1 представлена принципова схема фотоколориметру типу ФЕК.

Рисунок 1. Принципова схема фотоколориметру типу ФЕК
1 - джерело світла; 2 - теплозахисні світлофільтри; 3 - розподільча призма;4,4' - поворотні призми; 5,5' - кольорові світлофільтри; 6,6' - кюветні відділення; 7,7' - щілинні діафрагми з відліковими барабанами; 8,8' - фотоелементи; 9 - обернений підсилювач; 10 - нуль-гальванометр.
Фотоелектроколориметр – нефелометр ФЕК – 56 має оптику яка дає можливість вимірювати в області спектра від 315 до 630 ммк. Прилад може використовуватись як нефелометр. Для цьохо необхідно в отвір, де поміщаються лінзи, розміщеніі перед кюветним відділенням, вставити точечні діафрагми, сильно звужуючи світлові промені і поставити рукоятку у положення „нефелометр". Для нефелометричних визначень мається три світлофільтра - № 9, 10 і 11. В решті принцип роботи на цьому приладі нічим не відрізняється от принципу роботи на ФЕК–М. Необхідно лише пам’ятати, що перед початком вимірів необхідно проводить установку електричного нуля.
Принцип дії двопроменевих фотоколориметрів заснований на принципі зрівняння потужності двох світлових потоків з допомогою рухливої щілинної діафрагми.
Два світлових променя (1 та 1') попадають на однакові фотоелементи (8 та 8'). Струм, який створюється, тече по рамці нуль-гальванометра 10 у протилежних напрямках. Коли у кюветах 6 та 6' знаходяться однакові розчини порівняння (дистильована вода або нульовий розчин), то при однаковій потужності світлового променю фотоструми будуть однакові по значенню, але протилежні по напрямку. Тобто має місце компенсації струмів і стрілка гальванометру 10 не буде відхилятися від "0". Якщо в один із потоків (правий) ввести досліджуваний розчин, то потужності світлових променів, що попадають на фотоелементи, різні, а, отже, різні і фотоструми. Тобто компенсація струмів порушується і стрілка гальванометру відхиляється на величину цього порушення, тобто на величину, пропорційну концентрації введеного розчину. Змінюючи площу вхідного отвору щілинної діафрагми, зрівнюємо світлові промені, що попадають на обидва фотоелемента. Про те, то світлові промені рівні, свідчить встановлення стрілки на "0". Значення оптичного поглинання знімають по відліковому барабану..
Старі фотоколориметри ФЕК мають чотири світлофільтри (ФЕК-56). ФЕК-60 (нове покоління) має 9 світлофільтрів і дає можливість досліджувати розчини в діапазоні 400-950 нм.
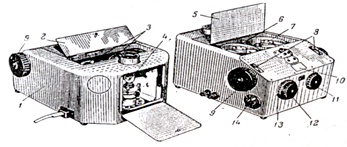
Рисунок 2. Зовнішній вигляд фотоколориметру ФЕК-М
1 - корпус; 2 - кришка відділення світлофільтрів; 3 - сектори зі світлофільтрами; 4 - лампа; 5 - кришка кюветного відділення; 6 - рукоятка шторки; 7 - кювето-тримач; 8 - відлікові шкали; 9-барабани; 10 - нуль-гальванометр; 11 - маховичок світлофільтрів; 12 - маховичок сірого клину тонкого настроювання; 14 - перемикач чутливості.
Порядок операцій при вимірах на фотоколориметрі типу ФЕК – М:
1. Вмикають прилад у мережу. При цьому загорається лампа 4. Рукояткою 11 встановлюють потрібний світлофільтр. Перемикач шторки 6 при цьому повинен бути в положенні "зачинено". Через 30 хвилин відкривають шторку, і через 5 хвилин знову її закривають.
2. Компенсують темновий струм ("електричний 0"). Для цього поворотом рукоятки 12,13 встановлюють стрілку мікроамперметра 10 на "0".
3. В лівий світловий потік па весь час вимірів встановлюють кювету з розчином порівняння 7. В правий кюветотримач встановлюють: в одне гніздо- кювету з розчином порівняння, в друге - кювету з досліджуваним розчином.
4 В лівий і правий світловий потік встановлюють розчин порівняння. Закривають кришку кюветного відділення 5. Індекс правого відлікового барабану 9 встановлюють на "0" по шкалі 8. Відкривають шторку 6 і повертаючи барабани 12 (точно) і 13 (грубо), встановлюють стрілку мікроамперметра 10 на "0"
5. Відкривають кюветне відділення 7 і в правий світловий потік вводять кювету з досліджуваним розчином. Кришку кюветного відділення 7 закривають, стрілка мікроамперметра 10 при цьому відхиляється від "0".
6. Поворотом правого відлікового барабану 9 встановлюють першопочаткове нульове значення стрілки "0"-гальванометра і відліковують по червоній шкалі барабану 8 значення оптичного поглинання.
7. Відкривають кюветне відділення, закривають шторку 6.
8. Виймають кювети з кюветного відділення, промивають їх, вимикають прилад із мережі. Охолоджують прилад при відкритому кюветному відділенні.
3. ЕКСПЕРЕМЕНТАЛЬНА ЧАСТИНА
3.1 Методики визначення сульфатів у стічній воді
3.1.1 Комплексонометричним методом аналізу
Метод заснован на осадженні іонів SO4
2-
хлоридом барію.
BaCl2
+ H2
SO4
= BaSO4
↓ + 2 HCl
Осад сульфату барію розчиняють в титрованому розчині трилону Б, залишок якого визначають титруванням розчином хлориду магнію.

Кількість трилону Б , витраченого на розчинення сульфату барію еквівалентного кількості сульфат– іонів у взятому об’ємі води. Точність методу ± 2,0 мг/дм3
SO4
2-
.
Оптимальні інтервали концентрацій для комплексно-метричного визначення сульфат – іонів находяться у межах 5–25мг.
Засоби вимірної техніки, дослідницьке і допоміжне обладнання, матеріали і реактиви:
1. Баня водяна.
2. Електроплитка.
3. Посуд мірна лабораторна скляна по ГОСТ 1770 – 74 і ГОСТ 20292 – 74, місткістю 50, 100, 250, 500, 1000 см3
.
4. Бюретки місткістю 25 см3
з краном.
5. Воронки скляні по ГОСТ 25336 – 82.
6. Фільтри беззольні паперові „синя стрічка".
7. Хлорид барію по ГОСТ 4108 – 72.
8. Хлорид магнію по ГОСТ 4209 – 77.
9. Трилон Б по ГОСТ 10652 – 73.
10. Сульфат магнію фіксонал по ГОСТ 4523 – 77.
11. Хлорид амонію по ГОСТ 3773 – 72.
12. Аміак по ГОСТ 3760 – 79.
13. Хлорид натрію по ГОСТ 4233 – 77.
14. Цинк металічний.
15. Кислота соляна по ГОСТ 3188 – 77.
16. Хромоген чорний ЕТ – 00.
17. Спирт етиловий ректифікований по ГОСТ 5962 – 67.
Підготовка до аналізу
Всі реактиви готують на двічі перегінній дистильованій воді в скляному приладі ( вода не повинна мати у своєму складі міді ).
Хід визначення
100см3
досліджуємої води (при необхідності концентрують або розбавляють) поміщають в конічну колбу ємністю 250 см3
. В цій же колбі, якщо необхідно, випаровуванням ( не досягає кипіння ) підкисленого розчину концентрують SO4
2-
, підливаючи по мірі випаровування нову порцію досліджуваної води.Розчин підкислюють трьома краплинами концентрованої соляної кислоти ( до кислої реакції ), додають 25,00 см 3
з молярною концентрацією еквівалентів 0,05 моль/л розчину хлориду барію, нагрівають до кипіння, кип’ятять 10 хвилин від початку кипіння і залишають на водяній бані біля 1 години.
Через 1 годину розчин фільтрують звичайним способом крізь невеликий беззольний фільтр „синя стрічка", попередньо промитий гарячою дистильованою водою. Фільтрування проводять, по можливості, не переміщаючи осад сульфату барію на фільтр. Колбу с осадом промивають 5 – 6 разів помірно гарячою водою ( 40 – 50 0
С ), не зчищаючи приставшого до стінок колби осаду, пропускають промивні води через той же фільтр. Фільтр с частиною потрапившого на нього осаду BaSO4
промивають 2 – 3 рази водою до негативної реакції на Cl-
. Коли вода стече, осад поміщають у ту ж колбу, в якій проводилось осадження. Приливають 5 см3
розчину аміаку з молярною концентрацією еквівалентів 9 моль/л, фільтр обережно розгортають скляною паличкою і розправляють по дну колби. Потім приливають 6см3
розчину трилону Б з молярною концентрацією еквівалентів 0,05 моль/л на кожні 5 мг припустимого вмісту сульфат – іонів у взятому для визначення об’ємі дослідж. води.
Склад сульфат – іонів може бути приблизно визначено по попередньо проведеній якісній реакції.
Вміст колби обережно нагрівають на пісчаній бані до кипіння і кип’ятять до розчинення осаду ( 3 – 5 хвилин ), тримаючи колбу під нахилом, періодично перемішують рідину.
Розчин охолоджують, приливають 50 см 3
дистильованої води, 5 см 3
аміачного буферного розчину і додають суху суміш індикатора ~ 0,1 г ( або додають 5 крапель спиртового розчину індикатора ). Залишок трилону Б титрують розчином хлориду магнію до переходу забарвлення з синього у лілове.
1 см 3
,з молярною концентрацією еквівалентів 0,05 моль/л, розчину трилону Б містить 2,4 мг SO4
2-
.
Вміст сульфатів ( Х ), мг/л, розраховують за формулою:
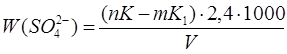 , ,
де n – кількість доданого розчину трилону Б, см3
;
K–поправочний коефіцієнт до нормальності розчину трилону Б;
m–кількість хлориду магнію, витраченого на титрування,см3
;
К1
– поправочний коефіцієнт до нормальності розчину хлориду магнію;
V – об’єм досліджуємої води, взятий для визначення, см3
;
При вмісті у воді сульфатів SO4
2-
більше 250 мг/дм3
пробу води необхідно розвести водою.
При вмісті сульфатів менше 50 мг/дм 3
необхідно брати для визначення великий об’єм досліджуємої води і концентрувати його.
Припустиме відхилення між повторними визначеннями сульфатів: 3 – 5 мг/дм3
, якщо їх вміст не перевищує 25 мг/дм3
, 5 – 10 мг/дм3
, якщо їх вміст не перевищує 25 – 300 мг/дм 3
при більш високих концентраціях – 3 % відношення.
3.1.2 Турбидиметричним методом аналізу
Метод заснований на визначенні сульфат – іону у вигляді BaSO4
і солянокислому середовищі за допомогою гліколєвого реагента. Гліколь, введений в реакційну суміш при осаджувані сульфату барія, стабілізує утворюючу суспензію BaSO4
і робить можливим турбидиметричне мікровизначення сульфатів. Чутливість методу 2 мг/дм3
SO4
2-
.
Засоби вимірної техніки, дослідницьке і допоміжне обладнання, матеріали і реактиви:
1. Баня водяна.
2. Електроплитка.
3. Плита муфельна ( 800 0
С ).
4. Щипці тигельні.
5. Фотоелектроколориметр.
6. Кювета l = 20 мм.
7. Ексикатор.
8. Посуд мірний лабораторний скляний по ГОСТ 1770 – 74 і ГОСТ 20292 – 74, місткістю: піпетки 50 і 100 см3
без ділень, піпетки 5 і 10 см3
с діленням на 0,1 см3
, циліндри мірні 10 см3
.
9. Колби мірні місткістю 250, 500 і 1000 см3
.
10. Стакан хімічний місткістю 250, 400 і 600 см3
по ГОСТ 25336 – 82.
11. Крапельниці скляні лабораторні по ГОСТ 25336 – 82.
12. пробірки колориметричні с притертою пробкою і відміткою на 10 м по ГОСТ 25336 – 82.
13. Палички скляні.
14. Скельця годинникові.
15. Фільтри беззольні „синя стрічка".
16. Воронки скляні по ГОСТ 25336 – 82.
17. Тиглі лабораторні.
18. Сульфат калію по ГОСТ 4145 – 74.
19. Кислота азотна по ГОСТ 4461 – 77.
20. Хлорид барію по ГОСТ 4108 – 72.
21. Кислота соляна по ГОСТ 3118 – 77.
22. Метиловий оранжевий.
23. Етиленгліколь по ГОСТ 10164 – 75.
24. Нітрат срібла по ГОСТ 1277 – 75.
25. Спирт етиловий ректифікований по ГОСТ 5962 – 67.
26. Вода дистильована по ГОСТ 6709 – 72.
Усі реактиви для аналізу повинні бути кваліфікації „чисті для аналізу".
Хід визачення
До 5 см3
досліджуваної проби або концентрату води, відібраної в мірний циліндр місткістю 10 см3
, додають 1 – 2 краплини соляної кислоти (1:1) і 5 см3
гліколієвого реагенту, ретельно перемішують. Після 30 хвилин експозиції вимірюють оптичну густину розчину фотоелектроколориметром, в кюветах l = 20 мм і світлофільтром с довжиною хвилі 364 нм. Досліджувана проба води с додаванням гліколєвого реагента, приготованого без BaCl2
, являється розчином порівняння. Вміст сульфатів находять по каліброваній кривій.
Для побудови каліброваної кривої в ряд мірних колб місткістю 50 см3
вносять 0,0; 0,1; 0,2; 0,4; 0,6; 0,8; 1,0; 1,2; 1,4; 1,6; 1,8; 2,0 см3
основного стандартного розчину K2
SO4
( 0,5 мг SO4
2-
в 1 см3
) і доводять об’єм до мітки дистильованою водою. Приготовані розчини містять: 0,0; 1,0; 2,0; 4,0; 6,0; 8,0; 10,0; 12,0; 14,0; 16,0; 18,0; 20 мг/дм3
SO4
2-
. Вимірюють по 5 см3
з кожного розчину у мірні циліндри місткістю 10 см3
( або в мірні колориметричні пробірки с відміткою 10 см3
).
В кожний циліндр з утвореним розчином додають 1 – 2 краплини соляної кислоти (1:1) і 5 см3
гліколєвого реагенту, ретельно перемішують, через 30 хвилин вимірюють оптичне поглинання, потім будують калібрований графік. Оптимальні інтервали концентрацій для турбидиметричного визначення сульфат – іона знаходиться в межах 2 – 25 мг/дм 3
. При концентрації SO4
2-
менше 2 мг/дм3
необхідно попередньо концентрування проби води упарюванням.
Для побудови каліброваного графіку беремо стандартні зразки з вмістом сульфату 0,5 мг/см 3
та готуємо з нього стандартні розведення та вимірюємо їх аналітичний сигнал.
3.2 Експеримент по визначенню сульфатів у стічній воді
3.2.1 Комплексонометричним методом аналізу
Виконуємо аналіз по визначенню сульфатів у стічній воді комплексонометоричним методом аналізу згідно з інструкцією описаною в розділі 3.1.1 „Методики визначення сульфатів у стічній воді комплексонометричним методом аналізу".
Таблиця 3.1 Об′єм MgCl2
який пішов на титрування розчину трилону Б
| № |
Vx
(досл.зр.) , см3
|
VTp
Б
, см3
|
VMgCl
2
(досл.зр.), см3
|
V MgCl2
(хол.), см3
|
| 1 |
2 |
3 |
4 |
5 |
| 1 |
100,00 |
6,00 |
0,3500 |
0,2 |
| 2 |
100,00 |
6,00 |
0,3500 |
| 3 |
100,00 |
6,00 |
0,3500 |
| 4 |
100,00 |
6,00 |
0,3550 |
| 5 |
100,00 |
6,00 |
0,3550 |
| 6 |
100,00 |
6,00 |
0,3500 |
| 7 |
100,00 |
6,00 |
0,3500 |
| 8 |
100,00 |
6,00 |
0,3550 |
| 9 |
100,00 |
6,00 |
0,3500 |
| 10 |
100,00 |
6,00 |
0,3500 |
3.2.2 Турбидиметричним методом аналізу
Виконуємо аналіз по визначенню сульфатів у стічній воді згідно з інструкцією описаною в розділі3.1.2 „Методики визначення сульфатів у стічній воді турбидиметричним методом аналізу".
Знімаємо аналітичні сигнали для стандартних зразків розчину стічної води та заносимо дані у таблицю 3.2
Таблиця 3.2 Аналітичні сигнали стандартних розчинів стічної води.
| № |
Vст.
, см3
|
Aст.
|
Ax
ол
|
Aст
– Aхол
|
| 1 |
2 |
3 |
4 |
5 |
| 1 |
1,40 |
208 |
8,00 |
200 |
| 2 |
1,60 |
383 |
375 |
| 3 |
1,80 |
488 |
480 |
| 4 |
2,00 |
593 |
585 |
| 5 |
2,20 |
658 |
650 |
| 6 |
2,40 |
718 |
710 |
| 7 |
2,60 |
778 |
770 |
| 8 |
2,80 |
808 |
800 |
| 9 |
3,00 |
833 |
825 |
| 10 |
3,20 |
848 |
840 |
Знімаємо аналітичні сигнали для досліджуваного зразку стічної води та заносимо дані у таблицю 3.3
Таблиця 3.3 Аналітичні сигнали досліджуваних зразків стічної води.
| № |
Vк
, см3
|
Vа
, см3
|
Ax
|
Aхол
|
Ax
-Aхол
|
| 1 |
2 |
3 |
4 |
5 |
6 |
| 1 |
2 |
3 |
4 |
5 |
6 |
| 1 |
10,00 |
5,00 |
658 |
8,00 |
650 |
| 2 |
10,00 |
5,00 |
663 |
655 |
| 3 |
10,00 |
5,00 |
663 |
655 |
| 4 |
10,00 |
5,00 |
673 |
665 |
| 5 |
10,00 |
5,00 |
668 |
660 |
| 6 |
10,00 |
5,00 |
658 |
650 |
| 7 |
10,00 |
5,00 |
653 |
645 |
| 8 |
10,00 |
5,00 |
678 |
670 |
| 9 |
10,00 |
5,00 |
663 |
655 |
| 10 |
10,00 |
5,00 |
658 |
650 |
3.3 Математична обробка отриманих результатів аналізу по визначенню сульфатів у стічній воді
3.3.1 Комплексонометричним методом аналізу
По результатам отриманим в розділі 3.2.1 розраховуємо вміст сульфатів у стічній воді за формулою:
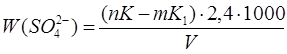 , ,
де: n – кількість доданого розчину трилону Б, см3
;
K–поправочний коефіцієнт до молярної концентрації еквівалентів розчину трилону Б;
m–кількість хлориду магнію, витраченого на титрування,см3
;
К1
– поправочний коефіцієнт до молярної концентрації еквівалентів розчину хлориду магнію;
V – об’єм досліджуємої води, взятий для визначення, см3
;
Дані для розрахунків берем із таблиці 3.1.
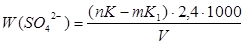
Проба 1:
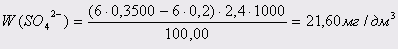
Проба 2:
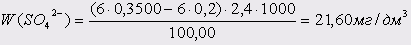
Проба 3:
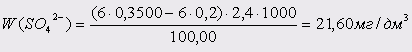
Проба 4:
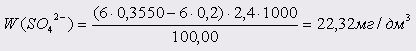
Проба 5:
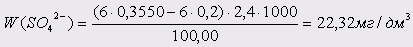
Проба 6:
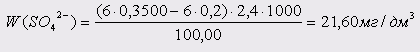
Проба 7:
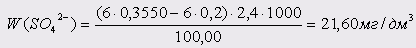
Проба 8:
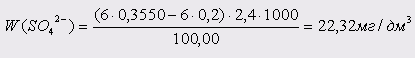
Проба 9:
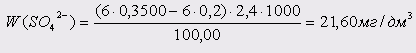
Проба 10:
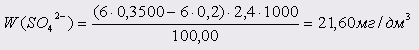
3.3.2 Турбидиметричним методом аналізу
По результатам отриманим в розділі 3.2.2 будуємо калібрований графік залежності Аст
(SO4
) – W (SO4
) див. рисунок 3.1. по каліброваному графіку знаходимо вміст сульфатів у стічній воді в досліджуваній пробі. Дані зводимо у таблицю 3.4.
Таблиця 3.4 Вміст сульфатів у стічній воді в досліджуваній пробі
| № |
Vк
, см3
|
Vа
, см3
|
Ax
|
Aхол
|
Ax
-Aхол
|
WSO
4
,мг/дм3
|
| 1 |
10,00 |
5,00 |
658 |
8,00 |
650 |
22,00 |
| 2 |
10,00 |
5,00 |
663 |
655 |
22,20 |
| 3 |
10,00 |
5,00 |
663 |
655 |
22,20 |
| 4 |
10,00 |
5,00 |
673 |
665 |
22,40 |
| 5 |
10,00 |
5,00 |
668 |
660 |
22,30 |
| 6 |
10,00 |
5,00 |
658 |
650 |
22,00 |
| 7 |
10,00 |
5,00 |
653 |
645 |
21,70 |
| 8 |
10,00 |
5,00 |
678 |
670 |
22,50 |
| 9 |
10,00 |
5,00 |
663 |
655 |
22,20 |
| 10 |
10,00 |
5,00 |
658 |
650 |
22,00 |
4. СТАТИСТИЧНО – МАТЕМАТИЧНА ОБРОБКА РЕЗУЛЬТАТІВ АНАЛІЗУ
Проводимо статистично – математичну обробку результатів аналізу отриманих двома методами. Отримані результати комплексонометричним методом аналізу позначимо як 1 – у вибірку, а отримані результати турбидиметричним методом аналізу позначимо як 2 – у вибірку. Результати заносимо до таблиці 4.1.
1 – а вибірка : ( 22,00 )3
, ( 22,20 )3
, 22,40, 22,30, 21,70, 22,50.
2 – а вибірка : ( 21,60 )7
, ( 22,32 )3
.
Таблиця 4.1 Отримані результати комплексонометричним методом аналізу
| n |
Xі
|
S 2
|
S |
n |
Хі
|
S2
|
S |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| 1 |
22,00 |
0,0025 |
0,0500 |
1 |
21,60 |
0,0052 |
0,0721 |
| 2 |
22,20 |
0,0003 |
0,0173 |
2 |
21,60 |
0,0052 |
0,0721 |
| 3 |
22,20 |
0,0003 |
0,0173 |
3 |
21,60 |
0,0052 |
0,0721 |
| 4 |
22,40 |
0,0069 |
0,0831 |
4 |
22,32 |
0,0282 |
0,1679 |
| 5 |
22,30 |
0,0025 |
0,0500 |
5 |
22,32 |
0,0282 |
0,1679 |
| 6 |
22,00 |
0,0025 |
0,0500 |
6 |
21,60 |
0,0052 |
0,0721 |
| 7 |
21,70 |
0,0225 |
0,1500 |
7 |
21,60 |
0,0052 |
0,0721 |
| 8 |
22,50 |
0,0136 |
0,1167 |
8 |
22,32 |
0,0282 |
0,1679 |
| 9 |
22,20 |
0,0003 |
0,0173 |
9 |
21,60 |
0,0052 |
0,0721 |
| 10 |
22,00 |
0,0025 |
0,0500 |
10 |
21,60 |
0,0052 |
0,0721 |
n = 10 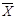 = 22,1500 S 2
= 0,0539±S = 0,2322 n = 10 = 22,1500 S 2
= 0,0539±S = 0,2322 n = 10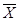 = 21,8160S 2
=0,1210 ±S = 0,3479±2S = 0,4644 ±2S = 0,6958 = 21,8160S 2
=0,1210 ±S = 0,3479±2S = 0,4644 ±2S = 0,6958
±3S = 0,6966 ±3S = 1,0437
1.Знаходимо середнє значення для даних вибірок за формулою 4.1:
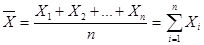 ( 4.1 ); ( 4.1 );
де 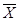 - середній результат; Х1
,Х2
, Хп
- величина досліджуваних речовин; n – кількість вимірів; Xi
– одинарний результат виміру. - середній результат; Х1
,Х2
, Хп
- величина досліджуваних речовин; n – кількість вимірів; Xi
– одинарний результат виміру.
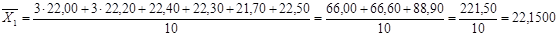
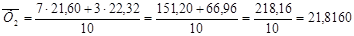
2. Знаходимо значення дисперсії ( S2
) за формулою 4.2:
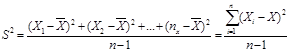 ( 4.2 ) ( 4.2 )
для 1 – ї вибірки:
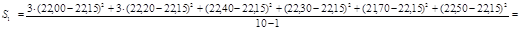
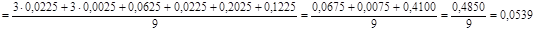
для 2 – ї вибірки:
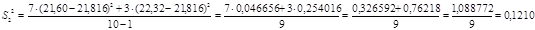
3. Знаходимо абсолютне стандартне відхилення за допомогою формули 4.3:
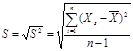 ( 4.3 ) ( 4.3 )
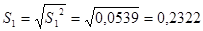
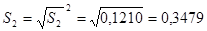
4. Знайдемо відтворюваність результатів зо допомогою формули (4.4):
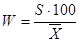 ( 4.4 ) ( 4.4 )
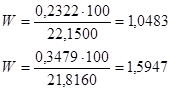
5. Знаходимо стандартне відхилення середнього результату ( довірчий інтервал ), за формулою 4.5 :
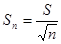 ( 4.5 )
( 4.5 )
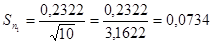
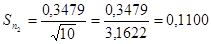
6. Знаходимо інтервал істинного значення за допомогою формули 4.6:
 ‹µ‹ ‹µ‹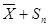 ( 4.6 ) ( 4.6 )
для 1 – ї вибірки:
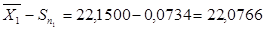
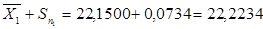
22,0766‹µ‹22,2234
µ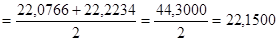
для 2 – ї вибірки:
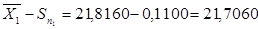
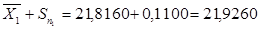
21,7060‹µ‹21,9260
µ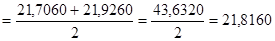
7. Знаходимо результати у межах довірчої вірогідності, що дорівнює :
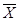 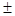 S; S;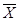 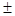 2S; 2S;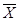 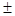 3S. 3S.
для 1 – ї вибірки:
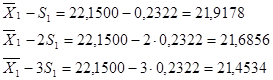
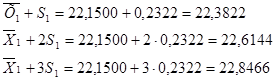
У даній вибірці результати дуже високої точності і вони знаходяться в діапазоні 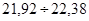 . Це результати: (22,00)3
; (22,20)3
; 22,30, що складає . Це результати: (22,00)3
; (22,20)3
; 22,30, що складає 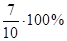 = 70 % . Результати достатньої точності знаходяться в межах = 70 % . Результати достатньої точності знаходяться в межах 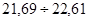 . Це результати: 21,70; 22,40; 22,50, що складають: . Це результати: 21,70; 22,40; 22,50, що складають: 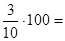 30 % вибірки. У зону сумнівної точності, що знаходиться в межах 30 % вибірки. У зону сумнівної точності, що знаходиться в межах 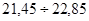 не підпадає ні один результат, тобто вибірка сумнівних значень не має. не підпадає ні один результат, тобто вибірка сумнівних значень не має.
для 2 – ї вибірки:
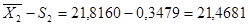 
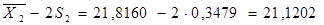
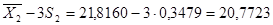
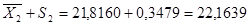
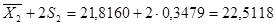
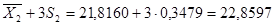
У даній вибірці результати дуже високої точності і вони знаходяться в діапазоні 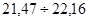 . Це результати (21,60)7
, що складають: . Це результати (21,60)7
, що складають: 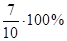 =70% вибірки. Результати достатньої точності знаходяться в межах =70% вибірки. Результати достатньої точності знаходяться в межах 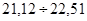 . Це результати (22,32)3
, що складають: . Це результати (22,32)3
, що складають: 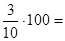 30 %. У зону сумнівної точності, що знаходиться в межах 30 %. У зону сумнівної точності, що знаходиться в межах 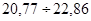 не підпадає ні один результат, тобто вибірка сумнівних значень не має. не підпадає ні один результат, тобто вибірка сумнівних значень не має.
8. Перевіряємо на сумнівність мінімальне і максимальне значення за допомогою формули 4.7 і 4.8 :
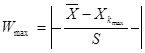 (4.7) (4.7) 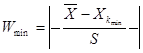 ( 4.8 ) ( 4.8 )
Для максимального значення у першій вибірці:
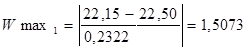
Згідно з таблицею „Ймовірність β появи 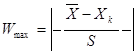 у ряду з п вимірів" отримане β = 1,5073 відповідає значенню, для кількості вимірів п=10, β=2,23=0,1, це свідчить про те, що β ‹ 0,1 – сумнівне значення не являється промахом і ми його залишаємо. у ряду з п вимірів" отримане β = 1,5073 відповідає значенню, для кількості вимірів п=10, β=2,23=0,1, це свідчить про те, що β ‹ 0,1 – сумнівне значення не являється промахом і ми його залишаємо.
Для мінімального значення у першій вибірці:
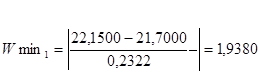
Згідно з таблицею „Ймовірність β появи 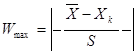 у ряду з п вимірів" отримане β = 1,9380 відповідає значенню, для кількості вимірів п=10, β=2,23=0,1, це свідчить про те, що β ‹ 0,1 – сумнівне значення не являється промахом і ми його залишаємо. у ряду з п вимірів" отримане β = 1,9380 відповідає значенню, для кількості вимірів п=10, β=2,23=0,1, це свідчить про те, що β ‹ 0,1 – сумнівне значення не являється промахом і ми його залишаємо.
Для максимального значення у другій вибірці:
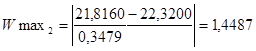
Згідно з таблицею „Ймовірність β появи 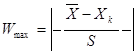 у ряду з п вимірів" отримане β = 1,4487 відповідає значенню, для кількості вимірів п=10, β=2,23=0,1, це свідчить про те, що β ‹ 0,1 – сумнівне значення не являється промахом і ми його залишаємо. у ряду з п вимірів" отримане β = 1,4487 відповідає значенню, для кількості вимірів п=10, β=2,23=0,1, це свідчить про те, що β ‹ 0,1 – сумнівне значення не являється промахом і ми його залишаємо.
Для мінімального значення у другій вибірці:
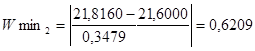
Згідно з таблицею „Ймовірність β появи 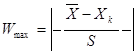 у ряду з п вимірів" отримане β = 0,6209 відповідає значенню, для кількості вимірів п=10, β=2,23=0,1, це свідчить про те, що β ‹ 0,1 – сумнівне значення не являється промахом і ми його залишаємо. у ряду з п вимірів" отримане β = 0,6209 відповідає значенню, для кількості вимірів п=10, β=2,23=0,1, це свідчить про те, що β ‹ 0,1 – сумнівне значення не являється промахом і ми його залишаємо.
9. Розраховуємо вірогідну похибку аналізу за допомогою формули ( 4.9 ):
ξ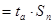 ( 4.9 ), ( 4.9 ),
де ξ – вірогідна похибка аналізу;
tа
– довідкова величина.
для 1 – ї вибірки:
К = п – 1 = 10 – 1 = 9 а = 95 % tа
= 2,2620
ξ1
= 2,2620 ·0,0734 = 0,1660
для 2 – ї вибірки:
К = п – 1 = 10 – 1 = 9 а = 95 % tа
= 2,2620
ξ2
= 2,2620 ·0,1100 = 0,2488
10. Знаходимо вірогідний результат вимірів і за допомогою формули 4.10:
R= 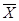 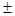 ξ( 4.10 ) ξ( 4.10 )
R1
= 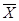 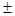 ξ= 22,1500 ± 0,1660 ξ= 22,1500 ± 0,1660
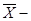 ξ = 22,1500 - 0,1660 = 21,9840 ξ = 22,1500 - 0,1660 = 21,9840 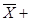 ξ = 22,1500 + 0,1660 = 22,3160 ξ = 22,1500 + 0,1660 = 22,3160
У першій вибірці вірогідний результат вимірів знаходиться у межах 21,9840 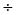 22,3160 22,3160
R2
= 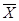 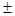 ξ= 21,8160 ± 0,2488 ξ= 21,8160 ± 0,2488
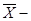 ξ = 21,8160 - 0,2488 = 21,5672 ξ = 21,8160 - 0,2488 = 21,5672 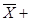 ξ = 21,8160 + 0,2488 = 22,0648 ξ = 21,8160 + 0,2488 = 22,0648
У другій вибірці вірогідний результат вимірів знаходиться у межах 21,5672 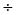 22,0648 22,0648
10. Знаходимо збіжність результатів аналізу, за допомогою формули 4.11:
P = 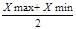 (4.11 ) (4.11 )
P1
=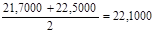
P2
=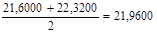
Дані проведеної статистично – математичної обробки результатів аналізу заносимо до таблиці 4.2.
Таблиця 4.2 Метрологічні характеристики визначення вмісту сульфатів у стічній воді комплексонометричним (1 – а вибірка) та турбидиметричним методами аналізу (2 – а вибірка).
| Назва метрологічної характеристики |
Позначення |
1 – а вибірка |
2 – а вибірка |
| 1.Кількість визначень |
n |
10 |
10 |
| 2 .Середній результат вимірів |
X |
22,1500 |
21,8160 |
| 3. Збіжність результатів |
P |
22,1000 |
21,9600 |
| 4. Дисперсія результатів |
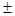 S 2 S 2
|
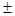 0,0539 0,0539 |
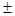 0,1210 0,1210 |
| 5.Відтворюваність результатів |
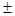 W W |
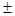 1,047 1,047 |
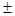 1,600 1,600 |
| 6. Похибка вимірів |
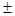 ζ ζ |
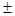 0,1660 0,1660 |
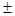 0,2488 0,2488 |
| 7. Вірогідний результат вимірів |
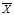 ±ξ ±ξ |
22,1500 ± 0,1660 |
21,8160 ± 0,2488 |
Висновок: Проводячи визначення вмісту сульфатів у стічних водах методами комплексонометріі та турбидиметрії я виявила, що метод комплексонометрії більш точний, ніж метод турбидиметрії так як у нього краща збіжність і відтворюваність результатів і менша вірогідна похибка аналізу. Згідно з проведеною статистично – математичною обробкою результатів аналізу ми виявили, що ні один результат з двох методів не являється сумнівним результатом, так як жоден результат аналізу отриманий двома методами не підпадає в інтервал 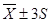 , а це свідчить про правильність проведення аналізу та досить точні результати. Переваги комплексонометричного методу полягають у тому, що утворюється міцний комплекс і робочі розчини, що використовують при аналізі більш стійкі, ніж у турбидиметрії. Недоліками турбидиметричного методу аналізу являється те, що важко одержати однакові по розмірах частки суспензії, осади повинні мати дуже малу розчинність. Отримання правильних результатів у турбидиметричному методі аналізу залежить від: порядку змішання реактивів, швидкості перемішування розчинів, часу отримання дисперсної системи, співвідношення концентрації осаджуваної речовини і осаджувача, температури, а також зміна струму в мережі дає помилку при вимірюванні аналітичного сигналу, що призводить до недостатньо точних результатів. Турбидиметричні методи заміняють, коли це можливо, іншими методами. , а це свідчить про правильність проведення аналізу та досить точні результати. Переваги комплексонометричного методу полягають у тому, що утворюється міцний комплекс і робочі розчини, що використовують при аналізі більш стійкі, ніж у турбидиметрії. Недоліками турбидиметричного методу аналізу являється те, що важко одержати однакові по розмірах частки суспензії, осади повинні мати дуже малу розчинність. Отримання правильних результатів у турбидиметричному методі аналізу залежить від: порядку змішання реактивів, швидкості перемішування розчинів, часу отримання дисперсної системи, співвідношення концентрації осаджуваної речовини і осаджувача, температури, а також зміна струму в мережі дає помилку при вимірюванні аналітичного сигналу, що призводить до недостатньо точних результатів. Турбидиметричні методи заміняють, коли це можливо, іншими методами.
5. ТЕХНІКА БЕЗПЕКИ ТА ОХОРОНА НАВКОЛИШНЬОГО СЕРЕДОВИЩА
5.1 Загальні вимоги техніки безпеки у хімічній лабораторії
Дійсна інструкція розроблена у відповідності з вимогами нормативних актів про охорону праці і є обов’язковою до виконання лаборантами хімічного аналізу контрольної групи.
До роботи лаборанта хімічного аналізу контрольної групи допускаються особи не молодше 18 років, які пройшли медичний огляд, і які отримали інструктаж, перевірку знань з професії і з питань охорони праці.
Особи, які допущені до роботи лаборанта хімічного аналізу контрольної групи забов′язані:
- виконувати обов’язки по охороні праці, які передбачені колективним договором, правилами внутрішнього трудового розпорядку комбінату, іншими нормативними актами з охорони праці і пожежної безпеки;
- на роботу з’являтись в установлений час, відпочившими. Хворі або особи, які знаходяться у нетверезому стані до роботи не допускаються і повинні бути направлені до медпункту для засвідчення про стан здоров′я;
- перед початком роботи оглянути своє робоче місце, перевірити справність обладнання. Якщо виявлені пошкодження, потрібно прийняти міри по їх усуненню. Якщо самостійно не можливо усунути несправність, потрібно звернутись до керівника;
- не виконувати роботу, якщо умови її проведення протирічать з вимогами інструкцій, інших нормативних актів охорони праці і пожежній безпеці;
Утримувати своє робоче місце, обладнання, пристрої та інструменти в чистому і справному стані. Забезпечити зберігання пристроїв, інструментів і засобів захисту в спеціально відведених місцях.
Працювати на несправному обладнанні, а також використовувати несправні прилади забороняється.
При русі по території комбінату користуватись пішохідними переходами і тротуарами, тримаючись правої сторони, а де їх не має – по лівій стороні, назустріч транспорту.
Лаборант хімічного аналізу контрольної групи повинен працювати в спеціальному спецодязі, виданому по нормам для даної професії. На території дозволяється ходити тільки у взутті, закріпленому на ногах, волосся закріплюють під головний убір.
Працюючи з отруйними, сильнодіючими, вибухонебезпечними та пожежонебезпечними речовинами працівники повинні дотримуватися інструкції по техніці безпеки.
До основних і небезпечних факторів при роботі з сильнодіючими речовинами відносяться: речовини, які володіють найбільшою токсичністю (оксид вуглецю, аміак, бензол, толуол, ксилол, фенол, сірковуглець, сірководень, нафталін).
Із хімічних реактивів основну небезпеку складають:
- азотна кислота – викликає сильні опіки на шкірі. В ряді реакцій з азотною кислотою виділяється отруйний азот;
- їдкий натрій – викликає появу роз’їдання шкіри;
- ртуть – в пароподібному стані, викликає сильний розлад нервової системи, випадання зубів;
- сірчана кислота – при потраплянні на шкіру залишає сильні опіки, велике пошкодження шкіряного покрову, може призвести до смерті;
- ацетон – подразнює верхні дихальні шляхи;
- чотирьох хлористий вуглець – наркотик.
Припустимі концентрації шкідливих речовин у повітрі і робочій зоні приведені в таблиці 4.1.1 (дивись таблицю 4.1.1)
Таблиця 5.1.1 Припустимі концентрації шкідливих речовин у повітрі і робочій зоні.
| Назви |
Мг/л |
Мг/м3
|
Аміак
Бензол
Піридин
Нафталін
Пари сірчаної кислоти
Толуол
Ксилол
Пари ртуті
Пари йоду
Ацетон
|
0,02
0,005
0,005
0,02
0,001
0,05
0,05
0,00001
0,001
0,2
|
20
5
5
20
1
50
50
0,01
1
200
|
Зберігати концентровані кислоти і луги, а також інші сильнодіючі речовини потрібно під витяжною шафою.
Забороняється викид в каналізаційну систему стоків легкозаймистих і горючих рідин, а також матеріали, які при взаємодії з водою виділяють вибухопожежонебезпечні гази ( карбід кальцію, негашений вапняк і інші ).
Особи, які працюють з сильнодіючими речовинами повинні знати закон України „Про оберт в Україні наркотичних засобів, психотропних речовин, їх аналогів і прекурсорів" список 2 IV
Приймати їжу необхідно в спеціально відведених місцях з дотриманням мір безпеки при користуванні столовими приборами і посудом.
5.2 Протипожежні заходи безпеки
Загальне положення:
Відповідальність за протипожежний стан приміщеннь кабінетів, матеріальних комор накладається персонально на керівника центральної лабораторії. Прізвища відповідальних за протипожежний стан повинні бути написані на спеціальних табличках, які розміщенні на видних місцях.
Всім працівникам при прийнятті на роботу і щорічно по місцю роботи проводиться первинний і вторинний інструктаж по пожежній безпеці відповідно.
Відповідальність за проведення якісного і своєчасного інструктажу працівникам центральної лабораторії, а також за проведення всієї масово пояснювальної роботи в лабораторії покладено на особи які відповідають за протипожежний стан.
Відповідальні за протипожежний стан повинні:
- забезпечити виконання на довірених їм дільницях встановленого протипожежного режиму;
- забезпечити справний стан та постійну готовність до дії засобів пожежегасіння;
- слідкувати за справністю електроустановок, вентиляції, опалення, технічного обладнання, приймати міри до негайного усунення, які можуть призвести до пожежі або вибуху;
- забезпечити регулярне прибирання робочих місць і приміщень;
- під час проведення ремонтних робіт стороннім організаціям забезпечити постійний нагляд за виконанням мір пожежної безпеки, не допускати проведення робіт з застосуванням відкритого полум’я без наявності наряд – допуску на проведення таких робіт і узгоджених з пожежною охороною.
Первинні засоби пожежегасіння:
- будівлі, споруди, приміщення і технологічні установки повинні бути забезпечені первинними засобами пожежегасіння: вогнегасниками, ящиками з піском, бочками з водою, ковдрами з негорючою теплоізоляційного полотна, войлока, пожежними відрами, совками, лопатами, пожежним інструментом, які використовуються для локалізації пожеж в їх початковій стадії розвитку;
- вогнегасники слід встановити в легко досяжних місцях, а також в пожежо небезпечних місцях, де найбільш вірогідна поява осередків пожежі. При цьому необхідно забезпечити їх захист від потрапляння прямих сонячних промінів і безпосередньої дії опалювальних і нагрівальних приладів;
- вогнегасники, які розміщенні поза приміщенням або в неопалювальних приміщеннях і не призначені для експлуатації при від’ємних температурах підлягають утриманню в найближчих приміщеннях з температурою вище +50
С, на стендах повинна висіти інформація про його найближче знаходження;
- використані вогнегасники, а також вогнегасники з зірваними пломбами необхідно негайно направляти на перевірку;
- на перезарядку з об’єкта дозволяється відправляти не більш як 50% вогнегасників з їх загальної кількості;
Матеріальні склади:
При зберіганні в складах різних речовин і матеріалів повинно враховуватись їх пожежонебезпечні фізико – хімічні властивості, сумісність, а також ознаки однорідності речовин, які застосовуються для гасіння пожежі.
В складах, які розміщенні в будівлях різного ступеню вогнестійкості, дозволяється використовувати стелажі з горючих матеріалів висотою не більше 3 м3
, забезпеченням проходу між стінами із стелажами шириною не менше 1м. Конструкції стелажів висотою більше 3м повинні виконуватись з негорючих матеріалів.
В складах конторські і побутові приміщення повинні бути обладнанні протипожежними перегородками першого типу і перекриттями третього типу і мати один з евакуаційних виходів назовні.
В складах не дозволяється:
- стоянка і ремонт завантажувально – розвантажувальних і транспортних засобів;
- експлуатація газових плит, печей, побутових електронагрівальних приладів, установок з метою штепсельних розеток;
- зберігання продукції в притулок до приладів і труб опалення;
- зберігання аерозольних пакунків в одному приміщенні з окисниками, горючими газами, ЛЗР і ГР;
- зберігання кислот в місцях, де можливе їх зіткнення з деревиною і іншими речовинами органічного походження.
Приміщення з ПК:
Користувачі персональних ЕОМ повинні дотримуватись всіх заходів пожежної безпеки, визначених даною інструкцією, а також вказаних в технічній документації заходів –виробників ПЕОМ.
ПЕОМ після закінчення роботи на них повинні вимикатися з мережі.
Приміщення з ПЕОМ повинні бути оснащенні вогнегасниками типу ОУ.
Не дозволяється:
- розмішувати машинні золи ПЕОМ в підвалах;
- виконувати роботи по ремонту блоків ЕОМ у машинному золі.
Лабораторія:
В кожному окремому приміщенні лабораторії відповідальним за протипожежну безпеку є співробітник, призначений розпорядженням керівника лабораторії.
Співробітники лабораторії забов′язані знати пожежну безпеку речовин і матеріалів при роботі з ними.
Речовини і матеріали в лабораторії повинні зберігатися суворо по асортименту. Не дозволяється зберігання речовин хімічна взаємодія яких може викликати пожежу або вибух.
Лабораторні меблі і обладнання повинні зберігатися так, щоб не заважали при евакуації людей. Ширина мінімально припустимих проходів між обладнанням повинна бути не менше 1м.
Витяжна вентиляція у всіх приміщеннях лабораторії повинна працювати весь день і вимикатися після роботи. Не можна працювати в лабораторії коли вона не працює.
Підлога в лабораторії повинна бути з негорючих матеріалів, які не вбирають в себе рідини, з якими працюють.
Балони зі зжатими і розчинними горючими газами встановлюються зовні будівлі лабораторії в металевих шафах. Шафи повинні мати прорізи або жалюзійні решітки, щоб провітрювати.
В лабораторіях дозволяється використовувати балони тільки з інертними газами ( азот, вугільна кислота ). Не дозволяється працювати з несправними балонами.
Не дозволяється зберігання рідкого повітря і кисню в одному приміщенні з ЛСР та ГР, жирами та оливами.
Лужні метали зберігаються в зневодненому керосині або оливах без доступу повітря в товстостінному посуді. Склянки з лужними металами розміщуються в металевих литках ретельно закритими, стінки і дно вкриті азбестом.
Штепселі і вимикачі нагрівальних приладів повинні бути розміщенні зовні витяжних шаф.
Скляний посуд з кислотами, лугами і іншими їдкими речовинами дозволяється переносити в спеціальних металевих або дерев’яних лотках, викладених азбестом. Для сірчаної і азотної кислот використання дерев’яних лотків, корзин і опилок дозволяється при умові їх обробки вогнезахисними засобами. Концентровану азотну кислоту забороняється розливати в скляну тару.
Легкозаймисті і горючі речовини, кислотні луги, проби газу і так далі, повинні зберігатися в окремих від інших приміщень стіною з межою вогнестійкості не менше 0,75 год з виходом в коридор.
Роботи пов’язані з нагріванням ЛЗР і ГР, проводяться під постійним наглядом працівника. Їх кількість в лабораторії не повинна перевищувати денної потреби, зберігати в металевих шафах, герметичній тарі з щільно закритими кришками.
Робочі поверхні столів, стелажів, витяжних шаф, повинні мати негорюче покриття, з матеріалів, стійких до дії речовин, з якими працюють.
Підігрів смол, нафтопродуктів на водяній бані.
Штепселі і вимикачі нагрівальних приладів повинні бути розміщенні зовні витяжних шаф.
Порядок дії при пожежі:
При виявленні пожежі працівник забов′язаний:
- негайно повідомити по телефону пожежну охорону підприємства. При цьому необхідно повідомити адресу об’єкту, кількість поверхів будівлі, місце виникнення пожежі, обставин під час пожежі, наявність людей, а також повідомити своє прізвище;
- прийняти заходи до евакуації людей, гасіння пожежі первинними
засобами пожежегасіння та зберігання матеріальних цінностей;
- повідомити про пожежу керівництво цеху;
- при необхідності викликати інші аварійно – рятувальні служби.
Посадова особа об’єкту, що прибула на місце пожежі забов′язана:
- перевірити, чи викликана пожежна охорона, поставити до відома керівництво підприємства;
- у випадку загрози життю людей, негайно організувати їх порятунок, використовуючи для цього сили і засоби;
- вивести за межі небезпечної зони всіх працівників, не пов’язаних з ліквідацією пожежі;
- провести при необхідності вимкнення електроенергії, зупинку транспортних засобів, агрегатів, апаратів, перекриття парів ті водних комунікацій, зупинка систем вентиляції в аварійному та сумісних з ним переміщень та виконати інші заходи, які сприяють запобіганню виникнення пожежі;
- організувати зустріч підрозділів пожежної охорони, надати їм допомогу при виборі найкоротшого шляху для під’їзду до осередку пожежі та підключенні водопостачання;
- одночасно з гасінням пожежі організувати евакуацію і захист матеріальних цінностей, забезпечити дотримання технічної безпеки робітниками, які приймають участь у гасінні.
Дії на випадок пожежі змінного персоналу:
а)змінний інженер керує роботою зміни, знеструмлює ділянку осередку пожежі;
- в загальній кімнаті – відключення загального рубильнику на 3ЩУ, який знаходиться зліва других дверей кімнати;
- в хімпробній – шляхом відключення загального рубильнику 1ЩУ зліва хімпробної, потім викликають пожежну охорону;
б) до прибуття пожежної охорони:
- лаборант по хімії працює зі стволом внутрішнього пожежного крану;
- лаборант по технічному аналізу працює з вогнегасником ОУ – 5;
- лаборант по роботі з сіркою засипає осередок пожежі піском.
У випадку виникнення пожежі в денний час, відповідальні за протипожежну безпеку знеструмлюють:
- кімнати нафтопродуктів, препараторської та дослідницької лабораторії шляхом відключення загального рубильнику;
- методична – загальним рубильником 4ЩУ;
- пластометрична – загальним рубильником 5ЩУ першого поверху, який зліва від дверей і викликає пожежну охорону.
Знеструмлювання всієї лабораторії здійснюється автоматом вводу, який знаходиться в шафі управління електрощитової кімнати на першому поверсі знаходиться в загальній кімнаті на дошці.
По прибутті, на пожежу, пожежної охорони, представник підрозділу, який керує гасінням пожежі, забовя′заний повідомити старшому начальнику пожежної охорони, усі відомості про осередок пожежі, заходи, які приймаються по його ліквідації і евакуації людей, а також про наявність людей зайнятих на ліквідації пожежі.
При прибутті пожежних підрозділів повинен бути забезпечений безперешкодний доступ їх на територію об’єкту.
Після прибуття пожежного підрозділу адміністрація і технічний персонал споруди або будівлі забов′язані приймати участь в консультації керівника гасіння про конструктивні та технологічні особливості об’єкту, де виникла пожежа.
5.3 Міри безпеки при роботі з електричним струмом
Електробезпека – система організаційних та технічних заходів і засобів, які забезпечують захист людей від шкідливої і небезпечної дії електричного струму, електричної дуги, електромагнітні поля та статичної електрики.
Статична електрика – це сукупність явищ, пов’язаних з виникнення, зберіганням та релаксацією вільного електричного заряду на поверхні і в об’ємі діелектричних і напівпровідникових речовин, матеріалів, виборів або на ізольованих провідниках.
Електротравма – травма, викликана дією електричного струму або електричної дуги.
Електротравматизм – явище, яке характеризує сукупність електротравм.
Електроустановка – установка, в якій виробляється, перетворюється, передається, розподіляється, споживається електрична енергія.
Діюча електроустановка – електроустановка або її ділянка, яка знаходиться під напругою, або на яку напруга може бути подана вмиканням коммутаційних апаратів.
Заземлюючий устрій – сукупність заземлювача та заземлюючих провідників.
Заземлюючий провідник – провідник, який з’єднує заземлені частини з заземлювачем.
Засоби електрозахисту – переносні та перевозні вироби, які служать для захисту людей, які працюють з електроустановками від ураження електричним струмом, дії електричної дуги та електромагнітного поля.
Засоби електрозахисту бувають:
- основні
- допоміжні
До електрозахисних засобів відносяться:
- ізолюючі штани, ізолюючі та електровимірні клещі, показники напруги для фазіровки;
- ізолюючі устрої та прилади для ремонтних робіт під напругою вище 1000 В та слюсарно – монтажний інструмент з ізолюючими рукоятками для роботи в електроустановках напругою до 1000 В;
- діелектричні рукавички, калоші, ковдри, ізолюючі накладки і підставки, боти;
- індивідуальні екрануючі комплекти;
- переносні заземлення;
- відгороджуючи устрої та діелектричні ковпаки;
- плакати та знаки безпеки.
Крокова напруга – напруга між 2 точками поверхні землі в зоні
замикання фази на землю, які відстають один від одного на відстань одного кроку ( 0,8м ). Найбільшу величину крокова напруга має поблизу від місця замикання вона практично не являється небезпечною.
Сила струму – це направлений рух заряджених часток від більшого потенціалу до меншого через провідник.
Напруга – це різниця потенціалів ( при з’єднанні потенціалів іде струм між 2 точками електромережі небезпечна напруга більше 42В, небезпечний струм більше 5мА, смертельний струм 0,1А ).
Вимоги до працівників працюючих з електроустановками:
1. до роботи не допускаються працівники молодші 18 років;
2. працівники, які пройшли медичний огляд;
3. до роботи допускаються працівники,які пройшли теоретичну підготовку і які здали екзамен і мають посвідчення по другій групі електробезпеки. Елементарні вимоги до працівників: знати де вмикаються і вимикаються електроустановки, так як перша дія при ураженні електричним струмом – вимкнення напруги. Невелике проходження струму через людину супроводжується скороченням м’яз.
5.4 Заходи під час нещасних випадків
Лаборант хімічного аналізу по хімпродукції повинен швидко орієнтуватись у всіх аварійних ситуаціях, надавати першу медичну допомогу на місці аварії до прибуття медпрацівників.
Перша медична допомога – це комплекс заходів, скерованих на відновлення, збереження життя та здоров′я потерпілого, здійснюваних не медичними працівниками ( взаємодопомога ) або самим потерпілим (самодопомога)
При виникненні аварійної ситуації лаборант хімічного аналізу повинен дотримуватися слідуючих вимог:
- прийняти заходи для забезпечення безпеки людей ( вивести людей із аварійної зони ).
- при виникненні пожежі негайно подзвоніть в чергову пожежну частину, повідомити адміністрацію цеху та приступити до гасіння пожежі підручними засобами (вогнегасники, вода, пісок).
- при загазованості приміщення негайно викликають чергових газорятувальників по телефону, посилити природну вентиляцію відчинивши вікна і двері.
Перша допомога при опіках кислотами і лугами:
- при потраплянні кислот, лугів на руки або обличчя необхідно швидко видалити ватним тампоном рідину, промити уражене місце великою кількістю води і обробити нейтралізуючими речовинами. При опіках кислотами в якості нейтралізатора використовують 2 % розчин карбонату амонію або бікарбонату натрію, при опіках лугами – 2 % розчин оцтової кислоти або 1 % розчин соляної кислоти.
- при потраплянні їдкого лугу в очі або порожнину роту необхідно промити уражене місце 2% розчином борної кислоти;
- при опіках бромом його слід швидко змити з поверхні шкіри декількома порціями етилового спирту і потім замазати уражене місце маззю від опіків.
Перша допомога при отруєнні газом:
- винести потерпілого на повітря;
- при послабленні дихання зробити штучне дихання.
Перша допомога при отруєнні хімічними речовинами:
- азотною кислотою або оксидами азоту – давати пити молоко, яєчний білок;
- соляною кислотою – винести потерпілого на повітря, давати вдихати пари аміаку;
- аміаком – винести потерпілого на повітря;
- солями важких металів ( міді, барію, свинцю, ртуті ) – давати в великій кількості яєчні білки і молоко.
Перша допомога при пораненнях:
- необхідно, як можна швидше зупинити кровотечу і перев’язати рану. Для перев’язки використовувати бинт, перев’язочний пакет, джгут або шматок матерії, які повинні бути обов’язково чистими, щоб не визвати зараження крові. При відсутності чистого перев’язочного матеріалу рану краще залишити відкритою;
- при незначних ударах, необхідно на забите місце покласти пов’язку змочену в холодній воді, переложену льодом або снігом;
- при важливих зовнішніх ударах, особливо при ударах внутрішніх органів, необхідна якомога швидше викликати лікаря або ж негайно доставити потерпілого на носилках до найближчого медпункту.
При переломах на місці подій викликати лікаря, до прибуття
лікаря слід негайно покласти потерпілого надавши зламаній кінцівці повну нерухомість наклавши пов’язку з шиною. В якості шин застосовують палки, фанери, картон та інше.
При термічних опіках необхідно обережно зняти з потерпілого одяг і взуття ( краще розрізати ). Не можна торкатися руками обпечених ділянок шкіри або змазувати мазями, розчинами або йодом. Обпечену поверхню перев’язати як будь яку рану, покрити стерильним матеріалом, а з верху накласти шар вати і все закріпити бинтом.
При опіках очей електричною дугою слід робити холодні примочки із розчину борної кислоти.
Перша допомога при кровотечах:
- зовнішні артеріальні кровотечі ( кров червоного кольору, витікає пульсуючою струєю, товчками ). Накладають жгут та найближчу до тулубу частину плеча або стегна вище місця поранення, при чому обов’язково на тканину або одяг. Перший виток роблять особливо тугим, а послідуючі три поступово послаблюють так, щоб між ними незащімлювалася шкіра. Після зупинення кровотечі затягувати джгут далі не треба. Необхідно пам’ятати, що накладений джгут не можна тримати більше 1,5 – 2 годин. Через одну годину накладений жгут слід зняти, щоб забезпечити приток крові до кінцівки, через 5 – 10 хвилин накласти знову, якщо кровотечу не зупинено;
- при венозній кровотечі ( кров темно – червоного кольору, витікає безперервно ) необхідно пам’ятати, що в уражену рану може потрапити повітря бульбашки якого в потоці крові може привести до закупорення судин та миттєвої смерті. Місце навколо рани необхідно обробляти йодом, спиртом, одеколоном.
При обмороженнях різних частин тіла (обличчя, рук, ніг) необхідно розтерти уражене місце шерстяними виробами або виробами із сукна до почервоніння, потім змазати їх жиром і перев’язати.
При тепловому або сонячному ударі необхідно вивести потерпілого на свіже повітря, змочити голову холодною водою.
5.5 Гігієна праці лаборанта
Гігієнічним нормуванням називають суворо визначений діапазон параметрів фактора середовища, який є оптимальним або принайні не є небезпечним з точки зору збереження нормальної життєдіяльності і здоров’я людини, людської популяції і майбутніх поколінь.
До об’єктів гігієнічного нормування належать гранично допустима для людського організму концентрації ( ГДК ) шкідливих хімічних домішок у повітрі, воді, ґрунті, продуктів харчування, граничні допустимі рівні ( ГДР ) і дози ( ГДР ) шкідливих фізичних факторів середовища антропогенного походження, зокрема шуму, вібрації, тощо, оптимальні і допустимі параметри мікроклімату і оптимальний і допустимий склад добового раціону і питної води.
Вентиляція хімічних цехів. Умови праці в хімічних цехах коксохімічних заводів характеризується більшою або меншою загазованістю повітря робочих місць летучими продуктами виробництва ( газами і парами ) і надлишковим теплом, виділюваним апаратурою і комунікацією.
Технологічне устаткування хімічних цехів у даний час розміщують в основному поза будинками; у будинках залишають тільки насоси, газодувки, енергетичні установки, центрифуги і преси смолорозгінного цеху, а також устаткування відділень по виробленню чистих продуктів з напівфабрикатів, що знижує ступінь загазованості і нагрівання повітря робочих місць і досить сприятливо відбивається на умовах праці.
Щоб розв’язати проблему чистого повітря необхідно допомогтись знешкодження викидних газів розпушників, вентиляції і витяжок або виведення їх у більш високі шари атмосфери ( на 40 – 60 м від рівня землі ) за допомогою спеціальних труб, установлених для окремих дільниць на виробництві.
Освітленість. Нормами освітленості встановлюються мінімально припустимі величини освітлюваності на робочих поверхнях і проходах.
У даний час норми природного і штучного освітлення для промислових підприємств визначаються „Будівельними нормами і правилами" БНІП 11 – 4 – 79, що поширюються на проектування освітлювальних установок і промислових підприємств, а також відкритих просторів для коксохімічного виробництва.
У нових нормах передбачається більш точна класифікація здорових робіт і встановлюються більш високі норми освітленості в порівнянні з діючими нині нормами.
Існують наступні види освітлення: робоче, аварійне та евакуаційне.
Робоче освітлення має забезпечувати освітленість на робочих поверхнях не нижче нормативного. Аварійне освітлення має забезпечувати освітленість на робочих місцях не менше 5 % від норми. Евакуаційне освітлення має забезпечувати освітленість на підлозі основних проходів, на землі і на сходинках. Лаборант хімічного аналізу в лабораторії повинен знаходитись в спецодязі, використовувати засоби індивідуального захисту(окуляри, рукавиці) при роботі зі шкідливими речовинами.
5.6 Охорона природи та навколишнього середовища
Коксохімічне виробництво являється значним джерелом забруднення повітряного басейну пилом, газами та різноманітними хімічними речовинами. Основна кількість викидів на коксохімічному виробництві спостерігається у коксових цехах при завантаженні вугільної шихти в піч та при видачі коксу із печі. У вуглепідготовчому цеху відбуваються викиди у атмосферу вугільного пилу. Вони складають, по деяким даним 300 – 500 г на однку тону коксу. При завантаженні у камери коксових печей вугільної шихти, в атмосферу викидається 165 – 180 м3
різних газів на тону коксу.
Розподіл викидів забруднюючих речовин по цехам коксохімічного виробництва зображені у таблиці 5.1. В умовах виробництва, також, виділення пилу пов’язано із процесу прийомки, складування прибуваючого вугілля, транспортування, подрібнення готової шихти. Вміст вугільного пилу у приміщеннях вуглепідготовчого цеху не повинен перевищувати 10 мг / м3
. Основний компонент вугілля, що входить до складу шихти, вуглець (76,0 – 95,0 % ) пройшов державну реєстрацію, як небезпечний фактор і зареєстрований в установленому порядку. Вугільний пил є також вибухонебезпечним. При його вмісті 1г/м3
може виникнути вибух. Розподіл викидів забруднюючих речовин по цехам коксохімічного виробництва представлена у схемі 5.1.
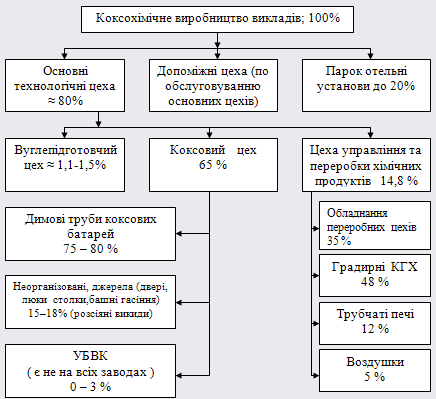
Схема 5.1 Розподіл викидів забруднюючих речовин по цехам коксохімічного виробництва
З метою скорочення викидів пилу у атмосферу, у всіх точках пилоутворення використовуються механічне і мокре очищення . Для уловлювання пилу використовують циклони, мультициклони та електрофільтри. Ефективним засобом забезпечення зниження запилення повітря є вентиляція. До системи вентиляції входять циклони, які виключають викиди пилу у атмосферу. По ступеню впливу на організм людини пил шихти відноситься до 4 класу небезпеки. Стан повітря робочої зони по вмісту у ньому вугільного пилу у процесі збагачення, шихтовки, подрібнення, відбору проб слід постійно контролювати. Точки відбору проб повинні бути узгоджені з місцевими органами санепідемслужби. Періодичність контролю – не менш 1 разу у квартал.
Охорона навколишнього природного середовища при виробництві шихти і проміжного продукту повинна передбачати очищення викидів від пилу, а використання перерахованих заходів дозволяє звести до мінімуму викиди пилу до шкідливих речовин.
ПЕРЕЛІК ПОСИЛАНЬ
1. Бачинський І.О., Беренда Н.В., Бондаренко В.Д. Основи соціоекології, К.: Вища шк., - 1995 – 238 с.
2. Борисова О.М., Сальников В.Д., Химические и физические методыанализа – М., Металлургия, - 1991 – 269 с.
3. Шапиро С.А., Шапиро М.А., Аналитическая химия: Учебник длятехникумов. 2 – ое изд., перераб. – М,: Высш. шк., 1971 – 342 с.
4. Бедрій Я.І., Дембіцький С.І., Джигирей В.С. Львів в – во „ек.к.к.о"., 1997 – 258 с.; іл
5. Шеремет В.О. Охорона праці на гірнича – металургійному підприємстві: Навч. посібник. – Ч.Ш.: Коксохімічний комплекс і аглофабрика – Дніпропетровськ: ІМА – прес, 2003 – 400 с.
6. Технологический регламент ТР 228 – КХ – 01 – 2003 Очистка сточных вод КХП на установке биохимической очистки цеха енергообеспечения.
7. Режимная карта Очистки сточных вод участка 15ХУ КХП.
8. Инструкция по охране труда для лаборанта химическокго анализа испытательной группы по химпродукции центральной лаборатории КХП.
9. Методика выполнения измерений массовой концентрации сульфатов турбодиметрическим и комплексонометрическим методами в точних водах. Проведена атестація в соответствии с требованиями ГОСТ 8.010 – 99.
10. Методика выполнения измерений масовой концентрации сульфатов в сточных водах коксохимического производства. Проведена атестация методики в соответствии с ГОСТ 8.010 – 99.
|