Курсовая работа
"Изучение кето-енольной таутомерии на примере АУЭ"
Введение
Цели работы определены следующим образом:
1. Изучить строение и свойства, а так же особенности строения ацетоуксусного эфира (АУЭ) на основе электронных представлений;
2. Рассмотреть особенности строения и свойств других β – дикарбонильных соединений;
3. Изучить кето-фенольную таутомерию моно- и β-дикарбонильных соединений экспериментально;
4. Изучить двойственную реакционную способность на примере АУЭ;
5. Изучить синтезы на основе АУЭ.
Задачи работы:
1. Подтвердить строение и свойства АУЭ на основе эксперимента;
2. Доказать связь ацетоуксусного эфира с другими классами органических соединений.
1. Обзор литературы
Класификация дикарбонильных соединений
Таблица 1. Физические свойства некоторых альдегидо- и кетокислот
| Кислота |
Мr |
Формула |
Темпера-
тура плавле-
ния, 0 °С
|
Температу-
ра кипения,
0 °С
|
Глиоксиловая
Пропионовая
|
74
74
|
OHC-COOH |
98
– 22
|
–
141
|
Пировиног-радная
Масляная
|
88
88
|
CH3COCOOH
|
13,6
– 6
|
165
184
|
Ацетоуксус-
ная
Валериановая
|
102
102
|
CH3COCH2COOH
|
__
– 34
|
180 с разложением
187
|
Левулиновая
Капроновая
|
116
116
|
CH3COCH2CH2COOH
|
37
– 3
|
245 с разложением
205
|
В таблице 1 приведены некоторые физические свойства первых представителей гомологического ряда альдегидо- и кетокислот. В сравнении с предельными одноосновными карбоновыми кислотами с той же молекулярной массой, оксокислоты заметно отличаются по физическим свойствам. Альдегидо- и кетокислоты обладают свойствами как карбоновых кислот, так и карбонильных соединений (альдегидов и кетонов). Кроме того они обнаруживают ряд специфических превращений, связанных с присутствием обеих функций и их взаимным влиянием. Оксокислоты проявляют более сильные кислотные свойства по сравнению с незамещенными карбоновыми кислотами. Повышение кислотных свойств связано с довольно сильным электроноакцепторным действием карбонильной группы (– I), которое приводит к усилению мезомерного эффекта карбоксильной группы и увеличению поляризации связи O – H. Индуктивный характер влияния подтверждается достаточно резким падением кислотных свойств по мере удаления карбонильной группы от карбоксильной вследствие затухания индукционного эффекта.
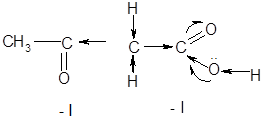
1.1 Ацетоуксусная кислота и ее эфир как С – Н кислоты
Реклама

Гомологический ряд β-кетонокислот начинается ацетоуксусной кислотой. Она может быть получена осторожным омылением ее эфиров или присоединением воды к дикетену:
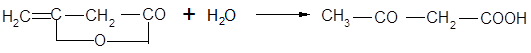
Важную роль в органическом синтезе играет этиловый эфир этой кислоты:
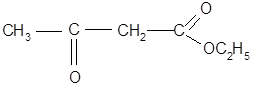
Он применяется для получения различных кетонов и кислот.
Одной из наиболее важных в синтетическом отношении реакций сложных эфиров, происходящих под действием оснований, является автоконденсация этилацетата, вызываемая этилатом натрия и приводящая к ацетоуксусному эфиру. Эта реакция носит название конденсации Кляйзена.
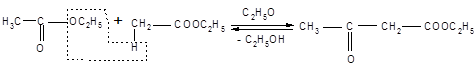
Этилацетат Ацетоуксусный эфир
Она интересна тем, что должна быть термодинамически невыгодной. Такое предположение оправдывается на практике. Было приложено немало усилий для того, чтобы отыскать условия, при которых выходы продукта конденсации имели практическую значимость.
Механизм конденсации Кляйзена: первая стадия представляет собой образование аниона этилацетата, который, будучи чрезвычайно сильным нуклеофилом, атакует карбонильный атом углерода второй молекулы сложного эфира. Элиминирование этилат-иона приводит далее к эфиру β – кислоты, этилацетоацетату.
С2
Н5
О-
+ Н+
– СН2
СО2
С2
Н5
 :-
СН2
СО2
С2
Н5
+ С2
Н5
ОН :-
СН2
СО2
С2
Н5
+ С2
Н5
ОН
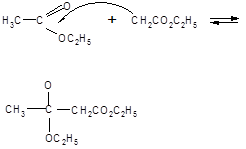
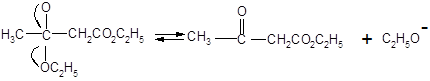
Все эти стадии в итоге приводят к невыгодному положению равновесия и удовлетворительные выходы β – кетоэфиров получают только в том случае, если равновесие оказывается возможным сдвинуть, удаляя один из продуктов. Это может быть достигнуто отгонкой этилового спирта; может, однако, оказаться трудным довести эту отгонку до завершения, а если исходный сложный эфир имеет низкую температуру кипения, то этот метод, естественно неприменим.
С другой стороны, можно применять большой избыток этилата натрия. Этот метод оказывается эффективным, так как этанол – более слабая кислота, чем фенол сложного эфира, и избыток этилата сдвигает равновесие вправо вследствие превращения β-кетоэфира в соль фенола.
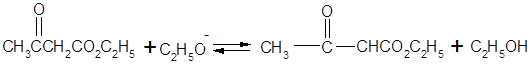
Очевидно, что продукт конденсации необходимо получать из соли фенола и выделять в условиях, предотвращающих обратную реакцию распада на исходные реагенты. Наилучшим методом оказывается «замораживание» реакционной смеси, для чего ее вливают в избыток холодной разбавленной кислоты.
Особенностью ацетоуксусного эфира является то, что в одних реакциях он ведет себя как кетон, а в других как непредельный спирт. Эта необычная реакционная способность объясняется тем, что ацетоуксусный эфир представляет собой смесь двух таутомерных форм.
Реклама

Под таутомерией понимается достаточно быстро устанавливающееся равновесие между изомерами, которые в обычных условиях не могут быть отделены друг от друга. Особенно распространена в органической химии так называемая прототропная таутомерия, при которой таутомерные изомеры отличаются друг от друга положением атома Н с одновременным перераспределением π – электронов. К ней относится триадная прототропная таутомерия.
По существу, прототропная таутомерия соответствует положению, когда одному и тому же основанию, благодаря наличию нескольких центров основности, соответствует несколько сопряженных кислот.
Классическим примером триадной прототропной таутомерии является кето-енольная таутомерия.
Ацетоуксусный эфир обычно существует в виде равновесной смеси кетонного и енольного таутомеров в отношении 92,5 к 7,5.
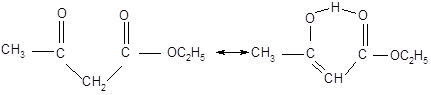
Кето-форма (92,5%) Енольная форма (7,5%)
Взаимопревращение енольной и кетонной форм ацетоуксусного эфира чрезвычайно чувствительно к катализу основаниями и, в меньшей степени, кислотами.
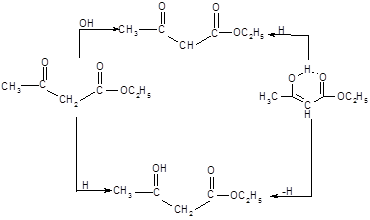
Однако в том случае, если контакт с веществами кислого или основного характера полностью исключен, скорость взаимного превращения снижается настолько, что оказывается возможным отделить более низкокипящий енол от кето-формы путем фракционной перегонки при пониженном давлении. Разделенные таким образом таутомеры устойчивы в течение сколь угодно долгого времени при хрании в кварцевых сосудах и t0 =800С.
Для установления содержания енольной и кето-форм в равновесной смеси разработан ряд методов. Обычно наиболее точными являются физические методы, так как при проведении химических определений всегда есть опасность сдвига равновесия под влиянием химического воздействия. Для установления состава аллелотропной смеси в случае ацетоуксусного эфира Кнорр применил рефрактометрический метод, он определил показатели преломления чистых десмотропных форм и показатель преломления их аллелотропной смеси.
Таблица 2
| nD10 |
| Кето-форма |
1, 4225 |
| Енольная форма |
1, 4480 |
| Эфир (аллелотропная смесь) |
1, 4230 |
На основании того, что в данном случае между изменениями показателей преломления и изменением состава смеси имеется прямая зависимость, Кнорр рассчитал, что ацетоуксусный эфир содержит 2% енола и 98% кето-формы. Однако в дальнейшем было показано, что в этом случае рефрактометрический метод оказался непригодным вследствие того, что стекло призмы катализирует кето-енольное превращение ацетоуксусного эфира. Впоследствии было произведено определение показателя преломления тщательно очищенных обеих десмотропных форм ацетоуксусного эфира с учетом их изомеризации во время измерения. На основании этих данных было установлено, что обычный ацетоуксусный эфир содержит 7,4% енола.
Химическое определение содержания енольной и кето-форм может быть применено только в том случае, когда известно, что под влиянием реагента не происходит сдвига равновесия во время опыта. Вследствие этого реакция с FeCl3 не может быть применена.
Химический метод определения состава кето-енольной смеси был разработан Мейером. Он основан на том, что енольная форма практически моментально реагирует с бромом. Определение производят следующим образом. К спиртовому раствору ацетоуксусного эфира при – 70 С прибавляют избыток брома; поскольку нарушенное при бромировании равновесие постепенно вновь восстанавливается за счет перехода кето-формы в енол, избыток брома уничтожают путем добавления α-нафтола. Так как образовавшееся бромкетосоединение, содержание которого соответствует содержанию енола в аллелотропной смеси, количественно реагирует с HI с выделением свободного йода, к исследуемому раствору добавляют KI и серную кислоту; выделившийся йод оттитровывают. Весь процесс можно представить следующей схемой:
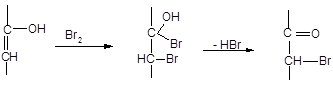
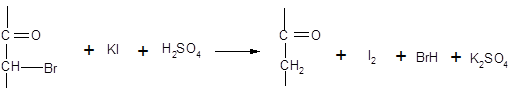
Вся работа до оттитровывания йода должна проводиться очень быстро (~ 15 сек).
В этих условиях бромистый водород, обычно способствующий енолизации ацетоуксусного эфира, не оказывает каталитического действия. Таким путем было установлено, что ацетоуксусный эфир содержит 7,7% енольной и 92,3% кето-формы. Свежеперегнанный эфир значительно более богат енольной формой, так как последняя имеет более низкую температуру кипения, чем кето-форма, вследствие чего положение равновесия кето-форма енол частично сдвигается вправо.
В различных растворителях содержание енольной формы различно: чем более полярен растворитель, тем большее содержание кетонной формы:
Таблица 3. Содержание енольной формы в различных растворителях
| Растворитель |
Содержание енола, % |
| Вода |
0,4 |
| Метиловый спирт |
6,9 |
| Этиловый спирт |
12,0 |
| Диэтиловый эфир |
27,1 |
| Гексан |
46,4 |
1.2 Химические свойства ацетоуксусного эфира
енольный дикарбонильный эфир ацетоуксусный
1. Алкилирование ацетоуксусного эфира.
Анионы сложных эфиров типа ацетоуксусного могут быть проалкилированы алкилгалогенидами. Сложный эфир превращается при действии сильного основания в енолят-анион, и последний далее алкилируется по SN2 реакции алкилгалогенидом. Обычно преобладает С – алкилирование.

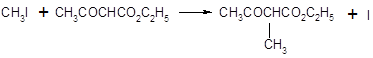
Ацетоуксусный эфир может быть гидролизован в кислых условиях до соответствующих кислот, которые при нагревании легко декарбоксилируются. Из алкилацетоуксусных эфиров при этом образуются метилалкилкетоны:
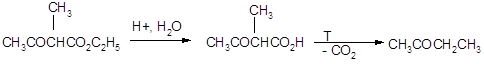
2. Ацилирование ацетоуксусного эфира.
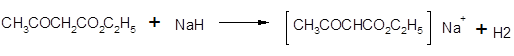
Анионы сложных эфиров взаимодействуют с ацилгалогенидами, образуя продукты ацилирования. Эти реакции осуществляются с наибольшим успехом, если использовать для получения соли енол????????, а гидрид натрия, так как в этом случае не происходит образования спирта, способного реагировать с ацилгалогенидом.
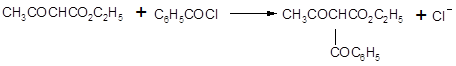
3. Синтезы с АУЭ.
АУЭ широко используется в органическом синтезе. С его помощью можно синтезировать кетоны, модифицировать эфир с образованием различных производных. Целый ряд дополнительных возможностей для синтеза обеспечивают еноляты АУЭ, которые способны подвергаться алкилированию и ацилированию с образованием разнообразных замещенных ацетоуксусного эфира. В отличае от натриймалонового эфира эти реакции могут протекать как по атому гидроксильного кислорода, так и по соседнему углеродному атому. Механзм реакций SN2 в качестве нуклеофила выступает енолят – ион.
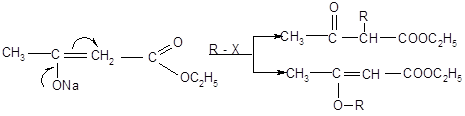
Направление замещения определяется несколькими факторами. Наиболее важным является природа реагента R – X. Чем более мягкой кислотой будет уходящая группа «Х», тем легче будет идти реакция по мягкому реакционному центру – атому углерода. Это и происходит при алкилировании енолята – аниона алкил – йодидами и – бромидами.
Возможности применения АУЭ в синтезах разнообразных продуктов расширяются благодаря его способности подвергаться расщеплению в двух направлениях. При нагревании с разбавленными растворами щелочей или кислот происходит распад образующейся после гидролиза ацетоуксусной кислоты с образованием кетонов. Обработка концентрированными растворами щелочей приводит к образованию из АУЭ двух молекул уксусной кислоты (кислотное расщепление):
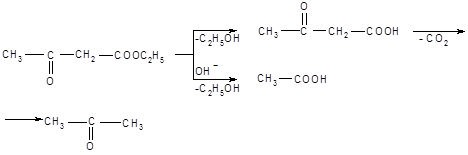
Механизм кислотного расщепления состоит в нуклеофильной атаке гидроксил-ионом карбонильного углерода, несущего частичный положительный заряд. После присоединения гидроксида неустойчивый продукт распадается:
Пример синтеза с использованием АУЭ:
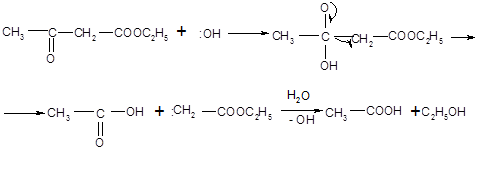
2. Экспериментальная часть
Опыт 1. Кислотные свойства ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир………….5 мл Цилиндр (100 мл)………..1
Едкий натр (2% раствор)……100 мл Капельная воронка………1
Соляная кислота (10%)……….50 мл
Выполнение опыта
В цилиндр с ацетоуксусным эфиром приливают из капельной воронки разбавленную щелочь, пока не получится прозрачный раствор. При прибавлении соляной кислоты до кислой реакции (на бумажку конго) вновь выделяется ацетоуксусный эфир в виде маслянистого слоя.
Опыт 2. Получение натриевого производного ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир (свеже – Колба (500 мл)………….1
перегнанный) ………………100 мл Холодильник……………1
Натрий металлический (в керосине Водяная баня……………1
или лигроине) ………………… 7 г Банка (50 мл)……………1
Фильтровальная бумага
Выполнение опыта
В колбу с обратным холодильником вводят ацетоуксусный эфир и бросают через холодильник мелконарезанные пластинки натрия, очищенные от корочки и обтертые от керосина. После того как весь натрий прореагирует, колбу с реакционной смесью охлаждают в бане с ледяной водой; при этом выпадает в осадок натриевое производное ацетоуксусного эфира. Так как натрий иногда не успевает в течении лекции раствориться полностью, осаждение натриевого производного можно показать на следующей лекции.
Опыт 3. Взаимодействие ацетоуксусного эфира с хлорным железом.
Реактивы и посуда
Ацетоуксусный эфир……….2 мл Цилиндр (200 мл)………1
Этиловый спирт (50%)….…50 мл
Хлорное железо (2%
раствор)……………….10 мл
Выполнение опыта
В цилиндре смешивают ацетоуксусный эфир со спиртом и приливают хлорное железо; появляется сине-фиолетовое окрашивание, характерное для енольной формы ацетоуксусного эфира.
Опыт 4. Взаимодействие ацетоуксусного эфира с уксуснокислой медью.
Реактивы и посуда
Ацетоуксусный эфир…….10 мл Цилиндр с притертой пробкой
Этиловый спирт…………..10 мл (50 мл)….………………………1
Уксусная медь (насыщенный
раствор)………………….10 мл
Аммиак (конц. раствор)… 3–5 мл
Выполнение опыта
В цилиндре смешивают ацетоуксусный эфир, спирт и уксуснокислую медь. При энергичном взбалтывании прибавляют несколько капель аммиака. Вскоре образуется кристаллическая масса, окрашенная в светло-зеленый цвет, – медное производное ацетоуксусного эфира.
Опыт 5. Кетонное расщепление ацетоуксусного эфира.
Реактивы, посуда и приборы
Ацетоуксусный эфир………10 мл Круглодонная колба (100 мл)…..1
Серная кислота (10%)……..20 мл Промывная склянка Тищенко….1
Баритовая вода……………..30 мл Стеклянные и резиновые трубки
Соответствующих размеров
Сборка прибора
Колбу соединяют с обратным холодильником, верхний конец которого закрывают пробкой с изогнутой вниз трубкой; последнюю соединяют с промывной склянкой, в которую налита баритовая вода.
Выполнение опыта
В колбу наливают ацетоуксусный эфир и серную кислоту. Реакционную смесь нагревают до кипения. При этом происходит разложение эфира с образованием ацетона и углекислого газа; последний с баритовой водой образует осадок углекислого газа.
Опыт 6. Таутомерия ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир…..5 мл Цилиндр (200 мл)…………………..1
Хлорное железо (2% раст – Капельные воронки………………..2
вор)……………………25 мл
Бромная вода………….25 мл
Выполнение опыта
В цилиндре растворяют ацетоуксусный эфир в 100 мл воды и приливают из капельной воронки несколько миллилитров хлорного железа; через некоторое время появляется сине-фиолетовая окраска комплексной железной соли енольной формы. При прибавлении из второй капельной воронки бромной воды бром присоединяется к енольной форме и раствор обесцвечивается. Через несколько секунд окраска появляется снова, так как равновесие смещается и вновь появляется енольная форма; при дальнейшем прибавлении бромной воды окраска исчезает.
Опыт 7. Титрование енольной формы ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир…..5 мл Капельные воронки ………………2
В-нафтол х.ч. (10% спир – Бюксы (маленькие)………………..3
товой раствор)………30 мл Конические колбы широкогорлые
Йодистый калий (5% (250 мл)…………………………..3
раствор) …………….30 мл Бюретки……………………………2
Этиловый спирт……..250 мл Склянка с притертой пробкой
Тиосульфат натрия (100 мл)…………………………..1
(0,1 н. раствор)…….150 мл Чашки фарфоровые ……………….2
Бром…………………..25 мл Водяная баня………………………1
Выполнение опыта
До лекции берут три навески ацетоуксусного эфира (приблизительно по 1.5.г). Спиртовой раствор β-нафтола, йодистый калий и спирт охлаждают в бане со льдом.
Приготовляют спиртовой раствор брома, для чего в склянку с притертой пробкой вливают 50 мл охлажденного спирта и приливают из капельной воронки бром до появления светло-красной окраски.
На лекции осторожно вносят бюкс с навеской ацетоуксусного эфира в коническую колбу, приливают 25 мл охлажденного спирта и колбу встряхивают до растворения эфира. К полученному раствору быстро прибавляют при взбалтывании спиртовой раствор брома до появления светло-красной окраски, после чего приливают спиртовой раствор β-нафтола до полного обесцвечивания. Затем из капельной воронки при охлаждении прибавляют раствор йодистого калия так, чтобы появился бурый цвет йода, и титруют тиосульфатом до исчезновения окраски йода.
Выводы
1. АУЭ относится к β-дикарбонильным соединениям;
2. Изучены особые свойства АУЭ. Разработан демонстрационный опыт по кето-енольной таутомерии АУЭ
3. Разработан видеофрагмент «Кето-енольная таутомерия АУЭ»
Библиографический список
1. Темникова Т.И., Курс теоретических основ органической химии, Ленинград, ВШ, 1968 г. с. 484–495
2. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для вузов – М.: Высшая школа, 1981 г. с. 261–265
3. Иванов В.Г. Органическая химия: Учеб. Пособие для студ. высш. пед. учеб. Заведений – М.: Издательский центр «Академия», 2005 г. с. 269–275
4. Зонис С.А., Мазуров С.М., Лекционные опыты и демонстрационные материалы по органической химии. – Ленинград: Ленгосхимиздат, 1966, с. 253–256
|