ЗМІСТ
Вступ
1. Завдання
2. Виробництво карбаміду
3. Матеріальний баланс стадії синтезу карбаміду
4. Матеріальний баланс одержання плаву карбаміду
Список використаної літератури
Вступ
Тема контрольної роботи «Виробництво карбаміду» з дисципліни «Основи екології у технології неорганічних речовин».
Сьогодні реконструкція існуючих технологій виробництв у багатьох випадках пов’язана з підвищенням їх екологічної безпеки. При створенні нових технологій однією з основних задач є також підвищення екологічної безпеки. Тому знання принципів створення безвідходних і маловідходних технологій, а також основних методів утилізації відходів є необхідним для інженерно-технічного персоналу підприємств, раціоналізаторів та адміністративно-управлінського персоналу. Необхідні ці знання студентам також для більш досконалого виконання курсових і дипломних проектів.
Дана дисципліна базується на знаннях, отриманих при вивченні курсів загальної та неорганічно хімії, органічної хімії, фізики, хімічної технології неорганічних речовин, теоретичних основ ТНР, основ екології, загальної хімічної технології, процесів і апаратів хімічної технології.
Задачею курсу є вивчення принципів і методів створення нових безвідходних і маловідходних виробництв, а також підвищення екологічної безпеки існуючих виробництв, найбільш розповсюджених методів утилізації відходів. Основна увага приділяється питанням класифікації відходів, джерелам їх утворення, методам утилізації, підбору основного типового устаткування.
При виконані завдання треба:
1. Привести принципову схему процесу.
2. Розрахувати матеріальний баланс процесу 1 т речовини (першої в рівнянні хімічної реакції) при відомих умовах. Визначити коефіцієнти витрати сировини, кількісний та якісний склади відходів.
3. Використовуючи навчальну і науково-технічну літературу, запропонувати методи зниження кількості відходів, що утворюються, або методи їх утилізації. Привести технологічну схему найбільш раціонального варіанта процесу утилізації відходів з описом, або схему основного виробництва з новими режимно-технологічними або апаратурно-конструктивними рішеннями, спрямованими на зниження кількості відходів, що утворюються.
Реклама

При виконанні завдання необхідно враховувати основний принцип екологізацїї техніки і технології – системний підхід. Він передбачає удосконалювання існуючих і розроблювальних природно-технічних систем на всіх рівнях ієрархії, починаючи з видобутку сировини і закінчуючи споживанням продукції з урахуванням взаємодії і взаємного впливу всіх складових. Саме системний підхід дозволяє забезпечити створення технічних систем з високими техніко-економічними характеристиками на кожнім окремо узятому ієрархічному рівні. В основу системної екологізації покладено наступні основні стратегічні принципи:
1. Економічні, технологічні та екологічні задачи необхідно вирішувати одночасно, підпорядковуючись єдиній стратегії екологізації економіки.
2. Екологізація економіки сьогодні звертає основну увагу та засоби не стільки на сферу споживання, скільки на удосконалення об’єктів, що являються фактичними або потенційними джерелами забруднення довкілля.
3. Успіх екологізації економіки здебільшого визначається наявністю достатньо підготовлених в області теорії та практики екологізації й екологічного менеджменту кадрів.
4. Створення цивілізованого екологічного ринку на регіональному рівні та у масштабах країни є необхідною умовою екологізації економіки.
Тактика реалізації цих стратегічних принципів базується на сполученні спеціальних підходів і організації технологічних процесів незалежно від галузі, до якої вони належать, з конкретними режимно-технологічними та апаратурно-конструктивними прийомами.
Системний підхід містить у собі одинадцять основних принципів екологізації техніки і технології та два основних тактичних прийоми.
Тактичні прийоми реалізації принципів системної екологізації
| № |
Тактичні прийоми реалізації |
Режимно-технологічні |
Апаратурно-конструктивні |
| Принципи системної екологізації |
надлишок менш токсичної речовини |
мінімізація часу обробки |
рециркуляція |
суміщення |
гетерогенизація |
адаптивність |
інтенсифікація |
замкнутість структури |
багатофункціональність |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
| 1 |
Безвідходність через селективність |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
| 2 |
Локальне знешкодження викидів |
+ |
+ |
+ |
+ |
| 3 |
Рекуперація |
+ |
+ |
+ |
| 4 |
Утилізація відходів |
+ |
+ |
+ |
+ |
| 5 |
Ресурсозбереження |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
| 6 |
Гнучкість |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
| 7 |
Комплексність |
+ |
+ |
+ |
+ |
+ |
+ |
| 8 |
Багаторазовість використання ресурсів і енергії |
+ |
+ |
+ |
+ |
+ |
+ |
| 9 |
Максимальна селективність синтезу і розділення |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
| 10 |
Екологізація освіти |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
| 11 |
Екологізація сфери споживання |
+ |
+ |
Приведені дані свідчать, що тільки один з режимно-технологічних прийомів „суміщення” дозволяє реалізувати всі одинадцять і „рециркуляція” десять принципів системної екологізації техніки і технології. У свою чергу такі принципи системної екологізації техніки і технології, як ресурсозбереження, „гнучкість” та „екологізації освіти” дозволяють реалізувати всі режимно-технологічні та апаратурно-конструктивні прийоми екологізації техніки і технології, й тому є найважливішими.
Вивчення дисципліни „Основи екології у технології неорганічних речовин та виконання контрольної роботи дозволяє реалізувати принцип екологізація освіти.
1.Завдання
| Технологічний процес, стадія |
Умови |
Виробництво карбаміду,
стадія синтезу
1) CO2
+2NH3
«NH2
COONH4
2) NH2
COONH4
«CO(NH2
)2
+H2
O
Реклама

3) CO2
+2NH3
«CO(NH2
)2
+H2
O
|
Склад експанзерного газу (% мас.):
СО2
– 96; інертні гази (N2
) – 4.
Надлишок аміаку – 125% від стехіометричної кількості.
Ступінь перетворення карбамата амонію в карбамід – 70%.
Ступінь конверсії CO2
-98%.
|
2. Виробництво карбаміду
Амід карбамінової кислоти NH2
COOH – карбамід (сечовина) СО(NH2
)2
одержують з аміаку і диоксида вуглецю при Р=18-20МПа і Т=185-2000
С. У результаті взаємодії в колоні синтезу утворюється плав, що містить 34-35% карбаміду, 18-19% карбамата амонію NH2
COONH4
, 34-35% аміаку і 10-11% води. Газова фаза містить непрореаговані аміак і СО2
, невеликі кількості водяної пари і продуктів реакції. Отриманий плав піддають дистиляції з метою розкладання карбамата з утворенням карбаміду, а також амонійних солей з відгоном аміаку, СО2
і водяної пари.
У схемі з повним рідинним рециклом [1] частина надлишкового аміаку повертається в колону синтезу карбаміду в газоподібному виді, а останній аміак – з концентрованим вуглеаміачним водним розчином.
Для очищення аміаку від СО2
і утворення вуглеаміачного розчину служить промивна колона, у яку надходять гази з ректифікаційних колон першої і другої ступіней дистиляції. Розчин повертається на синтез через змішувач, а газоподібний аміак прохолоджується водою в конденсаторі, скраплюється і надходить у збірник рідкого аміаку. Частина його відбирається на зрошення промивної колони для регулювання температури (90% аміаку входить у верхню, а 10% - у нижню частину промивної колони).
Гази ректифікаційної колони другої ступіні спочатку конденсуються і вводяться в промивну колону у виді розчину вуглеамонійних солей. Таким чином, система працює в замкнутому циклі, забезпечуючи підтримку в змішувачі колони синтезу постійного співвідношення NH3
:CO2
:H2
O у реакційній суміші приблизно 4:1:0,5.
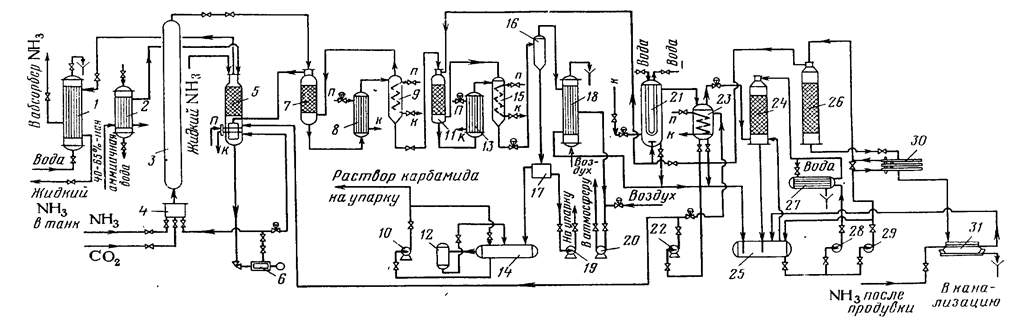
Рис.1. Схема виробництва карбаміду з повним рідинним рециклом (відділення синтезу і дистиляції): 1 – конденсатор аміаку; 2 – холодильник аміачної води; 3 – колона синтезу; 4 – змішувач; 5 – промивна колона; 6 – плунжерний насос; 7 – ректифікаційна колона першої ступіні; 8 – підігрівник першої ступіні; 9 – сепаратор першої ступіні; 10,19,22,28,29 – відцентрові насоси; 11 – ректифікаційна колона другої ступіні; 12 – збірник олії; 13 – підігрівник другої ступіні; 14,17 – збірники розчину карбаміду; 15 – сепаратор другої ступіні; 16 – вакуум-випарник; 18 – конденсатор першої ступіні; 20 – вакуум-насос; 21 – конденсатор другої ступіні; 23 – напірний бак; 24 – абсорбер; 25 – збірник розчину амонійних солей; 26 – десорбер; 27 – холодильник; 30 – теплообмінник; 31 – випарник; к – конденсат; п пара.
3.Матеріальний баланс стадії синтезу карбаміду
У 1000 кг подаваного технічного діоксиду вуглецю знаходиться СО2
:
1000×0,96=960 кг,
інертних газів
1000×0,04=40 кг.
З урахуванням ступеня конверсії прореагує CO2
:
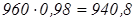 кг, кг,
не прореагує CO2
960–940,8=19,2 кг
Стехіометрична кількість аміаку по реакції (1) складе
940,8×2×17/44=726,98 кг
(де 44 – молекулярна маса діоксиду вуглецю).
Подавана надлишкова кількість аміаку
726,98×2,25=1635,71 кг.
У колоні утвориться карбамата амонію
940,8×78/44=1667,78 кг.
З урахуванням ступеня перетворення карбамата амонію на утворення карбаміду по реакції (2) витрачається карбамата амонію
1667,78× 0,7=1167,45 кг,
розкладається карбамата амонію по зворотній реакції (1)
1667,78× 0,3=500,33 кг.
Зі знайденої кількості карбамата утвориться по реакції (2)
карбаміду
1167,45× 60/78=898,04 кг
води
1167,45×18/78=269,41 кг
(де 60, 78, 18 – молекулярні маси карбаміду, карбамата амонію і води).
На утворення карбомата амонію витрачається аміаку
1667,78×2×17/78=726,98 кг
(17 – молекулярна маса аміаку). Залишається непрореагованого аміаку:
1635,71–726,98=908,73 кг.
Вода, що виділилася, взаємодіє з надлишковим аміаком, утворює NH4
OH, кількість якого, відповідно до реакції NH3
+H2
O=NH4
OH дорівнює
269,41(35/18=523,85 кг (35 – молекулярна маса гидроксида амонію).
На утворення такої кількості гидроксида амонію витрачається аміаку
523,85×17/35=254,44 кг.
Залишається надлишкового аміаку в газовій фазі:
908,73–25,44=883,29 кг
4. Матеріальний баланс одержання плаву карбаміду
| ПРИХІД |
ВИТРАТА |
| сировина |
кг |
%мас. |
м3
|
%об. |
продукт |
кг |
м3
|
%об. |
| 1)аміак |
1635,71 |
62,06 |
2155,29 |
80,54 |
карбамід |
898,04 |
- |
- |
2)експанзерний газ,
у т.ч. СО2
|
1000
960
|
37,94
96
|
488,73
|
18,26
|
карбамат амонію |
500,33 |
- |
- |
| інертні гази (N2
) |
40 |
4 |
32 |
1,2 |
Газові викиди: |
| вода |
269,41 |
335,27 |
19,68 |
| надлишковий аміак, |
908,73 |
| у т.ч. у вигляді NH4
OH, |
254,44 |
162,84 |
9,56 |
| у газоподібному вигляді |
883,29
|
1163,86
|
68,31
|
| інертні гази |
40 |
32 |
1,88 |
| СО2
|
19,2 |
9,77 |
0,57 |
| УСЬОГО |
2635,71 |
100 |
2676,02 |
100 |
УСЬОГО |
2635,71 |
1703,74 |
100 |
Витратні коефіцієнти на 1 т карбаміду:
СО2
1000/898,04=1,11 кг/кг
NH3
(надлишок 125%) 1635,71/898,04=1,82 кг/кг
Способи регенерації газів дистиляції і їх рециркуляція
Існує декілька способів регенерації газів дистиляції з метою їх рециркуляції:
1) гаряче компримування,
2) поглинання газів водою,
3) поглинання газів мінеральною олією,
4) виборча абсорбція аміаку і диоксида вуглецю.
Перший метод мало прийнятний через труднощі, що виникають при компресії суміші газів при високих температурах.
Другий метод зв'язаний із уведенням додаткової кількості води в процес і характеризується великим об’ємом апаратури і високою вартістю продукту.
По третьому способу, здійсненому в США, при поглинанні суміші аміаку і диоксида вуглецю інертною мінеральною олією утворюється суспензія карбамата амонію, що надходить у колону синтезу.
Четвертий спосіб – виборча абсорбція аміаку з газів дистиляції розчином нітрату карбаміду використовується у Швейцарії й у США. Непоглинений диоксид вуглецю викидається в атмосферу або повторно використовується в циклі. Виборча абсорбція СО2
за допомогою водного розчину моноетаноламіну заздалегідь насиченим аміаком здійснена в США і Японії. Регенерацію розчину для виділення СО2
і NH3
окремо проводять у дві ступіні. У першій ступіні відганяють аміак струмом інертного газу або вторинної водяної пари. В другій ступіні розкладанням карбонату моноетаноламіну виділяють з розчину диоксид вуглецю.
Становить інтерес процес поділу газів дистиляції двома поглиначами в три ступіні (рис.2).
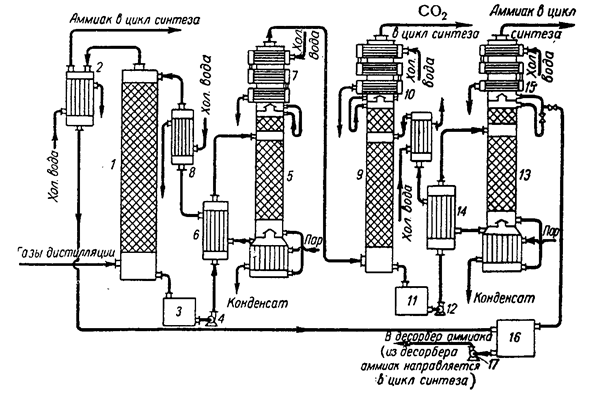
Рис.2. Схема регенерації NH3
і CO2
у виробництві карбаміду в три ступіні:
1,9 – абсорбційні колони; 2,10,15 – конденсатори; 3,11,16 – збірники;
4,12,17 – відцентрові насоси; 5,13 – колони регенерації;
6,14 – теплообмінники; 7,8 – холодильники
Гази дистиляції після синтезу карбаміду надходять у першу абсорбційну колону 1, зрошувану 30% водним розчином моноетаноламіну. Процес протікає при 700
С під атмосферним тиском. У колоні відбувається поглинання СО2
з утворенням карбонату і бікарбонату моноетаноламіну. Одночасно з поглинанням СО2
у колоні 1 поглинається приблизно четверта частина аміаку, що надійшов. Інша кількість аміаку з першої колони повертається в цикл на синтез карбаміду. Розчин моноетаноламіну, насичений СО2
і NH3
, з колони 1 надходить у першу колону регенерації 5, у якій процес йде при 1400
С и підвищеному тиску. Регенерований розчин моноетаноламіну повертається на зрошення колони 1. Гази, що містять аміак, диоксид вуглецю і водяну пару, направляють у другу абсорбційну колону 9, зрошувану 25% водним розчином моноамонійфосфату.
Тут аміак зв'язується
NH4
H2
PO4
+NH3
=(NH4
)2
HPO4
Непоглинений диоксид вуглецю повертають у цикл для синтезу карбаміду, а розчин диамонійфосфату піддають регенерації в другій десорбційній колоні 13 при 100-1050
С и атмосферному тиску. Газоподібний аміак, що виділився, повертають у цикл, а регенерований розчин моноамонійфосфату направляють на зрошення другого абсорбера 9.
Запропонований спосіб утилізації відходів у виробництві карбаміду дозволяють реалізувати: рекуперація, ресурсозбереження, утилізація, багаторазове використання ресурсів і енергії, комплексність шляхом використання тактичних прийомів – рециркуляція, суміщення, гетерогенезація.
карбамід екологічний утилізація баланс
Список використаної літератури
1) Соколовский А.А., Яшке Е.В. Технология минеральных удобрений и кислот. – М.: Химия, 1979. – 384 с.
2) Позин М.Е. Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот). – Л.: ГОСНТИХИМЛИТ, 1961. – 1009с.
|