ЗМІСТ
Вступ
1. ЗАВДАННЯ
2. ВИКОНАННЯ ЗАВДАННЯ
2.1 Аналітичний огляд методів
2.2 Фізико-хімічні основи виробництва
2.3 Опис технологічної схеми
2.4 Норми технологічного режиму
2.5 Розрахунок матеріального балансу процесу окисного випалу сірки
2.6 Розрахунок теплового балансу процесу окисного випалу сірки
ЛІТЕРАТУРА
Вступ
Контрольна робота з дисципліни «Загальна хімічна технологія».
Мета контрольної роботи – розвиток практичних навичок самостійного формування математичного опису хіміко-технологічного процесу та аналітичного вирішення сформульованих задач.
Задачі контрольної роботи полягають у виборі методу виробництва хімічного продукту (проведення хіміко-технологічного процесу), вивченні фізико-хімічних закономірностей проведення окремих технологічних стадій та методів керування ефективністю проведення технологічних стадій. За обраним формалізованим описом методу виробництва формують вихідні дані для розрахунку матеріальних та теплових балансів. За результатами розрахунків формують висновки відносно витрат сировини для отримання хімічного продукту та потребі в підігріві або охолодженні апаратури.
Контрольна робота вміщує наступні розділи:
1. Аналітичний огляд методів виробництва
2. Фізико-хімічні основи виробництва
3. Технологічна схема виробництва
4. Норми технологічного режиму
5. Матеріальні розрахунки
6. Теплові розрахунки
1. ЗАВДАННЯ
Одержання сірчаної кислоти контактним методом. Матеріальний і тепловий баланс процесу окисного випалу сірки.
2. ВИКОНАННЯ ЗАВДАННЯ
2.1 Аналітичний огляд методів
Заводське одержання сірчаної кислоти відноситься до числа найстарших великомасштабних хімічних виробництв. Широко застосовувані тепер процеси й апарати розроблялися й освоювалися спочатку стосовно до технології сірчаної кислоти, а потім ставали типовими для виготовлення інших хімічних продуктів. Саме в сірчанокислотному виробництві були впроваджені перші вежі з насадкою, що являють собою основний апарат багатьох хімічних виробництв. Також, розроблені для виробництва сірчаної кислоти поличні і трубчасті контактні апарати стали типовими для деяких каталітичних процесів. Освоєний для процесів окислювання сірчистого ангідриду гомогенний і гетерогенний каталіз, застосовувані для нього платинові і ванадієві каталізатори стали також застосовувати й в інших окислювально-відновних процесах.
Реклама

Виробництво сірчаної кислоти проходить у три основні стадії:
1. Одержання сірчистого ангідриду, що у складі сірчистого газу (суміш азоту, кисню, і сірчистого ангідриду) одержують при випалі сірковміщуючої сировини. Сировиною для виробництва служать природні мінерали (пірит, піритин, мідний колчедан, гіпс, ангідрид, а також самородна сірка), сірка виділювана при очищенні природного вуглецевої сировини (нафти і газу) і побічні сірковміщуючі продукти інших виробництв. Незважаючи на більш високу вартість, сірка є більш технологічною сировиною, тому що не вимагає попереднього збагачення й очищення випалювальних газів від пилу, а також утилізації шламів.
2. Окислювання сірчистого ангідриду яке виробляється баштовим (із застосуванням азотної кислоти)
Оксид азоту (II) є промисловим каталізатором реакції окислювання двоокису сірки. У цьому випадку реакція прискорюється внаслідок протікання проміжних реакцій.
2NO + O2
→ 2NO2
NO2
+ SO2
→ NO + SO3
і контактним (каталітичним) способом.
Тверді каталізатори використовується в контактному процесі (окислювання SO2
у SO3
): платина 5-10% на азбесті або п'ятиокись ванадію, промотована лугом і нанесена на носії з пемзи або кізельгуру, а також залізний каталізатор.
Окислювання звичайне проводять у двох або більш стадій, причому температура послідовно знижується від стадії до стадії.
Це має ту перевагу, що спочатку при високій температурі швидкість реакції велика, а наступне зниження температури дозволяє досягти рівноважного ступеня перетворення.
Перший (застарілий) спосіб вимагає громіздкого устаткування, серйозних енерговитрат і додаткової сировини — концентрованої азотної кислоти; другий — застосування каталізаторів і очищення сировини від каталізаторних отрут.
3. Абсорбція триоксиду сірки виробляється розчином сірчаної кислоти концентрацією 98,3-98,6%.
2.2 Фізико-хімічні основи виробництва
Елементарну сірку одержують з природних копалин (самородна сірка) або з газів, що містять SO2
та H2
S (газова сірка). Сірка є цінною сировиною для виробництва сірчаної кислоти, тому що при її спалюванні одержується концентрований сірчистий газ з високим вмістом кисню. Сірчистим газом називають суміш, що містить SO2
, O2
, N2
. Концентрація SO2
обмежена температурою випалу сірки 1300°С, вище якої руйнується футеровка печі випалу сірки, концентрація (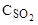 ) SO2
в сірчистому газі при цьому сладає 15%. Необхідну кількість кисню в сірчистому газі розраховують за рівнянням: ) SO2
в сірчистому газі при цьому сладає 15%. Необхідну кількість кисню в сірчистому газі розраховують за рівнянням:
Реклама

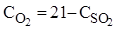
При нагріванні сірка плавиться, плавлення супроводжується збільшенням об’єму.Сірка не потребує спеціальної підготовки для спалювання.
2.3 Опис технологічної схеми
На схемі представлена схема виробництва сірчаної кислоти методом подвійного контактування (ДК) із природної або газової сірки, що не містить контактних отрут (з'єднань миш'яку, селен і ін.).
Розплавлена і відфільтрована від мінеральних домішок сірка спалюється в потоці попередньо висушеного повітря в печі окисного випалу 3. Отриманий сірчистий газ з масовою часткою близько 10% SО2
з температурою понад 1000ºС прохолоджується в паровому казані 4 до 420ºС і надходить у п'ятишаровий контактний апарат 5. У трьох верхніх шарах каталізатора відбувається окислювання диоксиду сірки приблизно на 60% у кожнім і адіабатичному підвищенні температури. Охолодженням газу в теплообмінниках 6 між полками досягається східчасте наближення до оптимальної кривої. На виході з третього шару досягається ступінь перетворення SО2
у SО3
на 93—95%, при цьому адіабата наближається до рівноважної кривої і швидкість реакції сильно зменшується. Тому в способі подвійного контактування (ДК) газ після третього шару надходить на абсорбцію, триоксид сірки поглинається практично цілком в абсорбері 8, рівновага не лімітує процес, а співвідношення О2
: SО2
досягає 10:1, і в четвертому шарі диоксид сірки (близько 0,5%) окисляється на 90-95%. Після четвертого шару газ прохолоджується добавкою холодного повітря, попередньо осушеного сірчаною кислотою в сушильній вежі 7 і подається на п'ятий шар каталізатора, після якого ступінь перетворення складає більш 99,5%, і надходить в абсорбер 13.
Абсорбція триоксиду сірки проводиться у вежах з насадкою, зрошуваної 98,3-98,6% розчином сірчаної кислоти за циркуляційною схемою. Для запобігання віднесення тумана сірчаної кислоти після абсорберів можуть застосуються циклони або електрофільтри. Для створення оптимального температурного режиму кислоту прохолоджують у зрошувальних холодильниках 9 водою або повітрям до температури 60-70?С. Для більш повного поглинання триоксиду сірки застосовується багатоступінчаста протиточна схема абсорбції.
2.4 Норми технологічного режиму
Продуктивність (по сірці),Q, т/сут.50
Температура випалу,ºС.T, ºC 1200
Температура сірки на вході,ТS
ºC 135
Температура повітря на вході,Тв
ºC 20
Склад сірки:SХS
, % 99,5
Золи ХЗ
, % 0,2
Вологи, Хвл
%0,3
Надлишок повітря α 1,25
Ступінь окислювання сірки χ0,95
Склад випалювального газу:SО2
, СSО2
% 12
SО2
, СSО3
% 0,4
2.5 Розрахунок матеріального балансу процесу окисного випалу сірки
1. Визначаємо годинну продуктивність по чистій сірці:
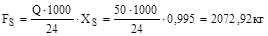
2. Кількість компонентів
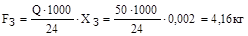
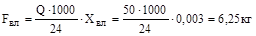
3. Окисленої сірки
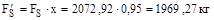
4. Не окисленої сірки
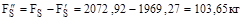
5. Кількість сірки на утворення диоксиду сірки:
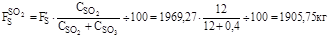
6. Кількість сірки на утворення триоксиду сірки:
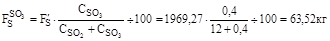
7. Кількість диоксиду сірки по реакції:
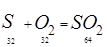
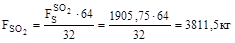
8. Кількість кисню на утворення диоксиду сірки:
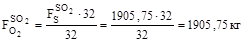
9. Кількість триоксиду сірки по реакції:
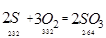
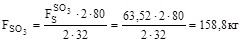
10. Кількість кисню на утворення триоксиду сірки:
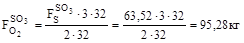
11. Усього кисню:
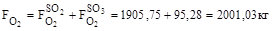
12. З урахуванням надлишку:
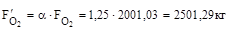
13. Кисню на виході:
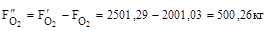
14. Азоту на вході і виході:
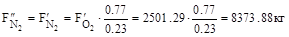
Таблиця 1 Матеріальний баланс процесу спалювання сірки
| Прихід |
F, кг/година |
Витрата |
F, кг/година |
| Повітря, у т.ч. |
10875,17 |
Випалювальні гази, у т.ч. |
| Кисень |
2501,29 |
Кисень |
500,26 |
| Азот |
8373,88 |
Азот |
8373,88 |
| Плав сірки, у т.ч. |
2083,33 |
Диоксид сірки |
3811,5 |
| Сірка |
2072,92 |
Триоксид сірки |
158,8 |
| Зола |
4,16 |
Зола |
4,16 |
| Волога |
6,25 |
Волога |
6,25 |
| Сірка |
103,65 |
| Разом |
12958,5 |
Разом |
12958,5 |
2.6 Розрахунок теплового балансу процесу окисного випалу сірки
сірчана кислота хімічний сірка
1. Теплота з вихідною сировиною:
Із сіркою
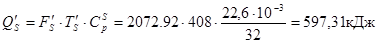
З водою
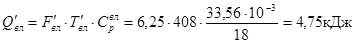
З золою (Si2
)
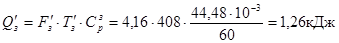
З киснем
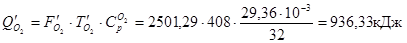
З азотом
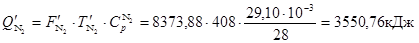
Усього
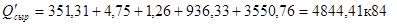
2. Теплота з продуктами реакції:
Із сіркою
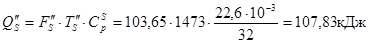
З водою
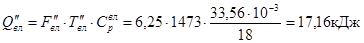
З золою (Si2
)
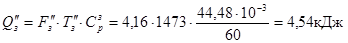
З киснем
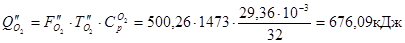
З азотом
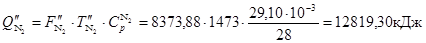
З SО2
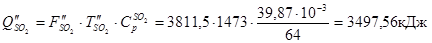
З SО3
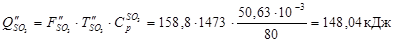
Усього

Тепловий ефект реакції:
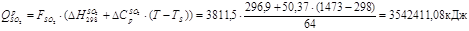
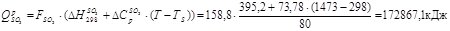
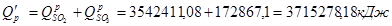
Утрати тепла (5%):
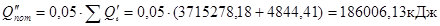
Кількості тепла на нагрівання повітря в кільцевому просторі печі:
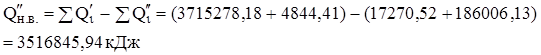
ЛІТЕРАТУРА
1. Мухленов И.П. и др. Общая химическая технология. – М.: Высшая школа, 1991.
2. Кутепов А.М. и др. Общая химическая технология. – М.: Высшая школа, 1990.
3. Общая химическая технология/ Под ред. А.Г. Амелина - М.: Химия, 1977.
4. Расчеты химико-технологических процессов/ Под ред. И.П. Мухленова – Л.: Химия, 1982.
5. Практикум по общей химической технологии/ Под ред. И.П. Мухленова – М.: Высшая школа, 1973.
6. Оборудование, сооружения, основы проектирования химико-технологических процессов защиты биосферы от промышленных выбросов/ А.И. Родионов и др. – М.: Химия, 1985.
7. Методические указания для выполнения контрольных заданий по курсу "Общая химическая технология" для студентов специальностей 7.090220, 2000.
8. Рябин В.А., Остроумов М.А., Свит Т.Ф. Термодинамические свойства веществ/ М.:Химия - 1977-370с
9. Справочник химика в 3-х томах, М.:ГНТИ химической литературы, 1962
10. Царева З.М., Орлова Е.М. Теоретические основы химической технологии – К.: Вища школа, 1986.
11. Сорока В.Е. и др. Основы химической технологии – Л.: Химия, 1986.
12. Левеншпиль О. Инженерное оформление химических процессов. – М.: Химия, 1969.
13. Химико-технологические системы/ Под ред. И.П. Мухленова. – Л.: Химия, 1986.
14. Кафаров В.В. Методы кибернетики в химии и химической технологии. – М.: Химия, 1976.
15. Юкельсон И.И. Технология основного органического синтеза / М.: Химия – 1962 - 848 с.
16. Голосов А.П., Динцесс А.И. Технология производства полиэтилена и полипропилена / М.: Химия –1978 – 216с.
17. Альбом технологических схем процессов переработки нефти и газа /под. ред. Б.И. Бондаренко - М.:Химия – 1983 –128 с.
18. Братичак М.М., Гришин Технологія нафти та газу: навч. посібник – Львів: Вид-во Нац ун-ту "Львівська політехніка" – 2002 –180 с.
19. Крекинг нефтяных фракций на цеолитсодержащих катализаторах / под. ред. Харламова – М.: Химия – 1982 –222с.
20. Е.В. Кузнецов Альбом технологических схем производства полимеров и пластических масс на их основе / М.: Химия – 1976 - с.108
21. Технические свойства полимеров: Уч.- справ. пособие / В.К. Крыжановский, В.В. Бурлов, А.Д Паниматченко, Ю.В. Крыжановская – СПб: Изд-во "Прогресс" –2003 - 240 с.
22. Очистка технологических газов / под. ред. Т.А. Семеновой – М.: Химия – 1969 – 342 с.
23. Попова М.М. Катализаторы очистки газовых выбросов промышленных производств - М.: Химия – 1991 – 175 с.
24. Гутчик С.П., Сосоно В.Е. Расчеты по технологии органического синтеза М.: Химия – 1988 –272 с.
25. А.Г. Амелин Производство серной кислоты М.:Химия – 1967- 472 с.
26. Ахметов А.С. Технология глубокой преработки нефти – Уфа: Гилен - 2002 – 673 с
27. Справочник азотчика т.1/ под. ред. Е.Я. Мельникова М.: Химия – 1967 – 492 с.
28. А.Г. Амелин Производство серной кислоты М.:Химия – 1972- 496 с.
29. Зайцев И.Д., Ткач Г.А., Стоев Н.Д. Производство соды М.: Химия – 1986 – 312с.
30. И.С. Торочешников, А.И. Родионов Техника защиты окружающей среды, М.: Химия – 1981 – 368 с.
31. Принципы технологии основного органического и нефтехимического синтеза : Уч. пособие для ВУЗов / В.С. Тимофеев, Л.А. Срафимов, - 2-е изд. переработ. – М.: Высшая школа – 2003 – 536 с.
32. Справочник нефтехимика в двух томах под. ред. Огородникова - Л.: Химия – 1978- 496с., 592 с.
33. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза, - М.: Химия – 1971 – 840 с.
34. Коршак В.В. Технология пластических масс – М.: Химия – 1976 – с.608
|