Оглавление
Введение
1 Материалы и методы эмпирического исследования
1.1 Объект исследования и подготовка образцов почв к микробиологическому исследованию
1.2 Определение общей численности бактерий в почве
1.3 Определение численности сапротрофов и олиготрофов
2 Результаты и обсуждение исследования
Заключение
Список использованных источников и литературы
Введение
Почва является основным депо разнообразных микроорганизмов на Земле [1;10]. Известно, что 60–90 % биомассы Земли представлено микроорганизмами, населяющими, главным образом почву [2], причем их численность в почве, по сравнению с другими природными средами, выше на несколько порядков [3].
Микроорганизмы распределяются по всему почвенному профилю вплоть до подстилающей породы [1;10]. Значительный практический и теоретический интерес представляет вопрос о том, как изменяется численность микроорганизмов по почвенному профилю, а также динамка численности микроорганизмов в нижнем почвенном горизонте в силу новизны самой проблемы. Особенно это касается недостаточно исследованных почв, имеющих в своем профиле оглеенные горизонты.
В анаэробных условиях при участии гетеротрофных бактерий, использующих органическое вещество, при постоянном или периодическом увлажнении идет один из интересных почвообразовательных процессов – глееобразование [2;8]. Этот процесс сопровождается восстановлением Fe(III) до Fe(II) и выносом Fe(II)-соединений в нижние горизонты почвенного профиля. Глееобразование практически всюду может происходить в результате антропогенной деятельности, если она приводит к переувлажнению почв.
В условиях застойно-промывного режима в результате глееобразования происходит максимальный вынос не только железа, но и других металлов – марганца, алюминия, кальция, магния [8;9]. Изучение особенностей микроорганизмов глеевых почв весьма актуально, так как при антропогенном воздействии на почвенный покров, в том числе при загрязнении почвы нефтью и нефтепродуктами, подобные почвы встречаются практически повсеместно. В Ярославской области почвы с различной степенью оглеения занимают около 18,3 %, что составляет 662,5 га земель [8].
Почвенные микроскопические грибы и бактерии являются практически единственными деструкторами органического вещества, поступающего в почву в виде растительного опада, мертвых животных, а также органических ксенобиотиков [4;9]. Важным микробиологическим показателем состояния почвы является соотношение численности бактерий двух физиологических групп, которые входят в функциональную структуру почвы: сапротрофов и олиготрофов [2;3]. Сапротрофы разлагают разнообразные органические соединения в значительной концентрации, попадающие в почву. Олиготрофы способны ассимилировать органические соединения в условиях их низкой концентрации, при этом они разлагают остаточные количества органических соединений, «рассеивающиеся» в почве при деятельности сапротрофов и автохтонных микроорганизмов, разлагающих почвенный гумус [1;3].
Реклама

Целью
работы было изучение динамики численности бактерий по почвенному профилю дерновой альфегумусовой глеевой почвы.
Для решения данной цели были поставлены следующие задачи
:
1. Определить общую численность бактерий в 5 горизонтах почвенного профиля дерновой альфегумусовой глеевой почвы путем прямого счета по методу Виноградского-Брида.
2. Определить численность сапротрофных бактерий в каждом горизонте исследуемой почвы.
3. Определить численность олиготрофных бактерий в каждом горизонте исследуемой почвы.
4. Проанализировать полученные данные по общей численности, численности сапротрофов и численности олиготрофов.
1 Материалы и методы исследования
1.1
Объект исследования и подготовка образцов почвы
к микробиологическому исследованию
Объектом исследования служили пять образцов дерновой альфегумусовой глеевой почвы, отобранной в 5 км от поселка Дорожный Ярославского района Ярославской области. Охарактеризуем горизонты по мере увеличения глубины их залегания:
1. почвенный образец взят из темногумусового горизонта почвенного разреза. Глубина 7 – 12 см, цвет темно-серый, структура зернистая, наблюдается обилие мелких корней;
2. образец взят из горизонта темногумусового с признаками оглеения почвенного разреза. Глубина 12 – 16 см, цвет темно-серый, наблюдаются мелкие серые, рыжие и сизые пятна, в качестве включений представлены мелкие корни, механический состав определяется как среднесуглинистый;
3. образец взят из светлогумусового горизонта почвенного разреза. Глубина 16 – 23 см, цвет серый, наблюдаются рыжие и сизые пятна, механический состав определяется как среднесуглинистый, структура зернисто-комковатая, в качестве включений представлены мелкие корни;
Реклама

4. образец взят из иллювиально-гумусово-железистого горизонта почвенного разреза. Глубина 25 – 45 см, преобладающий цвет светло-бурый с многочисленными охристыми, сизыми и голубыми затеками и пятнами; до глубины 45 см заметны затеки гумусового вещества; горизонт плотного сложения, сильно увлажнен; механический состав определяется как легкоглинистый;
5. образец взят из глеевого горизонта почвенного разреза. Глубина 45 – 70 см, цвет темно-серый, присутствуют кирпично-красные включения; горизонт более уплотнен, с глубины 70 см просачивается вода.
Подготовку почвенных образцов проводили согласно существующим рекомендациям [7].
1. Почву высыпали на сухое стекло, тщательно перемешивали и раскладывали ровным слоем. Пользуясь пинцетом, удаляли мелкие корешки и другие посторонние включения. Из разных мест рассыпанной почвы отбирали небольшие порции и взвешивали на технических весах по 1 г почвы из каждого горизонта.
2. Для разрушения почвенных агрегатов и десорбции клеток микроорганизмов с почвенных частиц, каждую навеску почвы вносили в отдельную колбу, содержащую 100 мл стерильного физиологического раствора (0,5% раствор хлорида натрия). Колбы встряхивали на качалке в течение 30 минут.
1.2
Определение общей численности бактерий в почве
Общее количество бактерий в почве учитывали прямым счетом на фиксированных окрашенных мазках (метод Виноградского-Брида) [6;7].
1. Пять предметных стекол обезжиривали и на каждом обводили карандашом по стеклу квадрат со стороной 15 мм.
2. Бактериальную суспензию объемом 0,1 мл из соответствующей колбы наносили на стекло и равномерно распределяли по площади квадрата.
3. Препараты подсушивали на воздухе, фиксировали в пламени спиртовки (проносили над пламенем 2 – 3 раза) и окрашивали 2 минуты фуксином. Краситель сливали, препарат промывали и высушивали между полосками фильтровальной бумаги.
4. Подсчитывали количество клеток, используя световой микроскоп марки «Биолам» с масляной иммерсионной системой при увеличении 10×1,0×100.
Для прямого счета микробных клеток вставляли в окуляр микроскопа сеточку Гаженко, 9 маленьких квадратиков которой составляют поле зрения. Просматривали 15 полей зрения.
Общую численность бактерий в 1 г почвы (Nобщ.
)определяли по формуле:
S
× Σ
ni
N
общ.
=
z
×
s
×
v
×
100 [кл/г], где
S – общая площадь окрашенного на стекле препарата (225 мм2
);
Σni
– сумма подсчитанных под микроскопом микробных клеток;
z – количество просмотренных полей зрения (15);
s – площадь одного поля зрения (1089×
10-6
мм2
);
v – объем образца воды, затраченный на приготовление окрашенного препарата (0,1 мл);
100 – разведение первоначального образца почвы в 100 раз.
Опыт проводили в двухкратной повторности, чтобы рассчитать доверительный интервал.
1.3
Определение численности сапротрофов и олиготрофов
Определение количества клеток сапротрофов (Nсапр.
)проводили высевом на жидкую питательную среду – мясо-пептонный бульон (МПБ) [6]. Для приготовления МПБ использовали стандартную питательную среду (ИЛО «Питательные среды»). Состав МПБ, г/л: панкреатический гидролизат кильки – 17,9; NaCl – 7,7 ± 0,3; вода дистиллированная – 1000 мл. Среду стерилизовали автоклавированием 20 мин при 1 атм. Численность определяли при помощи метода наиболее вероятного числа (НВЧ) с использованием таблиц Мак-Креди [7].Готовилиряд предельных десятикратных разведений 1 г почвы. Для посевов использовали разведения от 10-1
до 10-7
. Количество посевного материала везде составляло 1 мл, посев осуществляли в трехкратной повторности. Инкубацию проводили в термостате при 28 0
С в течение 7 сут. После инкубации регистрировали рост бактерий, используя различные показатели: помутнение среды, образование пленки [6;7].
Для выделения олиготрофов использовали среду М2 следующего состава [11]: Na2
HPO4
– 0,8 г; KH2
PO4
– 0,5 г; NH4
Cl– 0,5 г; MgSO4
– 0,2 г; CaCl2
– 0,1 г; FeSO4
×7H2
O –15 мг; дрожжевой экстракт – 0,1 г ; пептон – 0,2 г; агар – 15 г; глюкоза – 0,2 г; вода дистиллированная – 1000 мл. Среду стерилизовали автоклавированием 20 мин при 1 атм. Численность олиготрофов (Nолиг.
) определяли методом высева по Коху [7]. Готовили ряд предельных десятикратных разведений 1 г почвы в дистиллированной воде: от 10-1
до 10-9
.По 1 мл суспензии из каждого разведения вносили в три параллельные чашки Петри. Все чашки заливали расплавленной средой. Посевы инкубировали 14 сут., а затем подсчитывали количество колоний, выросших на каждой чашке и среднее число колоний, выросших из одного разведения. При этом определяли значимость различий двух повторных определений по критерию χ2
, рассчитываемому по формуле [7]:
(
ni
–
n
)2
χ
2
= п
,
где п
i
– число колоний, выросших на первой и второй чашках, засеянных из одного разведения; п
– их среднее значение.
Различие считается значимым при χ
2
не менее 3,841. Пересчет числа выросших колоний (п
) на численность бактерий соответствующей группы (N
) производили исходя из предположения, что одной колониеобразующей единицей (КОЕ) является отдельная микробная клетка. Для этого использовали формулу:
n
×
r
N
олиг.
=
v
[кл/г],
где п
– среднее число колоний на чашках Петри, засеянных из одного разведения; r
– величина разведения; v
– объем образца, посеянного на чашку (мл).
Кроме того, рассчитывали отношение Nсапр.
к Nобщ.
для каждого горизонта.
2
Результаты и обсуждение исследования
Результаты начального этапа микробиологического исследования почвенных образцов представлены в приложении 2 и на рисунке 1.
Таблица 1
Общая численность бактерий в почвенном профиле
дерновой альфегумусовой глеевой почвы
| Горизонты (расположены от верхнего к нижнему) |
Численность бактерий, кл/г сухой почвы
|
| 1. |
(5,35±0,05)×
109
|
| 2. |
(6,2±0,1)×109
|
| 3. |
(4,8±0,15)×109
|
| 4. |
(4,5±0,05)×109
|
| 5. |
(3,65±0,1)×109
|
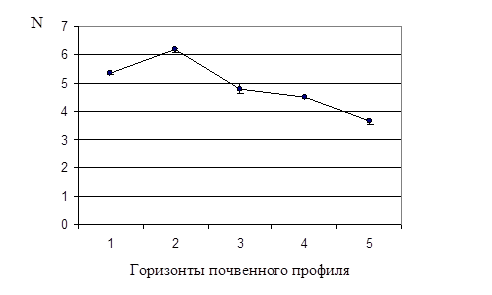
Рис. 1. Динамика общей численности бактерий в почвенном профиле дерновой альфегумусовой глеевой почвы.
N
– численность бактерий
(× 109
кл/г почвы).
Как видно из табл. 1 и рис. 1, максимальное значение общей численности бактерий (Nобщ.
)– 6,2×109
кл/г – наблюдали во втором горизонте, по сравнению с остальными четырьмя горизонтами. Этот факт можно объяснить тем, что два верхних горизонта исследуемой почвы обладают хорошей проницаемостью для воды и поступающего с ней органического вещества. Третий горизонт почвенного профиля уже более уплотнен, поэтому органическое вещество, накапливаясь во втором горизонте, является фактором, стимулирующим развитие в нем почвенных микроорганизмов.
Данные табл. 1 показывают, что Nобщ.
достоверно снижалась с увеличением глубины залегания почвенного горизонта: от второго к пятому, самому нижнему. Полученный результат согласуется с тем фактом, что содержание органического вещества, необходимого для развития почвенных микроорганизмов, также снижается с увеличением глубины залегания горизонта. При переходе от верхнего горизонта к нижележащим изменяются также окислительно-восстановительные условия, pH и др.
Порядок величин Nобщ.
в каждом горизонте был одинаков – 109
кл/г. По-видимому, в верхних более рыхлых горизонтах, куда поступает достаточное количество кислорода с поверхности, создались оптимальные условия для развития аэробных микроорганизмов. В нижележащих горизонтах содержание кислорода минимально, и прежний порядок значения Nобщ.
объясняется активным развитием анаэробов.
Численность сапротрофных бактерий (Nсапр.
) уменьшалась от первого горизонта к третьему, причем резкое снижение численности – более чем в 6 раз – было отмечено при переходе от первого ко второму горизонту (рис. 2А). Nсапр.
(таб.2) в четвертом горизонте – 4,5×104
кл/г – была незначительно выше, по сравнению с третьим – 2,0×104
кл/г, – тогда как в пятом она опять понижалось до значения, отмеченного в третьем горизонте (рис. 2А). Как показано на рис. 2Б, численность олиготрофных бактерий (Nолиг.
) последовательно снижалась с увеличением глубины залегания почвенного горизонта от 9,5×107
в первом до 1,5×107
кл/г в пятом горизонте (таб.2).
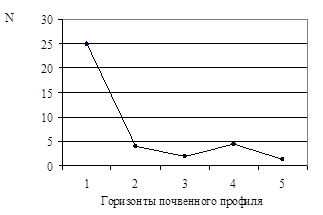
Рис. 2. Численность сапротрофов (А) и олиготрофов (Б) в почвенном профиле дерновой альфегумусовой глеевой почвы.
N
– численность бактерий (кл/г почвы)
Таблица 2
Численность сапротрофных и олиготрофных бактерий в почвенном профиле дерновой альфегумусовой глеевой почвы
| Горизонт |
Сапротрофы |
Олиготрофы |
| 1 |
2,5×105
|
9,5×107
|
| 2 |
4,0×104
|
7,5×107
|
| 3 |
2,0×104
|
3,5×107
|
| 4 |
4,5×104
|
2,0×107
|
| 5 |
1,4×104
|
1,5×107
|
В общем, Nсапр.
находилась на уровне 105
кл/гв первом, и 104
кл/г в остальных горизонтах (прил. 3). Nолиг.
соответствовала 107
кл/г в каждом горизонте профиля. Таким образом, Nолиг.
была меньше, чемNсапр.
: в первом горизонте в 100, а в остальных четырех – в 1000 раз. Выявленное значительное преобладание олиготрофов над сапротрофами свидетельствует о том, что в исследованной почве низкое содержание легкоразлагаемой органики [2], следовательно, данная почва не подвергалась антропогенному загрязнению. Бактерии функционируют в ней за счет органического вещества самой почвы. Сапротрофы, развивающиеся в условиях высокой концентрации органики [3;4], уже переработали ее большую часть. В настоящее время в исследованной почве доминируют олиготрофы, которым для существования необходимо низкое содержание органики в среде [2;4].
Интересным является факт, что для горизонтов с четвертого по пятый отмечаются признаки оглеения почвы – сизые и голубые пятна и затеки. В настоящее время известны три совокупные причины глеегенеза [5]: 1) высокая влажность; 2) наличие легкоразлагаемого органического вещества в избыточном количестве; 3) жизнедеятельность гетеротрофных микроорганизмов. Согласно нашим результатам, процесс глеегенеза идет в исследуемой почве при доминировании в микробоценозе олиготрофных бактерий, а, следовательно, в отсутствие избытка органического вещества.
Отношение Nсапр.
к Nобщ.
составило величины порядка 10-4
– 10-5
(табл.3), что свидетельствует о климаксном состоянии микробоценоза [3] и о доминировании бактерий, которые получают необходимые питательные вещества и энергию за счет использования трудноразлагаемых органических веществ почвы в течение длительного времени.
Таблица 3
Отношение общей численности к численности сапротрофных бактерий в почвенном профиле дерновой альфегумусовой глеевой почвы
| Горизонты (расположены от верхнего к нижнему) |
N
сапр.
Nобщ.
|
| 1. |
0,5×
10-4
|
| 2. |
0,6×10-5
|
| 3. |
0,4×10-5
|
| 4. |
1,0×10-5
|
| 5. |
0,4×10-5
|
Примечание: Nсапр.
– численность сапротрофных бактерий (кл/г); Nобщ.
– общая численность бактерий (кл/г).
Заключение
1. Общая численность бактерий снижается с глубиной залегания почвенного горизонта, максимальное значение – 6,2×109
кл/г – наблюдается во втором горизонте за счет того, что два верхних горизонта исследуемой почвы обладают хорошей проницаемостью для воды и поступающего с ней органического вещества.
2. Количество сапротрофных бактерий уменьшалось от первого горизонта к третьему – от 2,5×105
до 1,4×104
кл/г, – причем резкое снижение численности – более чем в 6 раз (от 2,5×105
до 4,0×104
кл/г) – было отмечено при переходе от первого ко второму горизонту.
3. Численность олиготрофных бактерий последовательно снижалась с увеличением глубины залегания почвенного горизонта от 9,5×107
в первом до 1,5×107
кл/г в пятом горизонтах.
4. Отношение численности олиготрофных бактерий к сапротрофным для первого горизонта составляет величину порядка 102
, а в остальных четырех – 103
, что свидетельствует о значительном преобладании олиготрофов над сапротрофами.
5. Отношение численности сапротрофных бактерий к общей численности бактерий составляет величины порядка 10-4
– 10-5
, что свидетельствует о климаксном состоянии микробоценоза и о доминировании бактерий, жизнедеятельность которых связана с использованием трудноразлагаемых органических веществ почвы.
6. Согласно нашим результатам, процесс глеегенеза идет в исследуемой почве при доминировании в микробоценозе олиготрофных бактерий, а, следовательно, в отсутствие избытка органического вещества.
Список использованных источников и литературы
1. Бабьева И.П. Биология почв / И.П. Бабьева, Г.М. Зенова. – М.: МГУ, 1989. – 336 с.
2. Емцев В.Т. Микробиология / В.Т. Емцев, Е.Н. Мишустин. – М.: Дрофа, 2005. – 445 с.
3. Добровольская Т.Г. О показателях структуры микробных сообществ / Т.Г. Добровольская, И.Ю. Чернов, Д.Г. Звягинцев // Микробиология. – 1997. – Т.66. – №3. – С. 408–414.
4. Заварзин Г.А. Введение в природоведческую микробиологию / Г.А. Заварзин, Н.Т. Колотилова. – М.: Книжный дом «Университет», 2001. – 256 с.
5. Зайдельман, Ф.Р. Процесс глееобразования и его роль в формировании почв / Ф.Р. Зайдельман. – М.: МГУ, 1998. – 316 с.
6. Кузнецов С.И. Методы изучения водных микроорганизмов / С.И. Кузнецов, Г.А. Дубинина. – М.: Наука, 1989. – 288 с.
7. Практикум по микробиологии / Под ред. Н.С. Егорова. – М: МГУ, 1976. – 307 с.
8. Соединения железа, алюминия, кремния и марганца в почвах лесных экосистем таежной зоны / М. Мурашкина, Г. Копцик, и др. // Почвоведение. – 2004. – № 1. – С. 40– 49.
9. Умаров М.М. Экология и почвы / М.М. Умаров. Избранные лекции 1–7 школ, М.: Пущино, 1998, 15–21 с.
10. Экология микроорганизмов: учебник / А. И. Нетрусов, Е.А. Бонч - Осмоловская, и др. – М.: Издательский центр «Академия», 2004. – 272с.
11. Hottes A.K. Transcriptional profiling of Caulobacter crescentus during growth on complex and minimal media / A.K. Hottes, M. McEwen, D. Yang et al. // J. Bacteriol. – 2004. – V. 186. – №5. – P. 1448–1461.
|