Дипломная работа
Оценка влияния микробиологических препаратов
на тлей и их энтомофага - хищную галлицу
Aphidoletes aphidimyza Rond
C
одержание
Введение
1. Литературный обзор
1.1 Тли, вредящие в защищенном грунте
1.2 Энтомофаги, применяемые против тлей в теплицах
1.3 Микробиологическая борьба с вредителями защищенного грунта
1.3.1 Систематическое положение актиномицетов
1.3.2 Распространение и экология
1.3.3 Препараты на основе актиномицетов рода Streptomyces
2. Материалы и методы
2.1 Место проведения опытов и материалы
2.1.2 Методы
2.1.3 Методика разведения виковой тли
2.1.4 Разведение галлицы
2.1.4.1 Оценка влияния микробиологических препаратов на пятнистую оранжерейную тлю в лабораторных условиях
2.1.4.2 Оценка влияния препаратов S-100кр. и П-56-1 на галлицу Aphidoletes aphidimyza
3. Результаты и обсуждение
3.1 Оценка влияния микробиологических препаратов на выживаемость и развитие пятнистой оранжерейной тли
3.2 Оценка влияния препаратов П-56-1 и S-100кр. на выживаемость и развитие пятнистой оранжерейной тли
3.3. Оценка влияния препаратов П-56-1 и S-100кр. на выживаемость галлицы Aphidoletes aphidimyza на эмбриональной стадии развития
3.4. Оценка влияния препаратов П-56-1 и S-100кр. на выживаемость Aphidoletes aphidimyza на личиночной стадии развития
3.5 Оценка влияния П-56 и S-100кр. на выживаемость галлицы Aphidoletes aphidimyza Rond. на стадии образования куколки
3.6 Оценка влияния препаратов П-56-1 и S-100кр. на выживаемость Aphidoletes aphidimyza на стадии имаго
4. Определение экономической эффективности применения биопрепаратов в защите основных сельскохозяйственных культур
5. Безопасность и экология
5.1 Анализ условий и охраны труда
5.2 Организационные мероприятия и рекомендации по улучшению условий и охраны труда
5.3 Производственная санитария
5.4 Техника безопасности и пожарная безопасность
5.4.1 Требования безопасности к технологическим процессам
5.4.2 Техника безопасности при работе с насекомыми в теплицах
5.4.2.1 Требования безопасности при массовом разведении галлицы
5.4.3 Пожарная безопасность
5.5 Безопасность в чрезвычайных ситуациях
5.6 Экология
Выводы
Список литературы
Введение
Для подавления вредной деятельности тлей хозяйства вынуждены проводить в период вегетации многократные обработки растений различными инсектицидами. Регулярно повторяющиеся опрыскивания приводят к быстрому появлению устойчивых рас вредителей и снижают эффективность обработок. На эффективность обработок отрицательно сказывается также необходимость ограничения сроков опрыскиваний. Токсичность ядов для пчел и неблагоприятное воздействие инсектицидов на почву и растения – одна из причин снижения урожая. Химическому методу свойственны и другие недостатки. Поэтому применение биологического метода борьбы с тлями в теплицах, оранжереях и парниках представляет большой практический интерес.
Реклама

Биологический метод борьбы с рядом опасных вредителей, причиняющих большой ущерб урожаю сельскохозяйственных культур, высокоэффективен как предупреждающий и сдерживающий их массовое размножение, распространение и вредоносность, безопасен для человека и теплокровных животных, насекомых опылителей и всей окружающей среды. Эффективность этого метода в значительной мере повышается при разумном сочетании его с агротехническими и химическими средствами.
Применение биологических средств защиты растений обеспечивает не только экономический (повышение урожайности, улучшение качества продукции, снижение себестоимости продукции, рост уровня рентабельности производства), но и социальный эффект (улучшение санитарно-гигиенических условий труда, улучшение условий окружающей среды). Однако, использование галлицы афидимизы, как и других энтомофагов сталкивается с необходимостью сочетания их применения с химическими препаратами против болезней растений. Эти препараты могут оказывать негативное действие на полезную фауну. Поэтому в последние годы очень актуальной задачей в разработке современной интегрированной системы защиты растений является оценка действия микробиологических инсектицидов на полезные виды членистоногих.
Цель работы
заключается в изучении возможности совместного использования энтомофага хищной галлицы Aphidoletes aphidimyza
Rond. и препаратов микробиологического происхождения предназначенных для использования против сосущих вредителей в защищенном грунте, а также оценить эффективность микробиологических препаратов на тлях. Для достижения этих целей нам необходимо было выполнить следующие задачи
.
1) Оценить влияние микробиологических препаратов на выживаемость и развитие пятнистой оранжерейной тли;
2) Оценить влияние П-56-1 и S-100кр. на выживаемость хищной галлицы Aphidoletes aphidimyza
Rond. на разных стадиях развития.
Реклама

1.
Литературный
обзор
1.1 Тли, вредящие в защищенном грунте
Тли – широко распространенная и многочисленная группа сосущих насекомых-фитофагов, наносящих значительный экономический ущерб культурным растениям. Они относятся к отряду Homoptera –равнокрылые, семейству Aphididae –тли. При благоприятных условиях среды в короткие сроки достигают очень высокой численности.
Особенно вредоносны тли в условиях защищенного грунта, где складывается оптимальная ситуация для их развития (высокая температура и влажность, неограниченная кормовая база, отсутствие естественных врагов), что приводит иногда к полной потере урожая.
Вредоносность тлей обусловлена тем, что при питании они высасывают большое количество растительного сока и при этом вводят в ткань растений токсические и биологически активные вещества. Все это ведет к ухудшению питания растений, снижает их прирост, плодоношение, засухоустойчивость, холодостойкость и долговечность, приводит к деформации листьев и побегов, нарушая их функции. Опасность тлей усугубляется также тем, что они являются переносчиками более 270 различных видов фитопатогенных вирусов. На сладких экскрементах тлей (пади) в изобилии поселяется сажистый грибок, существенно затрудняющий фотосинтез и ухудшающий качество продукции.
Всего известно 3500 видов тлей, из них 30% - опаснейшие вредители растений, около 30 видов встречаются в закрытом грунте.
Бахчевая тля ( Aphisfragulae). Окраска тела изменчива – от желтой до темно-зеленой, почти черной. Личинки желтые или зеленые. Бескрылые самки имеют овальное тело длиной 2,2 мм, трубочки черные, хвостик с перехватом у основания. У крылатых тлей тело длиной 1,2-1,8 мм, голова черная, брюшко желтое или зеленое, с темными пятнами. Зимует в стадии личинки, нимфы и имаго, преимущественно на сорняках. Первые поколения вредителя состоят из бескрылых особей, позднее появляются и крылатые самки. Самка размножается девственным путем, рождая до 80 личинок. Развитие от личинки до взрослой особи длится 6-10 дней, после чего вновь происходит отрождение личинок. Развитие тли идет быстрее при умеренной влажности и температуре воздуха. Температура выше 30ºС угнетает насекомых. Оптимальными условиями для их развития являются температура 23-25ºС и относительная влажность воздуха 80-85%. Бахчевая тля повреждает побеги, цветки, завязи и листья, вызывая их деформацию.
Зеленая персиковая или оранжерейная тля (Myzuspersicae). Окраска тела от светло- и темно-зеленой до желтой, коричневой и розовой. Глаза коричневые. Длина тела бескрылых тлей 1,4-2,5 мм, крылатых – 1,4-2 мм. У крылатых особей голова темно-бурая, средняя и задняя грудь черные, брюшко желтое или зеленое с черными или темно-зелеными поперечными полосками. Трубочки и ноги светлые, вершина голеней, бедер и лапок черные. Усики расположены на лобных бугорках, между которыми имеется продольный желобок.
В южной зоне, являясь видом с полным циклом, персиковая тля осенью откладывает зимующие яйца на ветки персика, абрикоса и миндаля. Здесь же весной развивается первое поколение. Затем тля мигрирует с деревьев персика на сорняки и культурные растения. В более северных районах страны тля развивается на травянистых растениях, не откладывая яиц. В средней и северной зоне персиковая тля наносит вред преимущественно в теплицах, перезимовывая в отапливаемых помещениях на растительных остатках, зеленных и декоративных культурах. В теплицах при температуре 23-25 градусов и относительной влажности воздуха 80-85% развитие тли идет очень быстро, и она дает много поколений. Вредитель заселяет побеги, листья, цветки и стебли растений, вызывая скручивание листьев, задержку роста растений. Кроме непосредственного вреда, причиняемого культурам, тля является переносчиком вирусных заболеваний растений. Предпочитает сладкий перец, салат, зеленные, а также декоративные культуры.
Обыкновенная картофельная тля (AulacorthumsolaniKalt.). Форма тела удлиненно-овальная. Длина тела крылатых особей 2,3-3 мм, бескрылых – 2-2,3 мм. Окраска тела бескрылых тлей оливково-зеленая. У слабопигментированных крылатых особей голова и грудь светло-коричневые, концы члеников усиков, бедер и трубочек коричневые, дорсальная поверхность брюшка без рисунка. У сильнопигментированных форм передняя часть тела коричневая. Усики длиннее тела. Первые три членика усика коричневые, а последние темные. Трубочки длинные, выступают за конец тела, светлые или светло-коричневые. Хвостик мечевидной формы, широкий, с затупленной вершиной, имеет с каждой стороны 3-4 волоска (Чалков А. А., 1986). Вид распространен повсеместно. Размножается исключительно живорождением, обоеполое поколение неизвестно. Полифаг. Зимует в теплицах на хризантеме, салате, петрушке, сельдерее. В летний период размножается на картофеле, лютике. При питании образует светло-желтые пятна, которые постепенно разрастаются, вызывая деформацию и гибель листа (Дорохова Г. И., 2003).
Большая картофельная тля (MacrosiphumeuphorbiaeThom.). Форма тела продолговато-овальная, вытянутая, заостренная к заднему концу. Длина тела бескрылых особей 2,7-2,8 мм, крылатых – 2,3-3,4 мм. Усики длиннее тела. У основания усиков имеются приантенные бугры, но они менее выражены, чем у персиковой тли. У бескрылых тлей трубочки длинные, вытянутые и выступают за конец тела. Трубочки у основания бесцветные, а на вершинах коричневые. Хвостик сильно вытянут, мечевидный, имеет по обеим сторонам по 5 волосков. Окраска бескрылых тлей интенсивно-зеленая с характерной темно-зеленой продольной полоской на дорсальной поверхности брюшка. Иногда встречаются тли со светло-зеленой или розовой окраской. У крылатых тлей голова, грудь, первые три членика усиков и хвостик светло-коричневые. Развивается без смены хозяев (аутоцийно), образует физиологические расы, отличающиеся по цвету (от интенсивно зеленых до светло-зеленых и розовых). Полифаг. Круг кормовых растений сходен с обыкновенной картофельной тлей, сюда также входят бодяк, марь белая, осот полевой, капуста. В теплицах в осенне-зимний период размножается на кочанном салате. Тля обычно неполноцикловая.
Пятнистая оранжерейная тля (AulacorthumcircurumflexusBuckt). Неполноциклый вид, полифаг. Значительный ущерб наносит в теплицах осенью и зимой на зеленных. Поврежденные листья обычно не деформируются, однако на цветках некоторых культур появляются желтые пятна, лепестки слегка завертываются с краев. Тля способна переносить некоторых возбудителей вирусных инфекций. Заселяет комнатные и оранжерейные культуры.
Салатная тля (HyperomyzuslactucaeL.). Развивается полноцикло, со сменой первичного хозяина на вторичного. Первичный хозяин – это разные виды смородины (черная, реже золотистая, красная, альпийская) и европейский крыжовник. Личинки основательниц на молодых листьях указанных видов растений образуют выпуклости, которые принимают зеленовато-желтую, а не красную окраску. Колонии располагаются на молодых побегах, черешках листьев и листьях. Промежуточными растениями являются растения семейства сложноцветные: салат, осот полевой, цикорий и др. В теплицах повреждает кочанный салат. Половые самки бескрылы, самцы крылаты. Может развиваться неполноцикло, зимуя в фазе личинки или имаго в условиях теплицах (Дорохова Г. И., 2003).
1.2 Энтомофаги, применяемые против тлей в теплицах
Против комплекса тлей в защищенном грунте применяется целый ряд энтомофагов. К ним относятся хищники-полифаги и паразиты, специализируются на конкретных видах.
К группе хищников полифагов и олигофагов относятся представители отрядов сетчатокрылых (златоглазки, микромус), двукрылых (галлица афидимиза), полужесткокрылых (хищные клопы – ориус, антокорис, макролофус) и жесткокрылых (хищные коровки). Группа паразитов включает представителей отряда перепончатокрылых из семейств афеленид и афидиид.
Наилучший результат достигается при использовании афидиид. При обнаружении тли в теплице раскладыванием мумии паразитов в соотношении паразит:хозяин 1:5, 1:10 (Ермолаев Н.Е., 1999). Повторно паразитов раскладывают через 5-7 дней, так как к этому времени заканчивается репродуктивный период у 1-ой их партии, а потомки начнут появляться лишь спустя 7-9 дней. Обычно при благоприятных условиях и соблюдении норм и кратности выпуска афидофагов тли полностью исчезает из теплицы через 30-40 дней с начала выпусков. В очаги с высокой плотностью вредителей может дополнительно раскладывать личинок хищников (галлицы, златоглазки, кокцинеллиды), которые способны быстро снизить численность жертвы. Норма выпуска хищников зависит от вида, но чаще всего используют соотношение хищник:жертва 1:5 – 1:10 (Ахатов А.К., Ижевский С.С., Миронова М.К., 1997, №6).
Галлица афидимиза
- Aphidoletes aphidimyza Rond.
(Diptera, Cecidomyiidae). Галлица является специализированным энтомофагом (олигофагом) и способна питаться более чем 65 видами тлей на большинстве сельскохозяйственных и декоративных культур (Ермолаев, 1984; 1998в). Самки галлицы отыскивают колонии тлей по запаху и откладывают яйца на поверхность листа или непосредственно на спинку тли. Взрослые насекомые слизывают "медвяную росу" и капельки влаги с поверхности листьев. Большая эффективность галлицы обусловлена тем, что её самки обладают высокой поисковой способностью и порог их реакции на плотность популяции жертвы значительно ниже, чем у коровок, сирфид и златоглазок (Асякин Б.П., 1974; Бондаренко Н.В., Асякин Б.П., 1974, 1975а; Бондаренко Н.В., Гавелка, 1977). Благодаря хорошей поисковой способности самок при откладке яиц они размещают их в непосредственной близости от тлей (0,2-1 см) или непосредственно на самих тлях. Из-за своих незначительных размеров они легко маскируются в колониях тлей (Асякин Б.П., 1976). Личинки галлицы особенно хорошо передвигаются по влажной листовой поверхности со скоростью до 3-4 см/мин, даже опушенность листьев (например, у томатов и огурцов) не припятствует передвижению личинок и не влияет на эффективность поиска жертвы. Поэтому своевременные поливы растений огурцов и томатов, а так же хороший тургор их листьев повышают миграционные способности и эффективность личинок афидимизы в борьбе с тлями в теплицах (Асякин, 1974, 1976).
Необходимо отметить, что у личинок афидимизы отсутствует каннибализм даже при длительном отсутствии пищи. Галлица обладает хорошо выраженной количественной реакцией на жертву (Ермолаев, 1984; Кузнецова и др., 1984; Ermolaev, 1998; Pavlyshine, 1998). По данным Ермолаева (2000) нижний порог численности бахчевой тли, при котором самки галлиц начинают откладывать яйца равен 1 особи.
Златоглазки
(сем. Chrysopidae – златоглазки, отряд Neuroptera – сетчатокрылые). Хищники, широкие олигофаги. Применяют златоглазок на стадии личинки или яйца способом сезонной колонизации тлей. Лучшие результаты дает выпуск личинок 2-го возраста. Их рекомендовано выпускать в очаги в соотношении хищник-жертва от 1:5 до 1:10. Успех применения зависит от своевременного обнаружения очагов тлей.
Микромус –
Micromus
angulatus
Steph
. (сем. Hemerobiidae – гемеробииды, отряд Neuroptera - сетчатокрылые). Хищник. Выпускают в теплицы микромуса на стадии личинки 1-2 возрастов или яйца. При постоянной температуре применяют на стадии яйца в соотношениях от 1:1 до 1:5. Наиболее рационально применение микромуса в колониях тлей с высокой плотностью вредителя (от 400 до 1000 особей на растение), а также совместно с другими энтомофагами.
Ориус –
Orius
niger
Wolff
.
(сем. Anthocoridae, отрядHemiptera – полужесткокрылые). Хищный клоп. Питается бахчевой тлей.
Антокорис –
Anthocoris
nemorum
L
.
(
сем. Anthocoridae – антокориды, отряд Hemiptera – полужесткокрылые). Широкий полифаг. Хищничают имаго и личинки. Разводят на персиковой тле. Выпускают в соотношении хищник-жертва 1:5 – 1:10, при выявлении очагов вредителя.
Циклонеда –
Cicloneda
limbifer
Casey
.
(сем. Coccinellidae – коровки, отряд Coleoptera – жесткокрылые). Интродуцированный тропический вид, не уходит при коротком дне в диапаузу. Разводят на бобовой тле, на конских бобах. Взрослый жук уничтожает в среднем до 34 тлей в сутки.
Китайская коровка –
Leis
dimidiate
Fabr
.
(сем. Coccinelidae – коровки, отряд Coleoptera – жесткокрылые). При коротком дне не уходит в диапаузу. Более активный хищник, по сравнению с циклонедой. Эффективна при высокой численности вредителя. Колонизация леис в теплицах затруднена из-за ее повышенной способности к миграции. Леис более эффективен при высоких температурах и высокой плотности тлей, чем другие энтомофаги-хищники, в частности циклонеда. Разведение этого объекта трудоемко из-за канибализма личинок.
Афидиус –
Aphidius
matricaria
Hal
.
(сем. Aphidiidae – афидииды, отряд Hymenoptera – перепончатокрылые). Наездник, паразитирующий на тле. Широкий олигофаг. Заражает личинок 2-3 возрастов, реже нимф и взрослых особей. В одном хозяине развивается одна личинка. Окукливание происходит в шкурке тли (так называемая мумия).
Афелинус –
Aphelinus
asychis
Wlk
.
(сем. Aphelinidae – афелиниды, отряд Hymenoptera – перепончатокрылые). Применяется в борьбе с большой картофельной и персиковой тлей на огурцах и зеленных культурах. Паразитирует на тле, предпочитая средние и старшие ее возраста.
1.3 Микробиологический метод борьбы с вредителями защищенного грунта
Условия защищенного грунта в большей степени пригодны для применения биологических средств защиты растений. Этому способствует ряд факторов: ограниченность и замкнутость пространства, возможность регулирования условий выращивания так, чтобы создать более благоприятные условия для развития биоагента и, напротив, неблагоприятные для вредителей.
В защищенном грунте против вредителей растений нашли применение главным образом микробиологические препараты на основе бактерий, потенциально способных регулировать численность вредителей. Среди бактерий известно много видов, связанных трофически с беспозвоночными животными, прежде всего, с насекомыми. Но в отношении вредителей защищенного грунта паразитической активностью обладают единичные виды. В то же время показана возможность высокоэффективного использования против тлей, клещей, трипсов и др. токсичных вторичных метаболитов некоторых бактерий (Streptomycesssp. и др.). В настоящее время подобные препараты интенсивно разрабатываются во многих странах (Штерншис Н.В., 2000). Однако они являются по существу химическими пестицидами, с той лишь разницей, что синтезируются с учетом биогенного происхождения такие препараты правильно рассматривать самостоятельно, называя «биохимическими средствами», а не биологическими, поскольку их использование не вписывается в ключевую идею биологического метода (Ахатов А.К., Ижевский С.С. (ред.), 2004).
1.3.1 Систематическое положение актиномицетов
Актиномицеты относятся к Царству
Bacteria
(строение нуклеотида напоминает бактерии, поэтому актиномицеты относятся к прокариотам), Отделу
Firmicutes
(по наличию клеточной стенки, грамположительные кокки, палочки, нитевидной формы, подвижные и неподвижные, споро- и неспорообразующие, аэробы и анаэробы, нефотосинтетики), Классу
Tallobacteria
(палочки неправильной формы, изогнутые, с заостренными или вздутыми концами, имеющие форму нитей (гиф), ветвящиеся с образованием таллома (мицелия)), Группе 22-29 Актиномицеты
. Группы объединяют организмы с характерным нитчатым строением клетки. В отдельных случаях и в известном приближении актиномицеты сходны по сложности морфологии с несовершенными грибами, за которые их и принимали в прошлом. В общих чертах мицелий похож на мицелий плесневидных грибков, но отличается от него более мелким размером поперечника и отсутствием в клетках сформированного ядра (Курсанов Л.И., 1960). Нити (гифы) ветвятся с образованием мицелия или распадаются на палочки и кокки. Различают субстратный и воздушный мицелий. На последнем часто формируются специальные спороносные гифы, распадающиеся на споры. Актиномицеты различаются по характеру расположения конидий: одиночные конидии, пары конидий, короткие цепочки конидий до 20 спор, длинные цепочки конидий и конидиенесущие гифы могут быть соединены в синнемы – пучки гиф, из которых высвобождаются подвижные споры. Спорангии могут образовываться на хорошо развитых воздушных гифах или на поверхности колоний со слабо развитым воздушным мицелием либо без него, либо в толще агара.
Размножение
Актиномицеты имеют специальные органы размножения – спороносцы. Они могут быть прямые, волнистые или спиральные. Они отличаются между собой также по расположению на гифах и могут быть по одному, мутовчатые или пучкообразные. Различают два вида споруляции.
Фрагментация. В цитоплазме происходит распределение ядерного вещества (хроматина). Зерна хроматина располагаются на определенном расстоянии друг от друга. Вокруг их концентрируется цитоплазма, и образуются проспоры. Проспоры покрываются оболочкой и превращаются в спору. Оболочка гифы лизируется, и споры освобождаются. Средний диаметр спор 1 мк. Форма спор может быть шаровидной, продолговатой или палочковидной. Оболочка спор может быть гладкой, шишковидной, игловидной, волосистой и бугристой. Характер поверхности спор является стабильным признаком, ценным при определении вида актиномицета.
Сегментация. На всем протяжении спороносной ветки образуются перегородки, и ветка расчленяется на отдельные споры. Но сначала споры цилиндрические с резко обрезанными краями, потом спора округляется. После созревания спор спороносец распадается на отдельные споры. Путем сегментации споры образуются у проактиномицетов и нескольких видов актиномицетов. Остальные актиномицеты образуют споры путем фрагментации. Актиномицеты могут размножаться так же оторвавшимися ветками и обрывками мицелия (Вулфа Л., 1974).
Большинство актиномицетов – аэробы, некоторые – факультативные или облигатные анаэробы. Хемогетеротрофы; используют разнообразные источники энергии, в том числе сложные полимеры. Свободноживущие (большинство), симбиотические (в том числе азотфиксирующие), некоторые патогенны для растений, животных, человека. Колонии актиномицетов часто окрашены в различные цвета. Многие актиномицеты образуют пигмент, который иногда выделяется в питательную среду (антоцианы, каротиноиды и др.). Многие актиномицеты при освещении ультрафиолетовыми лучами флуоресцируют. Флуоресцирующее вещество может выделяться в среду.
Группа 25. Стрептомицеты и близкие роды
Гетерогенная группа, для всех таксонов которой характерны клеточные стенки, содержащие L-ДАПк*
и глицин. Нити не распадаются на фрагменты и могут образовывать обильный воздушный мицелий с длинными цепочками спор (Заварзин Г.А. (ред.), 1997). Воздушный мицелий – густая, пушистая масса, поднимающаяся с поверхности колонии. Здесь образуются спорангии. Длина гиф воздушного мицелия может достигать 500 мкм.
Род
Streptomyces
Вегетативные гифы (диаметром 0,5-2,0 мкм) образуют обильно разветвленный мицелий, редко распадающийся на фрагменты. Воздушный мицелий в зрелом состоянии несет цепочки из трех или большего числа спор. Для нескольких видов характерны короткие цепочки спор на субстратном мицелии (Вулфа Л., 1974). Некоторые виды могут формировать склероцио-, пикнидио-, спорангио- и синнема-подобные структуры. Споры неподвижные. Колонии обособленные и лишайникоподобные, кожистые или маслянистые; поверхность вначале относительно гладкая, но затем формируется переплетение воздушного мицелия, который может быть хлопьевидным, зернистым, порошковидным или бархатистым. Субстратный мицелий погружен в глубину питательной среды, гифы субстратного мицелия поглощают питательные вещества. В таком случае колония актиномицета легко снимается петлей с поверхности среды. Образуют разнообразные пигменты, определяющие цвет субстратного и воздушного мицелия. Могут также синтезировать пигменты, диффундирующие в среду. Многие штаммы, продуцирующие один или большее число антибиотиков. Грамположительные, но не кислото- и спиртоустойчивые. В составе пертидогликана клеточной стенки большое количество L-ДАПк. Не содержит миколовых кислот, но в больших количествах содержат насыщенные жирные кислоты изо
- и антеизо
-строения; основные изопреноидные соединения – гекса- или октагидрированные менахиноны с 9 изопреновыми единицами. В составе сложных полярных липидов обычно присутствуют фосфатидилглицерол, фосфатидилэтаноламин, фосфатидилинозитол и фосфатидилинозитолманнозиды. Аэробы. Хемоорганотрофы; метаболизм окислительного типа. Каталазоположительные; как правило, восстанавливают нитрат до нитрита; разлагают аденин, эскулин, казеин, желатину, гипоксантин, крахмал и L-тирозин. В качестве единственных источников углерода и энергии для роста используют разнообразные органические соединения. Оптимальная температура 25-35ºС, некоторые виды растут как психрофильные и термофильные; оптимальный для роста диапазон рН 6,5-8,0. Широко распространены и обильно представлены в почве, включая компосты. Несколько видов патогенны для животных и человека, другие фитопатогенные (Заварзин Г.А. (ред.), 1997).
Род Streptomyces представлен видами, имеющими воздушный мицелий, несущий цепочки спор. Многие штаммы продуцируют антибиотики. Streptomycesalbus – продуцент стрептомицина, Streptomycesgriseus, Streptomyceslavendulae – продуценты биопрепарата фитолавина, используемого против фитопатогенов, Streptomycesscabies – возбудитель обыкновенной (актиномицетной) парши картофеля и корнеплодов (син. Actinomycesscabies) (Шапиро Я.С., 2005).
тля теплица грунт энтомофаг микробиологический
1.3.2 Распространение и экология
Актиномицеты присутствуют в воздухе, пресноводных водоемах и морях, а также в донных осадках. Почвы являются природными субстратами, откуда актиномицеты выделяются в наибольшем числе и разнообразии, принимая активное участие в почвообразовательных процессах. Они широко распространены в почвах всего земного шара, однако на их качественный и количественный состав значительное влияние оказывает географическое положение местности, тип почвы, ее химические и физические свойства, окультуренность, влагоемкость и др. особенности почв (Банников А.Г., Вакулин А.А., Рустамов А.К., 1996).
Актиномицеты в большом количестве встречаются в почве благодаря их способности легко адаптироваться к среде обитания и довольствоваться органическими соединениями, которые непригодны для других микроорганизмов. В почвах содержится от 19,7 до 46% актиномицетов от числа всех микроорганизмов, населяющих почву (Гаузе Г.Ф., Преображенская Г.П., Терехова Л.П., Максимова Т.С., Аверичева Л.Н., 1982).
1.3.3 Препараты на основе актиномицетов рода
Streptomyces
Среди почти 14000 известных биоактивных микробных вторичных метаболитов около 9000 продуцируются актиномицетами, 80% которых относятся к роду Streptomyces (BerdyI., 1994, p.27). Широкое распространение актиномицетов в природе (в почвах, например, их содержится 20–46% от числа всех микроорганизмов), богатое функциональное разнообразие, высокая биосинтетическая активность и простота культивирования делают их весьма перспективными продуцентами новых биопрепаратов, эффективных в борьбе с вредными насекомыми. Из 3200 известных продуцентов антибиотиков 2100 – актиномицеты (из них 1900 - стрептомицеты), 830 – грибы, 270 – бактерии. Большинство выделенных вторичных метаболитов, синтезируемых актиномицетами, обладают антибиотическими свойствами (антимикробными, антивирусными) (Русанова Е. П., Алехова Т.А., Федорова Г.Б., Катруха Г.С., 2000, том 36, №3). В настоящее время описан ряд веществ с другим характером биологического действия: ингибиторы ферментов, гербициды, инсектициды, находящие применение в растениеводстве (Коробкова Т.П., Иваницкая Л.П., Дробышева Т.Н., 1987, №8; Лобанок А.Г., Ялашко М.В., Анисимова Н.И., 1988). Наибольшее их количество найдено среди метаболитов актиномицетов рода Streptomyces (Головлева Л.А., Черменский Д.Н., 1988).
По данным Государственного Каталога пестицидов на 2004 год зарегистрировано 36 биопрепаратов, разрешенных к применению на территории РФ, из них 5 бактериальные: Вертимек, Фитоверм, Фитоверм-М, Акарин и Искра Био, но промышленное производство некоторых из них не налажено. Тем не менее, использование биологических средств защиты растений является одним из основных элементов в создании современных технологий фитосанитарной оптимизации агроэкосистем. В связи с этим актуальной является проблема поиска в различных местах обитания новых микроорганизмов, продуцирующих биологически активные вещества с широким спектром инсектицидного действия. Следует отметить, что 99% всех существующих биопрепаратов – бактериального происхождения (Кандыбин Н.В., 1991, №1). Однако во всем мире усилилось внимание к энтомопатогенным и энтомотоксичным актиномицетам, в особенности, к стрептомицетам. Создан ряд препаратов: актинин, глоберин, летарцид (Streptomycesglobisporus), авермектины (Streptomycesavermitilis), боррелидин (Streptomycesgriseus), хризомал (Streptomyceschrisomalus), индоцид-5 (Streptomycesceneoruber), индоцид-6 (Streptomycesloidensis). Учитывая богатое разнообразие стрептомицетов и их высокую метаболическую активность, можно с уверенностью сказать, что эта группа микроорганизмов таит в себе неисчерпаемые возможности (BettineLauer, RoderichSubmuth, DietmarKaiser, GuntherJunjandChristianBorman., 2000, v. 53, №4).
В результате исследований, проведенных в ВИЗР, из почв различных географических регионов выделены изоляты стрептомицетов с инсектоакарицидной активностью в отношении тлей, оранжерейной белокрылки, трипсов, клещей и т.д. Высокая специфичность и эффективность в отношении вредоносных объектов в широком интервале гидротермических условий, низкая токсичность и быстрый распад в аэробных условиях, стабильность метаболитных комплексов показали возможность их использования в качестве основы новых биопрепаратов.
Алейцид представляет собой смачивающийся порошок или пасту красно – оранжевого цвета с характерным запахом, слабо растворимый в воде, содержит активный комплекс метаболитов, действующим веществом которого является 9–диметилпиерицидин. Контактный препарат. Продуцент алейцида – штамм 0775 выделен Коневым Ю.Е. из почвенного образца № 8242/32, собранного в дендрарии г. Сочи. По культурально–морфологическим признакам и физиолого-биохимическим признакам продуцент является типичным представителем вида Streptomycesaurantiacus с выявленными штаммовыми отличиями.
При использовании препарата наблюдается не только смертность, обусловленная непосредственным действием токсинов, но и последействие – гибель на последующих стадиях развития, а также снижение жизнеспособности насекомых и тератогенный эффект.
Результаты лабораторных, вегетационных и производственных опытов показали высокую биологическую эффективность алейцида в отношении сосущих вредителей сельскохозяйственных растений различных видов тлей, оранжерейной белокрылки, табачного трипса, морковной листоблошки и сетчатого слизня. В лабораторных условиях обработка популяций персиковой, бобовой, виковой, картофельной, гороховой 0,1-1% суспензией препарата через 2 часа вызывала смертность 57,1-97,3% вредителей. Наиболее чувствительными к воздействию препарата оказались гороховая, бобовая и виковая тли.
Алейцид показал высокую эффективность в отношении всех стадий развития оранжерейной белокрылки, личинок морковной листоблошки и сетчатого слизня, а также проявляет акарицидные свойства при обработке от паутинного клеща (Бойкова И.В., Павлюшин В.А., 2002, стр. 102).
Недавно разработана улучшенная препаративная форма Алейцида, получившая название Алейцид-М, которая по своим показателям экологической безопасности (фитотоксичности) значительно превосходит ранее полученные образцы при сохранении высокой инсектицидной активности. Алейцид-М безопасен для растений, теплокровных животных и человека в рекомендуемых концентрациях, соответствуют требованиям экологической безопасности систем защиты овощных, декоративных, плодовоягодных культур в открытом и защищенном грунте. Однако в список пестицидов, разрешенных для применения, препарат не включен.
Индоцид-6. Препарат разработан в ВИЗР на основе штамма П-56 актиномицета Streptomycesloidensis, выделенного из образца индийской почвы. В состав препарата входит комплекс метаболитов (производных пептидов), обладающих высокой инсектицидной активностью в отношении различных видов тлей, трипсов, паутинных клещей. Против этих вредителей Индоцид-6 производят в виде смачивающего порошка или в жидкой форме, которая с экономической точки зрения предпочтительнее, поскольку в этом случае не требуется дорогостоящая стадия сушки. По данным многочисленных вегетационных испытаний, обработка популяций персиковой тли суспензией препарата в концентрации 0,025-0,1% через 4 часа вызывает гибель 70-100%, а через 6 часов – 90-100% особей. Смертность паутинно клеща через сутки после обработки суспензией препарата в концентрации 0,05-0,1% достигает 87%.
В виде сухой торфяной формы препарат перспективен для использования против галловых нематод р. Meloidogyne. При внесении в лунки перед посадкой растений 5-10 г препарата степень пораженности растений мелойдогинозом снижается до 2 балла (в контроле – 5 баллов).
Интересным свойством препарата является его комплексное действие на растения. В концентрации 0,01-0,05% Индоцид-6 проявляет выраженную фиторегуляторную активность: стимулирует рост и увеличивает массу корней и стеблей огурца, улучшает биохимический состав плодов.
Препарат контактного действия. Норма расхода препарата 0,5-1 кг/га. Концентрация рабочей суспензии 0,05-0,1%. Применяются методом опрыскивания насекомых в очагах размножения водной суспензией препарата. Хранение до 2-х лет при 4-6 ºС.
Препарат обладает стимулирующим действием на растения. Возникновения устойчивости к препарату у насекомых не отмечено.
Индоцид-6 безопасен для растений, теплокровных животных и человека в рекомендуемых концентрациях, соответствуют требованиям экологической безопасности систем защиты овощных, декоративных, плодовоягодных культур в открытом и защищенном грунте. Однако в список пестицидов, разрешенных для применения, препарат не включен (Ахатов А.К., Ижевский С.С. (ред.), 2004; Бойкова И.В. и др., 1999).
Среди представителей различных групп препаратов наиболее полному экспериментальному изучению с целью их практического использования подвергались авермектины, милбемицины, акдион, антимицины, тетранактин, пиерицидины.
Большое количество публикаций касается интересной и широко применяемой в с/х группы биоинсектицидов – авермектинов. Авермектины выделены японскими учеными в конце 70-х годов из продуктов жизнедеятельности почвенных актиномицетов вида Streptomycesavermitilis. Препараты широко изучены в качестве инсектоакарицидов и нематицидов (Цизин Ю.С., Бронштейн А.М., 1986, №10). Получен целый ряд производных авермектинов, обладающих инсектицидной активностью. Авермектины – высокоэффективные биопрепараты в борьбе с вредителями с/х растений, экзо – и эндопаразитами животных и синантропными насекомыми. В защите растений наиболее широко применяется препарат с шифром МК - 936.
Авермектин обладает свойствами регулятора роста насекомых и высокой акарицидной активностью в отношении растительноядных клещей.
К недостаткам авермектинов относят их высокую токсичность для теплокровных животных. Так, ЛД50
для белых крыс при пероральном введении составляет 10 мг/кг, однако в применяемых дозах (расход 30 г/га) не вызывает интоксикацию. Кроме того, авермектины быстро разлагаются в аэробных условиях. В опесчаненном и илистом суглинке под с/х культурами при внесении 0,1 мг/кг полупериод жизни составляет 3-4 недели. Особенно активно разложение происходит в щелочных почвах. В анаэробных условиях авермектин не разлагается.
В настоящее время зарубежные фирмы Японии, Голландии, США, Бразилии, Германии, Франции выпускают коммерческие препараты на основе авермектинов: Абамектин, Авид, Агри-мек, Аффирм, Вертимек, Ивомек, Экволан.
В результате направленного скрининга, на основе штамма Streptomycesavermitilis ВНИИСХМ-54 в НБЦ «Фармбиомед» создан биопрепарат Фитоверм, успешно прошедший производственные испытания. Это единственный отечественный препарат на основе штамма Streptomycesavermitilis, внесенный в список пестицидов и агрохимикатов, разрешенных к применению на территории России (Кобзарь В.Ф., 1995). Действующее вещество Фитоверма – Аверсектин С. Выпускается в форме концентрата эмульсии (2 г/л).
Фитоверм обладает нейротоксическим действием. Действующее вещество препарата относится к высокотоксичным соединениям (класс авермектинов), но в готовых продуктах их концентрация настолько мала, что они отнесены к 4 классу опасности. Обладает высокой биологической эффективностью в отношении колорадского жука на картофеле, растительноядных клещей, бахчевой и персиковой тлей, листоблошек и трипсов на овощных и декоративных культурах защищенного грунта. Не является специфическим инсектоакарицидом поэтому для борьбы с насекомыми используют повышенные концентрации. Против тлей препарат эффективен (на уровне 80-98%) при концентрации рабочего раствора 0,8% с нормой расхода препарата 1-3 л/га (1 мл на 1 л воды). В борьбе с трипсами рекомендуются обработки 1% раствором при норме расхода препарата 10-30 л/га (10 мл на 1 л воды).
Большое количество работ посвящено изучению обширной группы 16-членных макроциклических соединений - милбемицинов.
Милбемицины были открыты в 70-х годах в Японии в результате широкого направленного поиска инсектицидов микробного происхождения. Их продуцентом является Streptomycesnigroscopicus, образующий смесь биологически активных веществ. Милбемицины, как и авермектины, не проявляют антибактериальной активности, но обладают широким спектром нематицидного действия, а также проявляют инсектицидные и акарицидные свойства в отношении широкого круга вредителей с/х культур и гельминтов крупного рогатого скота.
Среди инсектицидных метаболитов актиномицетов обнаружены вещества, как общетоксического действия (авермектины, милбемицины, празиноны и др.), так и специфические регуляторы роста и развития насекомых, в частности, ингибиторы синтеза хитина – никкомикомицины.
Широким спектром инсектоакарицидного действия обладает пиерицидин и его производные. Наиболее изучены биологические свойства пиерицидинов А и В. Эти препараты высокоэффективны в отношении комнатной мухи, рыжего таракана, стеблевого бурильщика, шелковичного червя, репной белянки, персиковой тли, бобовой и гороховой тлей (Самоукина Г.В., Кандыбин Н.В., 1981, том 51; Самоукина Г.В., 1983, том 53).
В институте с/х микробиологии г. Санкт-Петербурга создан препарат Актинин (Самоукина Г.В., Кандыбин Н.В., Сергеева М.В., Бортник Н.И., 1990).
Актинин – актиномицетный препарат, создан на основе актиномицета Streptomycesglobisporus штамма 0234 при глубинном культивировании (ВНИИ с/х микробиологии). Препаративная форма – жидкость, порошок, концентрат – Л, концентрат – М. Действующее вещество – эндометаболиты нонактиновой группы. Жидкая форма – культуральная жидкость, или ее высушивают, и порошок применяют в виде водной суспензии. Актинин-Л и Актинин-М получают концентрированием культуральной жидкости, экстрагированием и фильтрацией.
Препарат эффективен (на уровне 85-100%) против паутинного клеща на овощных культурах защищенного грунта при норме расхода Актинина-Л – 100-200 л/га, расход рабочего раствора 1000-3000 л/га; против колорадского жука на картофеле при норме расхода 4 кг/га, расход рабочего раствора 150-400 л/га (Новикова И.И., Бойкова И.И., Павлюшин В.А., Матевосян Г.Л., Паршин В.Г., № 33, 2002; Павлюшин В.А., Агасонова Н.Е., 2001). В список пестицидов, разрешенных для применения, препарат не внесен.
В последние годы появились сообщения об использовании антрациклиновых антибиотиков и их производных для защиты растений. Большой резерв для открытия новых эффективных биопрепаратов кроется не только в выделении новых продуцентов, но и в более полном изучении их биологического потенциала.
Для успешного применения метаболитных препаратов в защите растений необходимо расширять поиск новых БАВ природного происхождения с различными механизмами действия, а, следовательно, необходимо совершенствовать стратегию скрининга микроорганизмов-продуцентов, использования достаточно широкий набор тестов.
Таким образом, по ряду показателей, а именно: отсутствию фитотоксичности, возможности совместного использования с энтомофагами; низкой токсичности и быстрому распаду в аэробных условиях; высокой специфичности и эффективности в отношении целевых вредоносных объектов в широком интервале гидротермических условий; биопрепараты на основе актиномицетов весьма перспективны для современных фитосанитарных технологий и, в частности, для комплексных систем защиты растений.
2. Экспериментальная часть
2.1 Материалы и методы
2.1.1 Место проведения опытов и материалы
Исходным материалом для исследования в лабораторных условиях послужили пятнистая оранжерейная тля (NeomyzuscircumflexusBuckt.) и лабораторная Санкт-Петербургская популяция хищной галлицы Aphidoletes aphidimyza Rond. (Diptera, Cecidomyiidae
). Для выкармливания личинок галлицы использовали виковую тлю. Для обработок использовали: препараты на основе актиномицетов, выделенные из штаммов Streptomycessp.
Характеристика препаратов
1. П-56 - на основе штамма Streptomycesloidensis,
выделенного из почв Индии, является основой препарата Индоцид. В состав препарата входит комплекс метаболитов, обеспечивающий высокую инсектицидную активность против ряда вредных сосущих членистоногих: различных видов тли, трипса, паутинного клеща.
Показано, что компоненты комплекса, ответственные за инсектицидную активность, по химическому составу относятся к пептидолактонам треонинового типа. Работа по их идентификации продолжается.
Из П-56 выделен клон П-56-1, с отличным от исходного комплексом метаболитов, действие которого на насекомых еще изучается.
2. Streptomycesherbaricolor S-100изолирован при микробиологическом обследовании дерново-подзолистых почв Западной Сибири вблизи г. Тюмени в 1989 году. Данные препараты находятся на стадии разработки.
Из S-100 был выделен клон с комплексом метаболитов, содержащий красный красящий пигмент. Поэтому далее мы называем его S-100кр.
Нами были проведены следующие эксперименты:
1) Оценка влияния микробиологических препаратов 729, 925, П-56, П-55, S-100 на выживаемость и развитие пятнистой оранжерейной тли;
2) Оценка влияния на выживаемость галлицы афидимизы при обработке препаратами П-56-1 и S-100кр. афидофага на эмбриональной, личиночной и на стадии кокона (сразу после окукливания и спустя некоторое время) инсектицидами микробиологического происхождения на основе штаммов Streptomycessp. (далее препараты П-56, П-56-1, S-100, S-100кр.), которые были получены в результате скрининга коллекционных, а также свежевыделенных из почв изолятов, в лаборатории микробиологического метода защиты растений №8, ВИЗР.
2.1.2 Методы
Работапо оценке влияния преператов микробиологического происхождения на тлей и галлицу выполнялась в 2005 году в лаборатории биометода №7, ВИЗР под руководством с.н.с. Козловой Е.Г. совместно с лабораторией микробиологического метода защиты растений №8, ВИЗР.
2.1.3 Разведение виковой тли
Бобы выращивают в стеклянных банках (емкостью 0,5 л) с обычной водопроводной водой. Банки закрывают полиэтиленовыми крышками, в которых пробито по 10 отверстий диаметром 5-7 мм. Семена овощных бобов замачивают на 1 день в 0,5%-ном растворе марганцовки. Затем семена размещают ровным слоем на противень со стенками высотой 5-6 см, засыпают смесью древесных опилок и стружки и ставят на стеллаж. После появления семядольных листьев растения высаживают в отверстия крышки, сохраняя одно незанятым для полива, банки ставят на тот же стеллаж и заселяют бобы виковой тлей, раскладывая кусочки листьев с тлей (Бондаренко Н.В., Воронова О.В., 1989). Разведение пятнистой оранжерейной тли осуществляли таким же образом, как и виковой.
2.1.4 Разведение галлицы
Разведение галлицы проводили по методике Бондаренко Н.В., Асякина Б.П., 1975 г. Для получения яйцекладок галлицы, в садках размером 35×35×35 см постоянно поддерживали высокую плотность популяции имаго галлиц. Для этого 2 раза в неделю в садки помещали коконы (1-2 тысячи). Затем в каждую секцию на 1 день помещали 2-3 банки с бобами, заселенными виковой тлей. Кроме того, в садки помещаличашки Петри с кусочком поролона, поставленные в каждую секцию садка, наливали 10 %-ный сахарный сироп.
Вынутые из садка банки с растениями, на которых отложены яйца галлиц, переносили на стеллаж на 3 дня до полного отрождения личинок. Отрождающиеся личинки питались тлями, находящимися на растениях.
Потом просеянный и обеззараженный влажный песок насыпали на дно кристаллизатора слоем 1 см. Срезали с трех-шести банок растения (в зависимости от численности личинок) и выкладывали на поверхность песка. Затем накрывали рамкой затянутой капроновой тканью, чтобы тли не расползались. Ежедневно, в течение семи последующих суток в кристаллизатор добавляли для питания личинок растения с тлями. Через 5 суток после окукливания, точнее ухода личинок в песок, с его поверхности удаляли все остатки растений, а затем отделяли коконы. Для этого просеивали песок с коконами через сито (с отверстиями 1 мм).
2.1.4.1
Оценка влияния микробиологических препаратов на пятнистую оранжерейную тлю в лабораторных условиях
Препараты применялись в концентрации 0,1%, 0,2%. Обработку проводили ручным лабораторным пульверизатором. Каждый вариант опыта закладывали в 5 повторностях. В опыте мы использовали пластиковые контейнеры, которые накрывали тканью с отверстием посередине и сажали в него росток боба и кисточкой подсаживали тлю. На каждом растении находилось в среднем по 9-10 личинок тли старшего возраста. Контролем служили тли, обработанные водой (влажный контроль). Обрабатывали ростки бобов с тлей и ламповое стекло, которым накрывали ростки. После обработки ламповое стекло накрывали двойным слоем марли. Подсчет тли проводили через день, подсчитывая число тли в каждом варианте. В таблицу вносили данные в % по отношению к первому дню, в который проводили обработку, т.е. число тли в первый день принимали за 100% во всех вариантах, а в последующие дни учета численность тли сравнивали с первым днем и вычисляли по формуле: 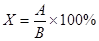 ,
где Х – % выживших тлей по отношению к первоначальному числу тли; А – число тли на день учета, шт.; В – общее число обработанной тли каждого варианта, шт. Обработку проводили в фазу личинок 3 возраста тли. Также вычисляли скорость нарастания популяции тли по формуле: ,
где Х – % выживших тлей по отношению к первоначальному числу тли; А – число тли на день учета, шт.; В – общее число обработанной тли каждого варианта, шт. Обработку проводили в фазу личинок 3 возраста тли. Также вычисляли скорость нарастания популяции тли по формуле: 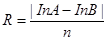 ,
где InA – численность тли в день А, InB – численность тли в день В, n – количество дней. ,
где InA – численность тли в день А, InB – численность тли в день В, n – количество дней.
Оценка влияния микробиологических препаратов на пятнистую оранжерейную тлю проводилась в лаборатории биологического метода защиты растений №7, ВИЗР.
2.1.4.2 Оценка влияния препаратов
S
-100кр. и П-56-1 на галлицу
Aphidoletes
aphidimyza
Rond
Препараты применяли в опытах в концентрациях, которые предполагается использовать в производственных условиях защищенного грунта, в борьбе с тлями. Это позволило в лабораторных условиях создавать токсический фон, адекватный фону для оценки выживания галлиц, после обработки препаратами в защищенном грунте. Обработки разных стадий развития насекомого проводили ручным лабораторным пульверизатором.
Образцы препаратов, приготовленные на основе Streptomycessp. П-56-1 иS-100кр. (далее препараты П-56-1,S-100кр.) по параметрам острой токсичности, относятся к веществам III класса опасности.
Оценка влияния препаратов П-56-1 и S-100кр. на AphidoletesaphidimyzaRond. проводилась в лаборатории биологического метода защиты растений №7, ВИЗР. Обработку проводили на фазах: яйцо, личинки 2 возраста, имаго и куколки галлицы.
Обработка яйцекладок
Суточные яйцекладки галлицы помещали на ростки бобов, заселенные виковой тлей, растущие в круглых контейнерах диаметром 10 см. Затем ростки с яйцекладками накрывали ламповым стеклом, предварительно обработав ламповое стекло и яйцекладки на растениях препаратами. В варианте с каждым препаратом П-56 и S-100 было 5 повторностей. Контроль был обработан чистой водой – 5 повторностей.
После обработки ламповое стекло закрывали двойным слоем марли. Выживаемость яйцекладок оценивали по вылету имаго. Для этого выкармливали отродившихся личинок, ежедневно подсыпая в контейнеры виковую тлю. Подсчет имаго во время лета проводили ежедневно.
Обработка личинок галлицы
Личинок 2 возраста помещали тонкой кисточкой на ростки бобов, заселенных виковой тлей, в пластиковые контейнеры. Контейнеры закрывали ламповым стеклом. Предварительно обработав личинок и ламповое стекло препаратами также как в эксперименте с яйцекладками. Ламповое стекло закрывали двойным слоем марли. Личинок выкармливали до имаго, подсыпая ежедневно до окукливания виковую тлю. Учет численности насекомых проводили по вылету имаго.
Обработка коконов галлицы
Коконы галлицы помещали в пластиковые чашки Петри, на дно которых клали фильтровальную бумагу - по 60 штук в опыте и в контроле. В опыте использовали свежие коконы, только что окуклившиеся личинки, и коконы после хранения в холодильнике в течение 10 дней, где куколка уже образовалась. Проводили обработку препаратами П-56-1 и S-100кр. в двух повторностях на свежих и старых коконах, в контроле одна повторность.
Обработка имаго галлицы
В этом эксперименте сначала обрабатывали контейнеры с тлей и ламповое стекло. Имаго выпускали после того, как влага испарится (т.к. имаго галлицы очень чувствительны к капельной жидкости).
Затем имаго (6 особей), при помощи эксгаустера помещали в пластиковые контейнеры с бобами заселенные тлей, заранее обработанные. Учитывали смертность каждый день, после обработки до полной гибели имаго. Затем рассчитывали среднюю продолжительность жизни имаго в каждом варианте. Также оценивали плодовитость имаго.
Долю погибших после обработки особей галлицы определяли по формуле: 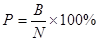 , где N – общее число обработанных особей, В – число погибших особей. Ошибку вычисляли по формуле: , где N – общее число обработанных особей, В – число погибших особей. Ошибку вычисляли по формуле: 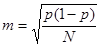 , где р – доля погибших после обработки особей галлицы, в %, N – общее число обработанных особей, шт. , где р – доля погибших после обработки особей галлицы, в %, N – общее число обработанных особей, шт.
Для статистического анализа использовали T-критерий Стьюдента (Лакин Г.Ф., 1973; Доспехов Б.А., 1979).
3. Результаты и обсуждение
3.1 Оценка влияния микробиологических препаратов на выживаемость и развитие пятнистой оранжерейной тли
В данном эксперименте мы наблюдаем небольшое снижение численности тли только в вариантах с препаратами S-100, П-56 (табл. 1). Наибольшую биологическую эффективность наблюдаем в варианте с препаратом S-100, которая составляет 34,1%. В варианте с препаратом П-56 она составляет 15%. Остальные варианты практически не отличаются от контроля (табл.1). В дальнейшем (на 5 и 8 день учета) мы наблюдаем, рост популяции пятнистой оранжерейной тли во всех вариантах. Однако скорость нарастания в варианте с S-100 несколько ниже (R=0.32) по сравнению с контролем (R=0.33). В то же время скорость нарастания популяции в вариантах с препаратами 729, П-55 и 925 выше, чем в контроле R=0.39; 0,34; 0,33 соответственно. Это может означать, что биологически активные вещества актиномицетов влияют на репродуктивный потенциал тли и в сторону увеличения и в сторону уменьшения. Исходя из результатов опыта, мы выбрали для дальнейших испытаний два препарата: S-100 и П-56.
Таблица 1
Изменение численности пятнистой оранжерейной тли после обработки микробиологическими препаратами с концентрацией 0,1%
| Вариант опыта |
Численность пятнистой оранжерейной тли по отношению к первому учетному дню,% |
| 1 день |
2 день |
5 день |
8 день |
| контроль |
100 |
106.2±3,2 |
301.5±17,7 |
1110.9±39,7 |
| S-100 |
100 |
65.9±6,9 |
200±10,3 |
623±33,3 |
| 729 |
100 |
94.2±4,0 |
337.1±26,0 |
1474.2±39,2 |
| П-55 |
100 |
105±2,9 |
325.4±19,5 |
823.7±35,0 |
| П-56 |
100 |
85±6,2 |
312.5±23,0 |
852.5±43,3 |
| 952 |
100 |
101.8±1,8 |
356.6±22,0 |
981.1±40,7 |
В эксперименте №2 с препаратами S-100 и П-56 мы взяли более высокую концентрацию 0,2, так как 0,1% концентрация оказалась малоэффективной. Однако и во втором эксперименте мы видим, что снижение численности тли на второй день небольшая: у S-100 до 68,6%, а у П-56 до 79,1% (табл.2). В следующие дни учета также как в опыте 1 наблюдается рост численности тли. Оценивая скорость роста популяции тли, приходим к выводу, что по сравнению с контролем ни один препарат не дал какого-либо снижения этого показателя. Исходя из данных таблицы, можно видеть снижение численности тли в варианте с S-100, по сравнению с контролем разница существенна. Снижение численности в варианте при применении П-56 также существенно отличается от контроля (tФ
≥tТ0,05;0,01
). На 4, 5 и 7 день численность тли возросла во всех вариантах. Следовательно, П-56 и S-100 проявляют токсическое слабое действие и на непродолжительный период времени.
Таблица 2
Изменение численности пятнистой оранжерейной тли после обработки П-56 и S-100кр. в концентрации 0,2%
| Вариант опыта |
Численность пятнистой оранжерейной тли по отношению к 1 учетному дню, % |
| 1 день |
2 день |
4 день |
5 день |
7 день |
| контроль |
100 |
112,3 ± 5,3 |
285,4 ± 31,0 |
385,5 ± 44,7 |
958,5 ± 122,3 |
| S-100 |
100 |
68,6 ± 6,7 |
262,5 ± 32,6 |
350 ± 46,7 |
750 ± 110,4 |
| П-56 |
100 |
79,1 ± 5,9 |
194,7 ± 22,0 |
271,1 ± 34,9 |
734,2 ± 110,7 |
3.2 Оценка влияния препаратов П-56-1 и
S
-100кр. на выживаемость и развитие пятнистой оранжерейной тли
Поскольку при повышении концентрации препаратов эффективность практически не изменилась, в лаборатории микробиологии №8 был проведен скрининг и получены активные клоны. На основе S-100 выделили клон имеющем в комплексе метаболитов красный пигмент и названный S-100кр. На основе П-56 выделили новый клон П-56-1. В данном эксперименте мы испытали эти клоны на пятнистой оранжерейной тле в концентрации 0,2%. Исходя из данных таблицы 3 наиболее сильно снижение численности на 2 день в варианте с S-100кр. как по сравнению с контролем так и по сравнению с П-56-1.К 5 дню произошло снижение численности тли на 92% в варианте с S-100кр. и на 68% в варианте с П-56-1 (tФ
≥tТ0,05;0,01
). Таким образом препарат S-100кр. оказался наиболее эффективным, развитие популяции тли значительно замедлялось и сокращалось число живых особей.
Поскольку клоны S-100кр. и П-56-1 проявили хорошую эффективность по отношению к тле, мы использовали их в опытах на галлице, для выявления их токсичности и возможности совместного применения данных препаратов и галлицы в системе защиты от тлей.
Таблица 3
Изменение численности пятнистой оранжерейной тли после обработки препаратами S-100кр и П-56-1 в концентрации 0,2%
| Вариант опыта |
Численность пятнистой оранжерейной тли по отношению к 1 учетному дню, % |
| контроль |
1 день |
2 день |
3 день |
5 день |
| 100 |
98±2,0 |
94±3,3 |
178±16,6 |
| S -100кр. |
100 |
36±6,8 |
12±4,6 |
8±3,8 |
| П-56-1 |
100 |
60±6,9 |
52±7,0 |
32±6,6 |
3.3 Оценка влияния препаратов П-56 и
S
-100кр. на выживаемость галлицы
Aphidoletes
aphidimyza
Rond
. на эмбриональной стадии развития
При обработке яиц различия по выживаемости между препаратами и контролем не существенны. В вариантах с обработкой препаратами П-56-1 и S-100кр. наблюдается более активный вылет имаго по сравнению с контролем.
Следовательно, препараты не оказывают влияния на выживаемость галлицы на стадии эмбрионального развития.
Таблица 4
Выживаемость галлицы AphidoletesaphidimyzaRond. после обработки препаратами П-56-1 и S-100кр.на стадии яйца в концентрации 0,2%
| Вариант опыта |
Число яиц, ос. |
Число, вылетевших имаго из яиц, ос. |
Выживаемость имаго по вылету, % |
| Контроль |
111 |
42 |
37,8±4,25 |
| S-100кр. |
83 |
41 |
49,4±5,49 |
| П-56-1 |
130 |
55 |
42,3±4,69 |
3.4 Оценка влияния препаратов П-56-1и
S
-100кр. на выживаемость
Aphidoletes
aphidimyza
на личиночной стадии развития
Из таблицы 3 видно, что при обработке личинок второго возраста различия по выживаемости между препаратами и контролем не существенны. Вылет имаго приблизительно одинаковый во всех вариантах, в контроле даже немного ниже (52%), чем в варианте с S-100кр. (56%), но такой же, как и в П-56-1 (52%) (табл.5).
Следовательно, препараты не оказывают влияния на личинок галлицы.
Таблица 5
Выживаемость галлицы Aphidoletesaphidimyza после обработки препаратами П-56 и S-100на стадии личинок 2 возраста
| Вариант опыта |
Число личинок, шт. на одну повторность |
Число, вылетевших имаго, особей, в среднем на повторность |
Выживаемость имаго по вылету, % |
| Контроль |
10 |
5,2 ± 1,58 |
52,00 ± 7,06 |
| S-100кр. |
10 |
5,6 ± 1,57 |
56,00 ± 7,02 |
| П-56-1 |
10 |
5,2 ± 1,58 |
52,00 ± 7,06 |
3.5 Оценка влияния П-56 и
S
-100кр. на выживаемость галлицы
Aphidoletes
aphidimyza
Rond
. на стадии образования куколки
При обработке хранившихся коконов выживаемость в варианте с препаратом П-56-1 ниже, чем в контроле (табл. 6). Однако различие между ними не существенно при 5%-ном и 0,01% -ном уровне значимости.
В варианте с препаратом S-100кр. наблюдается более сильное токсическое действие на вылет имаго 56,7%.. Разность между контролем и S-100кр. существенна при 0,05% уровне значимости. Таким образом, S-100кр. влияет на вылет имаго из коконов после хранения (tФ
≥ tТ
).
Таблица 6
| 0Вариант опыта |
Число коконов после хранения, особей на одну повторность |
Число, вылетевших имаго, особей, в среднем на повторность |
Выживаемость имаго по вылету, % |
| Контроль |
60 |
55,00 ± |
91,6 ± 3,58 |
| S-100кр. |
30 |
17,00 ± |
56,7 ± 9,04 |
| П-56-1 |
30 |
23,50 ± |
78,3 ± 7,53 |
При обработке свежих коконов вылет имаго в варианте S-100кр не сильно отличается от вылета имаго в контроле. Разность между вариантами не существенна при 0,05 и 0,01%-ном уровне значимости. В тоже время вариант с препаратом П-56-1 наблюдается менее активный вылет имаго 56%. При сравнении варианта П-56-1 с контролем разница существенна на 0,05% уровне значимости.
Таблица 7
| Вариант опыта |
Число коконов после окукливания, особей |
Число, вылетевших имаго, особей, |
Выживаемость имаго по вылету, % |
| Контроль |
60 |
53,00 |
88,3 ± 4,15 |
| S-100кр. |
60 |
44,00 |
73,3 ± 8,07 |
| П-56-1 |
60 |
34,00 |
56,7 ± 9,04 |
Таким образом, препарат S-100кр. проявляет токсическое действие на куколок после хранения в холодильнике. Но в тоже время не оказывает никакого влияния на свежие, только что образовавшиеся куколки. В варианте с П-56-1 наоборот, токсическое действие проявляется на свежих куколках, в то время как на куколки после хранения он не влияет.
3.6 Оценка влияния П-56 и
S
-100 на выживаемость галлицы
Aphidoletes
aphidimyza
на стадии имаго
В опытах на имаго галлицы (табл.8) отмечено очень слабое сокращение продолжительности их жизни. Различия в вариантах не существенны, т.к. значения очень близки.
Таблица 8
Продолжительность жизни галлицы Aphidoletesaphidimyza после обработки П-56-1 и S-100кр.на стадии имаго в концентрации 0,2%
| Препарат |
Число имаго в опыте |
Средняя Продолжительность жизни имаго, дни |
Контроль
П-56-1
S-100кр.
|
30
30
30
|
3,5 ± 0,32
3,1 ± 0,36
3,1 ± 0,18
|
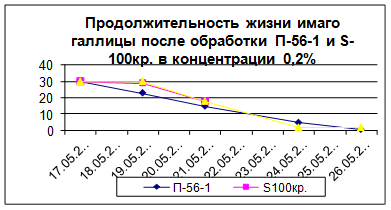
Различия в динамике гибели имаго между вариантами с препаратом П-56-1 и контролем так же очень малы и статистически не достоверны (рис.1).
4. Определение экономической эффективности
применения биопрепаратов в защите основных сельскохозяйственных культур
Исследования велись в лаборатории биологического метода защиты растений №7, ВИЗР. Испытывали эффективность микробиологических препаратов на тлях, вредящих в защищенном грунте и их энтомофаге - галлице афидимизе.
Рациональное использование средств защиты растений невозможно без оценки экономического эффекта от проводимых мероприятий, иначе необоснованные затраты на защиту растений могут превысить стоимость потенциальных потерь урожая от вредителей. Особенно это касается биологических препаратов, коммерциализация которых еще не достигла уровня повсеместного использования.
Биологизация защиты растений идет ускоряющимися темпами, поэтому в настоящей главе мы приводим методику экономической оценки агромероприятий, связанных с обработкой посевов культур микробиологическими препаратами в период вегетации.
Для определения экономической эффективности агромероприятий используется система следующих показателей:
1. Повышение выхода продукции с общей площади культуры в
2. расчете на га.
3. Стоимость дополнительной продукции в ценах реализации.
4. Размер дополнительно произведенных затрат.
5. Дополнительный чистый доход (ДЧД).
5. Уровень рентабельности и срок окупаемости дополнительных затрат.
Для определения критериев экономической эффективности мероприятий, направленных на получение ДЧД, необходима следующая информация:
1. Урожайность с/х культур по вариантам опыта;
2. Цены реализации продукции;
3. Норма расхода материальных ресурсов (биопестицидов) на основе техники:
4. Фактические цены на ресурсы с учетом доставки;
5. Норма выработки и расхода горюче-смазочных материалов (ГСМ) по видам работ, согласно справочникам или технологической карте;
6. Ставки, оплата труда (по тарифной системе) с учетом отчислений;
7. Годовая загрузка и баланс стоимости техники;
8. Нормы отчислений на амортизацию и ремонт техники и оборудования.
Методика определения обшей величины дополнительных затрат
зависит от характера мероприятия и его влияния на технологический процесс. В микробиологической защите растений предлагаемые дополнительные мероприятия обычно не предусматривают изменения технологии возделывания культуры, а связаны с обработкой посевов и посадок культур препаратом, то есть требуют дополнительного использования техники. Сумма дополнительных затрат (Σдз
) складывается из затрат на уборку дополнительной продукции (Зуд
) и затрат на проведение мероприятия (Зм
):
Σдз
= Зуд
+ Зм
Производственные затраты
(ПЗ) складываются из стоимости материалов (СМ), эксплуатационных затрат (ЭЗ) и затрат на организацию производства и управления (Зоу
):
ПЗ = СМ + ЭЗ + Зоу
1. Стоимость материалов можно рассчитать
, исходя из объема работ (Ораб
), норм расхода (НР) и действующих цен с учетом доставки (Цд
):
СМ = Ораб
* НР * Цд
П. Эксплуатационные затраты
определяются по формуле:
ЭЗ = ОФот
+ Сгсм
+ А + Зрем
+ Сээ
+ Суа
где: ОФот
- общий фонд оплаты труда; Сг
c
м
- стоимость горюче-смазочных материалов; Ам
- амортизационные отчисления; Зрем
- затраты на ремонт; Сээ
- стоимость электроэнергии; Суа
- стоимость услуг автотранспорта.
Расчет отдельных статей эксплуатационных затрат производится следующим образом:
Общий фонд оплаты труда
Для его расчета необходимо определить:
а) количество нормосмен (Кнс
) в данном объеме работ
Кнс
= Oраб
/ НВсм
,
где: Ораб
- общий объем работ;
НВсм
- сменная норма выработки;
б) затраты труда в сменах (ЗТСМ
)
ЗТсм
= Кнс
٭ Краб;
где: Краб
- количество рабочих, занятых в выполнении работ;
в) тарифный фонд оплаты труда (ТФОТ
)
ТФОТ
= СТС * ЗТСМ
где: СТС - сменная тарифная ставка (в справочнике);
Общий фонд оплаты труда равен:
ОФОТ
= ТФОТ
* К,
где: К - коэффициент, учитывающий все виды начислений.
Стоимость ГСМ
Рассчитывается из расхода ГСМ (РГСМ
) и комплексной цены 1 т ГСМ (КЦГСМ
):
Сгсм
= Ргсм
* КЦгсм
Ргсм =
НРед
* 0,001 * О׳раб
где: НРед
- норма расхода ГСМ на единицу работы;
О׳раб
- объем работ, требующих затрат ГСМ.
Амортизационные отчисления
Складываются из отчислений по тракторам и сельскохозяйственным машинам. Амортизационные отчисления по каждому виду техники (АОтех
) рассчитываются двумя способами:
1. АОтех
= КЧраб
* СБмаш
* НА / ГЗ,
где: КЧраб
- количество часов рабочего времени; СБмаш
— балансовая стоимость машин; НА - амортизационные отчисления; ГЗ - годовая загрузка, часов.
2. АОте
x
= Анорм
* О״раб,
где: Анорм
- нормативные амортизационные отчисления на эталонный га; О" раб
- объем работы в эталонных га.
О״ раб
= СВэг
* Кнс
,
где: СВэг
— сменная выработка трактора на эталонный га.
Затраты на ремонт
Вычисляются аналогично амортизационным отчислениям.
Стоимость электроэнергии
Сээ
= Рээ
* СкВт х ч
,
где: Рээ
- расход электроэнергии;
СкВтхч
- стоимость единицы энергии.
Рээ
= Мэм
* Кнс
* Всм
,
где: Мэм
- мощность электромотора, кВт;
Всм
- сменное время, ч.
Стоимость услуг автомобильного транспорта
Сув
= Оавт
* Стк,
где: Оавт
- объем работ автотранспорта, т х км ; Стк
- себестоимость ед. работы.
Оавт
= Г * ДП,
где: Г-груз, т; ДП - длина пути, км.
Затраты на организацию производства и управление
вычисляют, умножая нормативные отчисления на организацию производства и управление (НО) на сумму стоимости материалов и эксплуатационных затрат:
Зоу
= НО * (СМ + ЭЗ)
Основные показатели экономической эффективности мероприятия
Чтобы получить представление о размере ДЧД, следует сопоставить стоимость дополнительной продукции (СДП) с величиной дополнительных затрат (ДЗ):
ДЧД = СДП-ДЗ
Уровень рентабельности
(УР)
УР = ЧДД / ДЗ * 100%
Срок окупаемости в годах
(СО):
СО = ДЗ / ДЧД
На основании полученных данных можно сделать общие выводы о целесообразности рекомендуемого мероприятия.
Выводы:
1) Если стоимость ДП меньше ДЗ, рекомендация не имеет смысла, за исключением случаев, когда существует необходимость в увеличении объемов производства данного вида продукции.
2) Если стоимости ДП и ДЗ равны, данное мероприятие по применению микробиологических средств защиты позволяет увеличить выход продукции, а также заменить собой химические обработки, что позволит повысить безопасность системы защиты растений в данном технологическом процессе.
3) В случае, когда стоимость ДП превышает ДЗ, предлагаемое мероприятие имеет безусловные преимущества и оказывает благоприятный экономический эффект в данной отрасли растениеводства.
5. Безопасность и экология
5.1 Анализ условий и охраны труда
Общие принципы охраны труда предусматривают нормирование условий труда в сельскохозяйственном производстве и нацелены на ликвидацию травматизма.
Ответственным за охрану труда в хозяйстве является его директор. Приказом директора ответственность за безопасный труд на местах возлагается на руководителей производственных подразделений. Инженер по охране труда совместно с руководителями отделений, звеньев должен проводить всю практическую работу по обеспечению безопасных условий труда.
Руководители хозяйств в своей деятельности по охране труда руководствуются законодательными и нормативными актами, приказами и распоряжениями вышестоящих органов, типовыми правилами пожарной безопасности и другими документами.
В специализированных бригадах (звеньях) по защите растений ответственным за охрану и безопасность труда является бригадир (звеньевой) или агроном по защите растений. При проведении химических обработок возникает комплекс факторов, физически, химически и биологически вредных и опасных, так как могут привести к загрязнению окружающей среды и резкому ухудшению состояния микроклимата (условий) на рабочих местах. Это связано с тем, что такого рода работы проводятся с помощью тракторных опрыскивателей различными пестицидами. В процессе проведения обработок на людей воздействуют следующие вредные и опасные факторы:
-движущиеся машины и механизмы;
-незащищенные подвижные части движущихся машин и механизмов;
-повышенное содержание вредных веществ в воздухе рабочей зоны;
-
физические и нервно-психические перегрузки;
-повышенная запыленность и загазованность воздуха;
-воздействие на работающих внешних метеорологических факторов: ветра, осадков, солнечной радиации.
В хозяйстве с целью уменьшения вредного и опасного действия названных факторов, работающих обучают безопасным приемам труда, обеспечивают СИЗ (Шкрабак В.С., Казлаускас Г.К.,1989).
5.2 Организационные мероприятия и рекомендации по улучшению условий и охраны труда
Общее руководство и ответственность за организацию охраны труда на предприятиях возложена на руководителей хозяйств, по отраслям на главных специалистов.
Работами с использованием химических веществ руководит начальник производственного участка, который проводит инструктаж на рабочем месте, следит за исправностью машин, обеспечивает рабочих средствами индивидуальной защиты и спецодеждой.
Инструктажи работающих по характеру и времени проведения подразделяются на вводный, первичный на рабочем месте, повторный, внеплановый и целевой.
С прибывшими на работу, производственное обучение, практику или в командировку вводный инструктаж проводит инженер по охране труда или лицо, на которое возложены эти обязательства.
Первичный инструктаж на рабочем месте проводят с вновь принятыми или переведенными на другую работу лицами индивидуально или с группой лиц, выполняющие одинаковые виды работ. Первичный, повторный и внеплановый инструктажи проводит непосредственный руководитель работ.
К работе с удобрениями и ядохимикатами допускаются лица, достигшие 18 лет без медицинских противопоказаний для работ с пестицидами и удобрениями.
К проведению работ по защите растений не допускаются лица моложе 18 лет; беременные, кормящие женщины; лица, имеющие медицинские противопоказания, а также лица не прошедшие соответствующее обучение и инструктаж по технике безопасности. Продолжительность рабочего дня при работах с фосфорорганическими соединениями и препаратами ртути - 4 часа, с остальными пестицидами - 6 часов. Необходимо соблюдать личную гигиену, режим труда и отдыха. Во время работ запрещается принимать пищу, курить.
При проведении химических обработок рекомендуется пользоваться респираторами РПГ-67 или РУ-6 ОМ с фильтрующими патронами марки А.
Требования безопасности к технологическим процессам при защите растений предусматривает:
- обеспечение безопасности труда при приготовлении рабочего состава пестицидов (т.е. приготовление рабочего состава на специально оборудованных площадках, наличие индивидуальных средств защиты, точное соблюдение технологии приготовления рабочего состава пестицидов);
- предупреждение накопления в почве стойких препаратов;
-контроль за содержанием пестицидов впочве перед началом полевых работ и сроками выхода людей на обработанные участки.
При проведении любых работ в сельском хозяйстве необходимо учитывать возможность возникновения пожаров. Системы пожарной безопасности ориентированы на их профилактику. При складировании агрохимикатов следует учитывать противопожарные мероприятия. Склады должны быть кирпичными, а их покрытия - без чердаков. Площадь помещения не должна превышать 300 м2
, из них должно быть не меньше двух выходов. Агрохимикаты, которые между собой могут образовывать взрывчатую смесь или послужить причиной пожара, размещают на разных складах. В помещениях для складирования агрохимикатов не должны храниться другие органические материалы. В складах должны быть обязательно средства пожаротушения, в том числе огнетушители (ОП-5, ОП-10, ОВП-10).
5.3 Производственная санитария
Главная задача производственной санитарии - защита человека от воздействия вредных факторов, выделяемых в производственную среду при осуществлении технологических процессов. В основу создания здоровых условий труда положены санитарные нормы и правила, в которых установлены ПДК, ПДУ, что гарантирует при их соблюдении поддержание здоровых условий труда (Томский В.И., 1988).
Хозяйство должно быть обеспечено средствами и инструкциями по оказанию первой медицинской помощи. Инвентарь санитарно-бытовых помещений должен содержаться в исправном состоянии,
Запрещено приготовление рабочих растворов пестицидов в культивационных сооружениях. Приготовляют их и заправляют ими вручную аппаратуру в растворных узлах. На местах таких работ запрещено хранить продукты питания, воду.
Удобрения, поступающие на склад в незатаренном виде, хранят насыпью в отдельных отсеках, при высоте не более 2 м для слеживающихся туков. Затаренные удобрения хранят в штабелях. Жидкие минеральные удобрения хранят в специальных емкостях. Для химической защиты растений должны применяться только разрешенные пестициды.
Категорически запрещается повышать нормы расхода пестицидов и увеличивать кратность их применения. Всех работающих с пестицидами инструктируют об основных правилах работы с ними и мерах предосторожности. Обработка растений пестицидами должна проводится в вечерние часы и после всех агротехнических приемов (Правила по охране труда…, 2003). Лица, работающие с минеральными удобрениями и ядохимикатами, в обязательном порядке проходят медицинский осмотр не реже одного раза в год. Рабочие, занятые на обработке ядохимикатами посадочного материала, обеспечиваются спецодеждой, перчатками «Блю 30 Джи», «Универсал плюс», Унитек, респираторами "РУ-60М" с патронами А, защитными очками ЗФ-2, «Ультравижн» - плотноприлегающая модель. На местах работы оборудуются умывальники, душевые, места для хранения спецодежды.
5.4 Техника безопасности и пожарная безопасность
5.4.1 Требования безопасности к технологическим процессам
Требования безопасности к технологическим процессам в овощеводстве предусматривают:
1) соблюдение норм предельно допустимых нагрузок при подъеме и перемещении тяжестей вручную;
2) обеспечение безопасности труда при приготовлении рабочих растворов пестицидов, предупреждение накопления в почве стойких препаратов;
4) контроль над содержанием в почве пестицидов перед началом полевых работ;
5) к работе, связанных с покрытиями теплиц не допускаются лица имеющие противопоказания на работы на высоте.
5.4.2 Техника безопасности при работе с насекомыми в теплицах
К работе допускаются лица, которые по состоянию здоровья могут работать в условиях повышенной влажности и температуры. Поэтому перед приемом на работу обязателен медицинский осмотр, затем его проходят ежегодно. Так как в процессе работы мы имеем дело с химическими препаратами, то к работе не допускаются лица, не достигшие 18 лет, беременные и кормящие женщины, мужчины старше 55 лет и женщины старше 50 лет, лица перенесшие инфекционные заболевания и хирургические операции (в течение 12 месяцев) и кому по состоянию здоровья противопоказана работа с пестицидами.
Продолжительность рабочего дня в теплице 7 часов. Размер тлей и личинок галлицы обычно не более 2 мм и приходится много работать с лупой. Эта работа высокой точности и при комбинированной освещенности к.е.о. должен равняться 5 (Солуянов П.В. и др., 1977).
Также основным опасным фактором при работе в теплицах являются падающее и разбитое стекло, также стекло используется при разведении хищного клеща, что требует осторожного с ним обращения.
5.4.2.1 Требования безопасности при массовом разведении галлицы
Галлица афидимиза – специализированный хищник тлей, безопасна для человека, теплокровных животных и других насекомых (за исключением тлей, которыми они питаются).
При производстве энтомофагов в массовом количестве должны соблюдаться правила безопасности в соответствии с «Санитарными правилами к организации технологических процессов и гигиеническими требованиями к производственному оборудованию» (IV 0142-73 от 04.04.73).
Производственное оборудование в процессе эксплуатации должно обеспечить соблюдение условий труда в соответствии с ГОСТ 12.2003-74, ГОСТ 12.1.003-83, 12.1.012-78, ГОСТ 12.1.030-81.
Воздух рабочей зоны должен соответствовать ГОСТ 12.1.005-88. Рабочие помещения необходимо оборудовать общеобменной вентиляцией.
При производстве галлицы необходимо пользоваться спецодеждой по ГОСТ 12.4.103-83.
Все работники подвергаются периодическим медицинским осмотрам (приказ Минздрава и социального развития РФ №83 от 16 августа 2004 г.). К работе с насекомыми не допускаются лица с хроническими заболеваниями органов зрения, дыхания, кожи, склонные к аллергическим реакциям, а также лица не прошедшие медосмотр. Для приема пищи и хранения спецодежды необходимы специально выделенные места.
5.4.3
Пожарная
безопасность
Большой вред сельскому хозяйству наносят пожары: уничтожают урожай, складские помещения, приводят к гибели людей и животных. Пожарная безопасность обеспечивается системой предотвращения пожара и системой пожарной защиты.
Система предотвращения пожара или взрыва - это комплекс организационных мероприятий и технических средств, исключающих возможность пожара или взрыва. Для предотвращения пожара в первую очередь нужно не допускать образования горючей среды (не превышать допустимой концентрации горючих газов, паров или пыли в воздухе), а также внесения в нее источников зажигания. Основные причины пожаров в овощеводстве - неосторожное обращение с огнем, нарушение правил эксплуатации электрооборудования. При проектировании тепличных комбинатов, в целях обеспечения пожарной безопасности предусматривают удобную сеть дорог, подъезды к зданиям (Шкрабак В.С., Казлаузкас Г.К.,1989). В целях предупреждения пожаров или взрывов веществ в складах необходимо знать их физико-химические и пожарные свойства, возможность воспламеняться и другие. С этой целью склады разбивают на секции, изолированные друг от друга. На местах работы в складах оборудуют щиты с набором инвентаря, обязательно наличие бочки с водой (200 л), ящика с песком (1м3
) (Канарев Ф.М., Бугаевский В.В. и др., 1988, изд. 2).
Средства пожарной безопасности.
Для тушения загораний и пожаров в начальной стадии используют огнетушители, подразделенные на следующие основные группы. По виду огнегасительные вещества: пенные, химические пенные, воздушно-пенные, углекислотные, аэрозольные и углекислотно-бромэтиловые, порошковые.
Пенные огнетушители, OП-5 и ОП-10 имеют наибольшее распространение из ручных огнетушителей.
Воздушно-пенные огнетушители предназначены для тушения загораний различных веществ и материалов, а также электроустановок, находящихся под напряжением. Различают два вида воздушно-пенных огнетушителей: ручные (ОВП-5 и ОВП-10) и стационарные (ОВПУ-250 и ОВП-100).
Углекислотные ручные огнетушители ОУ-2, ОУ-5 и ОУ-8 предназначены для тушения загораний yглекислотой (Шкрабак В.С., Казлаузкас Г.К.,1989).
5.5 Безопасность в чрезвычайных ситуациях
Наиболее вероятная ЧС, которая может сложиться на территории Ленинградской области – это выпадение радиоактивных осадков в результате аварии на АЭС в г. Сосновый Бор.
В период вегетации загрязняются радиоактивными веществами не только почва, но и растительный покров. В этом случае применяют комплекс защитных мероприятий, направленных на спасение и уменьшение радиоактивного заражения продукции растениеводства. В течение многих лет почва будет содержать долгоживущие изотопы (Sr90
, Cs137
и др.), мигрирующие из почвы в растение. В подобных ситуациях проводят комплекс мероприятий, направленных на уменьшение перехода радиоактивных веществ в надземную часть растений (Акимов Н.И., 1984).
Наиболее эффективно, против радиоактивного заражения, применять известкование кислых и гипсование нейтральных почв, применение минеральных и органических удобрений (фосфорные против Sr90
, калийные против Cs137
). При поливе посевов, первые 1-2 дня после заражения, с помощью дождевальных установок значительная часть радиоактивных остатков смывается с растений (радиоактивность снижается в 5-10 раз) (Дмитриев И.М., 1990).
Поскольку с течением времени, надземные органы растений очищаются, уборку следует проводить в возможно более поздние сроки. Собранный урожай лучше складывать в хранилище или на подготовленные площадки и укрывать брезентом, чтобы не допустить вторичного заражения тропосферными осадками радиоактивных веществ. Вся продукция подлежит радиометрическому контролю (Дмитриев И.М., 1990).
В случае радиоактивного заражения местности в результате аварии (ЧС) объектов агропромышленного комплекса в первую очередь рассматривают факторы, влияющие на устойчивость их работы. При этом оценивают предполагаемую радиационную обстановку на объекте; возможный недостаток работников; состояние техники и обеспеченность ее горюче-смазочными материалами; возможные потери и загрязненность урожая сельскохозяйственных культур, степень загрязнения сенокоса и пастбищ; площади сельскохозяйственных угодий, которые могут выйти из севооборота в результате заражения долгоживущими радиоизотопами выше допустимых величин (Николаев Н.С., 1990).
Источниками заражения местности являются продукты деление радиоактивных веществ (радионуклиды), излучающие бета-частицы и гамма-лучи; радиоактивные вещества не прореагировавшей части ядерного топлива, выброшенных в результате аварии (ЧС). В радиационном поражении растений главную роль играет β-излучение, которое сильнее поглощается растениями благодаря большой поверхности листьев, непосредственно контактирующей с частицами (Дмитриев И.М., 1990).
Радиоактивные вещества, выпадающие на растения, всасываются через листья внутрь, а, оказавшись в почве (особенно долго они задерживаются в ее верхнем слое 5-7 см.), начинают поступать в растения через корневую систему. Растения наиболее чувствительны к облучению в ранние фазы развития, когда страдают зоны активного роста, т. е. молодые делящиеся клетки. Существует также видовая и сортовая радиочувствительность.
Лучевое поражение растений проявляется в замедлении роста и развития, снижении урожайности, понижении репродуктивности семян. Пищевое качество урожая также снижается. Тяжелое поражение приводит к полной остановке роста и гибели растения через несколько дней после облучения. Степень радиоактивного поражения зависит от величины получаемой дозы облучения и радиочувствительности растений (Дмитриев И.М., 1990).
5.6 Экология
Проблема охраны природы требует такой организации защиты сельскохозяйственных культур, чтобы в первую очередь применялись агротехнические, биологические, механические и другие безопасные фитосанитарные приемы. Пестициды использовать только при необходимости с учетом экономических порогов вредоносности болезней и вредителей. При этом обработки ведутся наиболее рациональным способом, такие как краевые и ленточные обработки, малообъемные и ультрамалообъемные опрыскивания, комбинированные обработки. Кроме того, в сельскохозяйственном производстве успешно применяется выращивание устойчивых сортов. Эти подходы используются при разработке интегрированных систем защиты растений с целью наименьшего использования пестицидов.
В случае применения химических обработок следует принимать меры общественной безопасности, для предотвращения загрязнения атмосферного воздуха, почвы, водных источников и продуктов питания. Строгое соблюдение правил работы с пестицидами подразумевает исключение случайного контакта с ними посторонних лиц, обеспечивает охрану пчел, птиц, полезных животных, насекомых.
Характер их распределения в окружающей среде зависит от метода их применения. Наиболее широко используется опрыскивание растений. При опрыскивании воздействие на окружающую среду зависит от токсикологических свойств препарата, нормы его расхода на единицу площади, степени распыла (Саммерсов В.Ф., 1990).
Загрязнение атмосферного воздуха и водоемов происходит в результате сноса пестицидов ветром при опрыскивании, со сточными водами, а также при нарушении правил хранения, перевозок препаратов. В защищенном грунте во избежание загрязнения грунтовых вод и почвы необходимо строго придерживаться нормы расхода препарата, а также при их выборе отдавать предпочтение менее стойким, менее летучим и малотоксичным (Акареллова В.А., 1990).
Интегрированная защита растений предполагает исключение применения химических средств, по крайней мере, в двух случаях: если защиту данной культуры можно осуществить с помощью другого метода или их сочетания, и если плотность популяции вредителя не столь высока, чтобы обусловить превышение экономического порога вредоносности (ЭПВ) и уровня эффективности их естественных врагов (УЭЕВ) (Бондаренко Н.В., 1986).
Экономические пороги вредоносности в нашей стране разрабатываются из трехкратной окупаемости химического метода защиты растений (Томский В.И., 1988).
При определении ЭПВ учитывают плотность популяции вредного вида или степень повреждения растений, которые без применения активных мер причиняют экономически ощутимый вред. ЭПВ к настоящему времени определены уже более чем для 100 видов вредителей. Разрабатываются методики определения ЭПВ для сорняков и болезней растений.
УЭЕВ выражают в виде соотношения хищника и жертвы (для хищников), процента паразитированных особей или яиц (для паразитов) (Бондаренко Н.В., 1986).
Однако на данный момент отказаться от применения пестицидов невозможно, так как их применяют в период вспышек вредителя, поэтому для осуществления контроля в проведении химических работ, в хозяйстве ведутся специальные книги, в которых записывают время обработок, нормы расхода препаратов, условия проведения обработки (Дмитриев И.М.,1990).
Выводы
1. Обработка пятнистой оранжерейной тли препаратами 729, П-55. 925 в 0,1% - ной концентрации не только не снижает численность вредителя, но напротив, стимулирует скорость роста популяции тли.
2. Обработка пятнистой оранжерейной тли препаратами П-56 и S-100 в 0,1% - ной и 0,2%- ной концентрации очень мало снижают численность вредителя. Максимальное снижение 34%.
3. Проведение скрининга штаммов П-56 и S-100 привело к получению активных клонов П-56-1 и S-100кр. Обработка пятнистой оранжерейной тли препаратами на основе этих клонов выявила их высокую эффективность. Снижение численности вредителя на 68% и 92% соответственно.
4. После обработки яйцекладок галлицы 0,2% суспензией препаратов на основе штаммов П-56-1 и S-100кр токсическое действие на эмбриональную стадию афидофага не обнаружено.
5. При обработке личинок галлицы второго возраста 0,2% суспензией препаратов на основе штаммов S-100 кр, П-56-1 токсического действия не обнаружено.
6. В опытах с имаго галлицы, после обработки их 0,2% суспензией препаратов на основе штаммов S-100кр, П-56-1, , отмечено слабое сокращение продолжительности жизни афидофага в вариантах с препаратами, но различия между вариантами опыта и контролем очень малы и не существенны. В целом токсическое действие на имаго не наблюдается.
7. Таким образом, возможен выпуск галлицы после применения данных препаратов в борьбе с тлями в теплицах и оранжереях. Необходимо дальнейшее изучение их действия в производственных условиях.
Список
литературы
1. Акареллова В.А. Средства защиты растений и экология II
XIV Менделеевский съезд по общей и прикладной химии, М., 1989, №2, С. 26-30
2. Ахатов А.К., Ижевский С.С. (ред.) Вредители тепличных и оранжерейных растений Москва: Товарищество научных изданий КМК, 2004
3. Ахатов А.К., Ижевский С.С., Миронова М.К. Тли – вредители тепличных культур //Гавриш, 1997, №6
4. Банников А.Г., Вакулин А.А., Рустамов А.К. Основы экологии и охрана окружающей среды. М, Колос, 1996
5. Бойкова И.В. и др. Алейцид, индоцид – новые биопрепараты на основе актиномицетов СПб, 1999
6. Бойкова И.В., Павлюшин В.А. Актиномицеты – основа новых биопрепаратов для защиты растений от вредных членистоногих. Информационный бюллетень ВПРС МОББ № 33, СПб, 2002, стр. 102
7. Бондаренко Н.В. Биологическая защита растений // М., Агропромиз-дат. 1986, С. 4-8
8. Бондаренко Н.В., Воронова О.В. Галлица афидимиза: методика массового разведения и применения против тлей на тепличных овощных культурах // Биологический метод борьбы с вредителями овощных культур. - М.: ВО Агропромиздат, 1989. - С. 8-19.
9. Бондаренко Н.В., Гавелка Я.Я. Опыт применения хищной галлицы афидимизы в борьбе с тлями в крупноблочных теплицах // Науч. тр. ЛенСХИ. – 1977. - Т. 321. - С. 3-7.
10. Вулфа Л. Выделение актиномицетов и определение их антагонистических свойств Рига, 1974
11. Гаузе Г.Ф., Преображенская Г.П., Терехова Л.П., Максимова Т.С., Аверичева Л.Н. Образование антибиотиков из группы пиримидиновых оснований и группы аминогликозидов культурой Streptomycescoeruleoaurantiacussp. nov. //Антибиотики, 1982
12. Головлева Л.А., Черменский Д.Н. Биологические средства защиты растений и животных: современное состояние и перспективы // Агрохимия, 1988
13. Дмитриев И.М. Гражданская оборона на объектах агропромышленного комплекса // М., Агроиромиздат,1990, С. 58-65
14. Дорохова Г.И., Верещагина А.Б., Великань В.С. и др. Определитель вредных и полезных беспозвоночных закрытого грунта // СПб., ВИЗР., 2003, С. 12-23
15. Доспехов Б.А. Методика полевого опыта // М., Колос, 1979, С. 229
16. Ермолаев Н.Е. Биологическая защита овощных культур от вредителей с помощью комплекса энтомофагов. Пушкин, ВИЗР, 1999
17. Ермолаев Н.Е. Хищная галлица афидимиза, совершенствование методики её массового разведения, хранения и применения в защищенном грунте Нечерноземной зоны: Автореф. дис. … канд. биол. наук. - Л.: ВИЗР, 1984. - 17 с.
18. Ермолаев Н.Е. Хищная галлица афидимиза: биология, разведение и применение. – СПб.; Пушкин: ВИЗР, 2000. - 42 с.
19. Заварзин Г.А. (ред.) Определитель бактерий Берджи Том 2, М, «Мир», 1997
20. Кандыбин Н.В. Биопестициды. Теория и практика //Защита растений, 1991, №1
21. Кобзарь В.Ф. Биологические и биорациональные средства защиты растений. Краткий справочник, ВНИИБЗР, 1995
22. Коробкова Т.П., Иваницкая Л.П., Дробышева Т.Н. Современное состояние и перспективы применения антибиотиков в с/х //Антибиотики и медицинская биотехнология, 1987, №8
23. Кузнецова Г.Н., Бондаренко Н.В., Ермолаев Н.Е. Биометод в борьбе с тлей на перцах // Картофель и овощи. – 1984. - № 7. - с. 33.
24. Курсанов Л.И. Определитель низших растений, том 5, М, 1960, с. 189
25. Лакин Г.Ф. Биомертрия. Высшая школа, М., 1973, с. 343
26. Лобанок А.Г., Ялашко М.В., Анисимова Н.И. Биотехнология – сельскому хозяйству. Минск, 1988
27. Новикова И.И., Бойкова И.И., Павлюшин В.А., Матевосян Г.Л., Паршин В.Г. Полифункциональные микробиологические препараты для защиты растений // Информационный бюллетень ВППРС МОББ, № 33, СПб, 2002
28. Павлюшин В.А., Агасонова Н.Е. Биопрепараты. Перечень разрешенных к применению и новых перспективных биопрепаратов для защиты растений СПб, ВИЗР, 2001
29. Правила по охране труда при использовании пестицидов и агрохимикатов ПОТ РО 018-2003.
30. Русанова Е. П., Алехова Т.А., Федорова Г.Б., Катруха Г.С. Разработка нового метода получения биологически активных соединений на основе типового штамма Str. werraensis //Пр. биохим. и микробиология, 2000, том 36, №3
31. Саммерсов В.Ф. Защита растений и экология // Экология земледелия - забота общая, Минск, 1990, С. 19-21
32. Самоукина Г.В. Изменчивость Actinomycessp. штамм 0234 //Тр. ВНИИСХМ Л, 1983, том 53
33. Самоукина Г.В., Кандыбин Н.В. Поиски микроорганизмов со свойствами антифидантного действия на насекомых //Тр. ВНИИСХМ, Л, 1981, том 51
34. Самоукина Г.В., Кандыбин Н.В., Сергеева М.В., Бортник Н.И. Эффективность актинина против паутинного клеща в защищенном грунте // Биологический метод защиты растений Минск, 1990
35. Томский В.И. Биологические основы вредоносности насекомых //
36. М., Агропромиздат, 1988, С. 17-23
37. Цизин Ю.С., Бронштейн А.М. Успехи в области создания новых антигельминтиков // Хим.-фарм. журнал, 1986, №10
38. Чалков А.А. Биологическая борьба с вредителями овощных культур // М., Россельхозиздат, 1986, С.46-60
39. Шапиро Я.С. Методические указания к изучению систематики бактерий. СПб, 2005
40. Штерншис Н.В. Повышение эффективности микробиологической борьбы с вредными насекомыми Новосибирск: Новосибир. Гос. Аграр. Ун-т, 2000
41. Бондаренко Н.В., Асякин Б.П. Методика массового размножения хищной галлицы афидимизы // Защита растений. - 1975а - № 8. - С. 42-43.
42. Бондаренко Н.В., Асякин Б.П. Оценка различных способов применения хищной галлицы афидимизы в борьбе с тлями на огурцах в теплицах // Заметки ЛенСХИ. – 1974 - Т.239. - С. 3-12.
43. Асякин Б.П. Влияние некоторых факторов на эффективность галлицы Aphidoletes aphidimyza (Rond) в борьбе с тлями на огурце в теплицах // Записки ЛСХИ. – 1974. - Т.239. - С. 13-15.
44. Гавелка Я.Я. Квопросу об имагинальном питании хищной галлицы Aphidoletes aphidimyza Rond. (Diptera, Cecidomyiidae) // Науч. тр. ЛСХИ. – 1976. - Т.297. - С. 29-32
45. Berdy I., Are actinomycetes exhausted as a source ot second ary metabolites? /The 9th Jnt. symp. on the Biology of Actinomycetes M, 1994, p.27
46. Bettine Lauer, Roderich Submuth, Dietmar Kaiser, Gunther Junj and Christian Borman. A putative Enjlpyzuvyl Trasferase gene Involved in Nikkomycin Biosynhesis //J. Antibiotics, 2000, v. 53, №4
47. Ermolaev N.E. Utilization des parasites et des predateurs des pucerons dans le systeme de la protection biolodique des cultures legumieres // Protection biologique des vegetaux et bonification du sol sale Exposition Seminaire Russe-Tunissien. - Saint-Petersburg; Poushkine, 1998. - P. 4-6.
48. Pavlyushine V.A., Voronov K.E., Ermolaev N.E., Krasavina L.P., Asiakine B.P., Razdobourdine V.A., Novicova I.I., Voronina E.G., Danilov L.G., Bykova G.A. (VIZR). Le systeme de la protection biologique du concombre et de la tomate sous serce // Protection biologique des vegttaux et bonification du sol sale. Exposition Seminaire Russe-Tunissien. - Saint-Petersburg; Poushkine, 1998. - P. 18.
*
- диаминопимелиновая кислота
|