Курсовая работа
Производство вольфрамового ангидрида вскрытием вольфрамового концентрата автоклавно–содовым выщелачиванием
Введение
1. Автоклавно-содовый способ разложения вольфрамовых концентратов
1.1 Физико-химические основы автоклавно–содового разложения
1.2 Кинетика процесса автоклавного выщелачивания
2. Практика автоклавно-содового процесса
3. Пути совершенствования автоклавно-содового способа выщелачивания
3.1 Регенерация или выведение избыточной соды из автоклавных щелоков
3.2 Повышение температуры
3.3 Механическое активирование
4. Получение вольфрамового ангедрида
4.1 Переработка растворов вольфрамата натрия
4.2 Очистка растворов Na2
WO4
от примесей
4.2.1 Очистка от кремния
4.2.2 Очистка от фторид-ионов
4.2.3 Очистка от молибдена
4.2.4 Очистка от Р и Аs
4.3 Получение вольфрамовой кислоты из растворов вольфрамата натрия
4.4 Очистка технической вольфрамовой кислоты
4.5 Получение WO3
5. Расчет специальной части курсовой работы.
5.1 Задание
5.2 Решение
Заключение
Список литературы
Введение
Элемент вольфрам открыт шведским химиком Шееле в 1781 гг. Вольфрам был открыт при разложении кислотой минерала "тунгстен" (тяжелый камень), впоследствии названного шеелитом. В 1783 г. было установлено, что новый элемент входит в состав другого минерала - вольфрамита, и в этом же году впервые был получен порошок вольфрама восстановлением триоксида вольфрама углеродом. Вольфрам относится к тугоплавким металлам. По внешнему виду похож на сталь. Тяжелый плотность составляет 19.3г. Тпл. = 3400°С, Ткип. = 5900°С.
Найдено около 15 минералов вольфрама. Наиболее распространённые – это вольфрамит и шеелит.
Вольфрамит
– (Fe,Mn)WO4
, представляет собой изоморфную смесь вольфрамата железа – FeWO4
и вольфрамата марганца – MnWO4
. Если MnWO4
< 20%, то минерал называется ферберитом, когда MnWO4
> 80% – гюбнеритом. Смеси, лежащие по составу между этими пределами, называются вольфрамитами. Вольфрамит - минерал черно-коричневого цвета, плотность 7,1¸
7,9 г/см3
, слабомагнитен.
Шеелит
– CaWO4
. Цвет – белый, желтый, серый или бурый; не магнитен, плотность 5,9¸
6,1г/см3
, часто содержит примесь повеллита – CaMoO4
.
Реклама

К другим минералам, не имеющим промышленного значения, относятся:

По минералогическому составу различают два типа месторождений – вольфрамитовые и шеелитовые. Основные месторождения вольфрамовых руд расположены вдоль побережья Тихого океана, причём Азиатские месторождения богаче Американских.
В России выяснены и ведется разработка месторождений в Забайкалье, Амурской области, Западном Алтае, Кавказе. Разные месторождения имеют разный состав.
Состав вольфрамита (Fe,Mn)WO4
:70
¸
75% WO3
, 7¸
14% FeO, ~14% MnO, 0,5¸
1,2% CaO, до 2,5% SiO2
, 0,5% SnO2
.
Состав шеелита CaWO4
: 71,6¸
79,6% WO3
, 19¸
20% CaO, до 7,6% MoO3
, до 0,4% MgO и др.
Cпособы обогащения: гравитация степень извлечения металла в концентрат вольфрамовых руд 65-85%
Нa воздухе вольфрам устойчив. Заметное окисление металла наступает при 400-500 С, при более высоких температурах происходит быстрое окисление. При 600-700 С пары воды быстро окисляют металл.
С азотом вольфрам - выше 20000
С с образованием нитридов, которые в отсутствие нитрирующего агента разлагаются при нагревании до 700-8000
С.
Твердый углерод и углеродсодержащие газы при 1000-1200°С взаимодействуют с вольфрамом с образованием карбидов (WC, W2
C,). Небольшие примеси карбидов в металле вызывают их хрупкость и сильно понижают электропроводность. Фтор взаимодействует с вольфрамом при обычной температуре. Хлор интенсивно реагирует при 800-10000
С с образованием летучих WC16
(температура кипения 337 °С соответственно). Пары иода с вольфрамом и не реагируют.
Пары серы и селена, а также H2
S и H2
Se при температуре выше 400°С взаимодействуют с металлами, образуя дихалькогениды WS2
, WSe2
.
Вольфрам на холоду практически устойчив против действия соляной, серной, азотной к плавиковой кислот любой концентрации, а также царской водки. При нагревании до 80-100 0
С происходит медленная коррозия в перечисленных кислотах, кроме плавиковой. Металл быстро растворяется в смеси азотной и плавиковой кислот.
Вольфрам находит широкое применение в современной технике в виде чистого металла и в сплавах, из которых важнейшие - легированные стали, твердые сплавы на основе карбида вольфрама, износостойкие, коррозионно-стойкие и жаропрочные сплавы. До 50 % добываемого вольфрама и используют в черной металлургии для производства легированных сталей и чугунов. Вольфрамовые стали применяют главным образом как инструментальные. Из них важнейшие - быстрорежущие стали, в состав которых вводят, %: W 8-20; Сг 2-7; V 0-2,5; Со 1-5; С 0,5-1,0. Кроме быстрорежущих применяют и другие инструментальные вольфрамовые и хромовольфрамовые стали (с содержанием 1-6% W, 0,4-2% Сг). Кроме того, вольфрам входит в состав магнитных сталей.
Реклама

Металлические вольфрам. Вольфрам в виде прутков, проволоки, листа и различных кованых деталей применяют в производстве электроламп, радиоэлектронике и рентгенотехнике. Вольфрам - лучший материал для изготовления нитей и спиралей в лампах накаливания. Высокая рабочая температура (2200-2500 °С) обеспечивает высокую светоотдачу, а малая скорость испарения - длительный срок службы нитей. Из вольфрамовой проволоки изготовляют катоды прямого накала и сетки электронных генераторных ламп, катоды высоковольтных выпрямителей, подогреватели катодов косвенного накала электронных приборов [1].
1. Автоклавно-содовый способ разложения вольфрамовых концентратов
Автоклавно-содовый способ был предложен в СССР в 1932 г. В.С. Сырокомским н в последующем детально разработан И.Н. Масленицким и сотрудниками института "Механобр" применительно к переработке шеелитовых концентратов и промпродуктов [1]. В настоящее время способ широко используют на отечественных заводах, а также в других странах (США, Японии, Великобритании, ФРГ, Австрии).
Преимущества автоклавно-содового разложения вольфрамового сырья перед способом спекания состоят в исключении печного процесса, предшествующего выщелачиванию, и несколько меньшем содержании примесей (особенно фосфора и мышьяка) в вольфраматных растворах. Кроме того, способ применим к вскрытию не только стандартных концентратов, но и низкосортных промпродуктов и хвостов обогащения, содержащих 4—5 % WO3.
Процесс разложения шеелита растворами соды основан на обменной реакции:
CaWO4
(тв) + Na2
СО3
(раств) →Na2
WO4
(раств) + СаСО3
(тв). (1)
С достаточной скоростью и полнотой реакция протекает при большом расходе соды (250—300 % от СНК) и температурах 200—225 °С, что требует осуществления процесса в автоклавах. Высокий расход соды обусловлен относительно малыми значениями концентрационной константы равновесия реакции разложения Kс, которая возрастает с повышением температуры и зависит от содового эквивалента (отношение количества молей соды к 1 молю CaW04
), значительно понижаясь по мере его увеличения (табл. 1). Таким образом, необходимость проведения процесса при 200—225°С (в автоклаве) определяется и термодинамическими показателями (более высокие значения константы равновесия), и увеличением скорости взаимодействия при повышенных температурах. Для полного извлечения вольфрама из шеелита в раствор при 200 °С минимальный содовый эквивалент должен быть равен 2,5, а при 225 °С 2,0. Для реальных концентратов, содержащих примеси других минералов, эта величина выше и зависит от содержания в них W03
[2].
Кинетика гетерогенной реакции рассматриваемого типа складывается из ряда последовательных стадий: переноса реагента из объема раствора к поверхности твердой фазы через пограничный слой жидкости; диффузии реагента через слой твердого продукта реакции (слой СаСОз на частицах шеелита); химической реакции на поверхности шеелита; переноса продукта реакции (Na2
WO4
) в объем раствора. Исследования кинетики взаимодействия шеелита (в форме пластинок с известной поверхностью) с растворами соды в интервале 150—200 °С показали, что пленки СаСОз пористые и вплоть до толщины 110 мкм не влияют на скорость процесса. Пористость пленки объясняется тем, что молярный объем СаСОз меньше молярного объема CaW04
(отношение молярных объемов равно 0,75). При интенсивном перемешивании взаимодействие протекает в кинетической области, энергия активации процесса E=75-92,кДж /моль. Следует учитывать, что при недостаточной интенсивности перемешивания (что имеет место в горизонтальныхвращающихся автоклавах) реализуется промежуточный режим: скорость процесса определяется и скоростью подвода реагента к поверхности, и скоростью химического взаимодействия.
Таблица 1. Зависимость Кс и степени извлечения вольфрама Е от температуры и содового эквивалента Q
| tºc |
Q |
E, доли единиц |
Кс
|
tºc |
Q |
E, доли единиц |
Kc |
| 90 |
1 |
0,316 |
0,46 |
225 |
0,75 |
0,495 |
1,56 |
| 175 |
1 |
0.547 |
1.21 |
225 |
1 |
0.608 |
1.56 |
| 200 |
1 |
0.586 |
1.45 |
225 |
1.5 |
0.899 |
1.49 |
| 200 |
1 |
0.829 |
1.19 |
225 |
2.0 |
0.995 |
0.99 |
| 200 |
1 |
0.979 |
0.96 |
225 |
1.0 |
0.634 |
1.85 |
| 200 |
1 |
0.994 |
0.67 |
225 |
1.5 |
0.923 |
1.61 |
Принимая, что реакция первого порядка по реагенту, и учитывая ее обратимость, удельную скорость процесса в кинетической области можно представить как:
I = K ([Na2
CO3
] - [Na2
WO4
]/ Kc), (1.1)
где К—константа скорости реакции; К.с—константа равновесия; [Na2
CO3
и [Na2
WO4
] - концентрации соды и вольфрамата натрия в объеме раствора. [1]
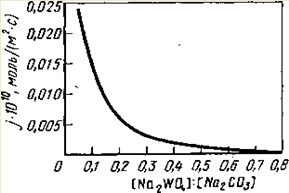
Рис. 1 Зависимость удельной скорости реакции разложения шеелита от молярного отношения концентрации Na2
WO4
/Na2
CO3
в растворе при 175 °С.
Как видно из рис.1, удельная скорость реакции уменьшается примерно обратно пропорционально возрастанию отношения молярных концентраций [Na2
WO4
]: [Na2
СО3
] в растворе, что соответствует уравнению c переменной I.
Это обусловливает необходимость применения значительного "кинетического" избытка соды. С целью снижения расхода соды проводят двустадийное противоточное выщелачивание: хвосты после первого выщелачивания, содержащие 15-20 % WOз от исходного количества, выщелачивают, используя большой избыток соды. Получаемый раствор, являющийся оборотным, поступает на первую стадию процесса. Однако расход соды и в этом случае не ниже 250 % от СНК.
Шеелитовые концентраты легче разлагаются растворами соды по сравнению с вольфрамитовыми. Добавление в автоклавную пульпу
NaOH или СаО (что приводит к каустификации соды) позволяет снизить расход соды.
Содержание примесей в щелоках автоклавно-содового процесса определяется взаимодействием сопутствующих минералов с растворами соды при 200—225 °С. В растворах могут присутствовать примеси соединений Si, P, As, F, Mo, A1. Для окисления примеси молибденита (с целью извлечения молибдена в вольфраматный раствор), а также удаления примеси мышьяка применяют предварительный обжиг вольфрамовых концентратов при 650—700°С. Удаление флотореагентов в процессе обжига улучшает показатели автоклавно-содового разложения вследствие исключения вспенивания пульп. В таблице 2 приведены сопутствующие компоненты шеелитового концентрата, их форма нахождения в концентрате и характер взаимодействия с растворами соды при выщелачивании.
Таблица 2.
Характер взаимодействия сопутствующих минералов шеелитовых концентратов с растворами соды при 200—225 °С
| Элемент |
Минерал |
Характер взаимодействия минерала с растворами соды |
Соединение, пере-ходящее в раствор |
| Фосфор |
Апатит
Са5
(Р04
)зF
|
Частично реагирует по обменной реакции с образованием фосфата и фторида натрия |
Na2
HPО4
;
(NaF)
|
| Мышьяк |
Арсенопирит
FeAsS
Скородит
FeAs04
|
Частично реагирует с образованием рас творимой тиосоли
Реагирует с образованием арсената нагрия
|
Na2
HAs04
Na2
HAs04
|
| Фтор |
Флюорит CaF2
|
Частично реагирует
По обменной реакции
|
NaF |
| Кремний и алюминий |
Кварц, силикаты, алюмосиликаты |
Реагирует с образованием растворимых
Силикатов и алюминатов натрия
|
Na2
SiO3
,
NaAl(OH)4
|
| Молибден |
Молибденит
MoS2
Повеллит
СаМо04
|
Не реагирует при отсутствии окислителя
Реагирует по обменной реакции
|
—
Na2
Mo04
|
| Олово |
Касситерит SnO2
|
Практически не реагирует |
— |
| Медь |
Халькопирит
CuFeS2
|
Частично реагирует с образованием неустойчивых комплексных анионов Сu(СОз)2
|
Комплекс разлагается
с выделением
Сu(ОН)2
|
| Сурьма |
Антимонит
Sb2
S3
,
|
Практически не реагирует |
— |
| Висмут |
Висмутииит
Bi2
S3
|
То же |
— |
| Кальций |
Кальцит СаСОз |
— |
Выщелачивание проводят в автоклавах двух типов: вертикальных периодического или непрерывного действия с обогревом и перемешиванием острым паром и горизонтальных вращающихся периодического действия с нагревом пульпы острым паром, и в вертикальных автоклавах с мешалками и глухим паром [3].
Автоклавы изготовляют из специальных никелевых и обычных углеродистых сталей. На отечественных заводах 2—4 вертикальных автоклава емкостью 5 м3
соединяют в батарею, работающую в непрерывном режиме (рис. 2). Горизонтальные автоклавы имеют емкость 10 м3
. Шеелитовые флотационные концентраты обычно тонкодисперсные (~90% частиц диаметром менее 0,07 мм) и непосредственно поступают на приготовление пульпы, тогда как вольфрамитовые большей частью до измельчают в шаровых мельницах, работающих в замкнутом цикле с классификатором. Приготовленная в смесителе автоклавная пульпа, подогретая паром до 80—100 °С, подается насосом в автоклавы, в которых нагревается до 220—225 °С острым паром (температура пара ~250°С, давление 2,7 МПа), разбавление пульпы вследствие конденсации пара составляет 30—40 %. Концентраты и промпродукты обрабатывают при тж =1 : (3,5—4) и продолжительности 4—5 ч [2]. При непрерывном режиме работы давление в автоклавах поддерживается путем выпуска пульпы через дроссель (калиброванную шайбу из твердого сплава).
Пульпа из автоклавов поступает в самоиспаритель—аппарат, находящийся под более низким абсолютным давлением, чем автоклавы (примерно 0,15—0,25 МПа), в котором происходит интенсивное испарение и вследствие этого быстрое охлаждение пульпы. Образующийся вторичный пар используют для подогрева автоквлавной пульпы рис 2[1].
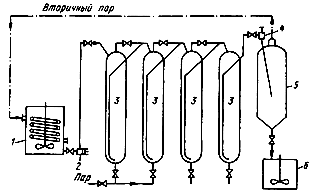
Рис. 2 Схема автоклавной установки непрерывного действия. 1-реактор подогрева, 2-насос, 3-автоклавы, 4-дроссель, 5-самоиспаритель, 6-сборник пульпы
Из самоиспарителя пульпа поступает в сборники и далее на фильтрацию на дисковых вакуумных фильтрах или автоматических фильтрпрессах.
При переработке некоторых шеелитовых концентратов (например, тырныаузских) осуществление процесса в вертикальных автоклавах при непрерывном режиме работы затруднительно вследствие образования прочных наростов на стенках труб для перетока пульпы на первой стадии выщелачивания [2]. В этом случае процесс ведут в периодическом режиме в горизонтальных вращающихся автоклавах.
При разложении шеелитовых концентратов степень извлечения вольфрама в раствор достигает 98,6—99,5%, а содержание WO3
в отвальных хвостах не превышает 1 % [4].
Основной недостаток автоклавно-содового способа—большой расход соды (260—400% от СНК). Высокая концентрация избыточной соды в растворах (80— 130 г/л) влечет за собой повышенный расход минеральных кислот на нейтрализацию растворов и, как следствие, значительную концентрацию солей в сточных водах. Примерно 30—50 % соды (в зависимости от исходной ее концентрации) можно выделить кристаллизацией Na2
CO3
*lOH2
O, охлаждая шеелитовые щелока до 0°С. Поскольку сода выделяется с кристаллизационной водой, концентрация WO3
в растворах повышается [4].
Другой путь выведения избыточной соды (который можно сочетать с кристаллизационным) состоит в использовании электродиализа с катионитовыми мембранами. В процессе электродиализа ионы натрия из исходных вольфраматных щелоков, находящихся в анодных камерах, диффундируют через катионитовые мембраны в катодные камеры. На катоде происходит разряд ионов водорода (Н2
0+е=0,5; H2
+ OH-
), что приводит к образованию щелочи. На аноде выделяется кислород преимущественно в результате реакции Н2
О - 2е = 0,5О2
+2Н+
.
Вследствие понижения рН в анолите первоначально образуются бикарбонат-ионы НСО3
, а затем (при рН<8) выделяется CO3
. He исключен также прямой разряд ионов НСОз на аноде с выделением кислорода и СОз: Кроме того, при рН<;8 образуются полимерные вольфрамат-ионы (W12
O41
и другого состава).
Если выделяющийся углекислый газ пропускать через католит, содержащий NaOH, можно регенерировать соду [3].
Исследования показали, что поступающие в анодные камеры щелока должны быть предварительно нейтрализованы до рН==8—9 с целью выделения основного количества примеси кремниевой кислоты (до содержания SiO2
0,3 г/л). Нейтрализацию можно проводить выводимым из диализатора анолитом, имеющим рН=7—7,5. Выход по току (в расчете на ионы Na4-
, выводимые из раствора) понижается с увеличением концентрации NaOH. Поэтому катодные камеры рекомендуется питать растворами соды, а образующуюся щелочь переводить в карбонат в скруббере, куда подается из анодных камер CO2
.
По данным испытаний, на промышленных щелоках выход по току в процессе диализа составляет 84—85 % при расходе электроэнергии на регенерацию 1 т соды 2800 кВт*ч. Экономическая эффективность электродиализного способа регенерации соды очевидна. Резко сокращается не только расход соды, но и соляной кислоты на нейтрализацию автоклавных щелоков, а также объем вредных сбросов хлористых солей[2].
В зависимости от интенсивности перемешивания взаимодействие шеелита с растворами соды протекает в кинетическом или промежуточном (диффузионно-кинетическом) режиме. Естественно, что один из возможных путей интенсификации разложения концентратов—повышение температуры. В рассматриваемом случае с увеличением температуры возрастают не только скорость процесса, но и константы равновесия обменных реакций, что снижает минимально необходимый избыток соды. Действительно, как показали исследования, повышение температуры с 225 до 275—300 °С приводит к резкому сокращению продолжительности процесса и снижению расхода соды. Однако это требует использования автоклавов, рассчитанных на давление 7,0— 7,5 МПа (70—75 ат), что связано с существенными затратами и необходимостью обеспечить производство паром более высоких параметров[3].
Другой путь интенсификации разложения вольфрамовых минералов, изученный в последние годы, заключается в предварительном их механическом активировании с использованием энергонагруженных аппаратов механического воздействия типа центробежных планетарных мельниц, дезинтеграторов и др. В таких аппаратах сочетаются высокая частота и сила ударов (Q = 20—100 м/с2
и больше), что вызывает в минералах различные структурные нарушения и вследствие этого повышение реакционной способности[4].
Исследованиями установлено резкое увеличение скорости взаимодействия активированных в центробежной планетарной мельнице шеелитовых и особенно вольфрамитовых концентратов с растворами соды в автоклавах, щелочи (для вольфрамита) и кислотами. Это позволяет интенсифицировать автоклавно-содовое разложение вольфрамовых концентратов, сократить расходы соды и в ряде случаев проводить процесс в одну стадию. Последнее увеличивает производительность автоклавов[4].
4.1 Переработка растворов вольфрамата натрия
Растворы в, содержащие 60—150 г/л WO3
, с целью получения триоксида вольфрама требуемой чистоты до настоящего времени перерабатывают по традиционной схеме. Схема включает: очистку от примесей (Si, P, As, Fe, Mo); осаждение искусственного шеелита, разложение его кислотами с получением осадка технической вольфрамовой кислоты; растворение вольфрамовой кислоты в аммиачной воде и выделение из растворов паравольфрамата аммония методом выпарки. Термическим разложением последнего получают WO3
.
Основной недостаток этой схемы ее многостадийность, большие затраты реагентов, осуществление большинства операций в периодическом режиме и длительность некоторых из них. В связи с этим разработаны и уже применяются на некоторых предприятиях схемы, в которых после очистки от примесей осуществляют конверсию раствора Na2
W04
в раствор (NH4
)2
W04
методом экстракции или ионного обмена. Это приводит к существенному сокращению схемы, так как исключаются операции, связанные с получением вольфрамовой кислоты.
Ниже рассмотрены основные переделы традиционной схемы и новые варианты технологии[2].
4.2 Очистка растворов Na2
WO4
от примесей
Растворы Na2
WО4
обычно содержат 1—3 г/л SiО2
. Для обеспечения нормируемого техническими условиями содержания примеси Si02
в триоксиде вольфрама (не более 0,05 или 0,1 % в зависимости от назначения) необходимо снизить отношение SiO2
: WОз в раствоере от 1—3 до примерно 0,1—0,2 % (т.е. примерно до 0,1— 0,2 г/л). Наиболее распространенный способ очистки от кремния основан на гидролитическом осаждении кремниевой кислоты при нейтрализации растворов до рН=8—9:
Na2
SiО3
+ Н2
О = H2
SiO3
+ 2NaOH. (2)
При кипячении раствора кремниевая кислота коагулирует и выделяется и форме объемистого осадка.
При высоком содержании флюорита в исходном концентрате содержание фторид-ионов достигает 5 г/л. Растворы очищают от фторид-ионов осаждением фторидом магния из нейтрализованного раствора, в который добавляют MgCl2
. Очистку от фтора можно сочетать с гидролитическим выделением кремниевой кислотых[1].
Растворы вольфрамата натрия необходимо очищать от молибдена в том случае, если его содержание превышает 0,1 % от содержания WО3
(т.е. 0,1-0,2 г/л). При концентрации молибдена 5-10 г/л (например, при переработке шеелито-повеллитовых Тырны-Аузских концентратов) выделение молибдена приобретает особое значение, так как имеет целью получение молибденового химического концентрата.
Распространенный способ состоит в осаждении из раствора малорастворимого трисульфида молибдена MoS3
Известно, что при добавлении в растворы вольфрамата или молибдата натрия сернистого натрия образуются сульфосоли Na2
ЭS4
или оксосульфосоли [4]:
Na
2
Э04
+ 4NaHS = Na2
ЭS4
+ 4NaOH(3)
Константа равновесия реакции (3) для Na2
MoO4
значительно больше, чем для Na2
WO4
г/л). Поэтому, если в раствор добавлено количество Na2
S, достаточное лишь для взаимодействия с Na2
MoО4
(с небольшим избытком), то преимущественно образуется сульфосоль молибдена. При последующем подкислении раствора до рН=2,5-3,0 сульфосоль разрушается с выделением трисульфида молибдена:
Na2
MoS4
+ 2HCI = MoS3
+ 2NaCl + H2
S. (4)
Оксосульфосоли разлагаются с выделением оксосульфидов (например, MoS; и др.). Вместе с трисульфидом молибдена соосаждается некоторое количество трисульфида вольфрама. Растворением сульфидного осадка в растворе соды и повторным осаждением трисульфида молибдена получают молибденовый концентрат с содержанием WO3
, не более 2 % при потере вольфрама 0,3-0,5 % от исходного количества.
После частичного окислительного обжига осадка трисульфида молибдена (при 450-500 °С) получают молибденовый химический концентрат с содержанием 50-52 % молибдена. Недостаток способа осаждения молибдена в составе трисульфида это выделение серо водорода[1].
Очистку ведут при спекании с Na3
PO4
. В вольфрамате Р и Аs находятся в виде Na2
HPO4
и Na2
AsO4
. Добавляют MgCl2
и Nh4
OH:
Na2
HPO4
+ MgCl2
+ Nh4
OH = Mg(NH4
)PO4
+ NaCl + H2
O(5)
Na2
AsO4
+ MgCl2
+ Nh4
OH = Mg(NH4
)AsO4
+ NaCl + H2
O (6)
Mg(NH4
)PO4
+ H2
O = MgH2
PO4
+ Nh4
OH (7)
Mg(NH4
)AsO4
+ H2
O = MgHAsO4
+ Nh4
OH (8)
Получаемые соли MgH2
PO4
и MgHAsO4
растворимые. Чтобы увеличить скорость реакции необходим избыток амиака. В раствор добавляют Nh4
Сl чтобы не допустить образования гидроксида магния[2].
Вольфрамовую кислоту можно непосредственно выделить из раствора вольфрамата натрия соляной или азотной кислотами.
Na2
WО4
+2HCl = H2
WO4
+ NaCl(9)
Однако этот способ применяют редко вследствие трудностей отмывки осадков от ионов натрия, содержание которых в триоксиде вольфрама лимитировано.
Большей частью первоначально из раствора осаждают вольфрамат кальция, который затем разлагают кислотами. Вольфрамат кальция осаждают, добавляя в нагретый до 80-90 С раствор вольфрамата натрия раствор СаС12
; при остаточной щелочности раствора 0,3-0,7 %. При этом выпадает белый мелкокристаллический легко отстаивающийся осадок, в маточном растворе остаются ионы натрия, что обеспечивает низкое их содержание в вольфрамовой кислоте. Из раствора осаждается 99-99,5 % W, маточные растворы содержат 0,05-0,07 г/л W03
. Отмытый водой осадок CaWO4
в виде пасты или пульпы поступает на разложение соляной кислотой при нагревании до 90 °С:
CaWO4
+ 2HCI = H2
WO4
+ CaCl2
. (10)
При разложении поддерживают высокую конечную кислотность пульпы (90-100 г/л НС1), что обеспечивает отделение вольфрамовой кислоты от примесей соединений фосфора, мышьяка и отчасти молибдена (молибденовая кислота растворяется в соляной кислоте). Осадки вольфрамовой кислоты требуют тщательной отмывки от примесей (особенно от солей кальция)[3].
Техническая вольфрамовая кислота полученная выше описанным способом содержит 0,2 –0.3% примесей. Основная примесь кремний. В результате прокаливания кислоты при Т = 500 – 600 получают триоксид вольфрама, пригодный для производства твердых сплавов на основе карбида вольфрама. Для производства вольфрама необходим триоксид более высокой чистоты.
Часто используют амиачный способ очистки вольфрамовой кислоты. Она легко растворяется в амиачной воде, при этом большая часть примесей оседает в осадок, но раствор может содержать примесь молибдена, соли щелочных металлов. Из амиачного раствора выделяют ПВА в результате выпаривания и охлаждения. Оставшийся вольфрам из раствора осаждают в виде CaWO4
и H2
WO4
. Эти соединения возвращают вверх схемы, CaWO4
отправляют на операцию разложения осадка CaWO4
, а H2
WO4
отправляют на стадию растворения в аммиаке технической вольфрамовой кислоты[2].
Триоксид вольфрама получают термическим прокаливанием ПВА и вольфрамовой кислоты:
(NH4
)10H2
W12
O42
*4H2
O=12WO3
+10NH3
+10H2
O (11)
H2
WO4
= WO3
+ H2
O(12)
H2
WO4
(при 500°С полностью теряет воду), 5(NH4
)2
O-12WO3
-nH2
O (>250°С разлагается нацело)
Температура прокаливания ПВА Т = 500 - 850ºС. Вольфрамовую кислоту прокаливают при 750¸
850°С в барабанной вращающейся электропечи. Она представляет собой трубу из нержавеющей жаропрочной стали (длиной ~2,5м), которую помещают в нагревательную камеру (печь). Печь наклонена на 2¸
3° к горизонту. Наклон печи и вращение обуславливают перемешивание и перемещение материала по винтовой линии. Заполнение печи материалом составляет 8¸
15%. Загрузка производится шнековым питателем. Труба вращается от электродвигателя. К выгрузочному отверстию прикреплено барабанное сито с отверстиями 1,2¸
3 мм. Для получения вольфрама важна величина частиц WO3
. Она зависит от условий получения кислоты и от температуры прокаливания. Величина частиц или зернистость любого порошка косвенно характеризуется величиной насыпного веса (вес в граммах, единицы объёма свободно насыпанного порошка)[4].
5.1 Задание
На предприятии получают в сутки 100 м3
автоклавных щелоков. Рассчитать суточный расход соляной кислоты (30% - ой) для неитролизации растворов и кол-во выделяющегося сероводорода при осаждении молибдена из раствора в виде трисульфида (MoS3
).
Состав автоклавных щелоков: г/л;
Na2
WO3
- 100; Mo – 5 (в виде Na2
MoO4
);
Na2
CO3
- 80 ; SiO2
- 2 (в виде Na2
SiO3
)
Рассчитаем кол-во веществ находящихся в 100 м3
автоклавных щелоков, т.к 100 м3
=100000 л то:
Na2
WO4
будет: 100 г/л * 100000 л = 10000 кг;
Na2
CO3
будет: 80 г/л * 100000 л = 8000 кг;
Na2
SiO3
: т.к. SiO2
- 2 г/л
в перещёте на Na2
SiO3
будет:
Na2
SiO3
= m(SiO2
)*M(Na2
SiO3
)/M(SiO2
) = 2*122/60=4,066 г/л,
Na2
SiO3
в 100 м3
будет: 4,066 г/л * 100000 л = 406,66 кг;
Na2
MoO4
: т.к. Mo – 5 г/л
в перещёте на Na2
MoO4
будет:
Na2
MoO4
= m(Mo)*M(Na2
MoO4
)/M(Mo) = 5*206/96=10,73 г/л,
Na2
MoO4
в 100 м3
будет: 10,73 г/л * 100000 л = 1073кг.
Рассчитаем кол-во образовавшегося Na2
MoS4
по реакции:
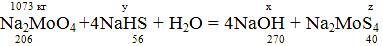
x = (1073*270)/206 =1406,36 кг;
y = (1073*4*56)/206 =1166,757 кг;
z = (1073*4*40)/206 = 833,4 кг.
Рассчитаем кол-во HCI для неитролизации раствора и осаждения MoS3
и кол-во выделяющегося H2
S:
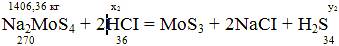
x2
= (1406,36*2*36)/270 = 375,03 кг;
y2
= (1406,36*34)/270 = 177,097 кг;
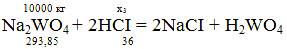
x3
=(10000*2*36)/293,85 = 2450,23 кг;
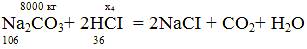
x4
= (8000*2*36)/106 = 5433,96 кг;
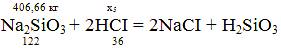
x5
= (406,66*2*36)/122 = 239,99 кг;
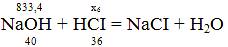
x6
= (833,4*36)/40 = 750,06 кг.
Найдем общий расход соляной кислоты на неитролизацию:
m(HCI) = x2
+x3
+x4
+x5
+x6
= 239,99+5433,96+2450,23+375,03+750,06 = 9249,27 кг;
m(HCI – 30%-ой) = 9249,27/0,3 = 30830,9 кг.
Ответ: На нейтрализацию 100 м3
автоклавных щелоков потребуется 30830,9 кг соляной кислоты (30% - ой) и при этом выделится 177,097 кг сероводорода.
Автоклавное выщелачивание является наиболее интенсивным вариантом вскрытия разнообразного вида минерального сырья и полупродуктов. Особенно для вскрытия шеелитовых концентратов этот способ особенно эффективен и наиболее применим в производстве. Это достигается за счет использования повышенных температур (400-600 К), давлений реакционного газа (0,2-0,15МПа). Поскольку процесс осуществляется в герметичной аппаратуре, это и наиболее экологически оптимальный вариант выщелачивания, обеспечивающий эффективное использование теплоносителя и реакционного газа. Но используемая для этого процесса аппаратура дорогая и сложная в эксплуатации. Так же к недостаткам процесса следует отнести большой расход Na2
СО3
, высокая концентрация избыточной Na2
СО3
влечет за собой повышенный расход кислот на нейтрализацию растворов и соответственно большие затраты на утилизацию растворов. Возможен большой расход пара, это решается с помощью теплоизоляции, теплообменника.
Список литературы
1) Зеликман А.Н., Никитина Л.С. Вольфрам: Учебник для студентов вузов.- М.: Металлургиздат, 1978. – 272с.
2) Зеликман А.Н., Коршунов Б.Г. Металлургия редких металлов: Учебник для вузов. - 2-е издание.- М.: Металлургия, 1991.- 432с.
3) Зеликман А.Н. Металлургия тугоплавких металлов.: Учебник для студентов вузов. – М.: Металлургизд, 1986.- 395с.
4) Конецкий Ч.В. Структура и свойства тугоплавких металлов: Учебник для студентов вузов. – М.: Металлургия, 1974.- 206с.
|