Министерство науки иобразования Российской Федерации
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
"Пермский государственный технический университет"
Березниковский филиал
Кафедра химической технологии и экологии
Расчетная работа
Основы физической химии
2010
1. Задание. 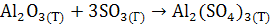
Определить ∆Н, ∆U, ∆S, ∆F, ∆G реакции при постоянном давлении р = Па и Т = 450 К. Па и Т = 450 К.
Справочные материалы.
| Вещество |
∆
кДж/моль
|
Дж/моль*К
|
∆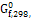
кДж/моль
|
Коэффициенты уравнения
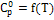
|
| a |
b*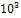 |
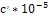 |
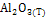 |
-1675,69 |
50,92 |
-1582,27 |
114,55 |
12,89 |
-34,31 |
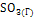 |
-395,85 |
256,69 |
-371,17 |
64,98 |
11,75 |
-16,37 |
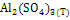 |
-3441,80 |
239,20 |
-3100,87 |
366,31 |
62,59 |
-112,47 |
1.1Расчет теплового эффекта реакции
Расчет теплового эффекта реакции в изобарном процессе в стандартных условиях (DH):
∆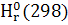 = ∆ = ∆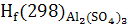 -(∆ -(∆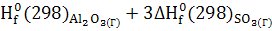 ) )
∆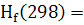 -3441,80-(-1675,69+3(-395,85))=-578,56 кДж -3441,80-(-1675,69+3(-395,85))=-578,56 кДж
Вывод: В стандартных условиях данный процесс является экзотермический, реакция идет с выделением тепла.
Расчет теплового эффекта реакции в изобарном процессе при заданной температуре(DH):
∆с=0, т.к. все вещества неорганические
∆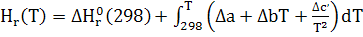
∆a =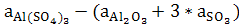 =366,31-(114,55+3*64,98)=56,82 =366,31-(114,55+3*64,98)=56,82
∆b =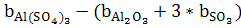 =62,59-(12,89+3*11,75)=14,45*1 =62,59-(12,89+3*11,75)=14,45*1
∆ = =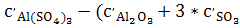 )=-112,47-(-34,31-3*16,37)=-29,05*1 )=-112,47-(-34,31-3*16,37)=-29,05*1
∆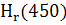 =-578560+ =-578560+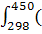 56,82+14,45*1 56,82+14,45*1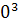 T-29,05*1 T-29,05*1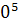 / /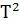 )dT= -578560+56,82 )dT= -578560+56,82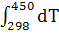 +14,45*1 +14,45*1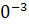 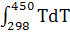 -29,05*1 -29,05*1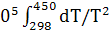 = -578560+56,82(450-298)+14,45*1 = -578560+56,82(450-298)+14,45*1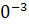 /2*(45 /2*(45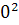 -29 -29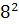 )-29,05*1 )-29,05*1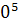 ((450-298)/298*450)=-578560+8636,64+821,45-3292,77=-572,39 кДж ((450-298)/298*450)=-578560+8636,64+821,45-3292,77=-572,39 кДж
Вывод: При увеличении температуры на 152 К тепловой эффект реакции изменился на 6,17 кДж, реакция осталась экзотермической.
Расчет теплового эффекта реакции в изохорном процессе в стандартных условиях(DU):
∆Н=∆U+p∆V; ∆U=∆H-p∆V
p∆V=∆nRT
∆U=∆H-∆nRT
∆n=∆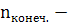 ∆ ∆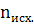 = 0 – 3 = -3; ∆n = -3 = 0 – 3 = -3; ∆n = -3
R=8,314 Дж/моль*К
∆U(298)=-578,56-(-3)*0,008314*298=-571,13 кДж
Вывод: В изохорно-изотермическом процессе, при стандартных условиях реакция протекает с выделением тепла, т.е. процесс экзотермический.
Расчет теплового эффекта реакции в изохорном процессе при заданной температуре (DU):
∆U(450)=-572,39-(-3)*0,008314*450=-561,17 кДж
Вывод: При увеличении температуры на 152 К тепловой эффект данной реакции в изохорно-изотермическом процессе уменьшился на 9,96 кДж, реакция идет с выделением тепла.
1.2 Определение направления протекания химического процесса
Реклама

Определение направления протекания реакции в изолированной системе (DS):
а) в стандартных условиях:
∆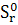 (298) = (298) =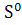 (298 (298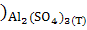 - ( - (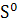 (298 (298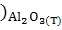 + 3* + 3*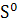 (298 (298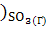 ) )
∆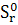 (298) =239,2-(50,92+3*256,69)=-581,79 Дж (298) =239,2-(50,92+3*256,69)=-581,79 Дж
Вывод: При взаимодействии оксида алюминия с оксидом серы (VI) в изолированной системе получилось, что ∆S<0, поэтому процесс невозможен.
б) при заданной температуре:
∆с=0, т.к. все вещества неорганические
∆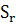 (T)=∆ (T)=∆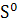 (450)+ (450)+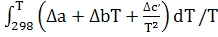
∆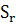 (450)=-581,79+ (450)=-581,79+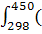 56,82+14,45*1 56,82+14,45*1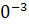 *T-29,05*1 *T-29,05*1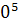 / /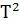 )dT/T= -581,79+56,82 )dT/T= -581,79+56,82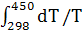 +14,45*1 +14,45*1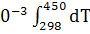 -29,05*1 -29,05*1 = -581,79+56,82*ln450/298+14,45*1 = -581,79+56,82*ln450/298+14,45*1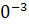 (450-298)- 29,05*1 (450-298)- 29,05*1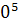 *1/2*((45 *1/2*((45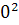 -29 -29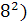 /29 /29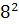 *45 *45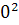 )=-581,79+23,42+2,196-9,15=-565,32 Дж )=-581,79+23,42+2,196-9,15=-565,32 Дж
Вывод: При увеличении температуры на 152 К энтропия увеличилась на 16,466 Дж, но осталась отрицательной. В изолированной системе процесс невозможен. Расчет изобарно-изотермического потенциала (DG):
а) в стандартных условиях
∆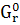 (298) = (298) =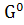 (298 (298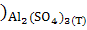 - ( - (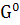 (298 (298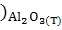 + 3* + 3*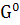 (298 (298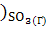 ) )
∆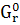 (298) =-3100,87-(-1582,27+3*(-371,17))=-405,13 кДж/моль (298) =-3100,87-(-1582,27+3*(-371,17))=-405,13 кДж/моль
Вывод: При взаимодействии оксида алюминия с оксидом серы (VI) в стандартных условиях ∆G<0, поэтому процесс самопроизвольный.
∆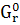 (298) = ∆Н(298)-Т∆ (298) = ∆Н(298)-Т∆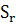 (298) (298)
∆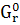 (298) = -578560-298*(-581,79)=-405,19 кДж (298) = -578560-298*(-581,79)=-405,19 кДж
% ош.=((-405,13+405,19)/(-405,13))*100=0,01% ,
т.к процент ошибки очень мал, следовательно, можно использовать для расчета оба метода.
Вывод: В закрытой системе изобарно-изотермический процесс будет протекать самопроизвольно, т.к. ∆G<0.
б) при заданной температуре
∆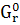 (450) = ∆Н(450)-450*∆ (450) = ∆Н(450)-450*∆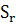 (450) (450)
∆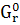 (450) = -572390-450*(-565,32)=-317,996 кДж (450) = -572390-450*(-565,32)=-317,996 кДж
При увеличении температуры на 152 К, энергия Гиббса увеличилась на 87,194 кДж, отсюда следует, что чем больше температура, тем больше энергия Гиббса. В закрытой системе изобарно-изотермический процесс остался самопроизвольным, т.к. ∆G<0. Дальнейшее повышение температуры не выгодно, т.к. ∆G стремится к нулю и процесс от самопроизвольного перейдет в равновесный, а затем в не самопроизвольный.
Расчет изохорно-изотермического потенциала (DF):
а) в стандартных условиях
1 способ:
∆F = ∆U-T∆S
∆F(298)=-571130-298*(-581,79)=-397,76 кДж
2 способ:
∆F(298)=∆G-∆nRT
∆F(298)=-405,13-(-3)*298*0,008314=-397,7 кДж
%ош.=((-397,76+397,7)/(-397,76))*100=0,02%,
т.к процент ошибки очень мал, следовательно, можно использовать для расчета оба метода.
Вывод: В закрытой системе при стандартных условиях изохорно-изотермический процесс будет протекать самопроизвольно, т.к. ∆F<0.
Реклама

б) при заданной температуре
1 способ:
∆F(450)= -561170-450*(-565,32)=-306,78 кДж
2 способ:
∆F(450)=-317,996-(-3)*450*0,008314=-306,78 кДж
%ош.=((-306,78-306,78)/(-306,78))*100=0%,
т.к процент ошибки равен нулю, следовательно, можно использовать для расчета оба метода.
Вывод: При увеличении температуры энергия Гельмгольца увеличилась. В закрытой системе изохорно-изотермический процесс будет протекать самопроизвольно.
Вывод:
| Т, К |
∆Н, кДж |
∆U, кДж |
∆G,кДж/моль |
∆F, кДж |
∆S, Дж |
| 298 |
-578,56 |
-571,13 |
-405,19 |
-397,76 |
-581,79 |
| 450 |
-572,39 |
-561,17 |
-317,996 |
-306,78 |
-565,32 |
С увеличением температуры тепловые эффекты изобарно-изотермического и изохорно-изотермического процессов увеличились.
В данной работе ∆Н, ∆S, ∆G получились отрицательными, отсюда следует, что процесс протекает самопроизвольно, но при невысоких температурах.
При увеличении температуры энергия Гиббса и энергия Гельмгольца увеличились, значит система стремиться к равновесию (в условиях равновесия ∆F, ∆G достигают минимума).
2. Задание: Определить ΔH, ΔU, ΔS, ΔF, ΔG, реакции при постоянном давлении P=1.013 * 105
Па.
СdO(
т
)
+ H2
SO4
(
ж
)
= CdSO4 (
т
)
+ H2
O (
г
)
Реакция протекает при температуре 511 градусов Цельсия .
Исходные данные
| Вещест-во |
ΔHf˚
298
кДж/моль
|
S˚
298
Дж/моль*К
|
ΔGf˚
298
кДж/моль
|
Ср298
Дж/моль*К
|
Коэф. уравнения
Ср
˚
= f(T)
|
| a |
b * 103
|
c΄ * 10-5
|
| H2
O |
-241,81 |
188,72 |
-228,61 |
33,61 |
30,00 |
10,71 |
0,33 |
| CdO |
-258,99 |
54,81 |
-229,33 |
43,64 |
48,24 |
6,38 |
-4,90 |
| H2
SO4
|
-813,99 |
156,90 |
-690,14 |
138,91 |
156,9 |
28,3 |
-23,46 |
| CdSO4
|
-934,41 |
123,05 |
-828,88 |
99,62 |
77,32 |
77,40 |
- |
2.1 Расчёт теплового эффекта реакции
Расчёт теплового эффекта реакции в изобарном процессе в стандартных условиях
ΔНr
˚
(298)
= (ΔНf
˚
(298)
CdSO
4
+ ΔНf
˚
(298)
H
2
O
) – (ΔНf
˚
(298)
CdO
+ ΔНf
˚
(298)
H
2
SO
4
)
ΔНr
˚
(298)
= (-934,41 – 241,81) – (-258,99 – 813,99) = -103,24 кДж.
Вывод: При реакции в стандартных условиях ,произошло выделение тепла в количестве 103,24 кДж как следствие реакция является экзотермической.
Расчёт теплового эффекта реакции в изобарном процессе при заданной температуре
ΔH(T)
= ΔНr
˚
(298)
+ 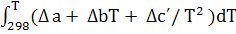 ; ;
Δa = ( ΔaCdSO
4
+ ΔaH
2
O
)- ( ΔaCdO
+ ΔaH
2
SO
4
)
Δa = (77,32+30,00) – (48,94+156,90) = -97,82 ;
Δb = (ΔbCdSO
4
+ ΔbH
2
O
)- (ΔbCdO
+ ΔbH
2
SO
4
)
Δb = (77,40+10,71) – (6,38+28,30) = 53,43 * 10-3
Δc΄ =( Δc΄CdSO
4
+ Δc΄H
2
O
)- (Δc΄CdO
+ Δc΄H
2
SO
4
)
Δc΄ = (0 + 0.33) – (-4,90-23,46) = 28,69 * 105
Δc = 0, т.к. все вещества неорганические.
ΔH(511)
= -103,24 * 103
+ 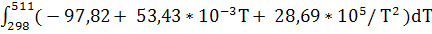 = =
= -103,24 * 103
+ (-97,82) * (511-298) + 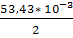 * (5112
– 2982
) + * (5112
– 2982
) + 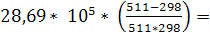 -103240 – 20835,66 + 4603,45 + 4050,80 = -115,42 kДж. -103240 – 20835,66 + 4603,45 + 4050,80 = -115,42 kДж.
Вывод: Увеличение температуры привело к увеличению количества теплоты выделившегося в следствии реакции.
Расчёт теплового эффекта реакции в изохорном процессе в стандартных условиях
ΔU = ΔН – ΔnRT
Δn = Δnкон.
– Δnнач
Δn=1-0=1
Газовая постоянная R = 8.314 Дж/моль*К
ΔU(298)
= ΔНr
˚
(298)
–Δn*R*T
ΔU(298)
= -103,24 * 103
-1 * 8,314 * 298 = -103240 – 2477,57 = -105,72 кДж.
Вывод: Внутренняя энергия реакции в изохорном процессе составила 100,76 килоджоуля.
Расчёт теплового эффекта реакции в изохорном процессе при заданной температуре
ΔU(511)
= ΔНr
˚
(511)
–Δn*R*T
ΔU(511)
= -115,42 * 103
- 1 * 8,314 * 511 = -115420– 4248,45= - 119,67 кДж.
Вывод: Как и в изобарном процессе увеличение температуры приводит к увеличению внутренней энергии реакции на 18,91 кДж.
2.2 Определение направления протекания химического процесса
Определение направления протекания данной реакции в изолированной системе
Определение направления протекания реакции в стандартных условиях
ΔS˚
(298)
= (S(298)
Cd SO4
+ S(298)
H2O
) – (S(298)
Cd O
+ S(298)
H2SO4
)
ΔS˚
(298)
=(123,05+188,72)-( 54,81+156,90)= 100,06 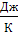
Вывод: Так как энтропия S больше ноля 100,06>0 то процесс реакции в изолированной системе протекает самопроизвольно без внешнего воздействия. Определение направления протекания реакции при заданной температуре.
ΔS(
T
)
= ΔS˚
(298)
+ 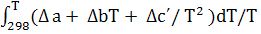 ; ;
ΔS(511)
= 100,06 + 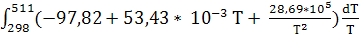 = 100,06 – 97,82 = 100,06 – 97,82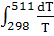 + 53,43 * 10-3 + 53,43 * 10-3
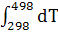 + 28,69 * 105 + 28,69 * 105
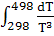 = 100,06 – 97,82 = 100,06 – 97,82 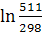 + 53,43 * 10-3
* (511-298) + + 53,43 * 10-3
* (511-298) + 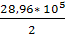 * * 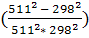 = 121,66 = 121,66 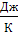
Вывод: Изменение температуры привело к увеличению энтропии по сравнению с процессом при стандартных условиях . Следовательно повышение температуры ведёт к увеличению неупорядоченности и увеличению количества соударений молекул при реакции.
Определение направления протекания химического процесса в закрытой системе
Расчёт изобарно – изотермического потенциала в стандартных условиях
ΔGr
˚
(298)
= (G(298)
Cd SO4
+ G(298)
H2O
) – (G (298)
Cd O
+ G(298)
H2SO4
)
ΔGr
˚
(298)
= (-823,88 – 228.61) – (-229,33 – 690.14) = -133,02 кДж/моль.
Вывод: Изобарно – изотермический потенциал показывает что процесс в закрытой системе идёт самопроизвольно ΔGr
˚
< 0 ; -133,02<0 .
Произведем расчет изобарно – изотермического потенциала по другой формуле:
ΔGr
˚
(298)
= ΔНr
˚
(298)
- Т* ΔS˚
(298)
ΔGr
˚
(298)
= -103,24 * 103
– 298 * 100,06 = -133,06 кДж/моль.
Найдем процент ошибки:
% ошибки = 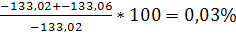
Расчет можно производить любым способом, т.к. процент ошибки не существенен. Расчёт изобарно – изотермического потенциала при заданной температуре
ΔGr
˚
(511)
= ΔНr
˚
(511)
- Т* ΔS˚
(511)
ΔGr
˚
(511)
= -119,46 * 103
– 511 * 121,66 = -181,63 кДж/моль.
Вывод: Увеличение температуры никак не повлияло на процесс реакции в закрытой системе, она по прежнему идёт самопроизвольно ΔGr
˚
< 0; -181,63<0. Расчёт изохорно – изотермического потенциала в стандартных условиях.
ΔF(298)
= ΔU(298)
– T* ΔS˚
(298)
ΔF(298)
= -105,72 * 103
– 298 * 100,06 = -135,53 кДж.
Вывод: Изохорно – изотермический потенциал показывает что процесс в закрытой системе идёт самопроизвольно ΔF< 0 ; -135,53<0
Расчёт изохорно – изотермического потенциала при заданной температуре
ΔF(511)
= ΔU(511)
– T* ΔS˚
(511)
ΔF(511)
= - 123,70 * 103
– 511 *121,66 = -185,87кДж.
Вывод: Изменение температуры привело к уменьшению потенциала по сравнению с процессом при стандартных условиях, а это означает что глубина реакции в закрытой системе увеличилась ΔF< 0 ; -185,87>0.
Вывод
Рассмотренная реакция оксида кадмия и серной кислоты идёт самопроизвольно на это указывают все характеристики реакции, а рассмотренное увеличение температуры реакции её ничуть не замедляет. Всё это позволяет сделать вывод о том что увеличение температуры реакции позволяет увеличить её глубину и полноту. При этом реакция останется самопроизвольной.
| T, K |
ΔH, кДж |
ΔU, кДж |
ΔS, |
ΔG, кДж/моль |
ΔF, кДж |
| 298 |
-103,24 |
-105,72 |
100,06 |
-133,02 |
-135,53 |
| 511 |
-115,42 |
-119,67 |
121,66 |
-181,63 |
-185,87 |
|