1. Химия металлов
1.1 Общие сведения и классификация
Большинство химических элементов относятся к металлам.
В атомах металлов внешние электроны удерживаются значительно слабее, чем в атомах неметаллических элементов. Металлы, как правило, имеют низкие потенциалы ионизации и выступают в качестве восстановителей.
В соответствии с особенностями электронной структуры и положением в периодической системе (ПС) различают s-, p-, d-, f-металлы. К s-металлам относят элементы, у которых происходит заполнение внешнего s-уровня. Это элементы главных подгрупп I и II групп ПС – щелочные и щелочноземельные металлы. Они наиболее сильные восстановители среди металлов. К числу р-металлов относят элементы III – IV групп, находящихся в главных подгруппах и расположенных левее диагонали B-At. Металлические свойства этих элементов выражены гораздо слабее. Металлы IV – VIгрупп, примыкающие к диагонали B-At, типичные полупроводники (т.е. их электрическая проводимость с повышением температуры увеличивается, а не уменьшается). Характерная черта этих элементов – образование амфотерных гидроксидов. Наиболее многочисленны d-металлы. В ПС они расположены между s- и p-элементами и получили название переходных металлов. У атомов d-элементов происходит достройка d-орбиталей. Каждое семейство состоит из десяти d-элементов. Известны четыре d-семейства: 3d, 4d, 5d и 6d. Кроме Sc и Zn, все переходные металлы могут иметь несколько степеней окисления. Максимально возможная степень окисления d-металлов +8 (OsO4
). С ростом порядкового номера максимальная степень окисления возрастает от III группы до первого элемента VIII группы, затем убывает. Эти Элементы типичные металлы. Химия изоэлектронных соединений d-элементов весьма похожа. Элементы разных периодов с аналогичной электронной структурой d-слоев образуют побочные подгруппы ПС (Cu-Ag-Au, Zn-Cd-Hgи т.д.). самая характерная особенность d-элементов – исключительная способность к комплексообразованию. Этим они резко отличаются от непереходных элементов. Химию комплексных соединений часто называют химией переходных металлов.
Металлы с достраивающимися f-слоями образуют две группы очень похожих между собой элементов – лантаноидов и актиноидов.
Реклама

Небольшое число металлов (Au, Ag, Pt, Hg) встречаются в природе в свободном состоянии. Большинство же находится в виде минералов и руд. Среди наиболее распространенных природных соединений металлов – оксиды, сульфиды, карбонаты, силикаты, сульфаты.
В промышленности металлы получают восстановлением соответствующих руд. Железо и сплавы на его основе традиционно называют черными металлами. Cu, Zn, Sn, Pb и некоторые другие относят к цветным металлам.
При н.у. все металлы – твердые кристаллические вещества, за исключением Hg – тяжелой подвижной жидкости (Тпл=-39°С).
1.2 Химия s-элементов
Щелочные металлы
Главная подгруппа I группы ПС, называется подгруппой щелочных металлов, включает Li, Na, K, Rb, Cs, Fr (радиоактивный с наименьшим периодом полураспада Т1/2
=22 мин.). Название подгруппы – щелочные металлы – отражает характерные особенности химии этих элементов. Все они имеют один s-электрон на внешнем электронном слое и проявляют окислительное число +1. Единственный валентный электрон атомов щелочных металлов сравнительно слабо связан с ядром, поэтому потенциалы ионизации этих элементов невелики.
Физические свойства щелочных элементов приведены в таблице 1.
Таблица 1.
| Элемент |
Атомный номер |
Относительная атомная масса |
Атомный радиус, нм |
Ионный радиус, нм |
Энергия ионизации, эВ |
Окраска пламени |
| Li |
3 |
7 |
0.155 |
0.066 |
5.390 |
Коричнево-красная |
| Na |
11 |
23 |
0.189 |
0.095 |
5.138 |
Желтая |
| K |
19 |
39 |
0.236 |
0.133 |
4.339 |
Фиолетовая |
| Rb |
37 |
85 |
0.248 |
0.148 |
4.176 |
Красная |
| Cs |
55 |
133 |
0.268 |
0.169 |
3.893 |
Фиолетовая |
В твердом состоянии щелочные металлы хорошо проводят электрический ток. Это типичные металлы. Они легкоплавки, быстро окисляются на воздухе (Cs со взрывом). Хранят щелочные металлы без доступа воздуха и влаги, чаще всего под керосином. Свойства щелочных металлов закономерно изменяются по группе с увеличением относительной атомной массы (таблица 2).
Таблица 2.
| Элемент |
tпл
, °С |
tкип
, °С |
Плотность, г/см3
|
| Li |
180.5 |
1317 |
0.534 |
| Na |
97.83 |
882.9 |
0.968 |
| K |
63.55 |
760 |
0.862 |
| Rb |
38.9 |
703 |
1.525 |
| Cs |
28.55 |
667 |
1.9 |
В химическом отношении элементы главной подгруппы I группы схожи. Все они активны, причем с увеличением атомного номера химическая активность металлов усиливается. При взаимодействии с неметаллами щелочные металлы образуют соединения с ионной связью.
В электрохимическом ряду напряжений металлов все щелочные металлы стоят значительно левее водорода, причем с увеличением атомного номера (и уменьшением потенциала ионизации) электрохимическая активность металлов увеличивается. Исключение составляет Li – расположение на левом фланге электрохимического ряда напряжений металлов обусловлено исключительно высокой энергией гидратации Li, максимальной среди металлов.
Натрий и калий
Натрий – серибристо-белый металл. В природе встречается только в виде соединений. По распространенности в земной коре натрий занимает шестое место (2.5% по массе). Минералы натрия очень разнообразны. Наиболее важные из них – галит NaCl (поваренная соль), мирабилит Na2
SO4
×10H2
O (глауберова соль), натриева селитра NaNO3
.
Реклама

Калий также серибристо-белый металл. Калий занимает седьмое место по распространенности в земной коре (~ 2.5% по массе), вслед за натрием. В свободном состоянии в природе не встречается, как и натрий. Важнейшие минералы калия следующие: сильвин KCl (и смешанные калийнатриевые и калиймагниевые минералы), сильвинит (K, Na)Cl, карналлит KCl×MgCl2
×6H2
O, каинит KCl×MgSO4
×3H2
O.
Химические свойства натрия и калия похожи, причем активность калия несколько выше. Оба они отдают внешний s-электрон с образованием ионных соединений.
С кислородом в зависимости от условий натрий и калий образуют оксиды Na2
O, K2
Oили пероксиды Na2
O2
, K2
O2
.
2Na + О2
= Na2
O2
(горение),
2Na2
O2
= 2Na2
O + О2
(нагревание)
Взаимодействие натрия и калия с кислородом протекает очень бурно. С водородом натрий при 400 °С, а калий при 200 °С образуют солеобразные гидриды:
2Na + H2
= 2NaH
Здесь водород выступает в качестве аналога галогенов, образуя ион Н-
.
При обычной температуре натрий горит в атмосфере фтора и хлора:
2Na + Cl2
= 2NaCl
Реакция калия в аналогичных условиях протекает со взрывом.
Растирание натрия или калия с серой приводит к образованию полисульфидов:
2Na + nS = Na2
Sn
(n от 2 до 5)
Натрий и калий легче воды, поэтому кусочки металлов в воде плавают, бурно реагируя:
2K + 2H2
O = 2КОН + Н2
↑
Выделяющейся водород воспламеняется. В результате реакции получают сильные основания (щелочи). Загоревшийся натрий и калий нельзя тушить водой!
Сплавы натрия и калия со ртутью (амальгамы) – сильные восстановители. Химические реакции амальгированных щелочных металлов протекают так же, как и с чистыми элементами, но гораздо спокойнее без загорания и взрыва. Это свойство амальгам широко используют в лабораторной практике.
Гидроксиды калия и натрия – важнейшие химические соединения щелочных металлов. В промышленности получают электролизом растворов хлоридов:
NaClDNa+
+ Cl-
1½2H2
O + 2e-
= 2OH-
+ H2
#
1½2Сl-
- 2е-
= Сl2
#
2H2
O + 2Сl-
электролиз
2OH-
+ H2
#+ Сl2
#
2H2
O + 2NaСlэлектролиз
2NaOH + H2
#+ Сl2
#
Полученный продукт – технический едкий натр – содержит 92-95% NaOH, остальное NaCl и Na2
CО3
.
В лабораторных условиях раствор гидроксида натрия можно получить, используя соду и известь:
Na2
CО3
+ Са(ОН)2
= 2NaOH + СaCО3
¯
Щелочи идут на приготовление электролитов щелочных аккумуляторов, на производство мыла, красок, целлюлозы.
При реакции щелочей с кислотами образуются соли:
NaOH + HCl = NaCl + H2
O
Реакции такого типа называют реакциями нейтрализации.
Как сильные основания щелочи вытесняют более слабые основания солей:
NaOH + СоCl2
= 2NaCl + Со(ОН)2
¯
Амфотерные гидроксиды растворяются в избытке щелочи:
NaOH + Al(OH)3
= Na[Al(OH)4
]
При этом образуются комплексные гидроксосоли, содержащие сложный анион [Ме(OH)n
]m
-
. Применение натриевых солей обширно. Помимо поваренной соли следует назвать карбонат натрия (сода) Na2
CО3
, гидрокарбонат натрия (питьевая сода) NaНСО3
, нитрат натрия (силитра) NaNО3
. Растворимые соединения калия важные удобрения, увеличивающие способность к фотосинтезу. KClO3
и КNО3
используют в пиротехнике, обе соли сильные окислители.
Рубидий и цезий используют для изготовления фотоэлементов.
Щелочноземельные металлы
К Щелочноземельным металлам относят элементы, главной подгруппы II группы ПС: Ca, Sr, Ba, Ra. Кроме них в эту группу входят Be и Mg. На внешнем слое атомов щелочноземельных металлов два s-электрона. Во всех соединениях проявляется степень окисления +2. Активность металлов растет с увеличением атомного номера. Все эти элементы – типичные металлы, по свойствам близкие к щелочным. Атомные и ионные радиусы элементов главной подгруппы II группы значительно меньше радиусов соседних щелочных металлов. Это связано с большим зарядом и полным заполнением внешних электронных s-слоев щелочноземельных металлов. Сравнительные характеристики щелочноземельных металлов приведены в табл. 3
Таблица 3.
| Элемент |
Атомный номер |
Относительная атомная масса |
Атомный радиус, нм |
Ионный радиус, нм |
Энергия ионизации, эВ |
Окраска пламени |
| Be |
4 |
9 |
0.113 |
0.031 |
9.32 |
| Mg |
12 |
24 |
0.160 |
0.065 |
7.64 |
| Ca |
20 |
40 |
0.197 |
0.099 |
6.11 |
Кирпично-красная |
| Sr |
38 |
88 |
0.215 |
0.113 |
5.69 |
Коричнево-красная |
| Ba |
56 |
137 |
0.221 |
0.135 |
5.21 |
Желто-зеленая |
Физические свойства щелочноземельных металлов приведены в табл. 4.
| Элемент |
tпл
, °С |
tкип
, °С |
Плотность, г/см3
|
Характерные признаки |
| Be |
1287 |
2471 |
1.848 |
Светло-серый металл, очень твердый и прочный |
| Mg |
650 |
1095 |
1.739 |
Серибристо-белый металл |
| Ca |
842 |
1495 |
1.54 |
Серебристый металл |
| Sr |
768 |
1390 |
2.63 |
Серебристый металл |
| Ba |
727 |
1637 |
3.76 |
Серебристый металл |
| Ra |
969 |
1500 |
5.6 |
Радиоактивный серибристо-белый металл (Т½
226
Ra=1620 лет) |
Химические связи щелочноземельных металлов с неметаллами носят преимущественно ионный характер. Бериллий и магний по химическим свойствам отличаются от щелочных металлов. Бериллий по своим свойствам больше напоминает алюминий. Ион Ве2+
очень мал, поэтому для него характерно образование ковалентных связей. Гидроксид бериллия амфотерен.
Магний
Магний среди металлов занимает особое место. Его плотность (1.729 г/см3
) на ⅓ меньше плотности алюминия, а прочность почти в 2 раза выше. Эти качества обеспечивают сплавам на основе магния ведущее место в авиастроении.
В природе магний широко распространен в виде соединений (восьмое место по содержанию в земной коре, 1.87% по массе). Основные минералы – магнезит MgCO3
, доломит MgCO3
∙CaCO3
.
В химическом отношении магний очень активен, поэтому в свободном состоянии не встречается. На воздухе покрывается оксидной пленкой, дальнейшее окисление возможно лишь при 300-400 °С. Тонкую стружку магния легко поджечь. Реакция образования оксида магния сильно экзотермична (при сгорании 20 г Mg1 л ледяной воды можно нагреть до кипения).
2Mg + O2
= 2MgO + Q
Магний сильный восстановитель. Он восстанавливает при нагревании даже оксид углерода (IV):
2Mg + CO2
= 2MgO + C
Поэтому тушить горящий магний углекислотным огнетушителем нельзя – магний продолжает гореть в атмосфере углекислого газа.
Магний реагирует со всеми неметаллами. Реакции протекают примерно также как с кальцием. Металлический магний медленно реагирует с холодной водой:
Mg + 2H2
O = Mg(OH)2
+ H2
↑
Из кипящей воды и разбавленных кислот магний также вытесняет водород:
Mg + 2HCl = MgCl2
+ H2
↑
Гидроксид магния (как и Са(OH)2
) плохо растворим в холодной воде, гораздо лучше в горячей и полностью в разбавленных кислотах. Это типичное основание:
Mg(ОН)2
+ 2HCl = MgCl2
+ 2H2
О
Все растворимые соли магния бесцветны, горьки на вкус, но не ядовиты.
Магний используется в основном для получения легких сплавов. Прокаленный оксид магния прекрасный огнеупорный материал (до 2800 °С). Перхлорат магния (ангидрон) Mg(ClO4
) используют как осушитель газов (Mg(ClO4
)∙6Н2
О). Асбест (природный силикат магния) – прекрасный теплоизолятор.
Кальций
Типичный щелочноземельный металл – кальций. В земной коре содержится 2.96% кальция (по массе), он занимает пятое место. В горных породах кальций встречается преимущественно в виде нерастворимых соединений: алюмосиликата кальция – анортита CaO.
Al2
O3
.
2SiO2
, карбоната кальция CaСO3
(входящего в состав известняков, мела, мрамора), доломита CaCl2
.
MgСO3
, фторида кальция CaF2
(плавиковый шпат), фосфата кальция Ca3
(РO4
)2
в виде фосфорита и апатита, содержащего в своем составе также CaF2
и CaCl2
. Только сульфат кальция, встречающийся в виде минералов гипса CaSO4
.
2Н2
О и ангидрита CaSO4
. Кальций в виде различных соединений входит в состав многих горных пород осадочного или метаморфического происхождения; доломитизированных известняков, песчаников, сланцев. Кальций содержится в воде океанов, морей, озер и рек, а также в грунтовых водах.
Кальций в нормальных условиях проявляет степень окисления +2. Соединения одновалентного кальция существуют лишь при высоких температурах. Свободный кальций химически активен.
Кальций получают электролизом расплавленного хлористого кальция или восстановлением из из CaO методами металлотермии в вакууме.
СaCl2
DСa2+
+ 2Cl-
1½Ca2+
+ 2е-
"Caо
1½2Cl-
- 2е-
"Cl2
о
#
Ca2+
+ 2Сl-
электролиз
Caо
+ Сlо
2
#
CaСl2
электролиз
Ca+ Сl2
#
Металлический кальций применяется в качестве восстановителя при получении таких металлов, как торий цирконий, ванадий из их соединений. В небольшом количестве он используется в составе сплавов.
На воздухе кальций при обычной температуре окисляется, покрываясь оксидной пленкой.
Кальций реагирует с водородом, образуя гидрид CaH2
– стойкое соединение, вступающее во взаимодействие с водой с выделением водорода:
CaH2
+ 2H2
O"Ca(OH)2
+ 2H2
↑
Окись кальция получают из карбоната кальция CaCO3
при его термической диссоциации
CaCO3
"CaO +СО2
– Q
Эта реакция сопровождается поглощением теплоты, поэтому с повышением температуры равновесие смещается вправо, т.е. диссоциация возрастает.
Химически чистая окись кальция представляет собой бесцветные кристаллы с tпл.
=2600°С и плотностью 3,4 г/см3
. Она бурно реагирует с водой с выделением тепла:
CaO + H2
O " Ca(OH)2
+ 15,6 ккал/моль
Образуется гидроокись кальция которая имеет кристаллическую структуру. Растворимость в воде её невелика и уменьшается с повышением температуры.
Технический продукт, получаемый обжигом известняков, получаемый обжигом известняков, состоит в основном из окиси кальция и называется негашеной известью. В результате взаимодействия её с водой (гашения) образуется гашеная известь, основную массу которой составляет Ca(OH)2
.
При нагревании Ca(OH)2
диссоциирует на CaO и водяные пары.
Соли кальция. Фторид кальция CaF2
в природе встречается в виде плавикового шпата. Используется для получения HF и различных фторидов. Хлорид кальция CaCl2
– белая, чрезвычайно гигроскопичная масса, расплывающаяся на воздухе. Растворение безводного CaCl2
в воде сопровождается разогреванием. Хлорид кальция применяют в качестве добавки, регулирующей процесс твердения цемента. Нитрат кальция Ca(NO3
)2
– кальциевая селитра используется как азотное удобрение. Хлорная известь CaOCl2
.
nH2
O применяется как дезинфицирующее средство.
Сульфат кальция при обычных температурах выпадает из водных растворов в форме дигидрата CaSO4
.
2H2
O. Это прозрачные кристаллы способные при нагревании терять частично или полностью воду, переходя в соединения состава CaSO4
.
0,5H2
O и CaSO4
. Дегидратация происходит ступенчато. При умеренном нагревании двухводная соль переходит в полуводный гипс.
Полуводный гипс и растворимая форма безводного сульфата кальция способны присоединять воду, образуя CaSO4
.
2H2
O в виде твердого камневидного тела. На этом основано применение полуводного гипса и ангидрита в качестве вяжущих строительных материалов.
При высокой температуре (t»960°С) наблюдается разложение сульфата кальция:
2CaSO4
= 2CaО + 2SO2
+ О2
Этим процессом пользуются для получения серной кислоты. Обычно такое производство комбинируют с производством цемента. Обжигу подвергают смесь глины с гипсом.
В присутствии солей NH4
Cl, KNO3
, Mg(NO3
)2
или кислот HCl, H3
PO4
растворимость сульфата кальция возрастает.
Известны две соли угольной кислоты: карбонат CaCO3
и гидрокарбонат Ca(HCO3
)2
. первая нерастворимая в воде и обладает сравнительно высокой термической устойчивостью, а гидрокарбонат в обычных условиях существует только в водных растворах и обладает малой термической устойчивостью.
Образование гидрокарбоната кальция в природных условиях имеет место, когда породы, содержащие СаСО3
, подвергаются воздействию воды и растворенной в ней СО2
:
СаСО3
+ СО2
+ Н2
О= Ca(HCO3
)2
В этой реакции в присутствии твердой фазы СаСО3
при практически постоянной концентрации воды константа равновесия равна:
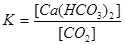
Поэтому при постоянной температуре с повышением концентрации СО2
в газовой фазе и в растворе должна возрастать и концентрация Ca(HCO3
)2
отвечающая равновесию раствора с твердым СаСО3
. Это увеличение количества Ca(HCO3
)2
происходит за счет уменьшения количества СаСО3
. таким образом, повышение концентрации СО2
в растворе вызывает переход соответствующего количества карбоната кальция в гидрокарбонат, что сопровождается понижением концентрации СО2
до равновесной. Поэтому СО2
, избыточная по отношению к равновесной, носит название агрессивной двуокиси углерода. Если такая повышенная концентрация СО2
в воде поддерживается за счет поступления из вне, то вода становится агрессивной по отношению к карбонату кальция.
В противоположном случае при понижении давления СО2
над раствором, гидрокарбонат кальция разлагается с выделением в осадок СаСО3
. В природных условиях процесс происходит когда глубинные воды, насыщенные двуокисью углерода под давлением, выходят на поверхность.
При повышении температуры равновесие реакции смещается влево. При кипячении водного раствора, содержащего гидрокарбонат, разлагается с образованием осадка СаСО3
.
Важным техническим продуктом является карбид кальция СаС2
. Карбид получают из извести и угля в мощных электрических печах при 1900-1980°С на основе реакции
СаО + 3С = СаС2
+ СО – 111ккал
Процесс сопровождается поглощением значительного количества теплоты. Химически чистый карбид представляет собой бесцветные кристаллы; технический продукт в зависимости от количества и характера примесей имеет окраску от светло-серого до черной. В числе примесей часто содержатся вредные и опасные сульфиды, фосфиды кальция и других металлов. Карбид кальция служит исходным веществом для получения ацетилена по реакции
СаС2
+ 2Н2
О = Са(ОН)2
+ С2
Н2
Примеси сульфидов арсенидов и фосфидов кальция при взаимодействии с водой образуют H2
S, AsH3
, PH3,
присутствие которых в ацетилене нежелательно из-за их ядовитости резкого запаха и склонности к самовоспламенению (PH3
). Чистый ацетилен запаха не имеет. Карбид кальция в больших количествах расходуется на получение ацетилена, который применяется для резки и сварки металлов и в качестве исходного материала для промышленного синтеза.
Контрольные вопросы
1. Почему щелочные металлы неустойчивы на воздухе и в водных растворах?
2. Напишите электронные формулы Na, Ba2+
.
3. Изобразите схематически структуру пероксида натрия.
4. Как изменяются радиусы и потенциалы ионизации атомов щелочных металлов с ростом порядкового номера элементов? Дать объяснение наблюдающимся закономерностям на основе электронного строения атомов.
5. Чем объяснить различную последовательность расположения щелочных металлов в ряду напряжений и периодической системе?
6. Можно ли получить щелочные металлы электролизом? Ответ поясните. Приведите примеры уравнений электродных реакций получения щелочного металла.
7. Почему щелочноземельные металлы неустойчивы на воздухе, а бериллий и магний достаточно устойчивы?
8. В чем отличие оксидов бериллия и оксидов других элементов II группы главной подгруппы? Как изменяются восстановительные свойства элементов II группы главной подгруппы по мере возрастания порядкового номера элемента и почему?
9. Как и почему изменяются основные свойства в ряду LiOH-CsOH?
10. Написать уравнения реакций получения карбоната натрия: а) силиката натрия; б) ацетата натрия; в) нитрата натрия; г) гидросульфата натрия; д) сульфита натрия.
11. Закончить уравнения реакций:
12. а) Na2
O2
+ KI + H2
SO4
® б) Li3
N + H2
O® в) К + O2(избыток)
® г) KNO3
нагревание
®
1.3 р-элементы – металлы
Алюминий
Алюминий - основной представитель металлов главной подгруппы IIIгруппы периодической системы химических элементов Д. И. Менделеева. Атомный номер 13, относительная атомная масса 26,98154. У алюминия единственный устойчивый изотоп 27
А1. Свойства аналогов алюминия-галлия, индия и таллия во многом напоминают свойства алюминия. Этому причина - одинаковое строение внешнего электронного слоя элементов s2
p1
, вследствие которого все они проявляют степень окисления +3. Другие степени окисления нехарактерны, за исключением соединений одновалентного таллия, по свойствам близким к соединениям элементов I группы. В связи с этим будут рассмотрены свойства только одного элемента-алюминия и его соединений.
Алюминий - серебристо-белый легкий металл, р - 2,699 г/см3
, Тпл.
= 660,24 °С, Ткип.
= 2500 °С. Он очень пластичен, легко прокатывается в фольгу и протягивается в проволоку. Прекрасный проводник электрического тока - его электрическая проводимость сравнима с электрической проводимостью меди. Поверхность металла всегда покрыта очень тонкой и очень плотной пленкой оксида А12
О3
. Эта пленка оптически прозрачна и сохраняет отражающую способность металла (блеск).
Алюминий весьма активен, если нет защитной пленки А12
О3
, инертного в химическом отношении вещества. По положению в электрохимическом ряду напряжений металлов алюминий стоит левее железа, однако пленка оксида алюминия практически останавливает дальнейшее окисление металла и препятствует его взаимодействию с водой и некоторыми кислотами. Если удалить защитную пленку химическим способом (например, раствором щелочи), то металл начинает энергично взаимодействовать с водой с выделением водорода:
2А1 + 6Н2
О = 2А1(ОН)3
+ ЗН2
↑
Порошкообразный алюминий сгорает на воздухе с ослепительной вспышкой. Алюминий непосредственно реагирует с галогенами, образуягалогениды:
2А1 + ЗС12
= 2А1С13
При сильном нагревании он взаимодействует с серой, углеродом и азотом с образованием сульфида A12
S3
, карбида А14
С3
и нитрида A1N. Эти соединения легко гидролизуются с выделением соответственно сероводорода, метана, аммиака и гидроксида алюминия.
Алюминий легко растворяется в соляной кислоте любой концентрации:
2А1 + 6НС1 = 2А1С13
+ ЗС12
Концентрированные серная и азотная кислоты на холоде не действуют на алюминий. При нагревании реакция протекает с восстановлением серной кислоты до оксида серы (IV) и азотной кислоты до низших оксидов азота без выделения водорода. Причем образуются соответственно сульфат А12
(SO)3
и нитрат А1(NO3
)3
. В разбавленной серной кислоте при небольшом нагревании алюминий растворяется с выделением водорода:
2А1 + 3H2
SO4
= Al2
(SO4
)3
+ ЗН2
В разбавленной азотной кислоте реакция идет с выделением оксида азота (II):
А1 + 4HNO3
= A1(NO3
)3
+ NO + 2Н2
О
Алюминий растворяется в растворах щелочей и карбонатов щелочных металлов с образованием алюминатов:
2NaOH + 2AI + 6Н2
О = 2Na[Al(OH)4
] + 3H2
Эти соединения можно рассматривать как соли очень слабых кислот. Гидроксид алюминия амфотерен (от греч. "амфотерос" - и тот, и другой). Он способен взаимодействовать как с кислотами, так и со щелочами (кроме раствора гидроксида аммония). Амфотерность- свойство гидроксида совмещать черты слабого основания и слабой кислоты - присуща гидроксидам р- и (d-металлов и особенно ярко выражена у гидроксида алюминия. Следствием этого является сильный гидролиз солей алюминия, имеющих в растворе кислую реакцию:
Н2
О + А1С13
= [AI (ОН)] С12
+ НСl,
и алюминатов, показывающих в растворе основную реакцию:
К[А1(ОН)4
] = КОН + А1(ОН)3
При взаимодействии фторида алюминия с плавиковой кислотой образуется комплексная алюминийфтороводородная кислота, соль которой Na3
AlF6
встречается в природе в виде минерала криолита. Криолит играет важную роль в производстве алюминия. Он может быть получен в результате реакции между растворами фторида натрия я сульфата алюминия:
12NaF4
+ AI2
(SO4
)3
= 2Na3
AlF6
+ 3Na2
SO4
Сырьем для производства алюминия служат бокситы - алюминийсодержащие руды, из которых в результате переработки извлекают оксид алюминия. Прокаленный оксид алюминия нерастворим не только в воде, но и плохо растворяется в кислотах и щелочах. Поэтому дальнейшая переработка оксида алюминия ведется методом электролиза. Полученный металл очищают электролитическим рафинированием.
Металлический алюминий служит в основном для производства сплавов. Сплавы алюминия менее устойчивы к коррозии из-за возникновения гальванических микроэлементов в местах включений примесей. Алюминий идет на производство кабелей, фольги, зеркал, серебристой краски. Способность алюминия восстанавливать металлы из оксидов при высоких температурах послужила основой метода алюмотермии, т. е. восстановления тугоплавких металлов, например хрома или марганца, из их оксидов;
Cr2
O3
+ 2A1 = А12
О3
+ 2Сг
Сульфат алюминия и алюмокалиёвые квасцы употребляют в красильной и кожевенной промышленности.
Оксид алюминия встречается в природе в виде твердого минерала корунда, используемого как абразивный материал для шлифовки и полировки металлов. Многие драгоценные камни - рубин, сапфир, аметист, разновидности корунда, окрашенные примесями. Искусственно выращенные монокристаллы рубина используют в лазерах, часовой и ювелирной промышленности.
1.4 d-элементы – металлы
Комплексные соединения
Комплексными соединениями называются, называются определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в растворенном состоянии.
В молекуле комплексного соединения один из атомов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем, или центральным атомом. В непосредственной близости к нему расположены (координированы) противоположно заряженные "ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения. Общее число σ-связей, образуемых комплексообразователем с лигандами, называется координационным числом центрального иона. По числу σ-связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно-, ди- и более дентатные лиганды.
За пределами внутренней сферы комплексного соединения находится его внешняя сфера, содержащая положительно заряженные ионы (если внутренняя сфера комплексного соединения заряжена отрицательно) или отрицательно заряженные ноны (если комплексный ион заряжен положительно); в случае незаряженной внутренней сферы внешняя сфера отсутствует.
В формулах комплексных соединений внутреннюю сферу отделяют от внешней квадратными скобками.
Названия комплексных солей образуют по общему правилу: сначала называют анион, а затем катион в родительном падеже. Названия комплексного катиона составляют следующим образом: сначала указывают числа (греч.: ди – 2, три -3…) и названия отрицательно заряженных лигандов с окончанием "о" (хлоро, сульфато, гидроксо…); затем указывают числа и названия нейтральных лигандов, причем называют комплексообразователь, указывая степень его окисленности (рим.: I, II…)
[Co(NH3
)5
Br]SO4
– сульфат бромопентааминокобальта (III)
Название комплексного аниона составляют аналогично названию катиона и заканчивают суффиксом "ат".
Ba[Pt(OH)2
Cl4
] – тетрахлородигидроксоплатинат (IV)аммония
Названия нейтральных комплексных частиц образуют также, как и катионов, но комплексообразователь называют в иминительном падеже, а степень его окисления не указывают.
[Pt(NH3
)2
Cl2
] – дихлородиаминоплатина
Ионы, находящиеся во внешней сфере, связаны с комплексным ионом в основном силами электростатического взаимодействия и в растворах легко отщепляются подобно ионам сильных электролитов. Лиганды, находящиеся во внутренней сфере комплекса, связаны с комплексообразователем ковалентными связями, и их диссоциация в растворе осуществляется, как правило, в незначительной степени.
[Ag(NH3
)2
]Cl ® [Ag(NH3
)2
]+
+ Cl-
[Ag(NH3
)2
]+
ÛAg+
+ 2NH
Поэтому с помощью качественных химических реакций обычно обнаруживаются только ионы внешней сферы.
1.5 Свойства переходных металлов VIII группы
Металлы VIII группы образуют три побочные подгруппы – железа, кобальта, никеля.
Семейство железа. Атомы элементов Fe, Co, Ni имеют электронные конфигурации 3d6
4s2
, 3d7
4s2
, 3d8
4s2
, наиболее характерные СО +2, +3.
Значения стандартных электродных потенциалов позволяют отнести их к числу металлов средней химической активности. При этом железо активнее чем кобальт и никель.
Железо устойчиво по отношению к сухому воздуху, но во влажном быстро корродирует и покрывается бурым гидроксидом Fe2
O3
×nH2
O, рыхлым и не предохраняющим металл от дальнейшего окисления. Реакция образования ржавчины многостадийна; суммарно ее можно выразить уравнением
4Fe + 3O2
+ 2nH2
O = 2(Fe2
O3
×nH2
O)
При температуре каления железо сгорает, превращаясь в железную окалину Fe3
O4
. При нагревании железо взаимодействует со многими неметаллами; реакции протекают особенно энергично, если железо мелко раздроблено. В зависимости от проведения процесса образуются твердые растворы с C, Si, N, P, H, металлоподобные соединения Fe3
C, Fe3
Si, Fe4
N, Fe3
P, Fe2
Hили соли FeCl3
, FeS. Железо легко растворяется в кислотах, вытесняя из них водород:
Fe + 2H+
= Fe2+
+ H2
Концентрированная азотная кислота пассивирует железо. Отношение Fe к серной кислоте зависит от концентрации H2
SO4
. Железу соответствуют два устойчивых оксида: FeO, Fe2
O3
. Гидроксиды Fe(OH)2
, Fe(OH)3
– труднорастворимые соединения проявляющие соответственно основные и амфотерные свойства (NaFeO2
). Известны также соли железной кислоты H2
FeO4
(СО +6).
При действии цианида калия на растворы солей железа (II) получается белый осадок цианида железа:
Fe2+
+ 2CN-
= Fe(CN)2
¯
В избытке цианида калия осадок растворяется в следствие образования комплексной соли (желтая кровяная соль):
Fe(CN)2
+ 4КCN = K4
[Fe(CN)6
]
Анионы [Fe(CN)6
]4-
является чувствительным реактивом на ионы Fe3+
:
4Fe3+
+ 3[Fe(CN)6
]4-
= Fe4
[Fe(CN)6
]3
¯ (берлинская лазурь)
Образующийся осадок имеет характерную синюю окраску, под действием окислителей он переходит в гексацианоферат (III) (красная кровяная соль):
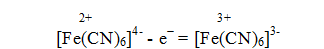
Ее анион является чувствительным реактивом на ионы Fe2+
:
3Fe2+
+ 2[Fe(CN)6
]3-
= Fe3
[Fe(CN)6
]2
¯
Образующийся осадок имеет характерный интенсивный синий цвет (турнбулева синь).
2. Химия неметаллов
Кремний
Кремний очень распространен в природе, содержание его в земной коре составляет 27,6 масс.% (он занимает второе место после кислорода).
Кремний в свободном виде в природе не встречается, но играет важную роль. Земная кора на 97 % состоит из соединений кремния; важнейшим из них является кремнезем SiO2
и силикатные минералы, представляющие собой сложные соединения, отличающиеся разнообразным составом и структурой.
Соединения кремния входят в состав растительных и животных организмов, они способствуют образованию твердых скелетных частей и тканей. Особенно много кремния могут накапливать некоторые морские организмы, как растительные – диатомовые водоросли, так и животные – кремневые губки, солнечники, скелет которых состоит из двуокиси кремния. Диатомовые водоросли и инфузории, погибая, образуют различные формы аморфного кремнезема: кизельгур, трепел, диатомит.
Таким образом, кремнезем в виде двуокиси кремния широко распространен в природе. Кремнезем бывает кристаллический и аморфный. Природной формой кристаллического кремнезема является минерал кварц. Он входит в состав горных пород: граниты, пегматиты.
Наиболее чистой природной разновидностью кварц является прозрачный, как вода, горный хрусталь. Окрашенные разновидности горного хрусталя известны как драгоценные камни: дымчатый – раухтопаз, черный – марион, фиолетовый – аметист. К микроволокнистым разновидностям кварца относятся халцедон, агат, яшма, кремень. Горный хрусталь и его разновидности применяются для изготовления оптических приборов и в ювелирном деле.
Кремнезем в виде различных песков используется в силикатной промышленности и в строительстве.
Землистые формы аморфного кремнезема – диатомит, трепел – имеют пористое строение, поэтому они обладают повышенной химической активностью, являются хорошими адсорбентами.
Кремнезем и его разновидности представляют неорганический полимер, построенный из тетраэдров SiO4
. В центре правильного тетраэдра находится атом кремния в вершинах атомы кислорода. Кремний соединен с атомами.
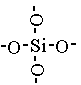
Двуокись кремния – устойчивое соединение, которое в воде практически нерастворима; из кислот на нее действует только HF, при этом образуется тетрафторид кремния и вода:
SiO2
+ 4HF = 2H2
O + SiF4
Эта реакция используется при травлении стекла.
В обычных условиях щелочи очень слабо взаимодействуют с SiO2
с образованием солей кремневой кислоты – силикатов:
SiO2
+ 2NaOH = H2
O + Na2
SiO3
Химическая активность модификаций SiO2
возрастает от кварца к аморфному кремнезему.
Аморфный кремнезем может вступать в химическое взаимодействие с щелочами и гашеной известью уже на холоду. На этом основано использование этих материалов в качестве гидравлических добавок в цементах. Имеющаяся в цементе известь взаимодействует с аморфным кремнеземом с образованием силикатов кальция. Этот процесс можно выразить следующим уравнением реакции:
SiO2
+ Ca(OH)2
= H2
O + CaSiO3
При сплавлении все модификации SiO2
легко взаимодействуют с основными оксидами, щелочами и карбонатами, например:
SiO2
+ 2NaOH = H2
O + Na2
SiO3
SiO2
+ Na2
СО3
= СО2
+ Na2
SiO3
Кремневыекислотыисиликаты
Свободнаякремневаякислотаизвестнаввиденесколькихформ: H4
SiO4
илиSiO2
.
2H2
O – ортокремневаякислота; H2
SiO3
илиSiO2
.
H2
O – метакремневаякислота; H2
Si2
O5
или 2SiO2
.
H2
O – двуметакремневаякислота.
Мономолекулярные кремневые кислоты неустойчивы и обычно конденсируются в полимерные практически нерастворимые в воде формы.
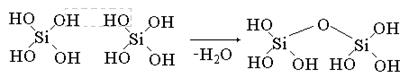
Кремневые кислоты слабее угольной кислоты.
Диссоциацию метакремневой кислоты можно представить уравнением реакции:
H2
SiO3
D H+
+ HSiO3
-
Кд
1
= 2.
10-10
HSiO3
-
D H+
+ SiO3
2-
Кд
2
= 1.
10-12
Диоксид кремния SiO2
в воде не растворяется, поэтому кремневая кислота получается косвенным путем – действием кислоты на растворимые силикаты:
Na2
SiO3
+ 2HCl = H2
SiO3
+ 2NaCl
Поликремневые кислоты в воде не растворимы, легко образуют коллоидные растворы – золи. Устойчивость золей этих кислит зависит от рН раствора.
Строение мицеллы кремневой кислоты условно можно выразить формулой:
{[SiO2
.
mH2
O]m
.
xHSiO3
-
(x-y)H+
}-
y
yH+
Золи кремневых кислот обладают гидрофильными свойствами. Прибавлением электролитов не всегда удается вызвать коагуляцию. Для более быстрой коагуляции необходимо добавить баритовой воды или концентрированного раствора Al2
(SO4
)3
При коагуляции кремнево-кислых золей образуются гели переменного состава с общей формулой SiO2
.
хH2
O.
Гель кремневых кислот представляет собой микрогетерогенную систему, состоящей из губчатой твердой фазы, в порах которой распределена вода. Высушенные гели кремневых кислот называются силикагелями. Они обладают сильно развитой внутренней поверхностью и являются хорошими сорбентами. Силикагель сильно поглощает пары воды, поэтому его используют для осушки газов.
Соли кремневых и поликремневых кислот называются силикатами.
В воде растворимы только силикаты щелочных металлов, остальные силикаты малорастворимы в воде.
|