МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Оренбургский государственный аграрный университет
КУРСОВАЯ РАБОТА
на тему:
"Частная микробиология, систематика и методы идентификации
бактерий рода Mycobacterium
".
Выполнил:
Проверил:
Оренбург - 2010 г.
Содержание
Введение
1. История изучения рода Mycobacterium
2. Особенности морфологии микроорганизмов рода Mycobacterium
3. Особенности физиологии микроорганизмов рода Mycobacterium
4. Антигенная структура микобактерий
5. Классификация и таксономия
6. Виды микобактерий и их дифференциация
7. Внутривидовая и межвидовая идентификация
8. Среды для выделения и идентификации микобактерий
9. Ветеринарное и медицинское значение
10. Распространение в природе
11. Применение
12. Заключение
13. Список литературы
Цель курсовой работы - изучить систематику и методы идентификации бактерий рода Mycobacterium.
Актуальность: Микобактерии являются значимой группой микроорганизмов, поскольку являются возбудителями инфекционных заболеваний как лепра и туберкулёз. Микобактерии являются одними из наиболее устойчивых микроорганизмов к воздействию факторов окружающей среды. В связи с высокой резистентностью возбудителя, борьба с инфекцией затруднена. Зачастую незнания свойств, особенностей микобактерий способствует их распространению, что приводит к высокой заболеваемости.
Задачи:
Изучить историю рода Mycobacterium.
Рассмотреть особенности морфологии микроорганизмов рода Mycobacterium.
Рассмотреть особенности физиологии микроорганизмов рода Mycobacterium.
Изучить антигенные особенности микобактерий.
Изучить классификацию и таксономию микобактерий.
Выявить среды для выделения и идентификации микобактерий.
Охарактеризовать внутривидовую и межвидовую идентификацию микобактерий.
Рассмотреть медицинское и ветеринарное значение микроорганизмов, принадлежащих к роду Mycobacterium.
Изучить распространение микобактерий.
Осветить применение микобактерий в практике.
История изучения микобактерий началась в конце XIX века. В 1874 г.А. Хансен открыл палочку лепры - Mycobacterium
leprae
, а Р. Кох в 1882 г. - туберкулезную палочку - Mycobacterium
tuberculosis
. Эти два представителя одного рода известны как возбудители древнейших болезней человека: лепры и туберкулеза. В 1896 г. К.В. Lehmann и R. Neumann предложили ввести в систематику бактерий новый род Mycobacterium
с включенными в него видами М
. tuberculosis
и М
. leprae
. Вскоре стали появляться сообщения об открытии других представителей этого рода - сапрофитных бактерий, широко распространенных в природе. В настоящее время род Mycobacterium
включает свыше 90 видов. Согласно определителю Берджи, группа микобактерий содержит единственный род Mycobacterium
[1].
Реклама

Все микобактерии неподвижны, окрашиваются по Граму положительно. На ранней стадии развития (впервые сутки) микобактерий имеют палочковидное строение клеток, и в этот момент они морфологически похожи на проактиномицетов, находящихся во второй стадии развития. Палочковидные клетки микобактерий, в отличие от бактериальных, имеют неправильные очертания: контуры их искривлены, в разных местах они неодинаковой толщины, часто колбовидно раздутые, клетки более или менее изогнуты, одиночные или соединены в пары или короткие цепочки (рис 2.1).
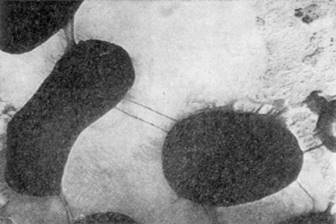
Рис.2.1 Клетки Mycobacterium
Цепочки никогда не бывают правильно очерченными и прямыми, строго расположенными в одну линию, как это наблюдается в культурах бактерий; обычно они угловато искривленные. На рисунке 2.2 показан общий вид односуточных культур разных видов микобактерий, наиболее типичных по своему строению и расположению клеток. Величина клеток микобактерий меняется в зависимости от вида культуры и состава среды. В молодом возрасте чаще всего клетки имеют длину 2,5 - 7,0 мкм [5].
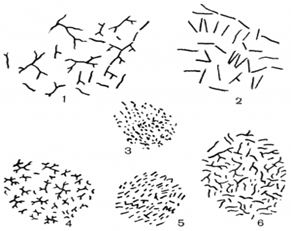
Рис.2.2 Общая картина микроскопических препаратов микобактерий. Односуточные культуры на синтетической агаризованной среде.
1
- М
. hyalinum
; 2
- М
.rubrum; 3
- М
. cyaneum
; 4
- М
. bifidum
; 5
- М
. citreum
; 6
- М
. filiforme
.
Нередко встречаются организмы, величина которых не превышает 2 - 3 и даже 1 - 2 мкм. Немало форм и с более длинными клетками, 10 - 15 мкм. Поперечник клеток у разных видов микобактерий также различен; чаще всего он равен 0,6 - 0,7 мкм. Однако нередко встречаются культуры с толщиной клеток 0,2 - 0,3 и 0,8 - 1,0 мкм. Толщина клеток микобактерий - величина более постоянная, чем длина. В культурах микобактерий более старого возраста (2 - 3 суточных) клетки укорачиваются и принимают кокковидную форму. Кокковидные клетки имеют такой же диаметр, как и палочки, или несколько больший; одиночные, или соединены в пары, или короткие кривые цепочки, или механически сцеплены в кучи. На этой стадии развития микобактерий легко можно принять за микрококки. Таким образом, микобактерий в своем развитии проходят цикл превращений из палочковидных форм в кокковидные. Поэтому, чтобы с достоверностью установить принадлежность организма к микобактериям, надо вести последовательное наблюдение за его развитием.
Реклама

Другим характерным морфологическим признаком микобактерий является ветвление. Ветки образуются на боковой поверхности палочковидных клеток. Степень ветвления у разных микобактерий неодинакова: у одних клетки при благоприятных условиях образуют многочисленные ветки, по 2 - 5 на каждой клетке, у других обычно по 1 - 2 ветки. У многих видов ветвящиеся клетки встречаются вообще редко, а на некоторых средах вообще не обнаруживаются. Наконец, имеется много культур, у которых ветвление обнаруживается только при особых условиях культивирования. Например, у синих (Mycobacterium
cyaneum
) и черных (Mycobacterium
nigrum
) микобактерий ветвления на обычных средах (МПА, сусло-агар) не наблюдается, клетки имеют бактериальное строение; при посеве их на ломтики картофеля или в жидкие среды обнаруживается большое количество типичных ветвящихся клеток. Следовательно, ветвление у микобактерий зависит в значительной степени от питательной среды [5].
Микобактерии характеризуются высоким содержанием липидов (от 30,6 до 38,9 %), вследствие этого трудно окрашиваются анилиновыми красителями, но хорошо воспринимают краску после обработки карболовым фуксином при подогревании. При таком методе микобактерии туберкулеза хорошо удерживают красители, и не обесцвечиваются при воздействии разведенных кислот, щелочей и спирта, чем отличаются от других микробов. На этом основан метод окраски микобактерии по Цилю-Нильсену.
Микобактерии с трудом окрашиваются положительно по Граму и приобретают сине-фиолетовый цвет.
Для быстрого обнаружения микобактерий в различных объектах существует люминесцентный метод, в основе которого лежит их способность окрашиваться люминесцентными красителями (родамин-аурамином) и давать золотисто-желтый цвет под воздействием ультрафиолетового излучения. Метод обладает высокой чувствительностью, дает цветное изображение возбудителя. Исследование ведется при среднем увеличении, что дает возможность просмотреть большее поле, чем при иммерсионной микроскопии под большим увеличением.
Благодаря электронной микроскопии у микобактерий выявлены трехслойная клеточная стенка, микрокапсула, цитоплазматическая мембрана. В состав цитоплазматической мембраны входят липопротеидные комплексы, различные ферментные системы, в частности, ответственные за окислительно-восстановительные процессы. Цитоплазма микобактерий представлена гранулами, вакуолями и полостями, число которых может возрастать после воздействия химических агентов.
В микрокультурах, развивающихся в жидких питательных cредах, микобактерии человеческого и бычьего видов образуют косы, жгуты, завитки, скопления. Микрокультуры легко обнаруживают при обычной микроскопии мазков, окрашенных по методу Циля-Нильсена. В препаратах, приготовленных из первичных посевов, при исследовании под фазовым контрастом обычно различают гомогенные зернистые элементы, среди которых встречаются сферические светопреломляющие структуры.
В культурах, выделенных от крупного рогатого скота, чаще находят шаровидные образования правильной формы, одинаковых размеров, а также отдельно лежащие нитевидные структуры [3].
Химически сложный полисахаридолипидный комплекс (полный антиген) при парентеральном введении в иммунизированном организме вызывает образование антител, выявляемых с помощью традиционных серологических тестов РА, РСК, РП, РНГА, РИД. Полный антиген является наиболее полноценным в иммуногенном отношении для получения широкого спектра антител, тогда как ни фосфоролипидный, ни белковый, ни полисахаридный компоненты не обладают свойствами полного антигена [3].
Исследуя растворимые антигены из микобактерий Stanford
и Grauge
описали 4 основные группы:
- антигены Iгруппы являются общими для всех видов микобактерий и близких бактериальных родов;
- антигены IIгруппы характерны для медленно растущих микобактерий;
- антигены IIIгруппы характерны для быстро растущих микобактерий и нокардий;
антигены IVгруппы являются специфическими для отдельных видов микобактерий.
В этой связи главный вывод заключается в том, что иммунные реакции к патогенным медленнорастущим микобактериям не являются специфическими, так как это одновременно является реакцией и на антигены общие для других видов. И, наоборот, быстрорастущие микобактерии могут вызывать образование антител к антигенам патогенных микобактерий, т.е. неизбежно наличие перекрестных реакций [8].
Близкое родство видов, входящих в одну группу, определяют групповые антигены (А, В, С, Д). У всех медленнорастущих микобактерий (группа А) выявлены антигены, отсутствующие у быстрорастущих. Группа А по антигенной структуре разделена на 3 подгруппы - А1,
А2
, А3
. В каждой подгруппе имеется по 1 - 2 антигена, отсутствующих в других группах или подгруппах. Среди быстро растущих микобактерий имеются значительные различия в антигенной структуре и установлены 3 серологические группы (В, С, Д) [1].
При нагревании антигенов при 100°С в течение 60 мин денатурируют групповые антигены, а видоспецифические сохраняются. У микобактерий выявлены 1 - 2 общих антигена, характерных для этого рода. Между некоторыми видами микобактерий имеется более близкое антигенное родство (до 10 - 12 общих антигенов).
При изучении антигенных связей микобактерий туберкулёза млекопитающих с атипичными видами микобактерий были обнаружены общие антигены. Однако степень их антигенного родства была различной в зависимости от вида атипичных микобактерий и колебалась от 15 до 62 % общих антигенов. Установлено, что М.
bovis
имеют до 63% антигенов общих с антигенами атипичных микобактерий.
В последнее время в исследованиях антигенной структуры микобактерий все чаще стал использоваться метод ИФА. При этом продемонстрирована строгая специфичность полученных антисывороток, каждая из которых реагировала в ИФА только с использованными для иммунизации антигенами [2].
Домен: Bateria
Отдел: Актиномицеты.
Порядок: Actinomycetales.
Подпорядок: Corynebacterineae.
Семейство: Mycobacteriaceae.
Род: Mycobacterium.
Вид: Mycobacterium tuberculosis (человеческий вид).
Mycobacterium bovis (бычий вид).
Mycobacterium africanum (промежуточный вид).
Mycobacteriumleprae.
РодMycobacterium
включает более 40 видов. Как оказалось, многие из них нередко выделяются в различных странах мира от людей, теплокровных и холоднокровных животных, страдающих заболеваниями легких, кожи, мягких тканей и лимфатических узлов. Эти заболевания получили название микобактериозов. Различают три типа микобактериозов, зависящих от вида микобактерий и иммунного статуса организма:
I. Генерализованные инфекции с развитием видимых невооруженным глазом патологических изменений, внешне напоминающих туберкулезные, но гистологически несколько отличающиеся от них.
II. Локализованные инфекции, характеризующиеся наличием макро - и микроскопических поражений, выявляемых в определенных участках тела.
III. Инфекции, протекающие без развития видимых поражений; возбудитель обнаруживается в лимфатических узлах внутриклеточно или внеклеточно.
По патогенным свойствам родMycobacterium
подразделяют на две группы:
1) патогенные и условно-патогенные (потенциально патогенные).2) сапрофиты.
Для их ускоренной предварительной дифференциации учитывают прежде всего три признака: а) скорость и условия роста; б) способность к пигментообразованию; в) способность синтезировать никотиновую кислоту (ниацин).
По скорости роста родMycobacterium
подразделяют на 3 группы:
1) Быстрорастущие - крупные видимые колонии появляются ранее 7-го дня инкубации (18 видов).
2) Медленнорастущие - крупные видимые колонии появляются после 7 и более дней инкубации (20 видов).
3) Микобактерии, которые требуют специальных условий для роста или не растут на искусственных питательных средах. К этой группе относятся два вида: М.
leprae
иM
.
lepraemurium
.
Дифференциация видов микобактерий среди быстро - и медленнорастущих проводится с учетом ряда их биохимических признаков: восстановление нитратов, теллурита; наличие каталазы, уреазы, никотин и пиразинамидазы, способность синтезировать ниацин; а также пигментообразования.
По способности к пигментообразованию микобактерии также делят на 3 группы:
1. Фотохромогенные - образуют пигмент лимонно-желтого цвета при росте на свету.
2. Скотохромогенные - образуют пигмент оранжево-желтого цвета при инкубировании в темноте.
3. Нефотохромогенные - пигмента не образуют (независимо от наличия света), иногда культуры имеют светло-желтоватую окраску [4].
Основным признаком, по которому микобактерии были отнесены к тому или другому виду, является различная патогенность их для разных видов животных и для человека. Среди патогенных микобактерий различают четыре вида: М
. tuberculosis
- возбудитель туберкулёза человека, М
. аvium
- возбудитель туберкулёза птиц, M
. bovis
- возбудитель туберкулёза рогатого скота, M
. microti
(OVS, или Oxford vole strain) - возбудитель туберкулёза полевых мышей.
Между отдельными видами микобактерий наблюдается переходные формы. Микобактерии различных видов имеют ряд морфологических, культурных, биохимических и биологических особенностей, которые позволяют дифференцировать их друг от друга. Существует мнение, что микобактерии бычьего вида имеют морфологические отличия от человеческих - меньшую длину тела микроба, меньшую его фрагментацию [2].
Предположен ряд питательных сред, на которых дифференциация микобактерий проводится в зависимости от изменения окраски среды, характера роста. Однако морфологические и культурные различия не позволяют с полной достоверностью дифференцировать эти виды. Более чёткая их дифференциация возможна с помощью биологических методов, основанных на неодинаковой чувствительности лабораторных животных к человеческим и бычьим микобактериям туберкулёза.
Важным тестом для идентификации микобактерий человеческого и бычьего видов является ниациновый тест (проба Конно), основанный на свойстве человеческих микобактерий продуцировать значительно больше ниацина, чем микобактерия бычьего вида.
Достоверные данные о принадлежности микобактерий к тому или иному виду можно получить только при помощи комплексного исследования. Микобактерии человеческого и бычьего видов могут вызвать заболевание туберкулёза не только у человека, но и крупного рогатого скота, овец, коз, свиней, верблюдов, реже у лошадей, собак и кошек.
Среди известных в настоящее время антропозоонозов самым распространённым является туберкулёз. Заболевают им практически все позвоночные животные. Известно 54 вида млекопитающих, у которых установлен туберкулёз.
Атипичными (нетуберкулезными) микобактериями, представители которых выделены в отдельную категорию, весьма неоднородную как по происхождению, так и по свойствам. Объединяющим фактором является кислотоустойчивость. В связи с этим вопрос о происхождении и характере атипичных микобактерий остаётся нерешённым.
По мнению многих авторов, атипичные микобактерии, во всяком случае, некоторые из них, имеют связь с туберкулёзной инфекцией.
Изучение патогинической роли атипичных микобактерий в клинике легочных и внелегочных заболеваний показало, что наиболее частые этиологическим фактором микобактериозов является микобактерии III группы, реже I группы и еще реже II и IV групп.
Основной видовой признак микобактерий туберкулеза - патогенность, т.е. способность жить и размножаться в тканях живого организма и вызывать специфические ответные реакции, приводящие к определенной нозологической форме патологии - туберкулезу. Наиболее восприимчивыми к заражению считаются морские свинки, которые применяют в качестве модели для биологической пробы при диагностике туберкулеза. Однако в настоящее время имеется большое количество штаммов микобактерий туберкулеза, различающихся по степени своей патогенности, т.е. по вирулентности. Следовательно, вирулентность является индивидуальным признаком отдельного штамма микроба и характеризуется интенсивностью размножения микроорганизма в тканях.
Высоковирулентные микобактерии туберкулеза у чувствительных к ним животных быстро размножаются в организме, не разрушаются фагоцитами, вызывают прогрессирующее образование туберкулезных очагов, приводящее в дальнейшем к неизбежной гибели животных. Слабовирулентные микобактерии также могут размножаться в организме, но они захватываются фагоцитами и разрушаются ими. Образующиеся специфические очаги подвергаются обратному развитию, животное не погибает. Вирулентность не является постоянным свойством. Она может изменяться у отдельных штаммов. Так, свежевыделенные из патологического материала микобактерии туберкулеза, как правило, более вирулентны, чем лабораторные штаммы, длительно содержащиеся на искусственных питательных средах. Для оценки вирулентности были предложены биологический метод (классический) и биохимические тесты. Последние установлены на установленном факте взаимосвязи корд-фактора микобактерий и их вирулентности, то есть цитохимических реакциях [1].
Идентификация микобактерий представляет большие трудности. Участились случаи выделения из патологического материала нетуберкулезных (атипичных) микобактерий, являющихся самостоятельными видами.
M.
bovis
дают первичный рост в виде мелких гладких колоний на 30; 45; 60-ый день. При пассажах рост наблюдают на 14; 21-ый день. Колонии не имеют пигмента, имеют белый или сероватый цвет. На жидкой среде образуют тонкую пленку. Температурный оптимум 37 - 38 0
С, при температуре 22 и 45 0
С - не растут. Патогенны для крупного рогатого скота, свиней, овец, коз, верблюдов, буйволов, оленей, маралов, собак, кошек и других видов животных, а также человека [8].
M.
tuberculosis
образуют первичный рост при посеве патологического материала на 21; 45; 60-ый день. Пассажированные культуры растут быстрее - на 10; 14; 21-ый день. Рост на плотной яичной среде, содержащий глицерин, обычно пышный; культуры имеют кремовый цвет оттенок и растут в виде шероховатых R-колоний, но могут быть гладкие, сливающиеся между собой. На жидкой питательной среде микобактерии человеческого вида туберкулеза образуют морщинистую грубую пленку, а иногда даже придонный крошковатый рост. Температурный оптимум 37 - 38 0
С, при 22 и 45 0
С не растут. В мазке, окрашенном по Цилю-Нильсену, морфологически представлены в виде полиморфных, тонких, кислотоустойчивых палочек, часто изогнутых. Патогенны для человека, обезьян, морских свинок, мышей, собак, коше, попугаев. У крупного рогатого скота, как правило, обуславливают сенсибилизацию организма к туберкулину для млекопитающих и лишь изредка вызывают ограниченные изменения, преимущественно в лимфатических узлах, регионарных местам проникновения микобактерий [7].
M.
avium
отличаются от бычьего и человеческого видов морфологией колоний. Они мягкие, слизистые, серовато - белые, изредка слегка желто - пигментированные, иногда при посеве из патологического материала вырастают в виде приподнимающихся над поверхностью среды "лепешек" или "бубликов". Рост появляется к концу 15; 20; 30-ого дня, иногда позже, при пересевах к 7 - 10 дню. В субкультурах представлены в виде гладкого, влажного налета. Культуры лучше растут при 43 - 45 0
С. Морфологически M.
avium
в мазках из культур выглядят как тонкие кислотоустойчивые палочки, более длинные и полиморфные в мазках-отпечатках из органов зараженных кур и кроликов. Патогенны в основном для птиц, кроликов, белых мышей, могут вызывать патологические изменения в органах у свиней и других животных.
M.
africanum
вызывает туберкулез у людей в тропической Африке. Систематическое положение как отдельного вида пока обсуждается.
M.
paratuberculosis
в мазках из патологического материала располагаются кучками, гнездами и палисадами, редко - попарно, три, четыре и еще реже - одиночно. Чрезвычайно трудно растут на искусственных питательных средах и только при обязательном добавлении к ним так называемого фактора роста. Оптимальная температура роста 38 С. Первичный рост появляется через 30 - 60 дней, иногда позже, в виде мельчайших колоний, постепенно приобретающих бело-кремовый цвет и увеличивающихся. Патогенны для крупного рогатого скота, коз, верблюдов, овец, северных оленей [7].
M.
konsasii
- палочки от умеренно длинных до длинных, расширяются и имеют заметную поперечную исчерченность. На яичных средах образуют гладкие или шероховатые колонии через 7 дней или позже посева. Оптимальная температура роста 37 0
С. Относится к фотохромогенным микобактериям. Патогенны для человека. Вызывает хронические легочные заболевания у людей, сходные с туберкулезом.
M.
simiae
- фотохромогенные, ниацонотрицательные, каталазо - и пероксидозаположительные. Патогенны преимущественно для обезьян.
M.
scrofulaceum
- на яичных средах растут при 25 - 37 0
С в виде гладких колоний желтого или оранжевого цвета. Рост появляется через 7 дней после посева при выращивании в термостате при 37 0
С. Для животных незначительно патогенны, редко выявляют локализованные поражения печени и селезенки у крыс, хомяков и цыплят; у морских свинок, зараженных подкожно, в месте инокуляции появляются абсцессы и увеличиваются регионарные лимфатические узлы [8].
M.
intracellularae
- палочки от коротких до длинных. На яичных средах через 7 дней после посева образуют гладкие непигментированные колонии при температуре 37 0
С. По мере старения колонии могут желтеть. Вызывают патологоанатомические изменения в лимфатических узлах свиней. Патогенны для цыплят [7].
M.
xeponi
- длинные нитевидные палочки. Растут при температуре 40 - 45 0
С. Молодые культуры дают непигментированные шероховатые колонии; позднее появляется пигмент желтого цвета. Выделены от жабы. Потенциально патогенны для человека.
M.
gastri
- умеренно длинные и тонкие палочки. На яичных средах образуют гладкие и грубые колонии через 7 дней и более после посева. Растут при температуре 25 - 40 0
С. Выделяют из почв, вод, желудка человека.
M.
terrae
- умеренно длинные тонкие палочки. На яичных средах расьтут на 7 дней и более после посева в виде гладких или шероховатых колоний белого или темно-желтого цвета при температуре 37 0
С. Выделяют из почвы.
M.
fortuitum
- палочки длиной от 1 - 3 мкм, кокковидные, утолщенные, иногда с нитевидными разветвлениями. На яичных средах рост отмечают через 2 - 4 дня после посева, колонии могут быть гладкими, полусферической формы. У морских свинок, кроликов и мышей редко вызывают генерализованную инфекцию даже при больших дозах заражения.
Локальные поражения обычно выявляют в почках мышей, морских свинок, кроликов, обезьян, цыплят. При заражении мышей в ухо наблюдают феномен вытечки [7].
Выделяют из лимфатических узлов крупного рогатого скота; обнаруживают в почве, в организме хладнокровных животных. Потенциально патогенны для человека [8].
M.
chelonei
- микроорганизмы разной морфологии размером от 0,2 - 0,5 до 1 - 6 мкм. Через 3 - 4 после посева на всех питательных средах появляются гладкие, ровные колонии, влажные, нехромогенные или имеющие кремовую окраску. Эти микобактерии вызывают проходящие поражения у мышей, морских свинок, хомяков и кроликов. Они обладают ограниченной патогенностью при внутрибрюшинном введении. Внутривенное заражение вызывает у мышей сильное поражение селезенки, печени легких и почек, у человека - патологические изменения в синовиальной ткани коленного сустава и поражения в ягодичной части, подобно абсцессам.
M.
thamnopheos
- длинные стройные палочки размером от 4 до 7 мкм, слегка изогнутые. На яичных питательных средах через 5 - 7 дней появляются влажные непигментированные колонии, иногда окрашенные в розовый или оранжево-розовый цвет. Растут при температуре 10 - 35 0
С, не растут при температуре 37 0
С. Патогенны для змей, лягушек, ящериц и рыб, непатогенны для морских свинок, кроликов и домашней птицы [6].
M.
phlei
- короткие палочки длиной 1 - 2 мкм. В посевах на яичной среде через два дня растут в виде шероховатых колоний темно-желтого или оранжевого цвета. Некоторые культуры дают гладкие мягкие или маслянистые колонии. Могут обуславливать сенсибилизацию крупного рогатого скота к туберкулинам [7].
M.
dienhoferi
- короткие прямые палочки размером от 0,5 - 0,8 до 1 - 30 мкм часто с толстыми закругленными концами. через три дня после посева на яичных средах появляются колонии от серого до темно-желтого цвета. Колонии обычно гладкие полусферические и блестящие. Оптимальный рост при температуре 22 - 37 0
С. Рост подавляется полностью при 42 0
С.
M.
flavescens
- на яичных средах через 7 - 10 дней после посева образуют мягкие, окрашенные в оранжевый цвет колонии. Непатогенны для человека и животных.
M.
ulcerans
- выделены из кожных поражений людей в Австралии, Мексике, Новой Гвинеи, Африке и Малайских островах.
M.
vaccae
- выделены из молочных желез коров. Найдены на лугах, пастбищах, в прудах, колодцах, иногда в кожных поражениях у коров.
M.
lepramurium
- не растут in
vitro
, но могут экспериментально пассажироваться через крыс, хомяков, мышей. Вызывают лепру у крыс, мышей и некоторых других родственных им грызунов.
В микробиологической литературе описано более 250 наименований видов микобактерий. Международный подкомитет по микобактериям утвердил только 26 наименований видов микобактерий.
Выделяемые из организма человека и домашних животных микобактерий, отличающихся по свойствам от M.
tuberculosisи
M.
bovis,
а также от сапрофитных микобактерий, находящихся в окружающей среде, названы паратуберкулезными. Их также называют атипичными, неклассифицированными, неидентифицированными, анонимными или оппортунистическими микобактериями.
В почве, воде, пыли, траве, на водопроводных, резиновых трубах, медных инструментах, в некоторых продуктах питания (молоке, масле, сметане), на коже здоровых людей и животных, в смегме, в нормальном содержимом желудка и ушной сере, а иногда и в патологических выделениях (мокроте, плевральном выпоте) находят кислотоустойчивые сапрофитные микобактерии. Они непатогенны для человека и животных.
Различают три группы кислотоустойчивых сапрофитов [6].
1-я группа M.
phlei,
или Тимофеевой травы. К этой группе относятся сапрофиты, выделенные из молока (M.
lacticola
), пыли (M.
stercosis
), воды, масла и др. Обладают небольшой первичной токсичностью; чтобы убить одну здоровую морскую свинку, нужен 1 г. очищенного белка М
. flei
, в то время как для той же цели достаточно 100 - 150мг микобактерий туберкулеза.
2-я группа M.
smegmatis.
Обнаружены на коже и половых органах человека и животного.
3-я группа M.
fortuitum
. Для морских свинок и кроликов не патогенны. При внутривенном введении мышам в почках образуются абсцессы, из которых выделяют множество микобактерий.
Кроме этих классификаций были предложены и другие. Так, Bonicke (1962) использовал некоторые биохимические свойства, Collins (1966) разделил атипичные микобактерии на 10 групп. Kappler (1966) применил 18 и биохимических тестов и распределил микобактерии на 12 групп.
Предложенные классификации не решают проблему атипичных микобактерий. И хотя многие из них широко пользуются до настоящего времени (группировка Раньона), необходима дальнейшая работа по идентификации микобактерий и рациональной систематизации с целью установления их видовой принадлежности [6].
Выделение возбудителя является более эффективным, чем бактериоскопия, и позволяет выявить 20 - 100 и более микобактерий в 1 мл исследуемого материала, а также определить их устойчивость к лекарственным препаратам, вирулентность, типовую принадлежность и другие важные характеристики. Недостатком метода является длительность исследования от 2-х до 12-ти недель [1].
При культивировании микобактерий большое значение имеет гомогенизация, флотация и деконтаминация материала, проводимые с целью повышения концентрации микобактерий и освобождения материала от посторонней микрофлоры и других частиц. Для обработки материала перед его посевом используют различные вещества, которые обеспечивают его гомогенизацию и концентрацию. При этом они должны обеспечивать сохранение жизнеспособности возбудителей туберкулеза и угнетать рост сопутствующей микрофлоры. Предварительную обработку материала, помещенного в стерильную склянку с бусами, производят кислотами, щелочами, ферментами или детергентами. Наиболее широко используют обработку 10% -м фосфатом натрия, реже применяют 1% -й N-ацетил-L-цистеингидроксид (они лучше обеспечивают жизнеспособность возбудителей туберкулеза). К исследуемому материалу добавляют равный объем фосфата и инкубируют смесь при 37°С в течение 24 ч, затем нейтрализуют смесь соляной кислотой и центрифугируют. Осадок засевают на элективные питательные среды. Одновременно делают посев необработанного материала на питательные среды для выявления L-форм возбудителей туберкулеза и других возможных возбудителей инфекции. При отсутствии контаминации (асептически взятый ликвор) можно делать посев необработанного материала на специальные среды для выделения микобактерий. В качестве плотных сред для выделения используют яичную среду Левенштейна-Йенсена, среду Финна IIи другие [2].
Модифицированная среда Левенштейна-Йенсена.
Она рекомендована ВОЗ в качестве стандартной среды для первичного выращивания микобактерий туберкулеза и определения их устойчивости к химиопрепаратам. Готовят отдельно 3 составляющих среды:
Минеральный солевой раствор: калия дигидрофосфат (2,4 г), магния сульфат (0,24 г), магния цитрат (0,6 г), аспарагин (3,6 г), глицерин (12 мл), дистиллированная вода (600 мл).
Раствор стерилизуют автоклавированием при 121°С 30 мин.
2% -й раствор малахитового зеленого (2,0 г малахитового зеленого + 100 мл стерильной дистиллированной воды).
Гомогенизат целых яиц (используют свежие куриные яйца). Все 3 ингредиента асептически смешивают в следующей пропорции: минеральный солевой раствор (600 мл), раствор малахитового зеленого (20 мл), яичный гомогенизат (1000 мл).
Готовую среду разливают в стерильные пробирки или флакончики и проводят коагуляцию при 80 - 85°С в течение 45 мин.
Среда Финна - II
Готовят отдельно три составляющих среды:
Питательная основа: магния сульфат (7Н2
0) (0,5 г), натрия цитрат (1,0 г),
железа аммонийного сульфат (0,05 г), калия дигидрофосфат (20,0 г), аммония дигидроцитрат (5,0 г), натрия глютамат (10,0 г), глицерин (20 мл), дистиллированная вода (1000 мл).
Раствор стерилизуют автоклавированием при 121°С 20 мин.2% -й раствор малахитового зеленого. Гомогенизат целых яиц (используют свежие куриные яйца - 40 шт.). Все 3 ингредиента асептически смешивают в следующей пропорции: минеральный солевой раствор (1000 мл), раствор малахитового зеленого (33 мл), яичный гомогенизат (1000 мл).
Готовую среду разливают в стерильные пробирки или флакончики по 4 - 5 мл и проводят коагуляцию при 85°С в течение 30 мин, после чего готовые скошенные среды выдерживают до остывания или до следующих суток при комнатной температуре в свертывателе. Готовые среды хранят в полиэтиленовых пакетах в холодильнике не более одного месяца. За рубежом для культивирования микобактерий в качестве неселективных широко используют жидкие и плотные среды Мидлбрука. В их состав входит глицерин, неорганические вещества, витамины, глюкоза, олеиновая кислота (используется в метаболизме микобактерий), альбумин (защищает микобактерии от действия токсических веществ и является источником протеина), каталаза (защищает от действия токсичных перекисей) [1].
Патогенность микобактерий не является стабильным признаком, а меняется в зависимости от многих признаков. Так, вид микобактерий, обладающий выраженной вирулентностью для одного вида животных, безвреден для других. Например, микобактерии патогенны для птиц, однако не патогенны для морских свинок, лошадей и редко вызывают туберкулез у крупного рогатого скота.
Один и тот же штамм микобактерий может иметь различную вирулентность в отношении различных животных одного и того же вида. Поэтому для определения вирулентности изучаемого штамма микобактерий следует использовать несколько видов опытных животных. Кроме того, на вирулентность влияют пути их введения в организм, доза вводимого штамма, возраст изучаемого штамма и, конечно, животное, подвергающееся заражению [7].
Виды возбудителей туберкулеза наиболее патогенны для тех животных, на которых они адаптировались. Так, M.
bovis
- наиболее патогенен для крупного рогатого скота, M.
tuberculosis
- для человека, а M.
avium
- для птиц.
Возбудителем туберкулеза бычьего вида заражаются и верблюды, причем процент их зараженности больше в тех хозяйствах, где более широко распространен туберкулез крупного рогатого скота. Хотя овцы более устойчивы к M.
bovis
по сравнению с крупным рогатым скотом, но в условиях обширного заражения последних высоковирулентным возбудителем и овцы заболевают туберкулезом. У пушных зверей к возбудителю туберкулеза крупного рогатого скота особенно чувствительны норки и нутрии, несколько меньше - песцы и серебристо - черные лисицы. У свиней регистрировали туберкулез, вызванный M.
bovis
. Наибольшую заболеваемость свиней отмечали в хозяйствах неблагополучных по туберкулезу крупного рогатого скота. Частота заболеваемости у кошек и собак зависит от степени контактирования их с крупным рогатым скотом больных туберкулезом. Кроме вышеназванных животных туберкулезом бычьего вида заболевают лошади, козы, ослы, обезьяны, кролики, морские свинки и другие виды животных.
M.
avium
- основной возбудитель туберкулеза диких и домашних птиц. Чаще он вызывает туберкулез у кур и отряда куриных, реже - у уток, гусей, индюков, лебедей и других видов птиц. Представители отряда Куринных заражаются как спонтанно, так и экспериментально при любом способе инфицирования, причем заражение возбудителем приводит к развитию туберкулеза, которое заканчивается гибелью птиц. При заражении крупного рогатого скота M.
avium
иногда поражены вымя, мезентеральные лимфатические узлы и серозные покровы грудной и брюшной полостей при нормальных легких, что несвойственно туберкулезу M.
bovis
.
В медицинской литературе описаны случаи легочной и внелегочной формы туберкулеза у людей, вызванные микобактериями птичьего вида. У ослабленных людей с нарушением сопротивляемости организма М
. avium
может стать причиной тяжелых легочных заболеваний.
Виды M.
avium
M.
intracellulare
по бактериологическому и биохимическому исследованиям практически неразличимы, то в последнее время их рассматривают как микобактерии комплекса avium -
intracellulare
. Возбудителями микобактериоза свиней почти без исключения являются микобактерии комплекса avium -
intracellulare
[7].
Однако имеются случаи описания тяжело протекающих маститов коров, вызванных M.
fortuitum
иM.
smegmatis
.
Виды быстрорастущих микобактерий (M.
fortuitum,
M.
chelonei
) в единичных случаях были выделены из содержимого абсцессов собак и кошек.
Атипичными микобактериями заражаются и птицы. Описаны в основном случаи выделения атипичных микобактерий от кур, в том числе скотохромогенные и быстрорастущих микобактерий. От диких птиц также изолированы культуры атипичных микобактерий [7].
Микобактерии широко распространены в природе.
Толчком к изучению микобактерий послужила их патогенность. Первым был открыт возбудитель туберкулеза - М
. tuberculosis
, о котором упоминалось в начале главы. Попадая в организм животного или человека, туберкулезная микобактерия поселяется на ткани и начинает размножаться. Образуется небольшой бугорок сероватого цвета, в центре которого находится скопление клеток микобактерий. Постепенно отдельные бугорки сливаются, омертвевшая ткань превращается в крошковатую желтую массу, образуется так называемый творожистый некроз. В случае поражения легких эта творожистая масса выделяется при кашле, а на месте некроза остается большая полость (каверна).
С глубокой древности известна людям болезнь проказа. В 1874 г. норвежским врачом Гансеном был открыт возбудитель проказы - М
. leprae
. К микобактериям относится и возбудитель дифтерии - М
. diphtheriae
(синоним - Corynebacterium
diphtheriae
). Поселяясь на слизистой зева или носа, эти организмы начинают выделять токсическое вещество. Дифтерийный токсин - один из самых сильных биологических ядов. Проникая в кровь, он поражает сердце, почки, надпочечники и нервы; иногда возможен летальный исход. Токсин нейтрализуется антитоксином, который есть в организме больного (естественный иммунитет) либо вводится в виде сыворотки. Недавно установлено химическое строение дифтерийного токсина. Он представляет собой сложный эфир миколовой кислоты и дисахарида трегалозы. Помимо описанных возбудителей туберкулеза, проказы, дифтерии, есть и другие виды микобактерий, патогенные для человека и животных [5].
Cуществует очень много микобактерий совершенно безвредных - это сапрофитные формы. В основном они обитает в почве, где принимает активное участие в минерализации органических остатков. Они могут разлагать такие вещества, которые недоступны другим микроорганизмам или плохо усваиваются, например нефтяные остатки, гуминовые соединения. Микобактерии прекрасно развиваются в почве с минимальной влажностью, при температуре, которая задерживает рост других организмов, а также в почвах с большим содержанием солей. Благодаря этим особенностям микобактерии играют особенно важную роль в превращении органических веществ в засушливых жарких районах, а также засоленных почвах [5].
Лучистые грибки, окисляющие углеводороды, способны синтезировать ряд ценных соединений. Это их свойство может быть использовано в народном хозяйстве. М. ceroformans
превращает гексадекан в цетилпальмитат, который широко применяется в парфюмерной промышленности. Парафиноокисляющие микобактерии синтезируют разнообразные витамины. Одни штаммы образуют витамины группы В, в частности рибофлавин. Другие накапливают каротиноиды - вещества, близкие к витамину А. Найдены и такие микобактерий, которые, окисляя углеводороды, выделяют в среду значительные количества аминокислот [5].
В настоящее время при получении витаминов и аминокислот используется дорогое пищевое сырье, например сахара. Из приведенных примеров видно, что его можно заменить нефтяными углеводородами. Работа в этом направлении очень перспективна.
Есть еще одна область, в которой парафиноокисляющие микобактерии могут сыграть существенную роль. За прошедшие 40 лет загрязнение нефтепродуктами рек, морей, океанов, почвы и атмосферы возросло во много раз. По данным американского журнала "National geografic magazin", каждый год выбрасывается в океаны от 3 до 10 млн. т. нефти. Так, Тур Хейердал находил нефтяные шарики и пленку далеко в океане на протяжении всего плавания на "Ра-2".
Химическая очистка нецелесообразна, так как приводит к накоплению еще более ядовитых соединений. Адсорбционные методы очистки также неэффективны из-за недостаточно глубокой очистки и трудности регенерации ионитов.
Наиболее перспективным является микробиологическое разрушение углеводородов нефти, приводящее к превращению их в нетоксичные кислородсодержащие вещества. Так, например, используя культуры активных парафиноокисляющих микобактерий, можно во многих случаях предотвратить загрязнение биосферы нефтепродуктами. Такие культуры, как М
. paraffinicum
и М
. lacticolum
var
. aliphaticum
, прекрасно разлагают многие образцы нефти.
Учитывая имеющиеся данные о биосинтезе парафиноокисляющими микроорганизмами витаминов, аминокислот, каротиноидов и других полезных метаболитов, можно предположить, что клеточная масса культур, разлагающих нефтяные отходы, может быть использована и в качестве удобрения.
Микобактерии нашли применение также как активные продуценты аминокислот. Наиболее широкое использование с целью получения глютаминовой кислоты получил вид М
. glutamicum
[5].
Безусловно, работы по изучению микобактерий необходимо продолжать. Очевидно, что основное прикладное значение эти исследования имеют для успешной диагностики и лечения туберкулёза, поскольку проблема данного заболевания всё ещё имеет место в нашем мире. Количество людей, умерших от микобактерий туберкулеза, ежегодно существенно превышает число случаев смертей, обусловленных каким-либо другим единичным патогенным микроорганизмом.
В настоящее время фтизиатрия вооружена эффективными методами лечения различных форм туберкулеза. Простые или более сложные схемы химиотерапии, построенные на различных принципах и одновременном назначении нескольких противотуберкулезных препаратов, усиливают терапевтический эффект и предупреждают развитие лекарственной устойчивости микобактерий. Химиотерапия туберкулеза расширила показания к хирургическим методам лечения болезни.
Однако только медицинские средства борьбы с туберкулезом не могут быть эффективными из-за большого количества таких больных. Препятствиями для эффективного лечения и профилактики туберкулеза являются его длительное и хроническое течение, а также целый ряд бытовых, экономических, моральных и психологических факторов, связанных с большими материальными затратами.
Тем не менее наряду с патогенными существует очень много микобактерий совершенно безвредных. Это - сапрофитные формы. Большая часть их обитает в почве, где принимает активное участие в минерализации органических остатков. Они могут разлагать такие вещества, которые недоступны другим микроорганизмам или плохо усваиваются, например нефтяные остатки, воск, гуминовые соединения и др. Микобактерии прекрасно развиваются в почве с минимальной влажностью, при температуре, которая задерживает рост других организмов, а также в почвах с большим содержанием солей. Благодаря этим особенностям микобактерии играют особенно важную роль в превращении органических веществ в засушливых жарких районах, а также засоленных почвах. Микобактерии принимают участие в процессах силосования, квашения, в приготовлении некоторых молочнокислых продуктов и сыров.
На основании проведённых исследований можно сделать вывод что микобактерии представляют значительный интерес для ведения научных исследований, ввиду разнообразия их форм, сложной природы а также возможности прикладного значения проведённых исследований.
1. Воробьев А.А., Быков А.С. Атлас по медицинской микробиологии, вирусологии и иммунологии, - М.; МИА, 2003.
2. Воробьев А.А., Микробиология и иммунология, - М.: Медицина, 1999.
3. Колычев Н.М., Госманов Р.Г., Ветеринарная микробиология и иммунология, - М.: Колос, 2003.
4. Коротяев А.И., Бабичев С.А. Медицинская микробиология, иммунология, вирусология. Учебник. - СПб: "Специальная Литература", 1998.
5. Красильников А.П., Романовская Т.Р., Микробиологический словарь-справочник. Мн. - 1999.
6. Мишустин Е.Н., Емцев В.Т., Микробиология. Изд.3-е, - М.: Агропромиздат, 1987.
7. Поздеев О.К., Медицинская микробиология, - М.: ГЕОТАР-МЕД, 2001.
8. Шлегель Г., Общая микробиология, - М.: МИР, 1987.
|