Содержание
1 Фотосинтез. Определение, общее уравнение, основные этапы становления учения о фотосинтезе. Историческое значение работ К.А. Тимирязева
2 Фотосинтез как основа энергетики биосферы. Космическая роль фотосинтеза. Роль фотосинтеза в процессах энергетического и пластического обмена растительного организма
3 Структурная организация фотосинтетического аппарата
3.1 Лист как орган фотосинтеза
3.2 Состав, строение, функции, возникновение и развитие хлоропластов
4 Пигменты хлоропластов
4.1 Хлорофиллы: состав, структура, биосинтез, оптические и химические свойства, значение
4.2 Каратиноиды. Их структура функции и физиологическая роль
4.3 Фикобилины. Их структура функции и физиологическая роль
4.4 Экологическое значение спектрально-различных форм пигментов у фотосинтезирующих организмов
5 Световая фаза фотосинтеза
5.1 Фотофизический этап. Электронно-возбуждённое состояние пигментов. Представление о фотосинтетической единице. Антенные комплексы. Реакционные центры. Преобразование энергии в реакционном центре
5.2 Фотохимический этап Электронно-транспортная цепь фотосинтеза. Представления о функционировании двух фотосистем. Фотофосфорилирование. Системы фотоокисления воды и выделения кислорода при фотосинтезе. Фотофосфорилирование. Связь фотосинтетической ассимиляции СО2 с фотохимическими реакциями
6 Метаболизм углерода при фотосинтезе (темновая фаза)
6.1 Химизм реакции цикла Кальвина
6.2 Цикл Хэтча-Слэка-Карпилова, его эволюционное значение. Различные типы усвоения углекислого газа С4-растениями
6.3 САМ-тип метаболизма. Потоки метаболитов в хлоропласт и из него
7 Фотодыхание, его значение. Сравнение фотодыхания у растений с различными типами метаболизма углерода
8 Эндогенные механизмы регуляции процесса фотосинтеза
9 Зависимость процесса фотосинтеза от факторов внешней среды
Список литературы
ВВЕДЕНИЕ
Фотосинтез — это процесс трансформации поглощенной организмом энергии света в химическую энергию органических (и неорганических) соединений. Главную роль в этом процессе играет использование энергии света для восстановления С02 до уровня углеводов. Часто говорят о фототрофной функции фотосинтеза, понимая под этим использование энергии света в различных эндергонических реакциях в живом организме. Фотосинтез осуществляют высшие растения, водоросли и некоторые бактерии. Он играет определяющую роль в энергетике биосферы.
Реклама

1 Фотосинтез. Определение, общее уравнение, основные этапы становления учения о фотосинтезе. Историческое значение работ К. А. Тимирязева
С древних времен люди отмечали, что деревья могут вырастать на бесплодных скалах. Английский ботаник и химик С.Гейлс в своей книге «Статика растений» (1727) высказал предположение, что растения значительную часть «пищи» получают из воздуха. При этом он вслед за И.Ньютоном полагал, что свет, поглощаемый листьями, «облагораживает» эту «пищу». Сходные мысли находят у М.В.Ломоносова. В «Слове о явлениях воздушных» (1753) он писал: «Преизобильное ращение тучных дерев, которые на бесплодном песку корень свой утверждали, ясно изъявляет, что листами жирный тук из воздуха впитывают...». Так возникла идея о воздушном питании растений.
Началом экспериментальных работ в области фотосинтеза послужили опыты английского химика Дж.Пристли, который в 1771г. обнаружил, что растения мяты, помещенные в стеклянный кувшин, опрокинутый в сосуд с водой, «исправляют» в нем воздух, «испорченный» горением свечи или дыханием мыши. Свеча могла длительно гореть, а мышь дышать, если под стеклянным колпаком находились зеленые растения. В связи с этими и последующими опытами Пристли в 1774 г. открыл кислород. Через год независимо от него кислород был открыт во Франции А.Л.Лавуазье, который и дал название этому газу.
В 1776 г. шведский химик К.В.Шееле повторил опыты Пристли, но не получил того же эффекта, который был описан Пристли. Растения в опытах Шееле делали воздух непригодным для дыхания так же, как горящая свеча. Объяснил противоречие между результатами опытов Пристли и Шееле голландский врач Я.Л.Ингенгауз. Он обнаружил, что все зависит от света: Пристли ставил опыты при ярком свете, Шееле — в помещении с недостаточным освещением. Ингенхауз показал, что зеленые растения выделяют кислород только при действии на них света. Зеленые растения в темноте, а их незеленые органы (например, корни) в темноте и при освещении поглощают кислород точно так же, как животные в процессе дыхания.
Швейцарский естествоиспытатель Ж.Сенебье в 1782 г. установил, что растения на свету не только выделяют кислород, но и поглощают испорченный воздух, т. е. С02. Сенебье назвал поглощение С02 «углеродным питанием».Применив методы количественного анализа, швейцарский ученый Т.Соссюр в 1804 г. показал, что растения на свету действительно усваивают углерод С02, выделяя при этом эквивалентное количество кислорода. Однако нарастание сухой массы растений превышает прирост количества углерода. Это превышение было значительно большим, чем количество поглощенных минеральных веществ. Соссюр сделал вывод, что органическая масса растения образуется не только за счет С02, но и за счет воды, т. е. вода такой же необходимый элемент питания, как и диоксид углерода. Результаты этих опытов были тщательно проверены французским агрохимиком Ж.Б.Буссенго (1840), который полностью подтвердил данные Соссюра.
Реклама

Французские химики П.Ж..Пельтье и Ж..Каванту в 1817 г. выделили из листьев зеленый пигмент и назвали его хлорофиллом
(от греч. «chloros» — зеленый и «phyllon» — лист), который, как выяснилось позднее, целиком локализован в хлоропластах. В 1865 г. немецкий физиолог растений Ю.Сакс продемонстрировал, что на свету в листьях образуется крахмал и что он находится в хлоропластах. Опыты ставили следующим образом. Листья предварительно выдерживали в темноте, затем освещали половинку каждого листа, а другую половинку, закрытую плотным картоном, оставляли в темноте. После экспозиции листья обесцвечивали спиртом и обрабатывали раствором йода. Освещенные части листьев становились темно-фиолетовыми из-за образования комплекса крахмала с йодом, а затемненные участки оставались неокрашенными. Микроскопический анализ показал, что крахмальные зерна образуются именно в хлоропластах. Эта «проба Сакса»,
как ее стали называть, настолько чувствительна, что на листьях удается получить отпечатки с фотонегативов. На прямом солнечном свету для образования крахмала достаточно уже 5 мин. А.С.Фаминцын в 60-е годы прошлого столетия наблюдал образование крахмала в клетках водоросли спирогиры уже через 30 мин освещения слабым светом керосиновой лампы.
Первые опыты по выяснению места образования кислорода при фотосинтезе были сделаны немецким физиологом Т.В.Энгельманом (1881). Нить спирогиры помещали в камеру с водой или в висячую каплю. Края покровного стекла, которым закрывали ячейку, замазывали вазелином, чтобы кислород воздуха не проникал из внешней среды. В эту же камеру помещались бактерии, способные двигаться только в присутствии кислорода. В темноте водоросль дышала и кислород исчезал из камеры. Затем включается свет и в ходе фотосинтеза выделяется кислород. Оказалось, что при включении света все бактерии «оживали» и скапливались вокруг локально освещенных участков хлоропластов. Следовательно, именно хлоропласты выделяют кислород на свету.
Вопросом о роли света в процессах фотосинтеза начали заниматься с середины XIX в. Американский физик Дж.У.Дрепер в 1846 г , вслед за ним Ю.Сакс и В.Пфеффер считали, что фотосинтез лучше всего осуществляется в желтых лучах, наиболее ярких для человеческого глаза. В то же время было уже хорошо известно, что хлорофилл имеет резко выраженные максимумы поглощения в красной и синей частях спектра. Исходя из этих данных делался вывод, что процесс фотосинтеза не подчиняется закону сохранения энергии, а свет действует на зеленый лист как раздражитель. Против этого утверждения выступили Ю.Р.Майер и Г.Гельмгольц, сформулировавшие закон сохранения и превращения энергии. На основе чисто теоретических рассуждений они утверждали, что зеленые растения поглощают лучистую солнечную энергию и превращают ее в химическую, т. е. фотосинтез — это процесс трансформации энергии света в энергию химических связей. Однако экспериментальных доказательств этой точки зрения не было. Они были получены крупнейшим физиологом растений К.А.Тимирязевым, который изложил их в своей докторской диссертации «Об усвоении света растением» (1875). Тимирязев нашел, что слишком широкие щели при пропускании света, разложенного с помощью призмы, не обеспечивают его монохроматической чистоты. Этот недостаток в постановке опытов и привел Дрепера и Пфеффера к неверным выводам. Тимирязев использовал в работе очень узкие щели и помещал в полоски монохроматического света тонкие пробирки с высечками из листьев. Для этих опытов ему пришлось разработать очень чувствительные методы газового микроанализа. В результате было установлено, что интенсивность ассимиляции С02 максимальна при освещении листьев красным светом, т. е. тем светом, который в наибольшей степени поглощается хлорофиллом.
Тимирязев постулировал, что при ассимиляции С02 хлорофилл служит оптическим сенсибилизатором
(т. е. веществом, увеличивающим чувствительность к свету) и что он непосредственно участвует в процессе фотосинтеза, необратимо переходя из восстановленного состояния в окисленное. Он сформулировал также идею о космической роли фотосинтеза: фотосинтез — единственный процесс, с помощью которого космическая солнечная энергия улавливается и остается на Земле, трансформируясь в другие формы энергии. Тимирязев писал, что в хлоропласте лучистая энергия солнечного света превращается в химическую энергию углеводов. Крахмал, клейковина и другие соединения, консервирующие солнечную энергию, служат нам пищей. Освобождаясь в нашем теле в процессе дыхания, эта энергия солнечного луча согревает нас, приводит в движение, поддерживает мышление.
Результаты изучения воздушного питания растений за первые сто лет после опытов Пристли нашли свое выражение в общем уравнении фотосинтеза:
свет
6СО2 + 12Н2О --- С6Н12О6 + 6СО2 + 6Н2О
хлорофилл
Происхождение
02 при фотосинтезе.
В приведенном выше уравнении остается неясным, каково происхождение выделяющегося кислорода (из С02 или из Н20). Во второй половине XIX в. и в начале XX в. считалось, что при фотосинтезе происходит фоторазложение С02 с последующим восстановлением углерода до углеводов с участием воды. Немецкий химик А.Байер в 1870 г. предложил следующий порядок реакций:

Исходя из этой гипотезы разложения диоксида углерода, можно было предположить, что для образования сахаров и крахмала растения должны усваивать промежуточные продукты — СО или формальдегид. Однако оба соединения оказались токсичными для растений, что указывало на ошибочность схемы Байера.
В 1893 г. крупнейший русский биохимик А.Н.Бах высказал мысль о том, что ассимиляция С02 при фотосинтезе связана не с отщеплением 02 от диоксида углерода, а является сопряженным окислительно-восстановительным процессом, происходящим за счет водорода и гидроксила воды, причем 02 выделяется из воды через промежуточные перекисные соединения.
 Голландский микробиолог К.Б. ван Ниль, изучая особенности бактериального фотосинтеза и сравнивая его с фотосинтезом у растений, в 1937—1941 гг. также пришел к заключению, что первичная фотохимическая реакция фотосинтеза состоит в диссоциации воды, а не в разложении С02. Способные к фотосинтетической ассимиляции С02 бактерии (за исключением цианобактерий) нуждаются в восстановителях типа H2S, Н2, СН3 и других и не выделяют в процессе фотосинтеза кислород. Такой тип фотосинтеза был назван фоторедукцией.
Ван Ниль пришел к выводу, что для пурпурных или зеленых серобактерий общее уравнение фотосинтеза может быть представлено следующим образом: С02 + H2A[СН20] + H2O + 2A Голландский микробиолог К.Б. ван Ниль, изучая особенности бактериального фотосинтеза и сравнивая его с фотосинтезом у растений, в 1937—1941 гг. также пришел к заключению, что первичная фотохимическая реакция фотосинтеза состоит в диссоциации воды, а не в разложении С02. Способные к фотосинтетической ассимиляции С02 бактерии (за исключением цианобактерий) нуждаются в восстановителях типа H2S, Н2, СН3 и других и не выделяют в процессе фотосинтеза кислород. Такой тип фотосинтеза был назван фоторедукцией.
Ван Ниль пришел к выводу, что для пурпурных или зеленых серобактерий общее уравнение фотосинтеза может быть представлено следующим образом: С02 + H2A[СН20] + H2O + 2A
 где Н2А — окисляемый субстрат (донор водорода). Он предположил, что для высших растений и водорослей Н2А — это Н20, а 2А — это 02. Тогда первичным фотохимическим актом в фотосинтезе растений должно быть разложение воды на окислитель [ОН] и восстановитель [Н]. Затем первичный восстановитель [Н] восстанавливает С02, а первичный окислитель [ОН] участвует в реакции, в которой высвобождается 02 и снова образуется H20. B соответствии с этим предположением полное уравнение фотосинтеза, по ван Нилю, можно записать так: CO2 + 4H2Oхлорофилл [CH2O] + 3H2O + O2 , причем эта суммарная реакцияtслагается из трех этапов: где Н2А — окисляемый субстрат (донор водорода). Он предположил, что для высших растений и водорослей Н2А — это Н20, а 2А — это 02. Тогда первичным фотохимическим актом в фотосинтезе растений должно быть разложение воды на окислитель [ОН] и восстановитель [Н]. Затем первичный восстановитель [Н] восстанавливает С02, а первичный окислитель [ОН] участвует в реакции, в которой высвобождается 02 и снова образуется H20. B соответствии с этим предположением полное уравнение фотосинтеза, по ван Нилю, можно записать так: CO2 + 4H2Oхлорофилл [CH2O] + 3H2O + O2 , причем эта суммарная реакцияtслагается из трех этапов:

Идеи ван Ниля были поддержаны результатами опытов английского физиолога растений Р. Хилла, который в 1937 г. показал, что изолированные хлоропласты под действием света способны разлагать воду и выделять кислород в присутствии акцепторов электронов (феррицианида, бензохинона и др.). Это явление получило название реакции Хилла.
Согласно Хиллу, процесс разложения воды осуществляется в три этапа:

Прямые экспериментальные доказательства того, что кислород при фотосинтезе освобождается именно из воды, были получены в 1941 г. независимо в СССР и в США. А.П.Виноградов и Р.В.Тейс с помощью масс-спектрометра показали, что отношение 160:180 в кислороде, выделяющемся при фотосинтезе, соответствует соотношению этих изотопов в воде, а не в диоксиде углерода. Группа американских ученых, возглавляемая С.Рубеном и М.Каменом, одновременно проводила опыты с водорослями. В одной камере, куда помещались водоросли, вода содержала тяжелый изотоп кислорода (Н2180), а кислород С02 не метился. Во второй камере, наоборот, использовался меченый С02 (С1802), а в состав воды входил обычный кислород. При освещении водорослей в этих камерах 1802 выделялся в значительно большем количестве, если метка была у кислорода воды.
2 Фотосинтез как основа энергетики биосферы. Космическая роль фотосинтеза. Роль фотосинтеза в процессах энергетического и пластического обмена растительного организма
К.А.Тимирязев, который первым начал изучать космическую роль зеленых растений, в публичной лекции, прочитанной в 1875 г., следующим образом представил эту проблему слушателям: «...луч солнца... упал на зеленую былинку пшеничного ростка ... Он ... затратился на внутреннюю работу ... превратясь в растворимый сахар ... отложился, наконец, в зерне в виде крахмала или в виде клейковины. В той или другой форме он вошел в состав хлеба, который послужил нам пищей. Он преобразился в наши мускулы, в наши нервы. Этот луч солнца согревает нас. Он приводит нас в движение. Быть может, в эту минуту он играет в нашем мозгу».
Действительно, фотосинтез — единственный процесс на 3емле, идущий в грандиозных масштабах и связанный с превращением энергии солнечного света в энергию химических связей. Эта космическая энергия, запасенная зелеными растениями, составляет основу для жизнедеятельности всех других гетеротрофных организмов на Земле от бактерий до человека. Выделяют пять аспектов космической и планетарной роли растений, которые рассмотрены ниже:
1. Накопление органической массы. В процессе фотосинтеза наземные растения образуют 100—172 млрд. т, а растения морей и океанов — 60 — 70 млрд. т биомассы в год (в пересчете на сухое вещество). Общая масса растений на Земле в настоящее время составляет 2402,7 млрд. т, причем 90% этой сухой массы приходится на целлюлозу. На долю наземных растений приходится 2402,5 млрд. т, а на растения гидросферы — всего 0,2 млрд. т (из-за недостатка света). Общая масса, животных и микроорганизмов на Земле — 23 млрд. т, что составляет около 1 % от растительной биомассы. Из этого количества 20 млрд. т приходится на обитателей суши, а 3 млрд. т — на животных и микроорганизмы гидросферы.
За время существования жизни на Земле органические остатки растений и животных накапливались и модифицировались. На суше эти органические вещества представлены в виде подстилки, гумуса и торфа, из которых, при определенных условиях, в толще литосферы формировался уголь. В морях и океанах органические остатки (главным образом животного происхождения) оседали на дно и входили в состав осадочных пород. При опускании в более глубокие области литосферы из этих остатков под действием микроорганизмов, повышенных температур и давления образовывались газ и нефть. Масса органических веществ подстилки, торфа и гумуса оценивается в 194, 220 и 2500 млрд. т соответственно. Нефть и газ составляют 10000-12000 млрд. т. Содержание органических веществ в осадочных породах достигает 20 000 000 млрд. т (по углероду).
Особенно интенсивное накопление мертвых органических остатков происходило 300 млн. лет назад в палеозойскую эру. Запасы древесины, а в последние 200 лет угля, нефти и газа используются человеком для получения энергии, необходимой в быту, промышленности и сельском хозяйстве.
2. Обеспечение постоянства содержания CO2 в атмосфере. Образование органических веществ гумуса, осадочных пород и горючих ископаемых выводило значительные количества С02 из круговорота углерода. В атмосфере Земли С02 становилось все меньше и в настоящее время он составляет только 0,03% (по объему), или (в абсолютных значениях) 711 млрд. т в пересчете на углерод.
В кайнозойской эре содержание диоксида углерода в атмосфере стабилизировалось и испытывало лишь суточные, сезонные и более длительные геохимические колебания. Эта стабилизация достигается сбалансированным связыванием и освобождением С02, осуществляемых в глобальном масштабе. Связывание С02 в ходе фотосинтеза и образование карбонатов компенсируется выделением С02 за счет других процессов. Ежегодное поступление С02 в атмосферу в пересчете на углерод (в млрд. т) обусловлено: дыханием растений — 10, дыханием и брожением микроорганизмов — 25, дыханием животных и человека — 1,6, производственной деятельностью людей — 5. геохимическими процессами — 0.05. При отсутствии этого поступления весь С02 атмосферы был бы связан в ходе фотосинтеза за 6 — 7 лет. Мощным резервом диоксида углерода является Мировой океан, в водах которого растворено в 60 раз больше С02, чем находится в атмосфере. Фотосинтез, с одной стороны, дыхание организмов и карбонатная система океана, с другой, поддерживают относительно постоянный уровень С02 в атмосфере.
Однако за последние десятилетия из-за все более возрастающего сжигания человеком горючих ископаемых, а также из-за вырубки лесов и разложения гумуса содержание С02 в атмосфере начало увеличиваться примерно на 0,23% в год. Это обстоятельство может иметь далеко идущие последствия в связи с тем, что концентрация С02 оказывает влияние на тепловой режим Земли.
3. Парниковый эффект. Поверхность Земли получает теплоту главным образом от Солнца. Часть этой теплоты поступает обратно в космос в виде инфракрасных лучей. Диоксид углерода в атмосфере, а также вода поглощают инфракрасное излучение и таким образом сохраняют значительное количество теплоты на Земле (парниковый эффект). Микроорганизмы и растения в процессе дыхания или брожения поставляют 85 % общего количества С02, поступающего ежегодно в атмосферу, и вследствие этого оказывают влияние на тепловой режим нашей планеты.
Тенденция к повышению содержания С02 в атмосфере из-за сжигания огромных количеств нефти, газа и из-за других причин, указанных выше, может способствовать увеличению средней температуры на поверхности Земли, что приведет к ускорению таяния ледников в горах и на полюсах, затоплению прибрежных зон. Возможно, однако, что повышение концентрации С02 будет способствовать усилению фотосинтеза растений, что устранит избыточное накопление диоксида углерода. Известно, что изменение концентрации С02 в биосфере выступает как элемент обратной связи.
4. Накопление кислорода в атмосфере.
Первоначально в атмосфере Земли 02 присутствовал в следовых количествах. В настоящее время он составляет 21 % по объему воздуха. Появление и накопление 02 в атмосфере связано с жизнедеятельностью зеленых растений. Ежегодно в ходе фотосинтеза кислород поступает в атмосферу в количестве 70— 120 млрд. т. Этот кислород необходим для дыхания всех гетеротрофов — бактерий, грибов, животных и человека, а также зеленых растений в ночное время. Особое значение в поддержании высокой концентрации 02 в атмосфере имеют леса. Подсчитано, что 1 га леса весной и летом за час выделяет 02 в количестве, достаточном для дыхания 200 человек.
5.Озоновый экран. Еще одно важнейшее следствие выделения растениями кислорода — образование озонового экрана в верхних слоях атмосферы на высоте около 25 км. Озон (03) образуется в результате фотодиссоциации молекул 02 под действием солнечной радиации. Озон задерживает большую часть ультрафиолетовых лучей (240 — 290 нм), губительно действующих на все живое. Возможность частичного разрушения озонового экрана из-за загрязнения атмосферы промышленными и другими отходами — серьезная проблема охраны биосферы.
3 Структурная организация фотосинтетического аппарата
3.1 Лист как орган фотосинтеза
Основные функции листа зеленого растения — фотосинтез (воздушное питание), транспирация (регулируемое испарение воды) и синтез ряда органических веществ, в том числе некоторых фитогормонов (ауксина, гиббереллинов, абсцизовой кислоты).
Лист, как правило, имеет плоскую форму и дорсовентральное строение. Пластинчатая форма листа обеспечивает наибольшую поверхность на единицу объема ткани, что создает наилучшие условия для воздушного питания.

Поперечный разрез листовой пластинки и средней жилки листа Бирючины – типичного двудольного растения
Важнейшая ткань листа — мезофилл, где осуществляется фотосинтез. Покрывающий лист эпидермис, клетки которого, за исключением замыкающих клеток устьиц, не содержат хлоропластов, защищает ткани листа, регулирует газообмен и транспирацию. Система разветвленных проводящих пучков необходима для снабжения тканей листа водой, минеральными и некоторыми органическими веществами и для оттока ассимилятов в другие части растения. Мезофилл обычно дифференцирован на две ткани — палисадную (столбчатую), расположенную под верхним эпидермисом, и губчатую, находящуюся в нижней стороне листа. В палисадном мезофилле клетки вытянуты перпендикулярно поверхности листа и расположены в один или несколько слоев. Клетки губчатого мезофилла связаны друг с другом более рыхло из-за больших межклетников. У большинства растений устьица находятся нанижней стороне листа, обширные межклетники губчатой паренхимы обеспечивают газообмен. Благодаря развитой системе межклетников мезофилл обладает громадной поверхностью, во много раз превышающей наружную поверхность листа.
Палисадная ткань, обращенная к свету, содержит большую часть всех хлоропластов листа и выполняет основную работу по ассимиляции С02. Число слоев клеток мезофилла в листе в большой степени зависит от интенсивности освещения. Листья, выросшие на ярком свету, имеют как правило, более развитый столбчатый мезофилл. У растений засушливых ареалов — ксерофитов — палисадная паренхима часто расположена по обеим сторонам листа, а губчатая сильно редуцирована или совсем отсутствует.
3.2
Состав, строение, функции, возникновение и развитие хлоропластов
Хлоропласты имеют зеленый цвет, обусловленный присутствием основного пигмента — хлорофилла. Хлоропласты содержат также вспомогательные пигменты — каротиноиды (оранжевого цвета). По форме хлоропласты — это овальные линзовидные тельца размером (5—10) * (2—4) мкм. В одной клетке листа может находиться 15—20 и более хлоропластов, а у некоторых водорослей — лишь 1-2 гигантских хлоропласта (хроматофора) различной формы.
Хлоропласты ограничены двумя мембранами — наружной и внутренней. Наружная мембрана отграничивает жидкую внутреннюю гомогенную среду хлоропласта — строму (матрикс). В строме содержатся белки, липиды, ДНК (кольцевая молекула), РНК, рибосомы и запасные вещества (липиды, крахмальные и белковые зерна) а также ферменты, участвующие в фиксации углекислого газа.
Внутренняя мембрана хлоропласта образует впячивания внутрь стромы — тилакоиды, или ламеллы, которые имеют форму уплощенных мешочков (цистерн). Несколько таких тилакоидов, лежащих друг над другом, образуют грану, и в этом случае они называются тилакоидами граны. Именно в мембранах тилакоидов локализованы светочувствительные пигменты, а также переносчики электронов и протонов, которые участвуют в поглощении и преобразовании энергии света.
Хлоропласты в клетке осуществляют процесс фотосинтеза.
Лейкопласты — мелкие бесцветные пластиды различной формы. Они бывают шаровидными, эллипсоидными, гантелевидными, чашевидными и т. д. По сравнению с хлоропластами у них слабо развита внутренняя мембранная система. Лейкопласты в основном встречаются в клетках органов, скрытых от солнечного света (корней, корневищ, клубней, семян). Они осуществляют вторичный синтез и накопление запасных питательных веществ — крахмала, реже жиров и белков.
Хромопласты отличаются от других пластид своеобразной формой (дисковидной, зубчатой, серповидной, треугольной, ромбической и др.) и окраской (оранжевые, желтые, красные). Хромопласты лишены хлорофилла и поэтому не способны к фотосинтезу. Внутренняя мембранная структура их слабо выражена.
Хромопласты присутствуют в клетках лепестков многих растений (лютиков, калужниц, нарциссов, одуванчиков и др.), зрелых плодов (томаты, рябина, ландыш, шиповник) и корнеплодов (морковь, свекла), а также листьев в осеннюю пору. Яркий цвет этих органов обусловлен различными пигментами, относящимися к группе каргиноидов, которые сосредоточены в хромопластах.
4 Пигменты хлоропластов
Пигменты — важнейший компонент аппарата фотосинтеза. Изучение растительных пигментов резко ускорилось благодаря работам русского физиолога растений М. С. Цвета. Пытаясь найти способ разделения пигментов на индивидуальные вещества, Цвет в 1901 — 1903 гг. открыл принципиально новый метод, который он назвал адсорбционной хроматографией.
Через колонку с сорбентом пропускается растворитель с растворенными веществами. Так как вещества различаются по степени адсорбции, они перемещаются по колонке с разной скоростью. В результате происходит разделение веществ. Этот прием широко используется в современной биохимии, химии и в некоторых отраслях промышленности. С помощью хроматографического метода Цвет обнаружил два хлорофилла — а
и b
и разделил желтые пигменты листа на три фракции.
Пигменты пластид относятся к трем классам веществ: хлорофиллам, фикобилинам и каротиноидам.
4.1 Хлорофиллы: состав, структура, биосинтез, оптические и химические свойства, значение
Впервые хлорофилл в кристаллическом виде был описан русским физиологом и ботаником И. П. Бородиным в 1883 г. В дальнейшем оказалось, что это не сам хлорофилл, а несколько видоизмененная его форма — этилхлорофиллид.
Польские биохимики М. Ненцкий и Л. Мархлевский (1897) обнаружили, что основу молекулы хлорофилла, как и гема гемоглобина, составляет порфириновое кольцо. Таким образом было показано принципиальное структурное сходство этих пигментов у растений и животных.
Немецкий химик Р. Вильштеттер в 1906—1914 гг. установил элементарный состав хлорофилла а — C55H72O5N4Mgи хлорофилла b— C55H70O6N4Mg, а немецкий биохимик Г. Фишер в 1930—1940 гг. полностью расшифровал структурную формулу хлорофилла. В 1960 г. химики-органики Р.Б. Вудворд (США) и М. Штрель (ФРГ) осуществили искусственный синтез хлорофилла. Хлорофилл — сложный эфир дикарбоновой кислоты хлорофиллина, у которой одна карбоксильная группа этерифицирована остатком метилового спирта, а другая остатком одноатомного непредельного спирта фитола. Структурная формула хлорофилла а представлена на рисунке:

Четыре пиррольных кольца (I — IV) соединены между собой метановыми мостиками, образуя порфириновое ядро. Наружные атомы углерода в тетрапиррольном цикле обозначены цифрами 1 — 10. Атомы азота пиррольных колец четырьмя координационными связями взаимодействуют с атомом магния. В структуре порфиринового ядра есть также циклопентановое кольцо (V), образованное остатком кетопропионовой кислоты и содержащее химически активную карбонильную группу у С9 и метилированную карбоксильную группу у С10. Структура, состоящая из тетрапиррольного и циклопентанового колец, получила название форбина. Боковая цепь IV пиррольного кольца включает в себя пропионовую кислоту, связанную сложноэфирной связью с полиизопреновым непредельным спиртом фитолом (С20Н39ОН). У 1, 3, 5 и 8-го углеродов пиррольных колец имеются метальные группы, у 2-го — винильная, у 4-го — этильная группа. Порфириновое кольцо представляет собой систему из девяти пар конъюгированных (сопряженных) чередующихся двойных и одинарных связей с 18 делокализованными p-электронами. Хлорофилл bотличается от хлорофилла а тем, что у 3-го углерода вместо метильной находится формильная (—СНО) группа. Структура хлорофилла, лишенная фитола, называется хлорофиллидом. При замещении атома магния протонами в молекуле хлорофиллов образуются соответствующие феофетины.
У высших растений и водорослей обнаружены хлорофиллы а, b, с, d. Все фотосинтезирующие растения, включая все группы водорослей, а также цианобактерии, содержат хлорофиллы группы а. Хлорофилл bпредставлен у высших растений, у зеленых водорослей и эвгленовых. У бурых и диатомовых водорослей вместо хлорофилла bприсутствует хлорофилл c, а у многих красных водорослей — хлорофилл d. Вфотосинтезирующих бактериях, осуществляющих фоторедукцию, найдены различные бактериохлорофиллы.
Биосинтез хлорофиллов. Первый этап биосинтеза хлорофиллов у растений — образование 5-аминолевулиновой кислоты (А Л К) из С5-дикарбоновых кислот. Показано, что глутаминовая кислота через 2-гидроксиглутаровую превращается в 4,5-диоксовалериановую, которая затем аминируется за счет аланина или других аминокислот (рис. 5.2). Реакция переаминирования катализируется АЛК-трансаминазой с участием пиридоксальфосфата в качестве кофермента. Для синтеза АЛК может использоваться и оскетоглутаровая (2-оксоглутаровая) кислота. Циклизация двух молекул АЛК приводит к образованию пиррольного соединения — порфобилиногена. Из четырех пиррольных колец формируется уропорфириноген, который превращается в протопорфирин IX. Дальнейший путь превращений протопорфирина может быть различным. С участием железа формируется гем, входящий в состав цитохромов, каталазы, пероксидазы и гемоглобина. Если молекулу протопорфирина включается магний, затем карбоксильная группа у С10 этерифицируется метильной группой 6-аденозил-b-метионина и замыкается циклопентановое кольцо (К), то образуется протохлорофиллид. Под действием света в течение нескольких секунд протохлорофиллид превращается в хлорофиллид а в результате гидрирования двойной связи у С7 — С8 в IV пиррольном ядре. У низших растений и некоторых голосеменных (у хвойных) хлорофиллид может образовываться в темноте. Хлорофиллид обладает теми же спектральными свойствами, что и хлорофилл. Последний этап в формировании молекулы хлорофилла а — этерификация фитолом, который, как и все полиизопреновые соединения, синтезируется из ацетил-KоА через мевалоновую кислоту. По данным А. А. Шлыка (1965), хлорофилл bможет образовываться из вновь синтезированных молекул хлорофилла а. Все описанные процессы, начиная с образования АЛК, осуществляются в хлоропластах. Первые признаки зеленения, выращенных в темноте этиолированных покрытосеменных растений, наблюдаются через 2 — 4 ч после начала освещения.
Физико-химические свойства хлорофиллов.
В твердом виде хлорофилл а представляет собой аморфное вещество сине-черного цвета. Температура плавления хлорофилла а 117 — 120 °С. Хлорофиллы хорошо растворимы в этиловом эфире, бензоле, хлороформе, ацетоне, этиловом спирте, плохо растворимы в петролейном эфире и нерастворимы в воде. Раствор хлорофилла а в этиловом эфире имеет сине-зеленый цвет, хлорофилла b — желто-зеленый. Резко выраженные максимумы поглощения хлорофиллов лежат в красной и синей частях спектра.
В этиловом эфире максимумы поглощения хлорофиллов группы а в красной части спектра — в пределах 660 — 663 нм, в синей — 428 — 430 нм, хлорофилла b — соответственно в пределах 642 — 644 и 452 — 455 нм. Хлорофиллы очень слабопоглощают оранжевый и желтый свет и совсем не поглощают зеленые и инфракрасные лучи. Поглощение в сине-фиолетовой части спектра обусловлено системой конъюгированных одинарных и двойных связей порфиринового кольца молекулы хлорофилла. Интенсивная полоса поглощения в красной области связана с гидрированием двойной связи у С7 — С8 в IV пиррольном ядре (при переходе от протохлорофиллида к хлорофиллиду) и присутствием магния в порфириновом кольце. Эти же условия способствуют снижению поглощения в желтой и зеленой частях спектра. Замещение магния протонами при обработке хлорофилла кислотой приводит к образованиюфеофетина,
имеющего буро-зеленый цвет и ослабленный красный максимум поглощения. Удаление остатков фитола и метилового спирта путем щелочного гидролиза мало сказывается на спектре поглощения хлорофилла. У хлорофиллина те же спектральные свойства, что и у хлорофилла: он зеленый, имеет красный и синий максимумы поглощения.
На положение максимумов спектра поглощения оказывают влияние природа растворителя и взаимодействие молекул хлорофилла друг с другом, а также с другими пигментами, липидами и белками. У агрегированных молекул хлорофилла (например, в твердых пленках и у хлорофилла, находящегося в хлоропластах) красный максимум поглощения сдвинут в более длинноволновую область (до 680 нм).
Растворы хлорофиллов в полярных растворителях обладают яркой флуоресценцией (люминесценцией). В этиловом эфире у хлорофилла а наблюдается рубиново-красная флуоресценция с максимумом 668 нм, у хлорофилла b — 648 нм т. е. максимумы флуоресценции в соответствии с правилом Стокса несколько сдвинуты в более длинноволновую часть спектра по отношению к максимумам поглощения. Агрегированный хлорофилл и хлорофилл в нативном состоянии (в живом листе) флуоресцируют слабо. Растворы хлорофиллов способны также к фосфоресценции (т. е. длительному послесвечению), максимум которого лежит в инфракрасной области.
Механизмы флуоресценции и фосфоресценции, в том числе молекул хлорофилла, достаточно хорошо изучены. Наиболее устойчивы те состояния атомов и молекул, в которых валентные электроны занимают самые низкие энергетические уровни и распределены по ним согласно принципу Паули (не более двух электронов с антипараллельными спинами на каждой орбитали). Такое состояние молекулы называют основным синглетным (S0) энергетическим состоянием. Суммарный спин (вектор магнитных моментов) всех электронов молекулы в этом случае равен нулю. Когда молекула поглощает квант света, то за счет этой энергии электрон переходит на более высокие вакантные орбитали. Если у возбужденного электрона сохраняется то же направление спина, то молекула находится в синглетном возбужденном состоянии (S*). Если при переходе на более высокую орбиталь спин электрона обращается, то такое возбуждение называется триплетным (T*). Прямой переход из основного состояния в триплетное — маловероятное событие, так как для этого необходимо обращение ориентации спина. Переходу молекулы из основного состояния в возбужденное, происходящему при поглощении кванта света, соответствует полоса в спектре поглощения.
Поглощение молекулой хлорофилла кванта красного света приводит к синглетному электронвозбужденному состоянию — S*1.

При поглощении кванта синего света с более высоким уровнем энергии электрон переходит на более высокую орбиту (
S
*
2).
Возбужденная молекула хлорофилла возвращается в основное состояние различными путями. Отдав часть энергии в виде теплоты (особенно с уровня S*1), молекула может излучить квант света с большей длиной волны (правило Стокса),
что проявляется в виде флуоресценции. Как уже отмечалось, хлорофилл а
поглощает свет в красной и синей областях спектра, но флуоресцирует лишь в красной. Время жизни синглетного возбужденного состояния 10-13 — 10-9 с.
Другой путь потери энергии состоит в переходе молекулы из синглетного возбужденного состояния в метастабильное триплетное (с обращением спина). Этот переход безизлуча-тельный, т. е. энергия теряется в виде теплоты. Триплетное возбужденное состояние имеет гораздо большее время жизни (>10-4 с). Из триплетного состояния молекула может вернуться в основное, излучив еще более длинноволновый (чём в случае флуоресценции) квант света. Это обычно более слабое свечение и есть фосфоресценция.
Наконец, энергия возбужденного состояния может быть использована на фотохимические реакции. В этом случае флуоресценции и фосфоресценции хлорофилла не наблюдается.
Структура молекулы хлорофилла, отобранная в процессе эволюции из многих других органических пигментов, прекрасно приспособлена к своим функциям сенсибилизатора фотохимических реакций. В ее состав входят 18 делокализованных π-электронов (представленных в структурной формуле хлорофилла в виде 18-членного кольца из конъюгированных двойных связей), что делает молекулу хлорофилла легко возбудимой при поглощении квантов света.
Еще Тимирязев предположил, что хлорофилл способен к окислительно-восстановительному превращению. Впервые реакция фотовосстановления хлорофилла была осуществлена в модельных опытах А. А. Красновским в 1948 г. Хлорофилл, растворенный в пиридине, в анаэробных условиях под действием света восстанавливается аскорбиновой кислотой или другими донорами электронов. При этом образуется восстановленная («красная») форма хлорофилла с максимумом поглощения при 525 нм:
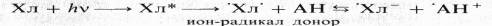
После выключения света реакция идет в обратном направлении. Фотовосстановленный хлорофилл в свою очередь может восстанавливать различные акцепторы электронов. В той же модельной системе, но с добавлением акцептора электронов хлорофилл при освещении действует как сенсибилизатор:
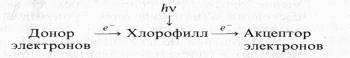
В этих условиях происходит восстановление NAD+, рибофлавина, хинона, Fe3+ , кислорода. Эти реакции получили название «реакций Красновского». Таким образом, молекула хлорофилла может выступать не только в роли первичного акцептора электрона, но и в роли его первичного донора.
Из всего сказанного следует, что молекула хлорофилла благодаря структурным и физико-химическим особенностям способна выполнять три важнейшие функции: 1) избирательно поглощать энергию света, 2) запасать ее в виде энергии электронного возбуждения, 3) фотохимически преобразовывать энергию возбужденного состояния в химическую энергию первичных фотовосстановленных и фотоокисленных соединений.
Для функционирования молекулы хлорофилла в процессах фотосинтеза существенное значение имеет ее пространственная организация. Магний-порфириновое кольцо молекулы представляет собой почти плоскую пластинку толщиной 0,42 нм и площадью 1 нм2. Это гидрофильная часть молекулы хлорофилла. Длинный алифатический остаток фитола (2 нм), образующий угол с порфириновым кольцом — ее гидрофобный полюс , необходимый для взаимодействия молекулы хлорофилла с гидрофобными участками мембранных белков и липидов.
4.2 Каротиноиды. Их структура, функции и физиологическая роль
Каротиноиды — жирорастворимые пигменты желтого, оранжевого, красного цвета — присутствуют в хлоропластах всех растений. Они входят также в состав хромопластов в незеленых частях растений, например в корнеплодах моркови, от латинского наименования которой (DaucuscarotaL.) они и получили свое название. В зеленых листьях каротиноиды обычно незаметны из-за присутствия хлорофилла, но осенью, когда хлорофилл разрушается, именно каротиноиды придают листьям характерную желтую и оранжевую окраску. Каротиноиды синтезируются также бактериями и грибами, но не животными организмами. В настоящее время известно около 400 пигментов, относящихся к этой группе.
Структура и свойства. Элементарный состав каротиноидов установил Вильштеттер. С 1920 по 1930 г. была определена структура основных пигментов этой группы. Искусственный синтез ряда каротиноидов впервые осуществлен в 1950 г. в лаборатории П. Каррера. К каротиноидам относятся три группы соединений: 1) оранжевые или красные пигменты каротины (С40Н56); 2) желтые ксантофиллы (С40H56O2 и С40H51O4);
3) каротиноидные кислоты — продукты окисления каротиноидов с укороченной цепочкой и карбоксильными группами (например, C20H24O2— кроцетин, имеющий две карбоксильные группы).
Каротины и ксантофиллы хорошо растворимы в хлороформе, бензоле, сероуглероде, ацетоне. Каротины легко растворимы в петролейном и диэтиловом эфирах, но почти нерастворимы в метаноле и этаноле. Ксантофиллы хорошо растворимы в спиртах и значительно хуже в петролейном эфире.
Все каротиноиды — полиеновые соединения. Каротиноиды первых двух групп состоят из восьми остатков изопрена, которые образуют цепь конъюгированных двойных связей. Каротиноиды могут быть ациклическими (алифатическими), моно- и бициклическими. Циклы на концах молекул каротиноидов являются производными ионона (рис. 5.5).

Примером ациклического каротиноида может служить ликопин (С40Н56) — основной каротин некоторых плодов (в частности, томатов) и пурпурных бактерий.
Каротин (рис. 5.5) имеет два β-иононовых кольца (двойная связь между С5 и С6). При гидролизе β-каротина по центральной двойной связи образуются две молекулы витамина А (ретинола). α-каротин отличается от β-каротина тем, что у него одно кольцо β-иононовое, а второе — £-иононовое (двойная связь между С4 и С5).
Ксантофилл лютеин — производное a-каротина, а зеаксантин — β-каротина. Эти ксантофиллы имеют по одной гидроксильной группе в каждом иононовом кольце. Дополнительное включение в молекулу зеаксантина двух атомов кислорода по двойным связям С5—С6 (эпоксидные группы) приводит к образованию виолаксантина. Название
«виолаксантин» связано с выделением этого соединения из лепестков желтых анютиных глазок (Violatricolor). Зеаксантин впервые получен из зерновок кукурузы (Zeamays). Лютеин (от лат. luteus — желтый) содержится, в частности, в желтке куриных яиц. К наиболее окисленным изомерам лютеина относится фукоксантин (С40Н60О6) — главный ксантофилл бурых водорослей.
Основные каротиноиды пластид высших растений и водорослей — Β-каротин, лютеин, виолаксантин и неоксантин. Каротиноиды, как и хлорофиллы, нековалентно связаны с белками и липидами фотосинтетических мембран.
Роль каротиноидов в процессах фотосинтеза. Каротиноиды — обязательные компоненты пигментных систем всех фотосинтезирующих организмов. Они выполняют ряд функций, главные из которых: 1) участие в поглощении света в качестве дополнительных пигментов, 2) защита молекул хлорофиллов от необратимого фотоокисления. Возможно, каротиноиды принимают участие в кислородном обмене при фотосинтезе.
Важное значение каротиноидов как дополнительных пигментов, поглощающих свет в синефиолетовой и синей частях спектра, становится очевидным при рассмотрении распределения энергии в спектре суммарной солнечной радиации на поверхности Земли.
Максимум радиации приходится на сине-голубую и зеленую части спектра (480 — 530 нм). В естественных условиях доходящая до поверхности Земли суммарная радиация слагается из потока прямой солнечной радиации на горизонтальную поверхность и рассеянной радиации неба. Рассеивание света в атмосфере происходит благодаря аэрозольным частицам (капли воды, пылинки и т. д.) и флуктуациям плотности воздуха (молекулярное рассеяние). Спектральный состав суммарной радиации в области 350 — 800 нм при безоблачном небе в течение дня почти не меняется. Объясняется это тем, что увеличение доли красных лучей в прямой солнечной радиации при низком стоянии Солнца сопровождается увеличением доли рассеянного света, в котором много сине-фиолетовых лучей. Атмосфера Земли в значительно большей степени рассеивает лучи коротковолновой части спектра (интенсивность рассеяния обратно пропорциональна длине волны в четвертой степени), поэтому небо выглядит голубым. При отсутствии прямого солнечного света (пасмурная погода) увеличивается доля сине-фиолетовых лучей. Эти данные указывают на важность коротковолновой части спектра при использовании наземными растениями рассеянного света и возможность участия каротиноидов в фотосинтезе в качестве дополнительных пигментов. В модельных опытах показана высокая эффективность переноса энергии света от каротиноидов к хлорофиллу а, причем этой способностью обладают молекулы каротинов, но не ксантофиллов.
Вторая функция каротиноидов — защитная. Впервые данные о том, что каротиноиды могут защищать молекулы хлорофилла от разрушения, были получены Д. И. Ивановским (1913). В его опытах пробирки, содержащие одинаковый объем раствора хлорофилла и разные концентрации каротиноидов, выставлялись на 3 ч на прямой солнечный свет. Оказалось, что чем больше каротиноидов было в пробирке, тем в меньшей степени разрушался хлорофилл. В дальнейшем эти данные получили многочисленные подтверждения. Так, бескаротиноидные мутанты хламидомонады на свету в атмосфере кислорода погибают, а в темноте при гетеротрофном способе питания нормально развиваются и размножаются. У мутанта кукурузы, у которого отсутствовал синтез каротиноидов, образующийся хлорофилл в аэробных условиях при сильном освещении быстро разрушался. В отсутствие кислорода хлорофилл не разрушался.
В настоящее время показано, что каротиноиды способны реагировать с хлорофиллом, находящимся в триплетном состоянии, предотвращая его необратимое окисление. При этом энергия триплетного возбужденного состояния хлорофилла превращается в теплоту:
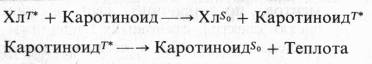
Кроме этого каротиноиды, взаимодействуя с возбужденным (синглетным) кислородом, который неспецифически окисляет многие органические вещества, могут переводить его в основное состояние:
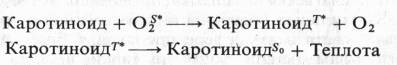
Менее ясна роль каротиноидов в кислородном обмене при фотосинтезе. У высших растений, мхов, зеленых и бурых водорослей осуществляется светозависимое обратимое дезэпоксидирование ксантофиллов. Примером такого превращения может служить виолаксантиновый цикл:
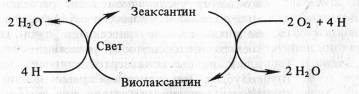
Значение виолаксантинового цикла остается невыясненным. Возможно, он служит для устранения излишков кислорода. Каротиноиды у растений выполняют и другие функции, не связанные с фотосинтезом. В светочувствительных «глазках» одноклеточных жгутиковых и в верхушках побегов высших растений каротиноиды, контрастируя свет, способствуют определению его направления. Это необходимо для фототаксисов у жгутиковых и фототропизмов у высших растений.
Каротиноиды обусловливают цвет лепестков и плодов у некоторых растений Производные каротиноидов — витамин А, ксантоксин, действующий подобно АБК, и другие биологически активные соединения. Хромопротеин родопсин, обнаруженный у некоторых галофильных бактерий, поглощая свет, функционирует в качестве Н+-помпы. Хромофорной группой бактериородопсина является ретиналь — альдегидная форма витамина А. Бактериородопсин аналогичен родопсину зрительных анализаторов животных.
4.3 Фикобилины. Их структура, функции и физиологическая роль
Синезеленые водоросли (цианобактерии), красные морские водоросли и некоторые морские криптомонады помимо хлорофилла а и каротиноидов содержат пигменты фикобилины. Наиболее известные представители фикобилинов — фикоэритробилины и фикоцианобилины. Первые преобладают у красных водорослей и определяют их цвет, вторые — у синезеленых.
Структура и свойства фикобилинов. По структуре фикобилины. (от греч. «phycos» — водоросль и лат. bilis — желчь) относятся к группе желчных пигментов — билинов (у животных представитель этой группы — билирубин). Это тетрапирролы с открытой цепью, имеющие систему конъюгированных двойных и одинарных связей. В своем составе они не содержат атомов магния или других металлов, а также фитола.
У фикоцианобилина пиррольные кольца соединены между собой метиновыми мостиками. I и IV пирролы имеют по одной карбонильной группе. Пиррольные кольца содержат следующие боковые радикалы: четыре метильных (у C1,3,6,7), винильную (у С2), этильную (у С8) и два остатка пропионовой кислоты (у С4 и С5).
Фикобилины являются хромофорными группами фикобилипротеинов — глобулиновых белков, с которыми в отличие от хлорофиллов они связаны прочными ковалентными связями. Фикобилипротеины делятся на три основные группы; 1) фикоэритрины — белки красного цвета с максимумом поглощения от 498 до 568 нм, 2) фикоцианины — сине-голубые белки с максимумами поглощения от 585 до 630 нм, 3) аллофикоцианины — синие белки с максимумами поглощения от 585 до 650 нм. Все эти хромопротеины обладают флуоресценцией с максимумами 575 — 578, 635 — 647 и 660 нм соответственно.

Фикобилипротеины водорастворимы, в клетках водорослей они локализованы в фшобилисомах — гранулах, расположенных на наружной поверхности фотосинтетических ламелл.
Значение фикобилинов. Максимумы поглощения света у фикобилинов находятся между двумя максимумами поглощения у хлорофилла: в оранжевой, желтой и зеленой частях спектра (см. рис. 4.3). Значение такого распределения максимумов поглощения становится понятным, если вспомнить оптические свойства воды, которая поглощает прежде всего длинноволновые лучи. На глубине 34 м в морях и океанах полностью исчезают красные лучи, на глубине 177 м — желтые, на глубине 322 м — зеленые и, наконец, на глубину свыше 500 м не проникают даже синие и фиолетовые лучи. В связи с таким изменением качественного состава света в верхних слоях морей и океанов обитают преимущественно зеленые водоросли, глубже — сине-зеленые и еще глубже — водоросли с красной окраской. В. Т. Энгельман назвал это явление хроматической комплементарной адаптацией
водорослей. По его наблюдениям (1881 — 1884), наиболее интенсивная ассимиляция С02 у водорослей с различной окраской соответствует максимумам поглощения света пигментными системами этих водорослей. Русский исследователь Н. М. Гайдуков (1903) экспериментально показал, что если культуру синезеленой водоросли Oscillaria
sancta
выращивать на свету разного спектрального состава, то у нее развивается дополнительная (комплементарная) окраска. При освещении зеленым светом водоросли становятся оранжево-красными, а при дейтвии красных лучей — зелеными. В настоящее время известно, что эти изменения цвета клеток связаны с изменениями в синтезе фикобилинов, принимающих участие в процессе фотосинтеза. Таким образом, у водорослей фикобилины — дополнительные пигменты, выполняющие вместо хлорофилла bфункции светособирающего комплекса. Около 90% энергии света, поглощенного фикобилинами, передается на хлорофиллы а. Явление хроматической комплементарной адаптации обнаружено далеко не у всех видов синезеленых и красных водорослей. У многих из них адаптация к изменяющемуся спектральному составу света обеспечивается изменением количества и состава хлорофиллов а.
Экологическое значение спектрально-различных форм пигментов у фотосинтезирующих организмов.
Пигментные наборы фотосинтезирующих организмов позволяют им использовать весь диапазон длин волн падающей на Землю солнечной энергии. Обращает внимание большое различие в спектрах поглощения у представителей разных групп фотосинтезирующих организмов и прежде всего существенные сдвиги в максимумах поглощения хлорофиллов в красной области спектра. Несомненно экологическое значение этого явления, позволяющего избегать конкуренции за свет между разными группами фотосинтезирующих организмов. Что же касается эволюции спектров поглощения хлорофиллов, то очевидна тенденция к перемещению в более коротковолновую часть спектра с более высоким энергетическим уровнем.
5 Световая фаза фотосинтеза
5.1 Фотофизический этап. Электронно-возбужденное состояние пигментов. Представление о фотосинтетической единице. Антенные комплексы. Реакционные центры. Преобразование энергии в реакционном центре
На световой фазе фотосинтеза происходит поглощение света молекулами хлорофилла ас участием дополнительных пигментов (хлорофилла b,
каротиноидов, фикобилинов) и трансформация энергии света в химическую энергию АТФ и восстановленного НАДФ. Все эти процессы осуществляются в фотохимически активных мембранах хлоропластов и представляют собой сложную систему фотофизических, фотохимических и химических реакций. В состав ламелл хлоропластов входят пять многокомпонентных белковых комплексов: светособирающий комплекс, фотосистемы I и II, цитохромный комплекс, включающий цитохромы b6 и f5 и АТФазный комплекс, участвующий в синтезе АТФ. Все они функционируют, взаимодействуя друг с другом.
Две фотосистемы. Впервые идею о существовании в хлоропластах двух фотосистем высказал Р. Эмерсон (1957), изучая влияние света на квантовый выход фотосинтеза у хлореллы. Под квантовым выходом фотосинтеза понимается количество выделившегося 02 или связанного С02 на 1 квант поглощенной энергии. Было показано, что квантовый выход высок при освещении хлореллы красными лучами с длиной волны 660-680 нм. Использование красного света с большей длиной волны приводило к снижению квантового выхода, а при 700 нм фотосинтез почти прекращался, хотя эта часть спектра еще поглощается хлорофиллом. Однако если хлореллу одновременно освещали коротковолновым (650 нм) и длинноволновым (700 нм) красным светом, то суммарный эффект (Y) был выше, чем при действии каждого красного света в отдельности.
Это явление получило название эффекта усиления Эмерсона. Отсюда возникло предположение, что в хлоропластах взаимодействуют две пигментные системы.
Предположение Эмерсона о двух пигментных системах подтвердилось в последующих работах, в которых из мембран хлоропластов с помощью детергентов (поверхностно-активных веществ, диссоциирующих гидрофобные связи) дифференциального центрифугирования в градиенте плотности сахарозы и других приемов удалось выделить и изучить белковые комплексы фотосистемы I (ФС I) и фотосистемы II (ФС II).
В состав ФС I в качестве реакционного центра входит димер пигмента П700 (хлорофилл а с максимумом поглощения 700 нм), а также хлорофиллы а675-695, играющие роль антенного компонента фотосистемы I. Первичным акцептором электронов в этой системе является мономерная форма хлорофилла а695 (Ах), вторичными акцепторами — А2 и Ав (железосерные белки — FeS). Комплекс ФС I под действием света восстанавливает водорастворимый FeS-белок ферредоксин (Фд) и окисляет медьсодержащий водорастворимый белок пластоцианин (Пц).
Белковый комплекс ФС II включает в себя реакционный центр содержащий хлорофилл а П680, а также антенные пигменты — хлорофиллы a670-673. Первичным акцептором электронов в этой фотосистеме выступает феофетин а (Фф), передающий электроны на первичный пластохинон, ассоциированный с FeS(QA) и дальше на вторичный пластохинон (Qb). В состав ФС II входят также белковый комплекс S-системы, окисляющий воду, и переносчик электронов Z, связанный с системой Sи служащий донором е для П680. Этот комплекс функционирует с участием марганца, хлора и кальция. В ФС II локализован цитохром b559. ФС II восстанавливает пластохинон (PQ) и окисляет воду с выделением 02 и протонов.
Связующим звеном между ФС II и ФС I служат пул (фонд) пластохинонов, белковый цитохромный комплекс b6 — f5 и пластоцианин.
В ходе эволюции ФС I возникла раньше. Она функционирует у ныне существующих фотосинтезирующих бактерий, фотосинтез которых осуществляется без разложения воды и выделения 02 (фоторедукция). В этом случае функцию доноров электронов для световой фазы фотосинтеза выполняют легко окисляемые соединения, такие, как H2S, Н2, СН4 и др.
Антенные комплексы и миграция энергии в пигментных системах. Эмерсон и Арнольд показали, что в хлоропластах растений на каждый реакционный центр приходится от 200 до 400 молекул хлорофилла, функции которых связаны с поглощением света и передачей энергии возбужденного состояния на реакционные центры. Молекулы хлорофилла а и дополнительные пигменты — хлорофилл b, каротиноиды, фикобилины — входят в состав антенных или светособирающих комплексов (ССК). Из ламелл хлоропластов выделены светособирающий белковый комплекс с хлорофиллами а и b(ССКa-Ь ), тесно связанный с ФС II, и антенные комплексы, непосредственно входящие в фотосистемы I и II (фокусирующие антенные компоненты фотосистем).
В ССКa-Ь присутствуют хлорофилл а в двух или трех формах с максимумами поглощения между 660 и 675 нм, хлорофилл bс максимумом поглощения 650 нм и каротиноиды. В каждом ССКa-b содержится от 120 до 240 молекул хлорофиллов, причем отношение хлорофилла а к хлорофиллу bсоставляет 1,2—1,4. Половина белка тилакоидов и около 60% общего количества хлорофилла локализовано в ССК. У сине-зеленых и красных водорослей, у которых хлорофилл bотсутствует, роль ССК выполняют фикобилисомы, в состав которых входят фикобилины.
Антенный белковый комплекс ФС II содержит 40 молекул хлорофиллов а с максимумами поглощения 670 — 683 нм на один П680 и β-каротин.
Антенный белковый комплекс ФС I состоит из хромопротеинов, содержащих 110 молекул хлорофиллов а с максимумами поглощения 680 — 695 нм на один П700, из них 60 молекул — компоненты антенного комплекса самой фотосистемы, а 50 входят в состав комплекса, который можно рассматривать как ССК ФС I. Антенный комплекс ФС I также содержит β-каротин.
Хромопротеины антенных комплексов не обладают фотохимической и энзиматической активностью. Если бы каждая молекула хлорофилла преобразовывала поглощенную ею энергию кванта света в фотохимическую реакцию, то такая система была бы крайне нерентабельна. Продолжительность синглетного возбужденного состояния исчисляется 10-12 — 10-9 с, и даже на прямом солнечном свету 1 квант света поглощается молекулой хлорофилла не чаще одного раза за 0,1 с. Большую часть времени молекула хлорофилла «простаивает». Поэтому роль пигментов антенных комплексов состоит в том, чтобы собирать и передавать энергию квантов на небольшое количество молекул реакционных центров П680 и П700, которые и осуществляют фотохимические реакции. Аналогично отдельные капли дождя ударяют в крышу и, сливаясь, создают постоянный ток воды в водостоке.
Передача (миграция) энергии по пигментам антенных комплексов происходит по принципу индуктивного резонанса (без флуоресценции и переноса заряда). Природа индуктивного резонанса сострил в следующем. Каждая молекула хлорофилла, поглотившая квант света и перешедшая в синглетное возбужденное состояние, является молекулярным осциллятором. Возникающее вокруг возбужденной молекулы переменное электрическое поле с определенной частотой колебаний индуцирует осцилляцию диполя (электрон — ядро) соседней молекулы. При этом молекула-донор переходит в основное состояние, а молекула-акцептор — в возбужденное. Условиями для резонансного переноса энергии электронного возбуждения служат малые расстояния между молекулами, не превышающие 10 нм, и перекрытие частот колебаний у двух взаимодействующих молекул.
Флуоресценция каждой молекулы-донора имеет более длинноволновый максимум по сравнению с максимумом ее поглощения (в соответствии с правилом Стокса) и в большей или меньшей степени перекрывает зону поглощения акцепторной молекулы. Миграция энергии осуществляется от коротковолновых пигментов в сторону все более длинноволновых, т. е. пигментов с более низким уровнем синглетного возбужденного состояния.
В антенных комплексах перенос энергии осуществляется в ряду: каротин (400-550 нм)--► хлорофилл b(650 нм)--►хлорофиллы a(660-675 нм)---► П680 (ФС II). Скорость резонансного переноса энергии от молекулы к молекуле 10-10 — 10-9 с, причем эффективность переноса между молекулами хлорофилла достигает 100, а между молекулами каротина и хлорофилла — лишь 40%.
Реакционные центры. Белки, содержащие длинноволновые формы хлорофиллов (П680 в ФС II и П700 в ФС I) в количестве одна молекула на 200 — 400 молекул других хлорофиллов и способные к первичному фотохимическому разделению зарядов, называют реакционными центрами.
Первичное разделение зарядов в реакционных центрах происходит между молекулами хлорофилловой природы и связано с транспортом электронов. Функцию первичного донора электронов выполняет молекула хлорофилла, находящаяся в синглетном возбужденном состоянии. В реакционном центре ФС II, перешнуровывающем мембрану, первичным донором электронов служит П680, а первичным акцептором — феофетин. В реакционном центре ФС I первичный донор электронов— П700, а акцептор — мономерная форма хлорофилла а695 (А1).
Порядок реакций в реакционном центре ФС II определяется продолжительностью того или иного состояния молекул. Молекулы находятся в синглетном возбужденном состоянии 10-10 — 10-9 с. Первичные акцепторы (Фф или А1) получают электроны от своих доноров (П680 или П700 соответственно) за время около 10-12 с. Время обратных рекомбинаций от Фф- на П680+ и от A1- на П700+ во много раз больше (10-6 с). То же самое относится к последующим парам взаимодействующих молекул. Поэтому весь ход реакций резко сдвинут вправо. В реакционных центрах энергия возбужденного состояния хлорофилла преобразуется в энергию разделенных зарядов, т. е. превращается в химическую энергию.
5.2 Фотохимический этап. Электронно-транспортная цепь фотосинтеза. Представления о функционировании двух фотосистем. Фотофосфорилирование. Системы фотоокисления воды и выделения кислорода при фотосинтезе. Связь фотосинтетической ассимиляции С02 с фотохимическими реакциями
Нециклический и циклический транспорт электронов.
Для восстановления одной молекулы NADP+ в процессе фотосинтеза необходимы два электрона и два протона, причем донором электронов является вода. Фотоиндуцированное окисление воды осуществляет ФС II, восстановление NADP+ — фотосистема I. Следовательно, эти две фотосистемы должны функционировать во взаимодействии.
Исходя из данных о квантовом выходе фотосинтеза (необходимы 8 квантов света для выделения одной молекулы 02) из состава компонентов, входящих в ФС I и ФС II, и величин их окислительно-восстановительного потенциала была разработана схема последовательности реакций в световой фазе фотосинтеза.

Из-за сходства с буквой Z эта схема, получила название Z-схемы. Впервые принцип Z-схемы был предложен Р. Хиллом и Ф. Бендаллом (1960) и экспериментально подтвержден работами Л. Дюйзенса (1961). В настоящее время Z-схема, или схема нециклического транспорта электронов при фотосинтезе является общепризнанной и непрерывно пополняется новыми деталями.
В ФС II димер П680, поглотив энергию, эквивалентную 2 квантам коротковолнового красного света, и перейдя в синглетное возбужденное состояние, отдает 2 электрона феофетину (Фф). От Фф электроны, теряя энергию, последовательно передаются на пластохиноны ФС 11 - QAи QB, на пул липидорастворимых молекул пластохинона (PQ), переносящих через липидную фазу мембраны электроны и протоны, на железосерный белок FeSK и цитохром цитохромного комплекса b6 — f, восстанавливая Cu-содержащий белок пластоцианин (Пц).
Вакантные места («дырки») в Пб80 заполняются двумя электронами из содержащего Мп переносчика электронов Z, который в свою очередь восстанавливается с участием системы S. Окисленный белковый комплекс Sсвязывает воду и восстанавливается за счет электронов воды. Для осуществления этой реакции в белковом комплексе S необходимы Мп и С1-, а также Са2 + .
Однако описанная цепь реакций резко замедляется, если не возбуждена ФС I, так как в этом случае весь Пц переходит в восстановленное состояние. При возбуждении П700 в реакционном центре ФС I энергией, эквивалентной 2 квантам длинноволнового красного света, 2 электрона захватываются мономерной формой хлорофилла a(A1) и затем последовательно передаются переносчикам электронов А2 и Ав (железосерные белки FeS), ферредоксину (водорастворимый FeS-белок) и ферредоксин: NADP-оксидоредуктазе с FAD в качестве кофактора. Наконец, редуктаза восстанавливает NADP + .
На вакантные места в П700+ переходят электроны с Пц, и нециклическая цепь переноса электронов таким образом замыкается. Z-схема убедительно объясняет «эффект усиления Эмерсона», так как только при совместном использовании коротковолновых (ФС II) и длинноволновых (ФС I) лучей красного света интенсивность фотосинтеза будет оптимальной.
Энергия, освобождающаяся при движении электронов от П680 до П700, используется для синтеза АТФ из AДФ и неорганического фосфата (фотофосфорилирование).
Наряду с нециклическим в мембранах хлоропластов функционирует циклический транспорт электронов, включающий в себя только ФС I и комплекс цитохромов Ь6 — f. В этом случае возбужденные молекулы П700 последовательно отдают электроны на А1, А2, АB, Фд, PQ, цитохром b6, FeSR, цитохром f, Пц и, наконец, П700. При этом НAДФ+ не восстанавливается. Освобождающаяся энергия используется для фосфорилирования AДP.
Интересно отметить, что комплекс цитохромов Ь6 — fфункционирует в системе транспорта электронов при фотосинтезе аналогично комплексу III (цит. Ь, C1) в митохондриях.
Разница в уровнях энергии между П680 и П700 (> 50 кДж) вполне достаточна для фосфорилирования AДФ, так как величина высокоэнергетической фосфатной связи АТФ равна 30,6 кДж/моль (7,3 ккал). Перепады энергии в ФС I еще значительнее. Однако само по себе освобождение энергии при нециклическом и циклическом транспорте электронов не объясняет, каким образом осуществляется фотофосфорилирование.
Механизм фосфорилирования AДФ, сопряженного с деятельностью ЭТЦ , объясняет хемиосмотическая теория, разработанная английским биохимиком П. Митчеллом (1961 — 1966). Для объяснения процессов фотофосфорилирования эта теория была впервые использована А. Ягендорфом (1967).

Сущность хемиосмотической теории состоит в следующем. Цепь переносчиков электронов и прогонов, действующая в соответствии с окислительно-восстановительным градиентом, перешнуровывает мембрану таким образом, что трансмембранный перенос е- и Н+ в одну сторону чередуется с переносом в обратную сторону только е-. В результате функционирования такого механизма (Н + -помпы) по одну сторону мембраны накапливается избыток Н+ и возникает электрохимический (т. е. электрический и концентрационный) потенциал ионов Н+, который служит формой запасания энергии. Обратный пассивный ток ионов Н+ через протонный канал Н+-АТФазы, получивший название сопрягающего фактор CF1, сопровождается образованием высокоэнергетической фосфатной связи АТФ.
На рис. 6.1 представлена упрощенная схема расположения переносчиков в мембране тилакоидов, объясняющая механизм фотофосфорилирования. На внутренней стороне мембраны тилакоида под действием света возбуждаются П680 и П700. Электроны от П680 захватываются акцепторами е- на наружной стороне и передаются на окисленную форму пластохинона (PQ) — липидорастворимого переносчика прогонов и электронов, выполняющего функцию челнока. Принимая два электрона, 2PQдиффундируют к цитохромному комплексу и захватывают из стромы 2Н + . Электроны с 2PQH2 поступают в цепь: F.eSR -> цит. f -> Пц,-> П700, а ионы Н + попадают в полость тилакоида. Вторая пара ионов Н+ освобождается там же при фотоокислении воды. В ФС I электроны П700 захватываются акцептором А, передаются ферредоксину и затем НAДФ+ на наружной стороне мембраны, причем 1Н+ используется на восстановление НAДФ.
Таким образом, из среды, окружающей тилакоид, при поглощении пигментами квантов света исчезают, а во внутренней полости тилакоида появляются протоны. В результате на мембране возникает электрохимический потенциал ионов Н + , который затем используется для фосфорилирования AДФ. Этот процесс называется нециклическим фотофосфорилированием.
При циклическом фотофосфорилировании, когда функционирует только ФС I, электроны от Фд поступают на цитохромный комплекс с использованием пула PQ, который действует как переносчик электронов и протонов. Затем электроны через цитохром f и Пц возвращаются на основной энергетический уровень в П700, а протоны поступают в полость тилакоида.
Белковые комплексы, участвующие в фотохимических реакциях фотосинтеза, в мембранах хлоропластов распределены неравномерно. Наибольшие различия наблюдаются между теми мембранами, которые плотно состыкованы друг с другом в гранах и теми участками мембран, которые контактируют со стромой (закругленные участки тилакоидов гран и мембраны тилакоидов стромы).
Светособирающий комплекс и пигмент-белковый комплекс ФС II находятся в основном в мембранах, плотно контактирующих друг с другом, причем ССК играет особую роль. В адгезии тилакоидных мембран.

Показано, что у мутанта хламидомонады, лишенного белка, с которым связан хлорофилл Ь,
граны не образуются. ФС I со своим светособирающим комплексом преимущественно, а АТФазный комплекс (CF1 + CF0), как правило, находятся на несостыкованных участках мембран. Комплекс цитохромов b6 — f равномерно распределен как в состыкованных, так и в не состыкованных мембранах. Такое распределение белковых комплексов, участвующих в световой фазе фотосинтеза, ставит вопрос о способе их взаимодействия. Показано, что это взаимодействие осуществляется с помощью легкоподвижного липофильного пластохинона PQв липидной фазе и благодаря перемещению водорастворимого пластоцианина вдоль внутренних поверхностей ламелл и водорастворимого ферредоксина вдоль ихнаружных поверхностей.
К латеральным перемещениям вдоль мембраны способны и сами белковые комплексы. На это передвижение влияет величина их электрического заряда. Например, восстановление пластохинона PQфотосистемой II приводит к активации киназы и фосфорилированию ССКа-ь.
Фосфорилирование ССК увеличивает его отрицательный заряд, что способствует перемещению ССК в стромальную область мембраны и возрастанию миграции поглощенной энергии света к ФС I. Возросшая фотохимическая активность ФС I усиливает окисление PQ,что, в свою очередь, приводит к инактивации киназы, фосфатаза же дефосфорилирует ССК. Таким образом, обратимое фосфорилирование ССК представляет собой петлю обратной связи в системе взаимной регуляции активности ФС I и ФС II. Механизм такой регуляции включает латеральный транспорт белковых комплексов в мембранах хлоропластов.
6 Метаболизм углерода при фотосинтезе (темновая фаза)
В результате фотохимических реакций в хлоропластах создается необходимый уровень АТР и NADPH. Эти конечные продукты световой фазы фотосинтеза стоят на входе в темновую фазу, где С02 восстанавливается до углевода:

Однако сами по себе АТФ и НAДФH не в состоянии восстановить С02. Очевидно, и темновая фаза фотосинтеза — сложный процесс, включающий большое количество реакций. Кроме того, существуют различные пути восстановления С02. В настоящее время известны так называемые С3-путь и С4-путь фиксации С02, фотосинтез по типу толстянковых (САМ-метаболизм) и фотодыхание. Рассмотрим каждый из этих путей в отдельности.
6.1 Химизм реакции цикла Кальвина
Этот способ ассимиляции С02, присущий всем растениям, в 1946—1956 гг. был расшифрован американским биохимиком М. Кальвином и его сотрудниками. Прежде всего, была поставлена задача обнаружить первичный продукт фотосинтеза и выяснить, какое соединение служит акцептором С02.
Для решения первого вопроса были использованы одноклеточные зеленые водоросли (хлорелла и др.) и меченый 14С02. Фотосинтезирующие водоросли помещали в среду, содержащую 14С02, на разные промежутки времени, затем клетки быстро фиксировали, экстрагировали из них спирторастворимые вещества и определяли содержание 14С в различных соединениях после их разделения с помощью хроматографии.
Оказалось, что после экспозиции в течение 1 мин 14С включался в С3 —С7-сахара и фосфосахара, в органические кислоты (яблочную, щавелевоуксусную, ФЕП), в аминокислоты (аланин, аспарагиновую кислоту). Если же время экспозиции было сокращено до 0,1—2 с, то большая часть метки обнаруживалась в фосфоглицериновой кислоте, в ее карбоксильной группе:
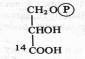
Следовательно, 3-фосфоглицериновая кислота (ФГК) является первичным продуктом фотосинтеза.
Второй вопрос — природа первичного акцептора С02. Сначала предположили, что таким акцептором является какое-либо двухуглеродное соединение. Однако введение в инкубационную среду винилфосфата, фосфогликольальдегида и других веществ с С2 не приводило к увеличению содержания радиоактивной метки из С02 в ФГК. Тогда схему опыта видоизменили следующим образом. Водоросли экспонировали на свету при высокой (1 %-ной) концентрации С02, затем резко снижали его концентрацию до 0,003%. Расчет был на то, что в условиях дефицита С02 быстро накопится именно то соединение, которое служит акцептором С02. С помощью двумерной хроматографии удалось установить, что при отсутствии возможности карбоксилирования в клетках кратковременно возрастает концентрация рибулозо-1,5-дифосфата (рибулозо-1,5-бисфосфата). Отсюда возникло предположение, что первичная фиксация С02 происходит следующим образом : С5 + С02-> С6-► 2С3. Для проверки этой гипотезы в бесклеточный экстракт из листьев шпината или клеток хлореллы вносили меченный по 32Р рибулозо-1,5-дифосфат. На свету в экстракте появлялась радиоактивная ФГК.
На основании полученных данных процесс первичной фиксации С02 можно записать следующим образом:

Эта реакция катализируется рибулозодифосфаткарбоксилазой (рибулозобисфосфаткарбоксилазой; другие названия — белок фракции I, карбоксидисмутаза). Максимум активности фермент имеет при рН 7,8 — 8,0 и нуждается в присутствии ионов Mg2 + .
Дальнейшая работа в лаборатории Кальвина и в других лабораториях привела к расшифровке всех последующих реакций С3-пути фотосинтеза, который получил название цикла Кальвина
(рис. 7.1). Этот цикл, весьма напоминающий обращенный пентозофосфатный путь дыхания, состоит из трех этапов: карбоксилирования, восстановления и регенерации.
1. Карбоксилирование. Молекулы рибулозо-5-фосфата фосфорилируются с участием АТР и фосфорибулозокиназы, в результате чего образуются молекулы рибулозо-1,5-дифосфата, к которым в свою очередь присоединяется С02 с помощью рибулозодифосфаткарбоксилазы. Полученный продукт расщепляется на две триозы: 2 молекулы 3-фосфо-глицериновой кислоты (3-ФГК).
2. Фаза восстановления. 3-ФГК восстанавливается до 3-фосфоглицеринового альдегида (3-ФГА) в два этапа. Сначала происходит фосфорилирование 3-ФГК при участии АТФ и фосфоглицераткиназы до 1,3-дифосфоглицериновой кислоты, а затем восстановление 1,3-ФГК с помощью НАДФH и дегидрогеназы фосфоглицеринового альдегида.

3. Фаза регенерации первичного акцептора диоксида углерода и синтеза конечного продукта фотосинтеза. В результате описанных выше реакций при фиксации трех молекул С02 и образовании шести молекул восстановленных 3-фосфотриоз пять из них используются затем для регенерации рибулозо-5-фосфата, а один — для синтеза глюкозы. 3-ФГА под действием триозофосфатизомеразы изомеризуется в фосфодиоксиацетон. При участии альдолазы 3-ФГА и фосфодиоксиацетон конденсируются с образованием фруктозо-1,6-дифосфата, у которого отщепляется один фосфат с помощью фруктозо-1,6-дифосфатазы. В дальнейших реакциях, связанных с регенерацией первичного акцептора С02, последовательно принимают участие транскетолаза и альдолаза. Транскетолаза катализирует перенос содержащего два углерода гликолевого альдегида от кетозы на адьдозу:

Альдолаза затем осуществляет перенос трехуглеродного остатка фосфодиоксиацетона на альдозу, в данном случае эритрозо-4-фосфат, в результате чего синтезируется седо-гептулозо-1,7-дифосфат. Последний дефосфорилируется и под действием транскетолазы из него и 3-ФГА образуются ксилулозо-5-фосфат и рибозо-5-фосфат. Две молекулы ксилуло-зо-5-фосфата при участии рибулозофосфатэпимеразы и одна молекула рибозо-5-фосфата с участием рибозофосфатизомеразы превращаются в три молекулы рибулозо-5-фосфата, с которого начинается новый цикл фиксации С02.
Из оставшейся неиспользованной 6-ой молекулы 3-ФГА под действием альдолазы синтезируется (при повторении цикла) молекула фруктозо-1,6-дифосфата, из которой могут образовываться глюкоза, сахароза или крахмал:

Таким образом, для синтеза одной молекулы глюкозы в цикле Кальвина необходимы 12 NADPH и 18 АТР (рис. 7.1), которые поставляются в результате фотохимических реакций фотосинтеза.
6.2 Цикл Хэтча-Слэка-Карпилова, его эволюционное значение. Различные типы усвоения углекислого газа
C
4-растениями
В работах Л. А. Незговоровой (1956—1957 гг.), было установлено, что при коротких экспозициях листьев кукурузы на свету 14С из 14С02 обнаруживается в аспарагиновой кислоте. В дальнейших исследованиях как советских, так и зарубежных специалистов эти представления были развиты, что привело к открытию C4-nymu углерода в фотосинтезе. Так, в 1960 г. Ю. С. Карпилов, а в 1963 г. И. А. Тарчевский и Ю. С. Карпилов представили данные о раннем образовании яблочной кислоты в листьях кукурузы. Г. П. Корчак и др. впервые показали, что дикарбоновые кислоты (яблочная и аспарагиновая) являются первичными продуктами фиксации С02 у сахарного тростника. Затем эти соединения через 3-ФГК и гексозофосфаты превращаются в сахара. Как новый тип фиксации С02, принципиально отличающийся от цикла Кальвина, этот цикл впервые описали австралийские ученые М. Д. Хетч и, К. Р. Слэк (1966). К группе растений с С4-путем фотосинтеза относятся сахарный тростник, кукуруза, сорго и др. Листья этих растений содержат два разных типа хлоропластов: хлоропласты обычного вида — в клетках мезофилла и большое количество крупных хлоропластов, часто не имеющих гран, — в клетках, окружающих проводящие пучки (обкладка). С02, диффундирующий в лист через устьица, попадает в цитоплазму клеток мезофилла, где при участии ФЕП-карбокси-лазы вступает в реакцию с ФЕП, образуя щавелевоуксусную кислоту (оксалоацетат). Затем уже в хлоропластах оксалоацетат восстанавливается до яблочной кислоты (малата) за счет NADPH, образующего в ходе световой фазы фотосинтеза.

Щавелевоуксусная кислота в присутствии NH4+ может превращаться также в аспартат. Затем малат (или аспартат) переносится в хлоропласты клетки обкладки сосудистого пучка, где он декарбоксилируется малик-энзимом (малатдегидрогеназой декарбоксилирующей) до пирувата и С02.
Как уже отмечалось, в хлоропластах обкладки отсутствуют граны, а следовательно, слабо представлена ФС II, необходимая для нециклического транспорта электронов, однако в них в изобилии накапливается крахмал. Объясняется это тем, что в хлоропластах обкладки используется поставляемый малик-энзимом НAДФH, а также тот С02, который образовался при окислительном декарбоксилировании малата (или аспартата). В этих хлоропластах в процессе циклического фотофосфорилирования синтезируется большое количество АТР и фиксация С02 осуществляется по типу цикла Кальвина. У некоторых растений с С4-путем фотосинтеза (амарант, лебеда) яблочная кислота декарбоксилируется в митохондриях клеток обкладки с восстановлением NAD.
Возникающий при расщеплении малата в хлоропластах клеток обкладки пируват перемещается назад в хлоропласты клеток мезофилла, где может снова превращаться в первичный акцептор С02 — ФЕП. Такая компартментация процессов позволяет растениям с С4-путем осуществлять фотосинтез даже при закрытых устьицах, так как хлоропласты клеток обкладки используют малат (аспартат), образовавшийся ранее, как донор С02. С4-растения могут также использовать С02, возникающий при фотодыхании. Закрывание устьичных отверстий в наиболее жаркое время дня сокращает потери воды за счет испарения (транспирации). Не удивительно поэтому, что к С4-растениям относятся многие виды засушливой тропической зоны. Растения с С4-путем фотосинтеза, как правило, устойчивы к засолению. Эффективность использования воды, т. е. отношение массы ассимилированного С02 к массе воды, израсходованной при транспирации, у С4-растений зачастую вдвое выше, чем у С3-растений. Таким образом, С4-растения имеют преимущества перед С3-растениями в засушливых местах обитания благодаря высокой интенсивности фотосинтеза даже при закрытых устьицах. Фиксация С02 с участием ФЕП и образование малата (аспартата) служит как бы насосом для поставки С02 в хлоропласты обкладки, функционирующие по С3-пути.
6.3 САМ-тип метаболизма. Потоки метаболитов в хлоропласт и из него
Суккуленты (роды Crassula, Bryophyllumи др.) также приспособились осуществлять фотосинтез в условиях резко засушливого климата. Для них характерен суточный цикл метаболизма С4-кислот с образованием яблочной кислоты ночью. В соответствии с английским выражением CrassulaceanAcidMetabolism (САМ) этот тип фотосинтеза часто сокращенно называют САМ-метаболизм. Устьица этих растений днем обычно закрыты, что предотвращает потерю воды, и открываются ночью. С02 поступает в листья, где при участии содержащейся в цитоплазме ФЕП-карбоксилазы взаимодействует с фосфоенолпируватом, образуя оксалоацетат. Источник ФЕП-карбоксилазы взаимодействует с фосфоенолпируватом, образуя оксалоацетат. Источником ФЕП служит крахмал. То же самое происходит и с С02, который освобождается в клетках в процессе дыхания. Образовавшийся оксалоацетат восстанавливается под действием NADH-зависимой малатдегидрогеназы до яблочной кислоты, которая накапливается в вакуолях клеток листа.

Это приводит к закислению клеточного сока в ночное время. Как и у С4-растений, оксалоацетат может быть источником аспартата, однако этот путь здесь менее выражен.
Днем в условиях высокой температуры, когда устьица закрыты, малат транспортируется из вакуолей в цитоплазму и там декарбоксилируется при участии малатдегидрогеназы декарбоксилирующей (малик-энзима) с образованием С02 и пирувата. С02 поступает в хлоропласты и включается в них в цикл Кальвина, участвуя в синтезе сахаров.
Таким образом, у растений с фотосинтезом по типу толстянковых много общего с С4-путем фотосинтеза. Однако при САМ-метаболизме фиксация С02 с образованием малата (ночью) и декарбоксилирование малата с высвобождением С02 и пирувата (днем) разделены во времени. У С4-растений эти же реакции разграничены в пространстве: первая протекает в хлоропластах мезофилла, вторая — в клетках обкладки. При достаточном количестве воды ряд растений с метаболизмом по типу толстянковых могут вести себя как С3-растения. В свою очередь некоторые растения с С3-путем фотосинтеза при недостатке воды проявляют черты САМ-метаболизма.
7 Фотодыхание, его значение. Сравнение фотодыхания у растений с различными типами метаболизма углерода
В растительных клетках, содержащих хлоропласты, помимо С3- и С4-путей фотосинтеза, осуществляется также фотодыхание, т. е. активируемый светом процесс высвобождения С02 и поглощения 02, который значительно, отличается от «темнового» дыхания митохондрий. Так как при этом первичным продуктом является гликолевая кислота, то этот путь получил название гликолатного. У некоторых С3-растений с малой эффективностью фотосинтеза интенсивность фотодыхания может достигать 50% от интенсивности фотосинтеза.
Фотодыхание у С3-растений обычно усиливается при низком содержании С02 и высоких концентрациях 02. В этих условиях РДФ-карбоксилаза в хлоропластах может функционировать как оксигеназа, катализируя окислительное расщепление рибулозо-1,5-дифосфата на 3-ФГК и 2-фосфогликолевую кислоту, которая затем дефосфорилируется в гликолевую кислоту (рис. 7.1). Молекулы С02 и 02 конкурируют между собой в каталитическом центре РДФ-карбоксилазы: при относительно высоких концентрациях С02 и низких 02 преобладает карбоксилирование, тогда как высокие концентрации 02 и низкое содержание С02 благоприятствуют окислению, а следовательно, и образованию фосфогликолевой кислоты. В том же направлении действует и повышение температуры.
Фотодыхание осуществляется в результате взаимодействия трех органелл — хлоропластов, пероксисом и митохондрий (рис. 7.1). Гликолат из хлоропласта поступает в пероксисому и там окисляется гликолатоксидазой до глиоксилата. Возникающая перекись водорода устраняется каталазой пероксисомы. Глиоксилат аминируется, превращаясь в глицин, причем в качестве донора аминогруппы функционирует глутамат.
Глицин транспортируется в митохондрию. Здесь из двух молекул глицина образуется серин и освобождается С02. Теперь цикл замыкается: серин может снова поступать в пероксисому и там передать свою аминогруппу на пируват. При этом из пирувата возникает аланин, из серина — гидроксипируват, который сразу после этого восстанавливается в глицерат. Затем глицерат может снова попасть в хлоропласты и благодаря фосфорилированию включиться в цикл Кальвина.
Последовательность реакций фотодыхания не обязательно образует цикл. Гликолатный путь С3-растений может завершиться в митохондриях. Конечными продуктами в этом случае является серин и С02. Освобождение С02 объясняет почему нетто-фотосинтез (чистая продуктивность) при интенсивном фотодыхании снижается (рис. 7.1).
У С4-растений С02, выделяющийся в результате фотодыхания, перехватывается в клетках мезофилла, где из ФЕП и С02 образуются оксалоацетат и малат. Затем малат «отдает» свой С02 хлоропластам обкладки, где функционирует цикл Кальвина. В связи с этим становится понятным высокий нетто-фотосинтез С4-растений.
Однако для чего же тогда нужно фотодыхание? Необходимо вспомнить, что гликолатный путь приводит к синтезу глицина и серина, в пероксисомах происходит восстановление NADP+; имеются косвенные данные о том, что в процессе образования серина может генерироваться и АТР. Показано, что С3-растения, помещенные в атмосферу с низким парциальным давлением 02 и высокой концентрацией С02, ведут себя подобно С4-растениям, т. е. имеют низкий уровень фотодыхания.
Из всего сказанного можно сделать вывод, что термин фотодыхание имеет лишь формальный смысл: 02 потребляется, С02 выделяется, однако в функциональном плане к дыханию этот процесс прямого отношения не имеет.

Рис. 7.1
8 Эндогенные механизмы регуляции процесса фотосинтеза
Регуляция фотосинтеза осуществляется на уровне фотохимически активных мембран, хлоропластов, клеток, тканей, органов и целого организма. Все системы регуляции принимают участие в этом процессе.
Процессы в хлоропластах при переходе к фотосинтезу. При освещении листьев хлоропласты уже через несколько минут начинают уменьшаться в объеме, становясь более плоскими (дисковидными). Тилакоиды и граны сдвигаются и уплотняются. Фотоиндуцируемое сокращение хлоропластов объясняется возникновением трансмембранных протонных градиентов и изменением электрического потенциала мембран хлоропластов. Определенная степень сжатия хлоропласта необходима для эффективной работы электронтранспортной цепи и для ее сопряжения с образованием АТР. Транспорт протонов внутрь тилакоидов приводит к подкислению их внутренней полости до рН 5,0—5,5 и одновременному подщелачиванию стромы хлоропласта от рН 7,0 в темноте и до рН 8,0 на свету. Вход ионов Н+ в тилакоиды сопровождается выходом из них в строму ионов Mg2 + .
Появление NADPH, ATP, 02, Mg2+ и изменение рН оказывают прямое и опосредованное влияние на реакции фотосинтетического усвоения С02 в строме. Экспериментально показано, что фиксация С02 изолированными хлоропластами практически не обнаруживается при рН ниже 7,2, но достигает максимальных значений при рН 8,0. Причина этого заключается в изменении активности ряда ферментов, имеющих оптимум рН в слабощелочной среде: рибулозофосфаткиназы (рН 7,9), дегидрогеназы фосфоглицеринового альдегида (рН 7,8), рибулозо-1,5-дифосфаткарбоксилазы (рН от 7,5 до 8,0), фруктозодифосфатазы (рН 7,5 — 8,5). Повышение рН стромы при освещении хлоропласта приводит к значительному связыванию С02 в виде Н2С03 и накоплению НСОз, из которого С02 освобождается с помощью карбоангидразы перед карбоксилированием рибулозо-1,5-дифосфата.
АТР участвует в фосфорилировании рибулозо-5-фосфата и ФГК, а также в реакциях, связанных с синтезом сахарозы и крахмала. NADPH необходим для восстановления ФГК до ФГА и для образования малата из щавелевоуксусной кислоты. Mg2+ нужен для функциональной активности РДФ-карбоксилазы, он также принимает участие в синтезе хлорофилла и белков.
Процесс фиксации С02 регулируется прежде всего светом.
Он активирует ряд ферментов цикла Кальвина: РДФ-карбоксилазу, дегидрогеназу 1,3-дифосфоглицериновой кислоты, фруктозо-1,6-дифосфатфосфатазу, седогептулозо-1,7-дифосфатфосфатазу и рибулозо-5-фосфаткиназу. Наиболее многообразна регуляция функционирования ключевого фермента цикла Кальвина — РДФ-карбоксилазы.

Помимо света, фермент активируется фруктозо-6-фосфатом, а ингибируется 6-фосфоглюконатом и фруктозо-1,6-дифосфатом. 6-Фосфоглюко-нат подавляет также активность завершающего цикл фермента — рибулозо-5-фосфаткиназы. Наконец, продукт цикла фиксации С02 — 3-фосфоглицериновая кислота положительно влияет на синтез крахмала. Повышение концентрации 02 в строме может привести к снижению интенсивности фиксации С02 за счет усиления фотодыхания.
Функциональные изменения в клетках мезофилла. Хлоропласты большинства растений способны перемещаться в клетке в зависимости от интенсивности и направления освещения. Сильный свет вызывает отрицательный фототаксис хлоропластов: они уходят от света, концентрируясь на боковых стенках клеток палисадной паренхимы; слабый свет вызывает положительный фототаксис. Предполагают, что освещенный хлоропласт меняет свое положение в клетке с помощью сократительных белков, связанных с оболочкой хлоропласта и взаимодействующих с сократительными белками цитоплазмы.
Мощное воздействие на клетку, определяющее ее метаболизм, оказывают образующиеся в хлоропластах ATP, NADPH и ассимиляты. При освещении отношение ATP/ADP в хлоропластах резко возрастает и вследствие быстрого обмена энергетическими эквивалентами почти тотчас же может воспроизводиться в цитоплазме, а через нее и в митохондриях. Так как оболочка хлоропласта лишь в слабой степени проницаема для АТР, перенос в цитоплазму высокоэнергетической фосфатной связи АТР осуществляется с помощью челночного механизма в результате реакции восстановления-окисления между ФГК и ФДА, так как скорость выхода триозофосфатов через мембраны оболочки хлоропласта приближается к скорости свободной диффузии. Одновременно это приводит к транспорту восстановительных эквивалентов (NADH).

Переносчиком высокого восстановительного потенциала NADPH может служить система ЩУК-малат, каждый компонент которой легко проходит через мембраны, совершая циклические перемещения между хлоропластом и цитоплазмой. В пользу этой гипотезы говорит то, что в хлоропластах находятся NAD + - и NADP + -зависимые малатдегидрогеназы.
Появление АТР и восстановительных эквивалентов в цитоплазме приводит к активации на свету таких энергопотребляющих процессов, как синтез жирных кислот, восстановление нитратов и сульфатов. Общеклеточные нужды могут даже «отзывать» АТР с пути восстановления С02, конкурируя с реакциями цикла Кальвина.
Уже в первые секунды фотосинтеза происходит выход ассимилятов в цитоплазму. После кратковременного фотосинтеза с 14С02 в цитоплазме прежде всего появляются меченые фосфотриозы — ФГК и ФДА, а затем [14С] фруктозо-1,6-дифосфат. На изолированных хлоропластах показано, что оболочка хлоропласта практически непроницаема для сахарозы. По-видимому, основным местом синтеза сахарозы в клетке является не хлоропласт, а цитоплазма. На это указывает также присутствие основного сахарозосинтезирующего фермента сахарозофосфатсинтетазы и UDP-глюкозопирофосфорилазы преимущественно в цитоплазме.
Выход предшественников углеводов из хлоропластов в цитоплазму совершается в виде ФГК, ФГА и ФДА. Дальнейшие превращения, ведущие к синтезу гексозофосфатов и сахарозы, происходят уже в цитоплазме. Аналогичным превращениям могут подвергаться триозофосфаты и в хлоропластах, вследствие чего при достаточно интенсивном фотосинтезе в хлоропластах накапливается крахмал, служащий резервом углеводов, предназначенных для экспорта в цитоплазму во вторую очередь. Отложения крахмала часто бывают очень значительными (до 90% от объема хлоропласта).
Выходящие из хлоропластов ассимиляты могут использоваться в самой фотосинтезирующей клетке двумя путями: 1) в окислительно-восстановительных процессах, что обычно заканчивается освобождением С02, 2) для увеличения массы клетки в процессе ее роста и отложения запасных и вторичных веществ. Большая часть ассимилятов транспортируется из фотосинтезирующих клеток листа в другие органы и ткани.
Взаимодействие тканей листа при фотосинтезе. Под действием света изменения происходят не только в клетках мезофилла. Свет выступает одним из важнейших факторов регуляции работы устьиц. При включении света у большинства растений устьица открываются более широко, а при выключении — закрываются. Исключение из правила — растения семейства толстянковых, у которых ночью устьица открыты, а днем закрыты. На движения устьиц влияет и концентрация С02: ширина устьичных щелей увеличивается при снижении содержания С02 в межклетниках. Открывание устьиц под действием света связано с работой фотосинтетического аппарата в замыкающих клетках. У этиолированных растений свет не влияет на движения устьиц. В замыкающих клетках на свету включается механизм Н +-насоса в плазмалемме, усиливается поглощение К+ и синтез малата, в результате чего возрастает внутриклеточное осмотическое давление и устьица открываются.
Увеличение степени открывания устьиц приводит к усилению транспирации и, следовательно, к более интенсивному поступлению воды и веществ по ксилеме из корней в листья, что необходимо для нормальной функциональной активности клеток мезофилла.
Фотосинтетическая деятельность клеток мезофилла обогащает ткани листа сахарами и другими продуктами фотосинтеза. В результате возрастает функциональная активность проводящих пучков. Теоретически существуют два способа транспорта ассимилятов к проводящим пучкам: по симпласту (через плазмодесмы и цитоплазму последовательного ряда клеток) и по апопласту (по клеточным стенкам). Однако у многих видов растений между клетками мезофилла и флоэмы плазмодесмы развиты крайне слабо или совсем отсутствуют. В апопласте листовой пластинки может находиться около 1/5 сахаров, содержащихся в листе, и значительная доля свободных аминокислот. Клетки листовой паренхимы сравнительно легко выделяют ассимиляты в наружную среду и относительно слабо их поглощают. Клетки флоэмных окончаний, напротив, способны усиленно поглощать из внешних растворов сахара и аминокислоты против концентрационного градиента с помощью энергозависимых переносчиков. Есть основание считать, что, выходя из паренхимных клеток листа в клеточные стенки, сахароза расщепляется находящейся там инвертазой на гексозы (фруктозу и глюкозу), которые в проводящих пучках вновь образуют сахарозу.
Флоэмные окончания выполняют в листе роль коллекторов, аккумулирующих ассимиляты против градиента концентрации. Ведущая роль в загрузке проводящих элементов ассимилятами принадлежит сопровождающим и паренхимным клеткам флоэмы, а у некоторых видов растений и более специализированным передаточным клеткам. Есть данные о том, что клетки флоэмных окончаний поглощают сахара с участием ионов Н +, которые выкачиваются из клеток благодаря работе энергозависимого Н +-насоса.
При перегрузке тканей листа ассимилятами интенсивность фотосинтеза снижается. Переполнение крахмалом пластид вызывает обратимые, а позднее и необратимые изменения структуры хлоропластов, что значительно ослабляет фотосинтез. Отрицательное действие избытка крахмала на фотосинтез в пластидах может быть объяснено: 1) механическим воздействием на тилакоиды, 2) ухудшением светового режима в хлоропласте, 3) сорбцией ферментов на зернах крахмала, 4) сорбцией ионов, особенно Mg2 + , необходимых для поддержания высокой активности ферментов, 5) ухудшением диффузии С02.
Регуляция процессов фотосинтеза в целом растении.
Реализация фотосинтетической функции в целом растении, с одной стороны, определяется значительной генетической и биохимической автономностью структур низших порядков (хлоропласт, клетка), а с другой — сложной системой интеграции и кооперативных связей фотосинтеза со всеми функциями растительного организма. Процессы онтогенеза обеспечивают постоянное существование в растительном организме так называемых аттрагирующих (притягивающих питательные вещества) зон. В аттрагирующих центрах происходит либо новообразование и рост структур, либо интенсивный однонаправленный синтез запасных веществ (плоды, клубни, луковицы). В обоих случаях состояние аттрагирующих центров определяет величину «запроса» на фотосинтез. Донор ассимилятов (фотосинтез) и их акцептор (процессы роста и отложения веществ в запас) представляют собой взаимосвязанную систему. Если внешние условия не лимитируют фотосинтез, то ведущая роль в его детерминации принадлежит именно эпигенетическим процессам (появлению и развитию новых органов). Это положение может быть проиллюстрировано многочисленными фактами. Так, удаление молодых початков у кукурузы, плодов у томатов, баклажанов или яблони вызывает значительное и устойчивое снижение фотосинтетической активности листьев. Удаление части листьев растения при сохранении прежней активности аттрагирующих центров обычно сопровождается увеличением фотосинтетической активности оставшихся листьев.
Механизм этих взаимоотношений основан на явлении метаболической репрессии фотосинтеза. Чем мощнее центры, аттрагирующие ассимиляты, тем эффективнее фотосинтезирующий лист освобождается от ассимилятов, что служит необходимым условием интенсивного фотосинтеза.
Во всех этих процессах важнейшую роль играют фитогормоны и эндогенные ингибиторы роста и метаболизма (некоторые полифенолы). Участие фитогормонов в процессах фотосинтеза можно представить в виде следующей схемы, предложенной А. Т. Мокроносовым (1983):

Согласно этой схеме, фитогормоны образуются в разных частях растений, в том числе в хлоропластах, и действуют на процессы фотосинтеза как дистанционно, так и непосредственно на уровне хлоропластов. Дистанционное действие осуществляется благодаря регулирующему влиянию фитогормонов на процессы роста и развития (эпигенез), на отложение веществ в запас, на транспорт ассимилятов, т. е. на формирование и активность аттрагирующих центров. С другой стороны фитогормоны оказывают прямое действие на функциональную активность хлоропластов через изменение состояния мембран, активность ферментов, генерацию трансмембранного потенциала. Доказана также роль фитогормонов, в частности цитокинина, в биогенезе хлоропластов, синтезе хлорофилла и ферментов цикла Кальвина.
Ряд фитогормонов (индолилуксусная кислота, гиббереллины, абсцизовая кислота), а также некоторые физиологически активные фенолы образуются в тканях листа. Цитокинин же, от которого во многом зависит формирование листа и его структур, поступает из других частей растения, прежде всего из корня. Такая система создает взаимозависимость всех органов, обеспечивая регуляцию функциональной активности в целом растении.
9 Зависимость процесса фотосинтеза от факторов внешней среды
При оценке действия внешних факторов необходимо различать два уровня. Первый их них генетический, который определяется влиянием факторов на генетический аппарат и экспрессию генов. Второй уровень обусловлен прямым действием внешних факторов на отдельные реакции фотосинтеза. Ответная реакция организма на изменение внешних факторов может быть быстрой, когда определяется непосредственно их воздействие на фотосинтетический аппарат, и более медленной, когда в новых условиях происходит формирование структур. Действие экзогенных факторов взаимосвязано и взаимообусловлено и реализуется через конкретные механизмы, сопряженные со всем комплексом физических, фотохимических и энзиматических реакций фотосинтеза. Познание этих механизмов необходимо для глубокого понимания основных закономерностей и оптимальных условий функционирования фотосинтетического аппарата как целостной системы.
Рассмотрим отдельно влияние на фотосинтез основных факторов внешней среды, хотя в природе они действуют на растение одновременно, и продуктивность растения является интегральной функцией совместного действия ряда экологических факторов.
Влияние интенсивности и спектрального состава света на фотосинтез
Интенсивность света и фотосинтез. Зависимость фотосинтеза о т л у ч и с т о й энергии является наиболее очевидной и существенной. Уже в ранних работах К.А.Тимирязева и других исследователей установлено отсутствие линейной зависимости между активностью процесса фотосинтеза и напряженностью действующего фактора. Зависимость активности фотосинтеза от интенсивности света — световая кривая фотосинтеза — имеет форму логарифмической кривой. Прямая зависимость скорости процесса от притока энергии имеет место только при низких интенсивностях света. В области насыщающих интенсивностей света дальнейшее увеличение освещенности не увеличивает скорость фотосинтеза.
Эти данные послужили основанием для представлений о включении в процесс фотосинтеза наряду с фотохимическими, световыми реакциями также темновых, энзиматических реакций, ограничивающее действие которых начинает проявляться особенно заметно при высоких, насьпдающих интенсивностях света. Результаты опытов А. А. Рихтера и Р. Эмерсона с прерывистым светом позволили оценить скорость световых и темновых реакций фотосинтеза: соответственно 10-5 и 10-2 с. Эти значения были полностью подтверждены в лаборатории Х.Витта (Witt, 1966) с использованием высокочувствительных методов импульсной спектрофотометрии.
При проведении физиологических исследований анализ световой кривой фотосинтеза дает информацию о характере работы фотохимических систем и ферментативного аппарата. Угол наклона кривой характеризует скорость фотохимических реакций: чем он больше, тем активнее система использует энергию света. По углу наклона линейного участка можно вести приближенные расчеты расхода квантов на восстановление моля С02. Скорость фотосинтеза в области насыщающей интенсивности света характеризует мощность систем поглощения и восстановления С02 и в значительной мере определяется концентрацией углекислоты в среде. Чем выше расположена кривая в области насыщающих интенсивностей света, тем более мощным аппаратом поглощения и восстановления углекислоты обладает система.
Минимальная интенсивность света, при которой возможен фотосинтез, различна у разных групп растений. Определенное практическое значение имеет световой компенсационный пункт (СКП) — уровень освещения, когда интенсивности газообмена в процессах фотосинтеза и дыхания равны. Только при интенсивности света свыше СКП устанавливается положительный баланс углерода. Положение светового компенсационного пункта определяется генотипом растения и зависит от соотношения фотосинтеза и темнового дыхания. Любое усиление темнового дыхания, например при повышении температуры, увеличивает значение СКП. У С4-растений световой компенсационный пункт расположен выше, чем у С3-растений, у теневыносливых растений он ниже, чем у светолюбивых.
Повышение интенсивности света до определенного уровня действует в первую очередь на фотохимические реакции хлоропластов. При освещении сначала включается нециклический транспорт электронов. По мере увеличения скорости электронного потока и насыщения электронных пулов часть электронов переключается на образование циклических потоков. Переключение связано с восстановлением переносчиков, занимающих ключевое положение в ЭТЦ (к ним относятся пул пластохинонов, ферредоксин), и изменением конформации редокс-агентов. В условиях избыточной освещенности циклический транспорт электронов может играть защититную роль в хлоропластах, а также служить источником энергии для дополнительного синтеза АТФ и таким образом способствовать активации процессов ассимиляции углерода в хлоропластах и адаптационных процессов в растении.
При увеличении интенсивности светового потока и скорости транспорта электронов возрастает активность фотовосстановления НАДФ+ и синтеза АТФ. Скорость образования восстановленных коферментов активируется в большей степени, чем синтез АТФ, что приводит к некоторому снижению отношения АТФ/НАДФН при увеличении интенсивности света. Изменение соотношения энергетического и восстановительного потенциалов является одним из факторов, определяющих зависимость от интенсивности освещения характера метаболизма углерода и соотношение продуктов фотосинтеза. При низком уровне освещения (около 2000 люкс) образуются главным образом вещества неуглеводной природы (аминокислоты, органические кислоты), при высокой интенсивности света главную часть конечных продуктов фотосинтеза составляют углеводы (сахароза и др.). Интенсивность освещения определяет характер формирующихся фотосинтезируюших структур. В условиях интенсивного освещения формируется большое число более мелких фотосинтетических единиц что характерно для высокоактивных систем, увеличивается отношение хлорофиллов а/b.
С3- и С4-группы растений существенно различаются по зависимости процесса фотосинтеза от интенсивности света. Сравнение хода кривых показывает, что высокий уровень фотосинтеза, свойственный С4-растениям, проявляется главным образом при высоких уровнях освещенности.
Спектральный состав света. Помимо интенсивности существенное значение для фотосинтеза имеет спектральный состав света. Основные закономерности действия на фотосинтез лучей разных длин волн были установлены К. А. Тимирязевым. Дальнейшие исследования показали, что интенсивность фотосинтеза в участках спектра, выровненных по количеству энергии, различна: наиболее высокая интенсивность фотосинтеза отмечена в красных лучах (O.Warburg, Е.Negelein, 1923; Е.Gabrielsen, 1935, и др.).
Спектр действия фотосинтеза (кривая его зависимости от длины волны падающего света) при выровненном числе квантов имеет два четко выраженных максимума — в красной и синей части спектра, аналогичных максимумам поглощения хлорофилла. Следовательно, красные и синие лучи наиболее эффективны в фотосинтезе. Анализ кривой квантового выхода фотосинтеза в зависимости от длины волны показывает, что он имеет близкие значения в диапазоне длин волн 580 — 680 нм (около 0,11). В сине-фиолетовой части спектра (400 — 490 нм), поглощаемой наряду с хлорофиллами также и каротиноидами, квантовый выход снижается (до 0,06), что связывают с менее продуктивным использованием энергии, поглощаемой каротиноидами. В дальней красной области спектра (более 680 нм) наблюдается резкое снижение квантового выхода. Явление «красного падения» фотосинтеза и последующие опыты Р. Эмерсона, показавшие усиление фотосинтеза при дополнительном освещении коротковолновым светом («эффект усиления»), привели к одному из фундаментальных положений современного фотосинтеза о последовательном функционировании двух фотосистем.
Качество света, как показали многолетние исследования Н.П.Воскресенской (1965—1989), оказывает сложное и разностороннее влияние на фотосинтез. Синий свет по сравнению с красным (выравненный по числу квантов) оказывает специфическое действие на фотосинтетический аппарат растений. На синем свету более активна общая ассимиляция С02, что обусловлено активирующим действием синего света на процессы электронного транспорта и на реакции углеродного цикла. В системе, где донором электронов служила вода, синий свет повышал активность фотовосстановления НАДФ+ почти в два раза по сравнению с активностью этой реакции у растений на красном свету. Спектральный состав света определяет состав продуктов, синтезируемых при фотосинтезе: на синем свету преимущественно синтезируются органические кислоты и аминокислоты, а позднее — белки, тогда как красный свет индуцировал синтез растворимых углеводов, а со временем — крахмала. Отмечено регулирующее действие синего света на активность ферментов фотосинтетического превращения углерода. У растений, выращенных на синем свету, обнаружена более высокая активность РуБФ-карбоксилазы, глицеральдегидфосфатдегидрогеназы, гликолатоксидазы, глиоксилатаминотрансферазы. Отмеченные в работе изменения активности ферментов связаны с активирующим действием синего света на синтез белков denovo. Вопрос о природе фоторецепторов синего света остается неясным. В качестве возможных акцепторов предполагаются флавины, каротиноиды, фитохромная система.
Влияние концентрации углекислоты на фотосинтез
Углекислый газ воздуха является субстратом фотосинтеза. Доступность С02 и его концентрация определяют активность углеродного метаболизма растений. В воздухе концентрация С02 составляет 0,03 %. Вместе с тем установлено, что максимальная скорость фотосинтеза достигается при концентрации углекислого газа на порядок выше (около 0,3 — 0,5 %). Таким образом, концентрация С02 — один из ограничивающих факторов фотосинтеза. Лимитирующее действие концентрации углекислого газа особенно проявляется при высоких интенсивностях света, когда фотохимические реакции производят максимально возможное количество НАДФН и АТФ, необходимых для метаболизма углерода в растении.
Как видно из рис, зависимость интенсивности фотосинтеза от концентрации С02 имеет логарифмический характер. Увеличение концентрации С02 приводит к быстрому увеличению интенсивности фотосинтеза. При концентрации С02 0,06—0,15 % у большинства растений достигается насыщение фотосинтеза. Увеличение интенсивности фотосинтеза при повышении концентрации С02 обусловлено реализацией в этих условиях потенциальной карбоксилазной активности Рубиско и созданием в хлоропластах большого пула акцептора С02 — рибулозобисфосфата.
Увеличение концентрации С02 одновременно с повышением интенсивности света приводит к сдвигу насыщающей концентрации С02 в область еще больших концентраций (вплоть до 0,5%) и к значительному увеличению ассимиляции углерода растениями. Однако длительное выдерживание растений при высоких концентрациях углекислого газа может привести к «перекорму» растений и ингибированию фотосинтеза.
Концентрация углекислоты, при которой поглощение углекислого газа при фотосинтезе уравновешивает выделение его в ходе дыхания (темнового и светового), называется углекислотным компенсационным пунктом (УКП). У разных видов растений положение УКП может существенно различаться. Особенно выражены различия между С3- и С4-растениями. Так, у С3-растений УКП находится при довольно высоких концентрациях С02 (около 0,005 %), что связано с наличием активного фотодыхания у этой группы растений. С4-растения, обладающие способностью фиксировать С02 через фермент ФЕП-карбоксилазу, производят рефиксацию углекислого газа при слабом фотодыхании. Поэтому у С4-растений УКП приближается к нулевой концентрации С02 (ниже 0,0005 % С02). При увеличении концентрации С02 выше компенсационного пункта интенсивность фотосинтеза быстро возрастает.
В естественных условиях концентрация С02 довольно низка (0,03 %, или 300 мкл/л), поэтому диффузия С02 из атмосферы во внутренние воздушные полости листа очень затруднена. В этих условиях низких концентраций углекислоты существенная роль в процессе ее ассимиляции при фотосинтезе принадлежит ферменту карбоангидразе, значительная активность которой обнаружена у С3-растений. Карбоангидраза способствует повышению концентрации С02 в хлоропластах, что обеспечивает более активную работу РуБФ-карбоксилазы.
Карбоксилирующий потенциал РуБФ-карбоксилазы существенно изменяется в зависимости от концентрации С02. Как правило, максимальная активность РуБФ-карбоксилазы достигается при концентрациях С02, значительно превышающих содержание ее в атмосфере. Анализ кинетики фотосинтеза в листьях в зависимости от концентрации С02 показал, что при одних и тех же концентрациях углекислоты активность РуБФ-карбоксилазы значительно выше, чем интенсивность фотосинтеза. Это обусловлено лимитирующим действием на фотосинтез ряда факторов: сопротивления диффузии С02 через устьица и водную фазу, активности фотодыхания и фотохимических процессов. У С4-растений ФЕП-карбоксилаза, использующая в качестве субстрата HCO3-, при насыщающих концентрациях субстратов (HCO3-, ФЕП) характеризуется высокими значениями vmax, достигающими 800— 1200 мкмоль.мг Хл-1ч-1, что значительно превышает скорость фотосинтеза в листьях (Дж. Эдварде, Д.Уокер, 1986).
Низкая концентрация углекислоты в атмосфере часто является фактором, ограничивающим фотосинтез, особенно при высокой температуре и в условиях водного дефицита, когда уменьшается растворимость С02 и возрастает устьичное сопротивление
(P.Gaastra, 1959). Повышение концентрации С02 от 0,03 до 0,1 —0,5 % приводит обычно к резкому увеличению интенсивности фотосинтеза (в 3 — 5 раз). Однако при длительном воздействии на
растение высоких концентраций С02 после временной активации фотосинтеза наступает его торможение вследствие разбаланса донорно-акцепторных систем. Происходящие вслед за этим морфо-генетические изменения, связанные с активирующим действием С02 на ростовые процессы, восстанавливают функциональные донорно-акцепторные взаимодействия. С02 оказывает регуляторное действие на ростовую функцию. Выдерживание растений при высоких концентрациях С02 сопровождается увеличением площади листьев, стимуляцией роста побегов 2-го порядка, возрастанием доли корней и запасающих органов, усилением клубнеобразования. Прирост биомассы при подкормке С02 происходит адекватно приросту площади листьев. В результате повышение концентрации С02 в атмосфере приводит к увеличению биомассы растения. Известным приемом повышения интенсивности и продуктивности фотосинтеза служит увеличение концентрации С02 в теплицах. Этот метод позволяет повысить прирост сухого вещества более чем в 2 раза.
Изменение содержания углекислоты влияет на состав конечных продуктов фотосинтеза. При высокой концентрации 14С02 меченый углерод включается преимущественно в сахара, при низкой — в аминокислоты (серии, глицин).
Следует отметить также регуляторное действие углекислоты на первичные процессы фотосинтеза. Работами последних лет показано, что С02 регулирует скорость транспорта электронов на уровне фотосистемы II. Центры связывания углекислоты находятся на белке D1 вблизи QB. Следовые количества С02, связанные в этих центрах, изменяя конформацию белка, обеспечивают высокую активность электронного транспорта в ЭТЦ на участке между ФС II и ФСI.
Структурная организация листа, свойства его поверхности, число и степень открытости устьиц, а также градиент концентрации углекислого газа определяют возможность поступления углекислого газа к карбоксилирующим ферментам. Основными параметрами, определяющими диффузию углекислого газа к хлоропластам, являются сопротивление пограничной поверхности листа, устьиц и клеток мезофилла. Сопротивление пограничных поверхностей прямо пропорционально площади поверхности листа и обратно пропорционально скорости ветра. Вклад сопротивления пограничных поверхностей относительно невелик (около 8 — 9 % от общего сопротивления листа диффузии С02). Сопротивление устьиц примерно в 10 раз больше, чем сопротивление пограничных поверхностей. Оно прямо пропорционально глубине устьиц и обратно пропорционально числу устьиц и размеру устьичных щелей. Все факторы, способствующие открыванию устьиц, будут снижать устьичное сопротивление. При расчете сопротивления устьиц учитывается также коэффициент диффузии С02. Его увеличение приводит к снижению сопротивления устьиц. Сопротивление мезофилла определяется диффузионными процессами, связанными с концентрационными градиентами углекислоты в отдельных структурах листа, сопротивлением клеточных стенок, скоростью движения цитоплазмы, активностью и кинетическими характеристиками карбоксилирующих ферментов и др.
Влияние кислорода на процесс фотосинтеза
Зависимость фотосинтеза от концентрации кислорода в среде довольно сложна. Как правило, процесс фотосинтеза высших растений осуществляется в аэробных условиях при концентрации кислорода около 21 %. Исследования показали, что как увеличение концентрации кислорода, так и отсутствие его неблагоприятны для фотосинтеза.
Действие кислорода зависит от его концентрации, вида и физиологического состояния растения, других условий внешней среды.Обычная концентрация кислорода в атмосфере (21 %) не является оптимальной, а значительно превышает последнюю. Поэтому снижение парциального давления кислорода до 3 % практически не сказывается отрицательно на фотосинтезе, а в ряде случаев может даже активировать его. У растений различных видов снижение концентрации кислорода вызывает неодинаковый эффект. Так, по данным А.А Ничипоровича (1973), уменьшение концентрации кислорода от 21 до 3 % сказывалось благоприятно на растениях с активным фотодыханием (бобы). Для кукурузы, у которой фотодыхание почти отсутствует, не отмечено изменений в интенсивности фотосинтеза при переходе от 21 до 3 % 02.
Неоднозначное и часто противоположное влияние разных концентраций кислорода на фотосинтез обусловлено тем, что конечный эффект зависит от направленности действия нескольких механизмов. Известно, что присутствие кислорода необходимо для
нормального функционирования электрон-транспортной цепи. Ряд
компонентов ЭТЦ (ферредоксин, хиноны) могут взаимодействовать с 02, регулируя таким образом редокс-состояние цепи. При активном потоке электронов влияние кислорода положительно, так как «разгружает» цепь. Этот механизм имеет положительное значение также в том случае, когда нарушена регенерация НАДФ+. Возможность сброса электронов на 02 обеспечивает функционирование ЭТЦ и запасание энергии в реакциях псевдоциклического фотофосфорилирования. Вместе с тем сброс электронов ЭТЦ на кислород приводит к образованию активных форм кислорода (АФК), которые могут вызывать нарушения фотосинтезирующих структур и ингибировать фотосинтез. При слабом электронном
потоке кислород, конкурируя за электроны, также снижает эффективность работы ЭТЦ.
Другим достаточно хорошо изученным механизмом действия кислорода на фотосинтез является его влияние на ключевой фермент фотосинтеза — РуБФ-карбоксилазу. Хорошо установлено ингибирующее действие высоких концентраций 02 на карбоксилазную функцию фермента и активирующее действие на его оксигеназную функцию (на скорость фотодыхания). В зависимости от концентрации С02 в среде ингибирующее действие высоких концентраций кислорода на фотосинтез может проявиться в большей или меньшей степени. Этот механизм лежит в основе явления, известного как «эффект Варбурга». В 1920 г. Варбург впервые обнаружил ингибирующее действие высоких концентраций кислорода на фотосинтез водоросли Chlorella. Эффект Варбурга отмечен для многих видов высших растений (O.Bjorkman, 1966), а также при исследовании фиксации С02 изолированными хлоропластами (R.Everson, M.Gibbs, 1967). Кислородное ингибирование фотосинтеза, по мнению многих исследователей, обусловлено двумя составляющими — прямым ингибированием РуБФ-карбоксилазы за счет высоких концентраций 02 и активацией процесса фотодыхания. При повышении концентрации С02 в атмосфере степень кислородного ингибирования фотосинтеза существенно снижается.
Эффект Варбурга проявляется не у всех растений, у ряда растений аридных пустынь обнаружен «антиэффект Варбурга» — подавление фотосинтеза низкими концентрациями кислорода (1 % О2) (А. Т. Мокроносов, 1981, 1983). Исследования показали, что положительное или отрицательное влияние 02 на фотосинтез зависит от соотношения в листе фототрофных и гетеротрофных тканей. У растений, где фототрофные ткани составляют большую часть объема листа, при низком содержании кислорода проявляется усиление фотосинтеза. У растений, содержащих большую долю гетеротрофных тканей, в этих условиях проявляется «антиэффект Варбурга» — подавление фотосинтеза в бескислородной среде. Это противоположное действие низких концентраций кислорода обусловлено сложным взаимодействием фотосинтеза, фотодыхания и темнового дыхания в клетках листа разного типа (фототрофных, гетеротрофных).
У С3-растений при естественном соотношении 02 и С02 (21 и 0,03 %) доля фотодыхания составляет 20 — 30% от скорости фотосинтетического карбоксилирования.
Влияние температуры на фотосинтез
Интегральный ответ фотосинтетического аппарата на изменения температуры, как правило, может быть представлен одновершинной кривой. Вершина кривой зависимости фотосинтеза от температуры находится в области оптимальных для фотосинтеза температур. У разных групп высших растений максимальная скорость фотосинтеза соответствует различным значениям температур, что определяется адаптацией фотосинтетического аппарата к различным пределам температур. Так, для большинства С3-растений умеренной зоны произрастания оптимальная для фотосинтеза температура находится в интервале 20—25 °С. У растений с С4-путем фотосинтеза и с САМ-фотосинтезом температурный оптимум приходится на 30—35°С. Для одного и того же вида растения температурный оптимум фотосинтеза непостоянен. Он зависит от возраста растения, адаптации к определенным условиям температур и может изменяться в течение сезона. К Нижний предел температур, при которых еще наблюдается фотосинтез, колеблется от -15 (сосна, ель) до +3 °С; у большинства высших растений фотосинтез прекращается приблизительно при 0о.
Анализ кривой зависимости фотосинтеза от температуры показывает быстрое возрастание скорости фотосинтеза при повышении температуры от минимальной к оптимальной (Q10 = 2). Дальнейшее повышение температуры сверхоптимальной ведет к быстрому ингибированию процесса. Верхний предел температуры для поглощения С02 для большинства С3-растений находится в области 40—50 °С, для С4-растений — при 50 —60 °С.
Зависимость фотосинтеза от температуры изучена на разных уровнях организации фотосинтезирующих систем. Наиболее термозависимыми в растении являются реакции углеродных циклов. Снижение интенсивности фотосинтеза в области сверхоптимальных температур объясняют снижением тургора в листьях и закрыванием устьиц в этих условиях, что затрудняет поступление углекислого газа к центрам его фиксации. Кроме того, при повышении температуры снижается растворимость С02, увеличивается отношение растворимостей 02/С02 и степень кислородного ингибирования, изменяются кинетические константы карбоксилирующих ферментов. Реакции транспорта электронов и синтеза АТФ, будучи по своей природе ферментативными процессами, также весьма чувствительны к температуре. Первичные же реакции фотосинтеза, связанные с поглощением света, миграцией энергии возбуждения и разделением зарядов в реакционных центрах, практически не зависят от температуры.
Влияние водного режима на фотосинтез
Значение водного режима для фотосинтеза определяется в первую очередь действием воды на состояние устьиц листа: до тех пор пока устьица остаются оптимально открытыми, интенсивность фотосинтеза не изменяется под влиянием колебаний водного баланса. Частичное или полное закрывание устьиц, вызванное дефицитом воды в растении, приводит к нарушению газообмена и снижению поступления углекислого газа к карбоксилирующим системам листа. Вместе с тем водный дефицит вызывает снижение активности ферментов ВПФ цикла, обеспечивающих регенерацию рибулозобисфосфата, и значительное ингибирование фотофосфорилирования. В результате в условиях водного дефицита наблюдается ингибирование фотосинтетической активности растений. Длительное действие дефицита воды может привести к снижению общей фотосинтетической продуктивности растений, в том числе и за счет уменьшения величины листьев, а значительное обезвоживание растений может в итоге вызвать нарушение структуры хлоропластов и полную потерю их фотосинтетической активности.
Различные стадии фотосинтеза в разной степени чувствительны к снижению содержания воды в тканях листа. Наиболее лабильны и быстрее всего ингибируются в условиях водного дефицита реакции фотофосфорилирования (при водном потенциале 11 бар), что обусловлено нарушением ультраструктуры сопрягающих мембран и разобщением транспорта электронов и фосфорилирования (R.Keck, Р. Воуеr, 1974). Транспорт электронов в целом более устойчив к обезвоживанию, однако потеря воды приводит к изменению конформационной лабильности мембранных белков и снижению скорости электронного потока. При дегидратации системы образуется жесткая матрица, в которой подвижность компонентов ЭТЦ понижена.
Высокочувствительны к обезвоживанию ферментативные реакции углеродных циклов. При низком водном потенциале значительно снижается активность ключевых ферментов — РуБФ-карбоксилазы и глицеральдегидфосфатдегидрогеназы (W. Stewart, Lee, 1972; O.Bjorkmanetal., 1980).
Фотосинтез в условиях светового, водного и температурного стресса. Адаптивные системы фотосинтеза
Напряженность любого внешнего фактора, выходящая за пределы нормы реакции генотипа, создает условия экологического стресса. Наиболее часто факторами экологического стресса для
наземных растений являются высокие интенсивности света, водный дефицит и предельные температуры.
В ряде работ исследовано влияние экстремальных условий освещения на активность фотосинтетического аппарата. Световое насыщение фотосинтеза у большинства растений находится в пределах 100—300тыс. эрг/см2*с; дальнейшее повышение интенсивности света может приводить к снижению скорости фотосинтеза. У теневыносливых растений световое насыщение достигается при значительно более низком освещении.
Обычно растения хорошо адаптированы к световому режиму местообитания. Адаптация достигается путем изменения количества и соотношения пигментов, размеров антенного комплекса, количества карбоксилирующих ферментов и компонентов электрон-транспортной цепи (О. Bjorkman, 1981). Так, у теневыносливых растений обычно ниже световой компенсационный пункт, больше размеры ФСБ и выше (3:1) отношение ФС И/ФС I (D. Fork, R. Govindjee, 1980). При резком изменении светового режима у растений, адаптированных к иным условиям освещения, происходит ряд нарушений в работе фотосинтетического аппарата. В условиях чрезмерно высокого освещения (более 300—400 тыс. эрг/см2с) резко нарушается биосинтез пигментов, ингибируются фотосинтетические реакции и ростовые процессы, что приводит в итоге к снижению общей продуктивности растений. В опытах с использованием мощных лазерных источников света показано (Т. Е. Кренделева и др., 1972), что световые импульсы, поглощаемые ФС I, значительно изменяют ряд фотохимических реакций: снижаются содержание П700, скорость восстановления акцепторов I класса (НАДФ+, феррицианид), скорость фотофосфорилирования. Действие лазерного облучения значительно уменьшает величину отношения Р/2е- и амплитуду быстрой компоненты фотоиндуцированного изменения поглощения при 520 нм. Авторы считают, что отмеченные выше изменения являются следствием необратимого повреждения реакционных центров ФС I.
Механизмы адаптации к различным интенсивностям света включают процессы, контролирующие распределение, использование и диссипацию поглощенной световой энергии. Эти системы обеспечивают эффективное поглощение энергии при низких уровнях освещения и сброс избыточной энергии при высокой освещенности. К ним относится процесс обратимого фосфорилирования белков светособирающих комплексов II (состояния 1 и 2), который контролирует относительное поперечное сечение поглощающих систем ФСI и ФС II. Защитные механизмы против фотоингибирования при высокой интенсивности света включают активируемые светом электрон-транспортные и сопряженные с ними эффекты (формирование циклических потоков вокруг ФС I и ФС II, виолаксантиновый цикл и др.), а также процессы дезактивации возбужденных состояний хлорофилла (A.Hortonetal., 1989; Н.Г.Бу-хов, 2004).
Влияние водного дефицита на фотосинтез проявляется, прежде всего, в нарушении газообмена. Недостаток водоснабжения приводит к закрыванию устьиц, связанному с изменением содержания абсцизовой кислоты (АБК). Водный дефицит уже на уровне 1 — 5 бар служит сигналом к быстрому увеличению количества АБК в листьях. В зависимости от генотипической устойчивости вида к засухе содержание АБК при потере воды в листьях возрастает от 20 до 100—200 раз, вызывая закрывание устьиц.
Устьичный аппарат регулирует поступление С02 в воздушные полости листа. Изменение ширины устьичной щели в зависимости от водного потенциала у разных видов высших растений определяется степенью их засухоустойчивости. В условиях водного дефицита, при закрывании устьичных отверстий, подавляется процесс фотосинтеза, ближний и дальний транспорт ассимилятов и снижается общий уровень продуктивности растений. При слабом водном дефиците отмечена временная активация фотосинтеза, дальнейшее увеличение дефицита воды приводит к значительным нарушениям активности фотосинтетического аппарата.
У растений С3- и С4-групп соотношение между фотосинтетической продуктивностью и водным балансом значительно различается. Для С4-растений характерно более экономное использование воды. Коэффициент транспирации, выражающий отношение количества транспирированной воды (в литрах), при образовании 1 кг сухого вещества у С4-растений значительно ниже: 250-350 л воды на 1 кг сухого вещества, у С3-растений - 600 -800. Последнее связано с функционированием у С4-растений специальных адаптивных механизмов, к числу которых относятся:
1. Кинетические свойства карбоксилирующих ферментов — высокое сродство ФЕП-карбоксил азы к С02, а также более высокая ее удельная активность (в расчете на белок). Активность ФЕП-карбокеилазы (25 мкмольмг-1 мин-1) в 5—10 раз больше активности РуБФ-карбоксилазы (2 мкмоль•мг-1•мин-1). Это позволяет С4-растениям более эффективно осуществлять процесс фотосинтеза при слабо открытых устьицах.
2. Характерные для С4-растений более низкие значения сопротивления мезофилла диффузии С02 и более высокое сопротивление устьиц диффузии водяных паров. Последнее связано с меньшим числом устьиц на единицу поверхности листа и с меньшей величиной устьичных щелей.|
Эти анатомо-биохимические особенности С4-растений обеспечивают более высокую эффективность использования воды по сравнению с С3-растениями.
При закрывании устьиц концентрация С02 в хлоропластах снижается до компенсационного пункта, что нарушает процессы ассимиляции С02 и работу углеродных циклов. У С3-растений в этих условиях вследствие процесса фотодыхания продолжается функционирование электрон-транспортной цепи и потребление образующихся НАДФН и АТФ. Это отчасти защищает фотосинтетический аппарат С3-растений от фотоингибирования, которое вызывается избытком энергии при ограниченном снабжении С02 и интенсивном освещении. У С4-растений механизм, предохраняющий фотосинтетический аппарат от фотоповреждения, связан с транспортом углерода из клеток мезофилла в клетки обкладки. Способность к рециклизации С02 является одним из путей адаптации фотосинтетического аппарата к нарушению газообмена при водном дефиците.
Однако несмотря на эти защитные механизмы, в условиях водного стресса при интенсивном освещении происходит ингибирование транспорта электронов, процессов ассимиляции С02, снижение квантового выхода фотосинтеза.
В условиях обезвоживания ткани листа, по-видимому, не происходит синхронного обезвоживания хлоропластов. Как показывают электронно-микроскопические исследования, хлоропласт сохраняет свою нативную структуру даже при значительном водном дефиците в листе. Полагают, что хлоропласт может поддерживать водный гомеостаз даже при значительной потере воды растением. Однако при значительном водном дефиците происходит набухание хлоропластов и нарушение их тилакоидной структуры. Увеличение содержания АБК вследствие водного дефицита вызывает синхронное системное ингибирование функций фотосинтеза и роста. Нарушается система репликации, транскрипции I и трансляции, контролируемая генами ядра и хлоропласта, происходит деструкция полисом, нарушается деление и структурно-функциональная дифференцировка клеток и хлоропластов, блокируются процессы роста и морфогенез. В этих условиях резко подавляются энергетические процессы. И.А.Тарчевский (1982) предполагает, что блок АБК связан с нарушением функции сопрягающих мембран и ингибированием фотофосфорилирования, результатом чего является дефицит АТФ.
В природных условиях водный стресс часто сопряжен с температурным стрессом. Специфика организации фотосинтетического аппарата, анатомические и биохимические особенности отдельных групп растений, их адаптация к температурным условиям окружающей среды определяют различные интервалы температур, благоприятные для протекания фотосинтеза. Неодинаковую зависимость от температурных условий проявляют С3- и С4-группы растений. Температурный оптимум фотосинтеза у С4 растений находится в области более высоких температур (35 —45 °С), чем у С3-растений (20 — 30 °С). Это обусловлено спецификой организации биохимических систем ассимиляции С02 у С4-растений и рядом адаптивных механизмов. За счет работы С4-цикла концентрация С02 в хлоропластах поддерживается на достаточно высоком уровне, что предотвращает кислородное ингибирование фотосинтеза и обеспечивает его высокую интенсивность в широком интервале температур. Ферментативный аппарат хлоропластов С4 -растений более активен при повышении температуры до 35 °С, в то время как у С3-растений при этих температурах отмечено ингибирование фотосинтеза.
Наиболее термозависимыми являются реакции углеродных циклов, для которых характерны высокие значения Q10: 2,0—2,5. Активность НАДФ-малатдегидрогеназы (маликоэнзим) в клетках обкладки у С4-растений значительно возрастает при повышении температуры до 39 °С за счет увеличения сродства фермента к субстрату. При этом увеличиваются активность декарбоксилирования малата, скорость его транспорта из клеток мезофилла в клетки обкладки, активируются карбоксилирующие системы (ФЕП-карбоксилаза) вследствие уменьшения ингибирующего действия малата как конечного продукта. Благодаря этому общая интенсивность фотосинтеза при высоких температурах у С4-растений выше, чем у Сз-растений.
Высокой степенью термочувствительности отличаются также реакции электронного транспорта. Все фотофизические и фотохимические реакции, протекающие в реакционных центрах, мало зависят от температуры, однако процессы переноса электронов между функциональными комплексами являются термозависимыми. Фотосистема II и сопряженные с нею реакции фотоокисления воды легко повреждаются при экстремальных температурах; фотосистема I более термостабильна.
Весьма чувствительны к температуре процессы фотосинтетического фосфорилирования. Наиболее благоприятен интервал температур 15—25 °С. У большинства высших растений повышение температуры выше 30—35° резко ингибирует реакции фотофосфорилирования, фотопоглощения протонов и активность каталитических центров CF. По-видимому, ингибирующее действие высоких температур на систему сопряжения связано с нарушением характера конформационных изменений, с изменением конформационных свойств белка. Повышение температуры искажает также нормальное функционирование сопрягающих мембран.
Высокая термоустойчивость фотосинтетического аппарата ряда сортов и видов растений связана со спецификой липидного состава мембран, физико-химических свойств мембранных белков, кинетическими свойствами ферментов пластид и рядом структурно-функциональных особенностей тилакоидных мембран. Одним из наиболее существенных факторов, определяющих устойчивость растений в стрессовых условиях, являются стабильность их энергетических систем и общий уровень энергообмена. Фонд АТФ обеспечивает восстановление нарушенных физиологических состояний, новообразование клеточных структур и нормализацию всего конструктивного обмена (В.Е.Петров, Н.Л.Лосева, 1986).
Зависимость фотосинтеза от засухи и температуры на уровне целого растительного организма оказывается еще более сложной, так как засуха в первую очередь тормозит ростовые процессы (деление и дифференцировку клеток, морфогенез). Это приводит к уменьшению «запроса» на ассимиляты со стороны морфогенеза, т. е. нарушается акцепторная функция в донорно-акцепторной системе, что вызывает торможение фотосинтеза через метаболитное и гормональное ингибирование.
Создание сортов сельскохозяйственных растений, сочетающих высокую термоустойчивость, засухоустойчивость и высокий уровень зерновой продуктивности является одной из важнейших проблем современной физиологической генетики и селекции.
В последние годы большое значение уделяется изучению действия на фотосинтез ряда техногенных экологических факторов, таких, как радиационное загрязнение, физические поля (электромагнитный «смог»), экология мегаполисов и др. В связи с этим возникает необходимость на новой молекулярно-генетической и физической основе расшифровать последовательность всех этапов адаптации основных реакций фотосинтеза ко всем видам природных и техногенных факторов.
Список литературы
1. Андреева Т.Ф. Фотосинтез и азотный обмен листьев.- М: Наука, 1969
2. Клейтон Р. Фотосинтез. Физические механизмы и химические модели. - М., 1984.
3. Кретович В.Л. Биохимия растений. М., 1986
4. Овчинников Н.Н. Фотосинтез. - М: Просвещение, 1972.
5. Полевой В.В. Физиология растений. - М.: “Высшая школа”, 1989
6. Рабинович Е. Фотосинтез. - М: Издательство иностранной литературы, 1959
7. Судьина Е.Г. Фотосинтез – основа жизни. - Киев: Издательство академии наук украинской ССР, 1962
8. Якушкина Н.И. Физиология растений.- М.: Просвещение, 1993.
|