|
Курсовая работа
по теме
«Тесты как измеритель уровня знаний по теме «Непредельные углеводороды» с элементами экологии»
Содержание
Введение
ГЛАВА I . ЭКОЛОГИЧЕСКИЕ ЗНАНИЯ И СИСТЕМА ТЕСТИРОВАНИЯ В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ
1.1 Содержание экологических знаний в курсе химии средней школы
1.2 Теория создания тестов для системы образования
Глава II. Методика преподавания темы “Непредельные углеводороды ” в современной школе
2.1 Алкены
2.1.1 Получение алкенов
2.1.2 Применение алкенов
2.1.3 Применение алкенов
2.2 Алкадиены
2.2.1 Получение алкадиенов
2.3 Алкины
2.3.1 Получение алкинов
2.3.2 Применение алкинов
Глава III. Мои уроки
Глава IV. Тесты и задачи по теме «Непредельные углеводороды»
Литература
ВВЕДЕНИЕ
В современных условиях одной из самых актуальных проблем методики преподавания химии в школе становится обеспечение практической ориентированности предметного знания. Это означает необходимость выявления тесной взаимосвязи между изучаемыми теоретическими положениями и практикой жизни, демонстрации прикладного характера химических знаний.
Для того чтобы сохранить познавательный интерес учащихся, нужно убедить их в действенности химических знаний, сформировать личную потребность в овладении учебным материалом. Этому могут способствовать специально составленные задания, которые кроме собственно контролирующих вопросов содержат информацию прикладного характера, полезную в быту [1].
ГЛАВА
I
. ЭКОЛОГИЧЕСКИЕ ЗНАНИЯ И СИСТЕМА ТЕСТИРОВАНИЯ В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ
1.1 Содержание экологических знаний в курсе химии средней школы
Роль школьного курса химии в экологическом образовании обуславливается тем, что данная наука связана с познанием законов природы, химической формы движения материи и ее значимость в материальной жизни общества.
Перед учителем химии, ведущим природоохранную работу, стоят следующие задачи:
· раскрытие единства неорганического и органического мира, влияние деятельности человека на окружающую среду и формирование на этой основе убежденности в необходимости бережного отношения к природе;
· раскрытие двойственной роли химической промышленности в отношении природы;
· вооружение школьников практическими умениями и навыками, позволяющими посильно участвовать в мероприятиях по защите природы.
Реклама

Для химического образования в целом еще не решена проблема содержания экологических знаний. Химизация пронизала все сферы жизни. Ее последствия стали соизмеримы с природными явлениями глобального масштаба и это ставит вопрос о взаимодействии природы и общества. Цели разумного регулирования этих отношений должны быть доведены до сознания учащихся, а именно:
· продукты жизни общества должны полностью утилизироваться, не должны накапливаться и оказывать вредного воздействия на человека и окружающую среду;
· размеры годового потребления возобновляющегося природного сырья не должны превышать его годовой прирост;
· не возобновляющееся природное сырье должно использоваться экономно, комплексно, практически не давать отходов при переработке. Таковы научный и практический аспекты химического образования.
Воздействие на природу в целом, на ее структурные элементы осуществляется промышленностью, транспортом, сельским хозяйством, которые влияют в различных направлениях:
1. Потребление химических веществ из природы.
2. Загрязнение природы отходами человеческой деятельности.
3. Появление в природе и, в частности, в биосфере новых высокоактивных химических соединений, выделенных из природных источников или синтезированных человеком.
Первое направление освещено в содержании курсов неорганической и органической химии, где рассматриваются природные соединения, как сырье для химической промышленности и других отраслей, в основе которых лежат химические процессы. Освещаются вопросы использования природных веществ в качестве удобрений и ядохимикатов.
В целях развития и формирования знаний о загрязнении необходимо ввести такие понятия как "загрязнители", "источники загрязнения", "естественное и искусственное загрязнение", "санитарные нормы чистоты", "предельно допустимые концентрации веществ" (ПДК). Необходимо рассмотреть источники загрязнения. Важно показать учащимся, что решение проблем загрязнения - это совершенствование и создание новой техники и технологии, повышение выхода продукта и снижение образования отходов производства, создание оборотного водоснабжения, уменьшающего сток загрязненных вод, разработка систем утилизации отходов и переход на замкнутые технологические циклы. Следует также дать характеристику использования защитных зон, показать значение растений в процессах оздоровления атмосферы. [1,3]
Реклама

1.2 Теория создания тестов для системы образования
Тесты как измерительный инструмент используются в большинстве стран мира. Их разработка и использование основано на мощной теории и подтверждено многочисленными исследованиями. Тестология как теория и практика тестирования существует более 120 лет, и за это время накоплен громадный опыт использования тестов в различных сферах человеческой деятельности, включая образование.
Тесты - одно из средств проверки и оценки результатов обучения школьников. В последнее время они получают все большее применение в практике обучения.
Тест (от английского test - испытание, проверка)
- стандартизированные, краткие, ограниченные во времени испытания, предназначенные для установления количественных и качественных индивидуальных различий.
Требования, предъявляемые к тестам: надежность, валидность, репрезентативность. Факторы, определяющие надежность теста:
· правильный выбор параметров, адекватно отражающих обученность;
· технологичность (четкость, ясность) инструментария проверки и оценки - четкая инструкция об организации проверки, однозначность оценки;
· одинаковость условий каждого тестирования;
· однородность (равнозначность) измерителя.
Валидность
- аспект надежности. Валидность в психологии и дидактике - это соответствие содержания теста результатам обучения, которые зафиксированы в программе. А содержание проверочных заданий должно соответствовать целям контроля. Валидность проверяется на основе сравнения результатов использования разработанного теста с результатами проверки уровня обученности протестированных школьников другими методами (устный опрос, традиционная контрольная работа), сопоставление этих результатов с текущей успеваемостью учащихся. Важнейшим здесь является полнота охвата заданиями проверяемого учебного материала, как говорят в дидактике, репрезентативность (представительность) проверочных заданий. Если речь идет об итоговой проверочной работе, то ею охватывается весь курс, важнейшие его темы, наиболее значимый в них материал.
Затрагивая вопросы методики использования тестов для контроля результатов обучения школьников необходимо вспомнить об основных функциях проверки и оценки результатов обучения. Выделим среди них:
· учетно-контрольную (информационную)
, которая систематически позволяет учителю фиксировать результаты обучения и судить об успеваемости каждого ученика, его достижениях и недочетах в учебной работе;
· контрольно-корректирующую (диагностическую)
, которая обеспечивает связь "учитель-ученик", для внесения коррективов в методику обучения, перераспределения учебного времени между различными вопросами темы и пр., позволяет осуществлять диагностику причин отставания школьников;
· обучающую
, которая в результате помогает повторить материал, акцентировать внимание учащихся на главных вопросах и важнейших мировоззренческих идеях курса, указывает на типичные ошибки, что способствует закреплению и углублению знаний учащихся;
· воспитательную (мотивационную)
, которая стимулирует учащихся к дальнейшей учебной работе, углублению своих знаний, развивает у школьников умения самоконтроля и самооценки;
· аттестационную
, которая связана с характеристикой уровня обученности школьника, является основой его аттестации, а также важнейшим компонентом аттестации работы учителя образовательного учреждения [4].
Положительные стороны тестирования
Во-первых, тесты оказываются значительно более качественным и объективным способом оценивания, так как стандартизирована процедура их проведения (на всех этапах проведения тестирования невозможно внести субъективную составляющую в оценку, она не зависит от настроения преподавателя, его отношения к конкретному учащемуся, впечатления от ответов на предыдущие вопросы). По данным английской организации NEAB, занимающейся итоговой аттестацией учащихся Великобритании, тестирование позволяет снизить количество аппеляций более чем в три раза, сделать процедуру оценивания одинаковой для всех учащихся вне зависимости от места проживания, типа и вида образовательного учреждения, в котором занимаются учащиеся.
Во-вторых, тесты - более емкий инструмент - показатели тестов ориентированы на измерение степени, определение уровня усвоения ключевых понятий, тем и разделов учебной программы, умений, навыков, а не на констатацию наличия у учащихся определенной совокупности усвоенных знаний. Стандартизированная форма оценки, используемая в тестах достижений, позволяет соотнести уровень достижений учащегося по предмету в целом и по отдельным его разделам со средним уровнем достижений учащихся в классе и уровнями достижений каждого из них. Кроме того, выполняя итоговую тестовую работу, каждый ученик использует знания по всем темам, изучение которых предусматривала программа. На устный экзамен обычно выносится 2-4 темы, на письменный несколько больше.
В-третьих, это более мягкий инструмент. Тестирование ставит всех учащихся в равные условия, используя единую процедуру и единые критерии оценки, что приводит к снижению предэкзаменационных нервных напряжений.
В-четвертых, с точки зрения интервала оценивания тест - широкий инструмент. Если провести аналогию с прыжками в высоту, то традиционная контрольная работа представит собой палочку, на которой нанесены метки: 2, 3, 4, 5. В случае выполнения учеником всех заданий он получает отметку отлично. При этом совершенно не ясно, перепрыгнул он нашу палочку с запасом в два раза или пролетел прямо над ней. То же можно сказать и про нижнюю отметку.
Означает ли тот факт, что если ученик не выполнил ни одного задания, то он ничего не знает? Скорее всего нет. А означает ли, что ученики, выполнившие верно все задания контрольной работы имеют одинаковый уровень подготовки - вероятно, что тоже нет. Можно видеть, что тестирование предоставляет возможность расширить шкалу оценивания как вверх, так и вниз. Тестирование приходит в противоречие с учительским стереотипом о том, что отличную оценку нужно выставлять только в том случае, если все задания выполнены правильно.
В-пятых, необходимо отметить гуманизм тестирования, который заключается в том, что всем предоставляются равные возможности, широта теста дает возможность ученику показать свои достижения на широком поле материала. Таким образом, ученик получает некоторое право на ошибку, которого он при традиционном способе оценивания не имеет.
· Кроме того, тесты эффективны с экономической точки зрения: основные затраты приходятся на составление качественного инструментария, т.е. носят разовый характер. При увеличении количества аттестуемых, эти затраты в значительной степени окупаются [4,5].
Классификация тестов
1.
По процедуре создания:
· стандартизованные (в образовании, для целей итоговой аттестации);
· не стандартизованные.
2. По средствам предъявления
:
- бланковые;
- предметные (манипулируем материальными объектами);
- аппаратурные (используются устройства для изучения особенностей внимания, восприятия, памяти, мышления);
- практические (лабораторные работы, снабженные соответствующими инструкциями и имеющие тестовое оснащение);
- компьютерные.
В рамках компьютерного тестирования В.С. Аванесов предлагает адаптивные тесты - задания, в которых предъявляются по одному, в зависимости от ответа испытуемого на предыдущий вопрос.
Во-первых, тесты привлекают своей оперативностью: можно быстро проверить и оценить уровень усвоения учебного материала.
Во-вторых, повышается объективность проверки и оценки знаний и умений обучаемых.
В-третьих, тесты являются наиболее перспективными измерителями уровня обученности школьников в условиях введения в практику школы образовательных стандартов.
Компьютерные тесты имеют и свои недостатки - провоцируют случайные ошибки, не оставляют исходных результатов на случай апелляции.
4. По направленности:
- · тесты интеллекта;
- · личностные тесты;
- · тесты достижений.
5.
По характеру действий:
- вербальные (с использованием умственных действий);
- ·невербальные (связанные с практическим манипулированием предметов).
5. По ведущей ориентации:
· тесты скорости (содержат простые задачи; время решения ограничено);
· тесты мощности или результативности (содержат трудные задачи, время решения не ограничено, или мягко лимитировано);
· смешанные тесты (задачи различного уровня сложности, от самых простых до самых сложных, время испытания ограничено, но достаточно для решения большинства задач).
Эти тесты наиболее часто применяются на практике, к ним относятся большинство тестов школьных достижений.
6. По степени однородности задач
:
· гомогенные (задачи, сходные по характеру, но различающиеся конкретным содержанием);
· гетерогенные (задания отличаются и по характеру, и по содержанию).
7. По объективности оценивания
:
· объективные (в процессе обработки результатов тестирования не предусматривается использование субъективных толкований тестирующим);
· проективные тесты (допускается чрезвычайно большое разнообразие ответов и проявление определенной субъективности при их толковании тестирующим.
8. По специализации
:
· широкоориентированные (для тестов в системе образовании), позволяющие оценить эффективность процесса обучения, степень освоения учащимися системы знаний, умений и навыков в ходе учебного процесса;
· узкоориентированные, направленные на выявление достижений учащихся в процессе освоения отдельных предметов, отдельных тем и т.д.
9. По целям использования (только для тестов в системе образования
):
· предварительный определяющий тест (определяет знания в начале обучения, затрагивает минимум знаний по теме обучения);
· тест прогресса, достигнутого в процессе обучения, формирующий тест (затрагивает ограниченный сегмент обучения, раздел или главу, состоит из серии отдельных тестовых вопросов, всесторонне охватывающих ограниченную область обучения). Пример, обучающие тесты. Ученику даются конкретные инструкции для исправления обнаруженных ошибок;
6. диагностический тест (содержит большое число вопросов, имеющих отношение к конкретной тестируемой области). Цель теста - определение трудностей обучения.
7. суммирующий тест (используется для оценки широкого диапазона результатов обучения, ожидаемого в конце учебного процесса, содержит вопросы, представляющие более высокий уровень сложности, чем другие виды тестов).
10. По широте использования (только для тестов в системе образования):
· для использования учителем;
· для использования группой учителей или администрацией образовательного учреждения;
· для целей отбора и формирования групп;
· для аттестации учащихся.
11. По форме
:
· тесты закрытого типа (задания с выбором верного ответа (или нескольких верных) из набора предлагаемых;
· тесты открытого типа (ввод предполагаемого ответа на задание самим тестируемым).
Правила составления тестовых заданий
1. Начинайте формулировать вопрос с правильного ответа.
2. Содержание задания должно отвечать программным требованиям и отражать содержание обучения.
3. Вопрос должен содержать одну законченную мысль.
4. При составлении вопросов следует особенно внимательно использовать слова "иногда", "часто", "всегда", "все", "никогда".
5. Вопрос должен быть четко сформулирован, избегая слова большой, небольшой, малый, много, мало, меньше, больше и т.д.
6. Избегайте вводных фраз и предложений, имеющих мало связи с основной мыслью, не следует прибегать к пространным утверждениям, так как они приводят к правильному ответу, даже если учащийся его не знает.
7. Неправильные ответы должны быть разумны, умело подобраны, не должно быть явных неточностей, подсказок.
8. Не задавайте вопросы с подвохом (в заблуждение могут быть введены наиболее способные учащиеся).
9. Все варианты ответов должны быть грамматически согласованы с основной частью задания, используйте короткие, простые предложения, без зависимых или независимых оборотов.
10.Реже используйте отрицание в основной части, избегайте двойных отрицаний, таких как: "Почему нельзя не делать…?"
11.Ответ на поставленный вопрос не должен зависеть от предыдущих ответов.
12.Правильные и неправильные ответы должны быть однозначны по содержанию, структуре и общему количеству слов. Применяйте правдоподобные ошибочные варианты, взятые из опыта.
13.Если ставится вопрос количественного характера, ответы располагайте по возрастанию, если дистракторы представлены в виде слов текста, располагайте их в алфавитном порядке.
14.Лучше не использовать варианты ответов "ни один из перечисленных" и "все перечисленные".
15.Избегайте повторения.
16.Используйте ограничения в самом вопросе.
17.Не упрощайте вопросы.
18.Место правильного ответа должно быть определено так, чтобы оно не повторялось от вопроса к вопросу, не было закономерностей, а давалось в случайном порядке.
19.Лучше использовать длинный вопрос и короткий ответ.
20.Проанализируйте задания с точки зрения неверного ответа наиболее подготовленных учеников.
21.Национальные системы ряда стран ставят специфические требования к тестовым заданиям, на которые у нас пока обращается недостаточно внимания [4].
ГЛАВА
II. СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
Непредельные углеводороды изучаются путем постоянного сравнения по строению и свойствам с предельными углеводородами.
При изучении данного раздела в занятия включается ученический эксперимент. Это осуществляется как на индуктивном, так и дедуктивном пути познания в виде лабораторных опытов или же практических занятий [3].
План изучения темы
1. Понятие непредельных углеводородов
2. Этилен, его строение
3. Строение и номенклатура углеводородов ряда этилена
4. Химические свойства, правило Марковникова
5. Применение и получение этиленовых углеводородов
6. Диеновые углеводороды, строение и химические свойства
7. Ацетилен, строение, химические свойства и применение
Преподавание темы «Непредельные углеводороды» начинается с 10 класса, первого полугодия.
При изучении этой темы пользуются учебником химии под редакцией Г. Е. Рудзитис, Ф.Г. Фельдман, также учебником за 10 класс под редакцией Н. С. Ахметова.
Дидактическим материалом служит книга по химии для 10 классов под редакцией А. М. Радецкого, В. П. Горшкова; используются задания для самостоятельной роботы по химии за 10 класс под редакцией Р. П. Суровцева, С. В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г. П. Хомченко, И. Г. Хомченко. В 10 классе на изучение закономерностей протекания химических реакции отводится 2ч[2,3].
2.1 Алкены
Свойства алкенов
Физические свойства
алкенов закономерно изменяются в гомологическом ряду: от С2
Н4
до С4
Н8
– газы, начиная с С5
Н10
– жидкости, с С18
Н36
– твердые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства
алкенов определяются строением и свойствами двойной связи С=С, которая значительно активнее других связей в молекулах этих соединений. Алкены химически более активны, чем алканы.
Характеристики углерод-углеродных связей:

| Е+
(энергия двойной связи) С=С ( + )
|
620 кДж/моль
|
| Е
(энергия -связи) С-С
|
348 кДж/моль
|
| Отсюда Е
(энергия -связи)
|
272 кДж/моль,
|
| т.е. Е
на 76 кДж/моль меньше Е
.
|
|
2.1.1 Получение алкенов
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
I. Крекинг алканов:

Например:

II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи.
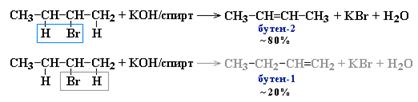
1. Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи

2. Дегидратация спиртов при температуре менее 150C в присутствии водоотнимающих реагентов
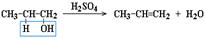
Реакции элиминирования идут в соответствии с правилом Зайцева
:
Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Современная формулировка:
реакции отщепления идут с образованием более замещенных при двойной связи алкенов.
Такие алкены обладают более низкой энергией.
3. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов :
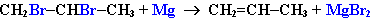
4. Дегидрирование алканов при 500С:
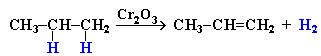
2.1.2 Применение алкенов
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Этилен
(этен) Н2
С=СН2
используется для получения полиэтилена, политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
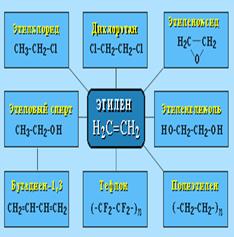
Применяется как средство для ускоренного созревания фруктов.
Пропилен
(пропен) Н2
С=СН2
–СН3
и бутилены
(бутен-1 и бутен-2) используются для получения спиртов и полимеров.
Изобутилен
(2-метилпропен) Н2
С=С(СН3
)2
применяется в производстве синтетического каучука.
2.2 Алкадиены
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов Сn
H2n-2
.
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах.
1.
Изолированные
двойные связи разделены в цепи двумя или более -связями:
СН2
=СН–СН2
–СН=СН2
Разделенные sp3
-атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах.
Таким образом, алкадиены этого типа проявляют химические свойства, характерные для алкенов.
2.
Кумулированные
двойные связи расположены у одного атома углерода:
СН2
=С=СН2
(аллен)
Подобные диены (аллены) относятся к довольно редкому типу соединений.
3.
Сопряженные
двойные связи разделены одной -связью:
СН2
=СН–СН=СН2
Сопряженные диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью 4-х sp2
-атомов углерода. Отдельные представители этих диенов широко используются в производстве синтетических каучуков и различных органических веществ.
2.2.1 Получение алкадиенов
Общие способы получения диенов аналогичны способам получения алкенов.
1. Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах:

Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:
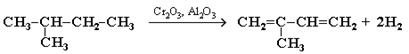
2. Синтез дивинила по Лебедеву:

3. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
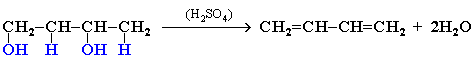
4. Действие спиртового раствора щелочи на дигалогеналканы:

2.3 Алкины
Свойства алкинов
Физические свойства.
Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2
Н2
-С4
Н6
– газы, С5
Н8
-С16
Н30
– жидкости, с С17
Н32
– твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов (табл.6.4.1).
Таблица 6.4.1. Физические свойства алкенов и алкинов

Алкины плохо растворимы в воде, лучше – в органических растворителях.
Химические свойства
алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
Характеристики связей в алкинах:

Реакции присоединения к алкинам
1. Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая -связь), а затем алканов (разрывается вторая -связь):
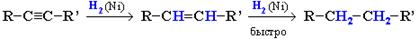
При использовании менее активного катализатора [Pd/CaCO3
/Pb(CH3
COO)2
] гидрирование останавливается на стадии образования алкенов.
2. Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая связь разрывается труднее, чем вторая):
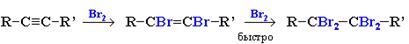
Алкины обесцвечивают бромную воду (качественная реакция).
3. Гидрогалогенирование
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова:
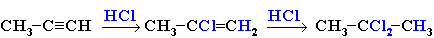
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида:
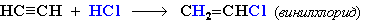
Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
4. Гидратация (реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
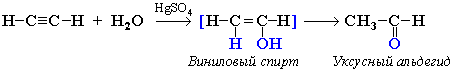
или в кетон (в случае других алкинов):
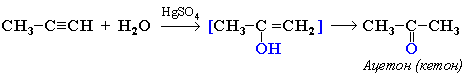
5. Полимеризация
1. Димеризация под действием водно-аммиачного раствора CuCl:
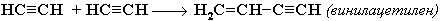
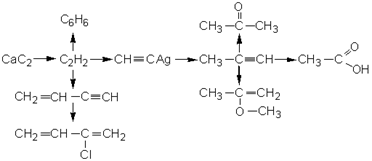
2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
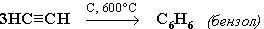
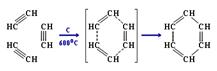
Возможно образование молекул, содержащих большее число звеньев ацетилена, как циклического, так и линейного строения
… -СН=СН-СН=СН-СН=СН-…
(такие полимеры обладают полупроводниковыми свойствами).
Следует также отметить, что высокомолекулярное вещество – карбин
(третья аллотропная модификация углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl:
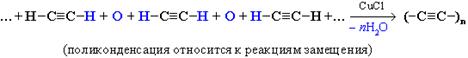
2.3.1 Получение алкинов
Ацетилен получают в промышленности двумя способами.
1. Термический крекинг метана:
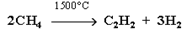
2. Гидролиз карбида кальция:
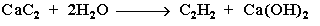
Карбид кальция образуется при нагревании смеси оксида кальция СаО (жженой извести) и кокса до 2500С:
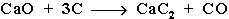
Вследствие большой энергоемкости этот метод экономически менее выгоден.
Для синтеза гомологов ацетилена применяют следующие методы.
1. Дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берутся в избытке):
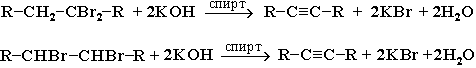
2. Удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами:
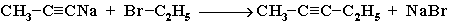
2.3.2 Применение алкинов
Наибольшее практическое значение имеют ацетилен  и винилацетилен и винилацетилен  (бутен-3-ин-1). (бутен-3-ин-1).
Ацетилен используется для получения самых разнообразных веществ:
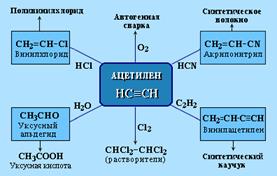
Винилацетилен является важным промежуточным продуктом в производстве масло- и бензостойкого синтетического хлоропренового каучука:

ГЛАВА
III
. МОИ УРОКИ
Контроль знаний учащихся 10-го класса по темам "Алкены" и "Алкины
"
· 1 вариант – облегченный;
· 2 вариант – средний уровень;
· 3 вариант – усложненный.
Контрольная работа
1 задание
1вариант.
Чему равно число изомерных алкенов состава С5
Н10
? Составьте их формулы и назовите их.
2вариант.
Составьте формулы изомеров для предложенного вещества, назовите их, укажите типы изомерии.
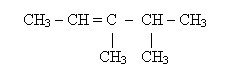
3вариант.
Какие из предложенных пар веществ являются изомерами?
Назовите вещества, укажите типы изомерии.
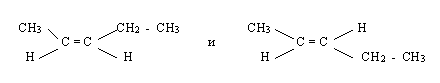

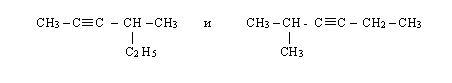
2 задание
1вариант.
Составьте уравнения реакций, назовите все вещества.

2вариант.
Осуществите превращения, укажите названия веществ, типы химических реакций, условия их проведения:

3 вариант.
Дана цепочка превращений:
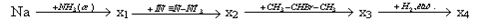
Осуществите превращения, назовите вещества, укажите типы реакций.
3 задание
1 вариант
Как распознать следующие вещества: этан, этен, этин ?
Составьте уравнения реакций.
2 вариант.
Предложите способ распознания соединений: бутан, бутен – 1, пропин.
Составьте уравнения реакций.
3 вариант.
Предложите способ распознания веществ: пропан, пентен – 2, пентин – 2, пентин – 1.
Напишите уравнения реакций.
4 задание
Задача.
1 вариант
Сколько литров водорода потребуется для полного гидрирования 16,2 г бутина – 2?
2 вариант
Какую массу карбида кальция, содержащего 15% примесей, необходимо взять для получения 40 л ацетилена (н.у.)?
3 вариант
Углекислый газ, полученный при сжигании 8,4 л этилена (н.у.), пропущен через 472 мл 6%-ного раствора NaOH (плотность = 1,06 г / мл). Каков состав образующейся соли и какова ее массовая доля в растворе?
Практическое занятие № 3
Тема.
Решение задач по теме «Непредельные углеводороды».
Цели:
· закрепить полученные ранее теоретические представления о типах химических реакций, механизмах их протекания на примере химических свойств алкенов, алкинов, диеновых углеводородов;
· развивать навыки составления названий веществ, структурных формул изомеров.
Ход работы
Основные задания
1. Перечислите типы реакций, характерные для этиленовых и ацетиленовых углеводородов.
2. Допишите уравнения реакций:
2.1. 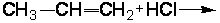
2.2. 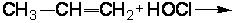
2.3. 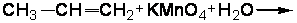
2.4. 
2.5. 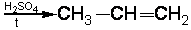
2.6. 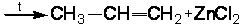
3. Объясните, почему при гидрогалогенировании пентадиена-1,3 получается смесь галогенпроизводных.
4. Приведите уравнения реакций, с помощью которых можно осуществить превращения:
5. В четырех пробирках находятся жидкости: четыреххлористый углерод, гексан, гексен-1 и гексин-1. Как определить, какое из веществ находится в каждой пробирке? Приведите уравнения реакций.
Дополнительные задания
1. Дайте названия соединениям:
| 1.1. 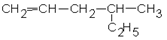
|
1.6. 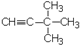
|
| 1.2. 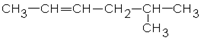
|
1.7. 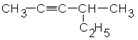
|
| 1.3. 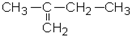
|
1.8. 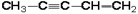
|
| 1.4. 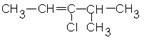
|
1.9. 
|
| 1.5. 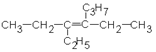
|
1.10. 
|
2. Укажите, для каких из них характерна геометрическая изомерия. Приведите структурные формулы цис
- и транс
-изомеров.
3. Приведите механизм реакции гидратации бутена-1.
4. Приведите уравнения реакций, с помощью которых можно осуществить превращения:→
3.1. этанол → бутадиен-1,3 → бутадиеновый каучук
3.2. 2-метилбутан → изопрен → цис-полиизопрен
ГЛАВА
IV
. ТЕСТЫ И ЗАДАЧИ ПО ТЕМЕ «НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ»
Задачи
1. При пропускании 11,2 л (н.у.) смеси этана, этилена и ацетилена через склянку с бромной водой масса склянки увеличилась на 10,9 г. При пропускании исходной смеси через сосуд с аммиачным раствором оксида серебра масса сосуда увеличилась на 3,9 г. Определите состав газовой смеси (в % по объему).
2.Этилен, образовавшийся при дегидратации этанола (массовая доля выхода 75%) пропустили через раствор перманганата калия. Масса раствора увеличилась на 5,6 г. Сколько спирта (г) было затрачено на получение этилена?
3. Составьте структурные формулы соединений по их названиям:
а) 2 – метилбутен – 1; б) пентен – 2; в) 3 – метилпентен – 1; г) пропин.
Какие из них являются изомерами и почему?
4.Составьте схемы реакций полимеризации этилена и пропилена.Какие продукты при этом образуются и каковы их области применения?
5. С помощью каких характерных реакций можно отличить ацетилен от этана? Напишите соответствующие уравнения реакций.
6. Какой объем воздуха ( н. у.) потребуется для полного сжигания 5 л этилена? Объемная доля кислорода в воздухе составляет 21 %.
7
. Неизвестный алкин массой 8 г в реакции с избытком брома образует продукт массой
72 г. Название этого алкина по систематической номенклатуре.
8
. Неизвестный алкен присоединил 0,36 г воды, при этом образовался 1,2 г продукта реакции, название этого алкена по систематической номенклатуре.
Тесты
1
.Какие из утверждений являются верными?
А) Органические вещества нельзя получить из неорганических.
Б) Свойства веществ зависят не только от состава, но и от строения.
2.
π-связь есть в молекуле:
1) пропана;
2) 2-метилпропана;
3) пропилена;
4) циклобутана.
3.
Пространственная конфигурация электронных облаков атома углерода в состояниях sp- и sp3
– гибридизации соответственно:
1) линейная, тетраэдрическая;
2) линейная, треугольная;
3) тетраэдрическая, треугольная;
4) треугольная, линейная.
4.
В виде цис- и транс-изомеров может существовать:
1) 2-метилпропен;
2) бутен-1;
3) гексен-1;
4) 1,4-дихлорбутен-2.
5.
Реакция, при которой происходит перегруппировка атомов, называется реакцией:
1) элиминирования;
2) изомеризации;
3) полимеризации;
4) поликонденсации.
6.
Только первичные и вторичные атомы углерода имеются в соединении, название которого:
1) 2,2 –диметилбутан;
2) 2,2- диметилпропан;
3) бутен-2;
4) этан.
7
.Продуктом взаимодействия пентена-1 с хлороводородом является:
1) 1-хлорпентан;
2) 1-хлорпентен-2;
3) 2-хлорпентан;
4) 1,2-дихлорпентан.
9
.В результате следующей цепочки превращений:
СаС2
—+Н2О
→Х1
—to
,
C
акт
→ Х2
—FeCl
3
, +
Cl
2
→Х3
образуется конечный продукт Х3
, название которого _______________
10
. π-связи нет
в молекуле:
1) циклогексана;
2) ацетилена;
3) бутадиена-1,3;
4) этена.
11
. Пространственная конфигурация электронных облаков атома углерода в состояниях sp2
- и sp3
– гибридизации соответственно:
1) треугольная, линейная
2) треугольная, тетраэдрическая;
3) линейная, тетраэдрическая;
4) тетраэдрическая, линейная.
12.
В виде цис- и транс-изомеров может существовать:
1) 2-метилбутен-2;
2) 2-метилпентен-2;
3) 2,3-дибромбутен-1;
4) 1-бром-2-хлорэтен.
13.
Реакция, в которой происходит присоединение воды, называется реакцией:
1) гидрирования;
2) гидратации;
3) дегидрирования;
4) дегидратации.
14.
Продуктом взаимодействия бутена-1 с водой является:
1) бутанол-2;
2) бутадиен-1,3;
3) ацетальдегид;
4) винилацетилен.
15
. В результате риформинга протекает реакция:
1) гидрирования;
2) гидратации;
3) дегидрирования;
4) присоединения.
16
.В результате следующей цепочки превращений: СН3
Сl—+
Na
,
to
→ Х1
—кат.,
to
→Х2
—полимеризация
→Х3
образуется конечный продукт Х3
, название которого ________________.
(Запишите слово в именительном падеже).
17. Как изменяется массовая доля углерода в алкенах с ростом значения молярной массы?
а) возрастает
б) уменьшается
в) не изменяется
г) изменяется случайным образом
18. Бромэтан может быть превращен в этилен:
а) взаимодействием с натрием
б) взаимодействием со щелочным раствором щелочи
в) нагреванием с серной кислотой
г) взаимодействием с водородом
19. Укажите значение относительной молекулярной массы для алкена с 6-ю атомами углерода в молекуле:
а) 86
б) 84
в) 82
г) 80
20. Какие реагенты взаимодействуют с этиленом?
а) бромная вода
б) водный раствор перманганата калия
в) кислород
г) вода в присутствии концентрированной серной кислоты
21. Реакция присоединения воды называется реакцией:
а) гидрирования
б) дегидратация
в) гидратации
г) дегидрирования
22. Какие вещества, названия которых приведены ниже, являются между собой гомологами?
а) этен
б) 2- метилпропан
в) 1, 2 дихлорпропен
г) 1- хлорпропен
23. Сколько изомерных алкенов можно получить при дегидрировании 2- метилбутана?
а) 2
б) 1
в) 3
г) 4
24. Укажите названия алкенов, для которых возможна геометрическая изомерия:
а) 1,1 – дихлорэтен
б) 1,2 – дихлорэтен
в) винилхлорид
г) бутен – 2
25. Присоединение каких веществ к алкенам объясняется с помощью правила Марковникова?
а) водород
б) хлороводород
в) вода
г) бром
26. Какие вещества обесцвечивают бромную воду?
а) полиэтилен
б) цис – 2- бутен
в) транс- 2- пентен
г) 2- хлор-2- бутен
27. Реакцией Лебедева называется реакция получения:
а) 1,3 – бутадиена из этилена
б) 1,3 – бутадиена из винилхлорида
в) 1,3- бутадиена из бутана
г) 1,3- бутадиена из этанола
28. Изопрен можно получить при дегидрировании:
а) метана
б) бутана
в) 2- метилбутена
г) 1,3- бутадиена
29. При взаимодействии 1моль водорода и 1моль бутадиена -1,3 преимущественно образуется:
а.) бутан
б) бутен- 1
в) бутен- 2
г) циклобутан
30. В результате вулканизации каучука можно получить:
а) гуттаперчу
б) резину
в) эбонит
г) фенопласт
31. С какими веществами реагирует 1,3- бутадиен?
а) бром
б) водород
в) кислород
г) хлороводород
32. При взаимодействии между собой трех молекул ацетилена в присутствии катализатора при нагревании получается?
а) ацетальдегид
б) винилацетилен
в) винилхлорид
г) бензол
33. По реакции Кучерова получают:
а) из этанола 1,3- бутадиен
б) из ацетилена винилацетилен
в) из ацетилена ацетальдегид
г) из хлорэтана этан
34. В молекуле какого вещества длина связи между атомами углерода наименьшая?
а) пропан
б) этен
в) этин
г) этан
35. В молекуле алкина 8 атомов углерода. Укажите значение молярной массы алкина (г/ моль)
а) 110
б) 112
в) 114
г) 108
36. Пропин можно получить:
а) гидрированием пропена
б) дегидрированием пропена
в) дегидрированием пропана
г) гидрированием одной двойной связи пропадиена
37. Охарактеризуйте тройную связь между атомами углерода
а) короче одинарной, но длинее двойной
б) короче и одинарной, и двойной связи
в) прочнее и одинарной, и двойной связи
г) энергия равна утроенной энергии одинарной связи
38. Как изменяется массовая доля углерода в алкинах с возрастанием молярной массы алкина7
а) уменьшается
б) возрастает
в) не изменяется
39. С каким веществом реагирует как пропан, так и пропин?
а) водородом
б) бромной водой
в) кислородом
г) водой
40. Ацетилен можно получить:
а) восстановлением этилена водородом
б) взаимодействием карбида кальция с водой
в) дегидрированием этана
г) крекингом метана
41. Укажите число изомерных алкинов состава 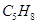
а) 2
б) 3
в) 4
г) 5
42. Как изменяется прочность связи между атомами углерода в ряду этан-этен-этин?
а) уменьшается
б) возрастает
в) не изменяется
г) наиболее слабая в этане, наиболее прочная в этине
43. Ацетилен можно превратить в ацетальдегид реакцией:
а) гидрирования
б) гидратации в присутствии сульфата ртути
в) окисления подкисленным водным раствором перманганата калия
г) горения
44. При окислении этилена водным раствором перманганата калия образуется:
а) уксусная кислота
б) этиленгликоль
в) глицерин
г) водород
45. Алкен можно получить при:
а) при крекинге пентана
б) при взаимодействии 1- хлорпропана со спиртовым раствором гидроксида калия
в) при дегалогенировании 1,2- дихлорэтана
г) при взаимодействии 1 моль пропина с 2 моль водорода
ЛИТЕРАТУРА
1. О. В. Байдалина. О прикладном аспекте химических знаний // Химия в школе, 2005, № 5, с. 45-47.
2.Ахметов Н. С. Учебник для 10класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
3.Рудзитис Г. Е., Фельдман Р. Г. Учебник для 10 класса средней школы. М.: Просвещение, 1992.
4 Майоров А.Н. Теория и практика создания тестов для системы образования. - М., "Интеллект центр", 2001. - 296 с.
5. Деревянкина, С.Е. Клинков, Т.А. Монастырская Вопросы экологии на уроках химии// Химия в школе, 2005, № 1,с.4-7
6.Единый государственный экзамен 2002: Контрольные измерительные материалы: Химия / А. А. Каверина, Д. Ю. Добротин, М. Г. Снастина и др.; М.: Просвещение, 2002. – с. 39 – 51.
7.Химия: Большой справочник для школьников и поступающих в вузы / Е. А. Алферова, Н. С. Ахметов, Н. В. Богомолова и др. М.: Дрофа, 1999. с. 430-438
8.Р. П. Суровцева, С. В. Сафронов. Задания для самостоятельной работы по химии. М.: Просвещение, 1993 г.
9.Борисев М. И. Н., Методика преподавания химии, т. 2, 1954
10.. Несмеянов А. Н., Несмеянов Н.А. «Начала органической химии», т.2, М.:Химия, 1969 - 826 с.
11.Чернобельская Г. М. Методика обучения химии в средней школе: Учеб. для студ. высш. учеб. заведений. — М.: Владос, 2000. — 336 с.
12.О. С. Зайцев. Методика обучения химии: Теоретический и прикладной аспекты. – М.: Гуманит. изд. ВЛАДОС, 1999. – 358 с.
13.Г. П. Хомченко. Пособие по химии для поступающих в вузы. М.: Просвещение, 1999 г. – 228 с.
14. Лидин Р.А. Химия: Руководство к экзаменам / Р.А. Лидин, В.Б. Маргулис. – М.: ООО Издательство «АСТ»: ООО «Издательство Астрель», 2003. 207 с.
|