| Функциональные производные карбоновых кислот. Двухосновные карбоновые кислоты.
a
,
b
-Ненасыщенные кислоты
Производные карбоновых кислот
1. Галогенангидриды
.
При действии галогенидов фосфора или хлористого тионила происходит образование галогенагидридов:
CH
3
COOH
+
PCl
5
®
CH
3
COCl
+
POCl
3
+
HCl
Галоген в галогенангидридах обладает большой реакционной способностью. Сильный индукционный эффект определяет легкость замещения галогена другими нуклеофилами: -
OH
, -
OR
, -
NH
2, -
N
3, -
CN
и др.:
CH3
COCl + CH3
COOAg
®
(CH3
CO)2
O
уксусный ангидрид + AgCl
1. Ангидриды.
Ангидриды образуются при взаимодействии солей кислот с их галогенангидридами:
CH
3
COONa
+
CH
3
COCl
®
NaCl
+ (
CH
3
CO
)2
O
Ангидриды кислот обладают большой химической активностью и являются, как и галогенангидриды, хорошими ацилирующими агентами.
2. Амиды
.
Амиды получают через галогенангидриды
CH3
COCl +2 NH3
®
CH3
CONH2
ацетамид
+ NH4
Cl
или из аммонийных солей кислот, при сухой перегонке которых отщепляется вода и образуется амид кислоты. Также амиды кислот образуются как побочный продукт при гидролизе нитрилов. Процессы амидирования имеют важное значение в промышленности для производства ряда ценных соединений (N
,
N
-диметилформамид, диметилацетамид, этаноламиды высших кислот).
4. Нитрилы
. Важнейшими представителями нитрилов являются ацетонитрил CH
3
CN
(применяется как полярный растворитель) и акрилонитрил CH
2
=
CHCN
(мономер для получения синтетического волокна нейрона и для производства дивинилнитрильного синтетического каучука, обладающего масло- и бензостойкостью). Основным способом получения нитрилов является дегидратация амидов на кислотных катализаторах:
CH
3
CONH
2
®
CH
3
C
-
CN
+
H
2
O
5. Сложные эфиры
. Сложные эфиры карбоновых кислот имеют важное практическое значение в качестве растворителей, гидравлических жидкостей, смазочных масел, пластификаторов и мономеров. Их получают этерификацией спиртов кислотами, ангидридами и галогенангидридами или взаимодействием кислот и алкенов:
CH3
-CH=CH2
+ CH3
COOH
®
CH3
COOCH(CH3
)2
Многие эфиры используются в качестве душистых веществ:
Реклама

| CH3
COOCH2
CH3
|
грушевая эссенция
|
| CH3
CH2
CH2
COOCH2
CH2
CH2
CH2
CH3
|
ананасовая эссенция
|
| HCOOCH2
CH3
|
ромовая эссенция
|
Двухосновные насыщенные кислоты
Двухосновные предельные (насыщенные) кислоты имеют общую формулу Cn
H
2
n
(
COOH
)2
. Из них важнейшими являются:
НООС-СООН
- щавелевая, этандикарбоновая кислота;
НООС-СН2
-СООН
- малоновая, пропандикарбоновая кислота;
НООС-СН2
-СН2
-СООН
- янтарная, бутандикарбоновая кислота;
НООС-СН2
-СН2
-СН2
-СООН
- глутаровая, пентандикарбоновая кислота.
Способы получения
Общие методы получения двухосновных кислот аналогичны способам получения одноосновных кислот (окисление гликолей, гидролиз динитрилов, синтез Кольбе - см. Лекцию№27).
1. Окисление оксикислот
:
OH-CH2
CH2
COOH
®
HOCCH2
COOH
®
HOOC-CH2
-COOH
2. Окисление циклоалканов
.
Это промышленный способ получения адипиновой кислоты HOOC
-
CH
2
CH
2
CH
2
CH
2
-
COOH
из циклогексана.
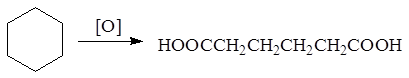
Побочно образуются также янтарная и щавелевая кислоты. Адипиновая кислота применяется для синтеза волокна найлон 6,6
и пластификаторов.
Химические свойства
Двухосновные кислоты более сильные, чем одноосновные. Это объясняется взаимным влиянием карбоксильных групп, облегчающих диссоциацию:
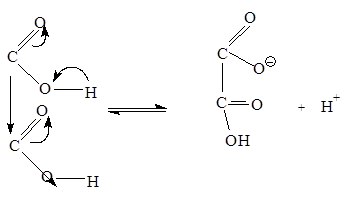
В целом реакции дикарбоновых кислот и их монокарбоновых аналогов почти не различаются между собой. Механизм реакций образования диамидов, диэфиров и др. из карбоновых кислот тот же, что и для монокарбоновых кислот. Исключение составляют дикарбоновые кислоты, содержащие меньше четырех атомов углерода между карбоксильными группами. Такие кислоты, две карбоксильные группы которых способны реагировать с одной функциональной группой или друг с другом, обнаруживают необычное поведение в реакциях, протекающих с образованием пяти- или шестичленных замкнутых активированных комплексов или продуктов.
Примером необычного поведения карбоновых кислот могут служить реакции, протекающие при нагревании.
1. Декарбоксилирование
.
При 150 о
С щавелевая кислота разлагается на муравьиную кислоту и СО2
:
HOOC-COOH
®
HCOOH + CO2
2. Циклодегидратация
.
При нагревании g
-дикарбоновых кислот, у которых карбоксильные группы разделены атомами углерода, происходит циклодегидратация, в результате чего образуются циклические ангидриды:
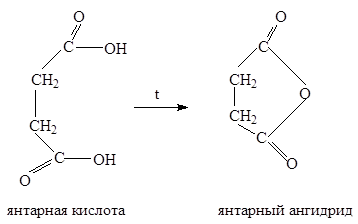
3. Синтезы на основе малонового эфира
.
Двухосновные кислоты с двумя карбоксильными группами при одном углеродном атоме, т.е. малоновая кислота и ее моно- и дизамещенные гомологи, при нагревании несколько выше их температур плавления разлагаются (подвергаются декарбоксилированию
) с отщеплением одной карбоксильной группы и образованием уксусной кислоты или ее моно- и дизамещенных гомологов:
Реклама

HOOCCH2
COOH
®
CH3
COOH + CO2
HOOCCH(CH3
)COOH
®
CH3CH2COOH + CO2
HOOCC(CH3
)2
COOH
®
(CH3)2
CHCOOH + CO2
Атомы водорода метиленовой группы, находящейся между ацильными группами диэтилового эфира малоновой кислоты (малоновый эфир
), обладают кислотными свойствами и дают натриевую соль с этилатом натрия. Эту соль – натрий-малоновый эфир
– алкилируют по механизму нуклеофильного замещения SN
2
. На основе натрий-малонового эфира получают одно- и двухосновные кислоты:
[CH(COOCH2
CH3
)2
]-
Na+
+ RBr
®
RCH(COOCH2
CH3
)2
+ 2 H2
O
®
R-CH(COOH)2
алкилмалоновая
кислота
®
R-CH2
COOH
алкилуксусная
кислота
+ CO2
4. Пиролиз кальциевых и бариевых солей
.
При пиролизе кальциевых или бариевых солей адипиновой
(С6
), пимелиновой
(С7
) и пробковой
(С8
) кислот происходит отщепление СО2
и образуются циклические кетоны:
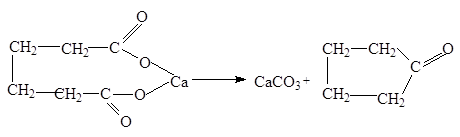
Непредельные одноосновные карбоновые кислоты
Непредельные одноосновные кислоты этиленового ряда имеют общую формулу Cn
H
2
n
-1
COOH
, ацетиленового и диэтиленового рядов - Cn
H
2
n
-3
COOH
. Примеры непредельных одноосновных кислот:
| CH2
=CHCOOH
|
акриловая кислота, пропеновая кислота
|
| CH2
=CHCH2
COOH
|
винилуксусная кислота, 3-бутеновая кислота
|
| CH3
CH=CHCOOH
|
кротоновая кислота, 2-бутеновая кислота
|
| CH2
=C(CH3
)COOH
|
a-метилакриловая кислота, метакриловая кислота, метилпропеновая кислота
|
| CH
º
CCOOH
|
пропиоловая (пропиновая) кислота
|
| CH3
CH2
CH=CHCH2
CH=CH(CH2
)7
COOH
|
линоленовая кислота
|
Непредельные одноосновные кислоты отличаются от предельных большими константами диссоциации. Ненасыщенные кислоты образуют все обычные производные кислот - соли, ангидриды, галогенангидриды, амиды, сложные эфиры и др. Но за счет кратных связей они вступают в реакции присоединения, окисления и полимеризации.
Благодаря взаимному влиянию карбоксильной группы и кратной связи присоединение галогенводородов к a,b-непредельным кислотам происходит таким образом, что водород направляется к наименее гидрогенизированному атому углерода:
CH
2
=
CHCOOH
+
HBr
®
BrCH
2
CH
2
COOH
b
-бромпропионовая кислота
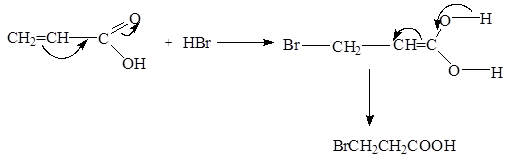
Этиленовые кислоты типа акриловой кислоты и их эфиры значительно легче подвергаются полимеризации, чем соответствующие углеводороды.
отдельные представители
Акриловую кислоту
получают из этилена (через хлоргидрин или оксид этилена), гидролизом акрилонитрила или окислением пропилена, что более эффективно. В технике используются производные акриловой кислоты - ее эфиры, особенно метиловый (метилакрилат
). Метилакрилат легко полимеризуется с образованием прозрачных стекловидных веществ, поэтому его применяют в производстве органического стекла и других ценных полимеров.
Метакриловая кислота
и ее эфиры получают в больших масштабах методами, сходными с методами синтеза акриловой кислоты и ее эфиров. Исходным продуктом является ацетон, из которого получают ацетонциангидрин, подвергают дегидратации и омылению с образованием метакриловой кислоты. Этерификацией метиловым спиртом получают метилметакрилат, который при полимеризации или сополимеризации образует стекловидные полимеры (органические стекла) с весьма ценными техническими свойствами.
Двухосновные ненасыщенные кислоты
Наиболее простые ненасыщенные двухосновные кислоты - фумаровая
и малеиновая
- имеют одну и ту же структурную формулу HOOCCH
=
CHCOOH
, но разную пространственную конфигурацию: фумаровая - транс
-, малеиновая - цис
-. Малеиновая кислота (лабильная форма) под действием брома, йода, азотистой кислоты легко переходит в устойчивую (стабильную) форму - фумаровую кислоту. Обратный переход осуществляется под действием ультрафиолетовых лучей. Малеиновая кислота в технических масштабах получается каталитическим окислением бензола и нафталина кислородом воздуха.
Обе кислоты способны образовывать соли, сложные эфиры, амиды и некоторые другие производные кислот. Однако, малеиновая кислота, в отличие от фумаровой, легко образует циклический ангидрид, так как обе карбоксильные группы расположены по одну сторону от двойной связи (цис
-изомер). Малеиновый ангидрид служит характерным реактивом для обнаружения 1,3-диеновых соединений: он легко вступает в реакцию диенового синтеза и во многих случаях дает ценные продукты. Малеиновый ангидрид широко применяется при производстве полиэфирных смол и сополимеров со стиролом, акриловым и метакриловым эфирами. Гидратацией малеинового ангидрида получают яблочную кислоту, применяемую в пищевой промышленности.
Монокарбоновые кислоты ароматического ряда
Ароматическими карбоновыми кислотами
называются производные бензола, содержащие карбоксильные группы, непосредственно связанные с ароматическим ядром. Кислоты, содержащие карбоксильные группы в боковой цепи, рассматриваются как жирноароматические
. По количеству карбокисльных групп ароматические кислоты делятся на одно-, двухосновные и т.д. Название кислоты производится от ароматического углеводорода (бензойная кислота, п
-толуиловая кислота).
Способы получения
1. Окисление ароматических углеводородов
.
Для синтеза ароматических кислот наиболее подходят метильные гомологи бензола, радикально-цепное окисление которых протекает через стадии первичного гидропероксида и альдегида:
ArCH3
+ O2
®
ArCH2
OOH
®
ArCHO+ O2
®
ArCOOH
Жидкофазным окислением метилбензолов кислородом воздуха в промышленности получают моно- и дикарбоновые ароматические кислоты.
2. Окисление спиртов, альдегидов и кетонов
.
Ароматические спирты, альдегиды и кетоны окисляются легче, чем углеводороды. Окисление обычно ведут с помощью гипохлоритов по схеме:
C
6
H
5
-
CO
-
CH
3
+ 4
NaOCl
®
C
6
H
5
-
COOH
+
NaCl
+
H
2
O
+
CO
2
3. Гидролиз галогенпроизводных
.
Этот способ широко применяется в технике.
C
6
H
5
CCl
3
+ 2
H
2
O
®
C
6
H
5
COOH
+ 3
HCl
При хлорировании толуола получают три вида галогенпроизводных: хлористый бензил для производства бензилового спирта; хлористый бензилиден – для получения бензальдегида; бензотрихлорид перерабатывается на бензойную кислоту.
4. Синтез
Гриньяра
.
C6
H5
Li + CO2
®
C6
H5
COOLi + LiBr
Химические свойства
В водных растворах монокарбоновые кислоты обнаруживают большую степень диссоциации, чем алифатические кислоты (Ка бензойная к-та
=6,6×10-5
, Ка уксусная к-та
=1,8×10-5
). Большая степень диссоциации бензойной кислоты обусловлена электрофильным характером бензольного кольца:
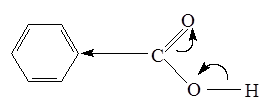
Кислотность ароматических кислот почти не зависит от резонансных эффектов.
Ароматические кислоты вступают во все те реакции, которые свойственны и кислотам жирного ряда. За счет карбоксильной группы образуются различные производные кислот: действием кислот на щелочи и карбонаты получаются соли
, эфиры
- нагреванием смеси кислоты и спирта в присутствии минеральной кислоты.
Если заместителей в орто
-положении нет, то этерификация карбоксильной группы происходит так же легко, как и в случае алифатических кислот. Если одно из орто
-положений замещено, то скорость этерификации сильно уменьшается, а если заняты оба орто
-положения, то этерификация не идет.
Эфиры орто
-замещенных бензойных кислот могут быть приготовлены при реакции серебряных солей с галогеналканами. Они с трудом подвергаются гидролизу. Такое явление носит название пространственных (стерических) затруднений.
Группы, большие, чем водород, в такой степени заполняют пространство вокруг углеродного атома карбоксильной группы, что затрудняет переход в промежуточное состояние при образовании или омылении эфира.
Хлорангидриды
получаются действием на кислоты хлористого тионила или пятихлористого фосфора:
C
6
H
5
COOH
+
SOCl
2
®
C
6
H
5
COCl
+
HCl
+
SO
2
Ангидриды
получают перегонкой смеси кислоты с уксусным ангидридом или действием хлорангидридов на соли:
C
6
H
5
COCl
+
NaOOCC
6
H
5
®
(
C
6
H
5
CO
)2
O
+ 2
NaCl
При сплавлении соли ароматической карбоновой кислоты со щелочью карбоксильная группа замещается на водород:
C
6
H
5
COONa
+
NaOH
®
ArH
+
Na
2
CO
3
Важнейшие представители
1. Бензойная кислота
.
Основными способами получения бензойной кислоты являются окисление толуола и декарбоксилирование фталевой кислоты. Применяется в качестве консерванта в пищевой промышленности вследствие сильного антисептического действия, а также в производстве красителей и душистых веществ. Очень важным производным бензойной кислоты является ее хлорангидрид - хлористый бензоил
. Это жидкость с характерным запахом и сильным лакриматорным действием.
2.
п-трет
-Бутилбензойная кислота
получается в промышленных масштабах окислением трет
-бутилтолуола в присутствии растворимой соли кобальта в качестве катализатора. Применяется в производстве полиэфирных смол.
Дикарбоновые ароматические кислоты
Известно три бензолдикарбоновых кислоты: фталевая
(о
-изомер), изофталевая
(м
-изомер) и терефталевая
(п
-изомер). Терефталевая кислота является кристаллическим веществом (Т возг
. 300о
С), по сравнению с изомерными кислотами наименее растворима в воде и органических жидкостях. Терефталевая кислота и ее диметиловый эфир играют важную роль в производстве синтетического волокна лавсан
(терилен
) - продукта их поликонденсации с этиленгликолем. Терефталевую кислоту получают окислением п
-ксилола.
Изофталевая кислота применяется для производства полиэфиров. Ее получают аналогично терефталевой кислоте - жидкофазным окислением м
-ксилола.
|