|
Функциональные замещенные алициклических и ароматических соединений
1. Галогенпроизводные предельных углеводородов
С галогенпроизводных углеводородов начинается изучение функциональных замещенных.
Большинство органических соединений состоит из различных группировок атомов, связанных с помощью ковалентной связи с основой из атомов углерода (наз. Углеродным скелетом).
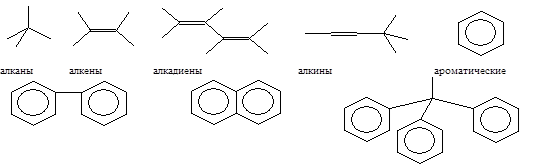
Эти группировки атомов являются функциональными группами и они участвуют в большинстве химических реакций.
Наиболее распростроненные функциональные группы органических соединений
| Группа
|
Структура
|
Класс
|
| Галоид- бром, хлор
|
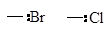
|
|
| Окси-
|
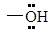
|
|
| Эфирная
|
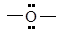
|
|
| Перокси-
|
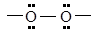
|
|
| Карбонильная
|
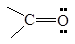
|
|
| Альдегидная
|
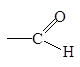
|
|
| Карбоксильная
|
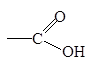
|
|
| Амино
|
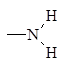
|
|
| Нитро
|
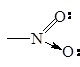
|
|
| Азо-
|
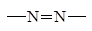
|
|
| Нитрозо-
|
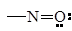
|
|
| Диазо-
|
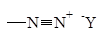
|
|
2. Изомерия
Изомерия галогенпроизводных зависит от строения углеводородного скелета и положения атома галогена в цепи СnH2n+1Hlg.
Номенклатура:

3. Характер связи С-Hlg
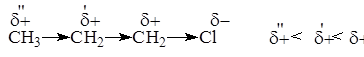
| |
Длина
|
Энергия
|
Поляризуемость, см2
|
| C-Br
|
0,194
|
276
|
9,4
|
| C-Cl
|
0,176
|
330
|
6,5
|
| C-F
|
0,140
|
485
|
1,6
|
4. Методы получения
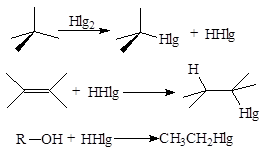
Промышленные способы:
· Галогенирование алканов
· Присоединение к алкенам
· Замещение гидроксильной группы в спиртах
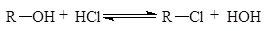
Реакция обратимая. Относится к реакциям SN. Ранее мы познакомились с реакциями SR (химические свойства алканов), SE (химические свойства ароматических углеводородов).
Для замещения гидроксильной группы используют галогениды фосфора (PCl3, PCl5) и галогениды серы (SOCl2).
Эти методы чаще используются в лабораторной практике:
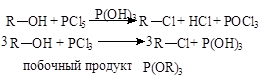
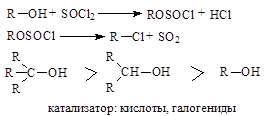
5. Химические свойства
Химические свойства определяются характером связи С-Hlg. Это реакции замещения, но ионного нуклеофильного замещения SN. Замещение может сопровождаться отщеплением Е.
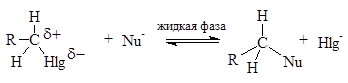
Без сольватации нет диссоциации, нет взаимодействия. Растворители - ацетон, спирты, вода, диоксан, аммиак (ж.), ДМСО, ДМФА.
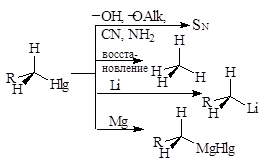
Примеры:
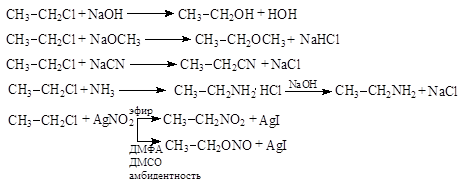
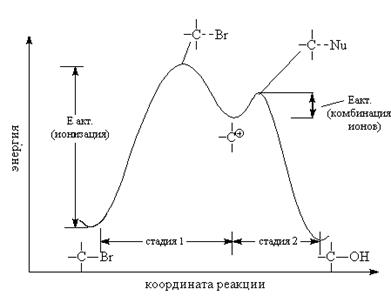
6. Механизм реакции SN
Существует два основных типа реакций ионного замещения алифатических соединений: SN2 и SN1.
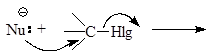
Нуклеофилом называется атом (или частица), который может отдать пару электронов любому элементу, иному чем водород. Hlg, который вытесняется (замещается) уходящей группой.
Реакция SN2
Энергетический профиль SN2-замещения
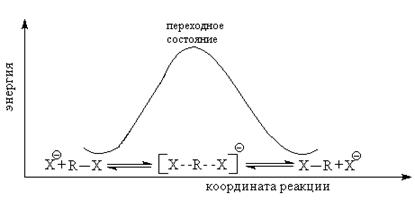
Частичное связывание между нуклеофилом, уходящей группой и атакуемым атомом обозначается пунктирной линией. Вцелом реакция проходит с обращением относительной конфигурации, это обращение называется вальденовским (Вальден, 1893).
Реклама

В реакции принимают участие 2 частицы и скорость реакции определяется концентрацией как галоид алкила так и нуклеофила.
Влияние алкильных заместителей на скорость реакции.
По сравнению с другими гидридными состояниями углерода реакции SN2 наиболее легко протекают у sp3-гибридизованного атома.
| Алкильная группа
|
Относительная скорость замещения
|
| 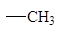
|
30
|
| 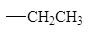
|
1
|
| 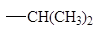
|
0,03
|
| 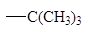
|
0
|
Влияние растворителя
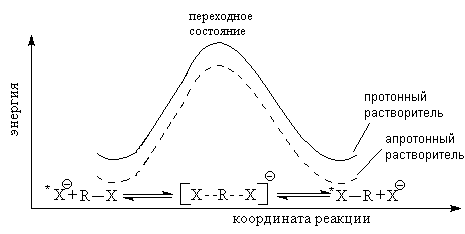
При увеличении полярности растворителя исходное соединение стабилизируется в большей степени, чем активированный комплекс, а стало быть, и энергия активации.
Порядок реакционноспособности нуклеофилов в протонных растворителях следующий:
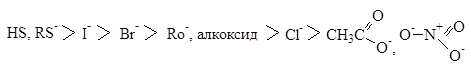
Ряд нуклеофильности галогенов:
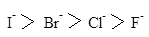
Ряд уменьшения способности быть уходящей группой:
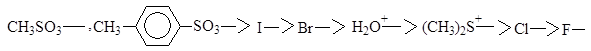
Реакция SN1
Характерна для третичных и вторичных алкилгалогенидов. SN1-реакция не является согласованным процессом и состоит из двух отдельных стадий:
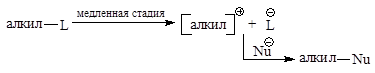

Скорость реакции зависит от концентрации бромистого алкила.
О стабильности карбкатионов, с которыми уже встречались при дегидратации спиртов:
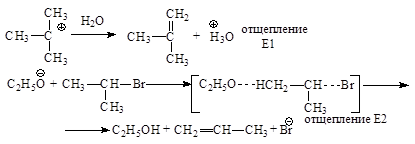
Действие хлора на углеродсодержащие вещества уже давно привлекало внимание многих химиков. Известно, что еще в 1815 г. Гей-Люсссак, обработав цианистоводородную кислоту хлором, обнаружил, что она превращается в хлорциан 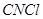 . Позже он же обратил внимание на то, что при отбеливании воска хлором последний поглощается воском, который при этом теряет равный хлору объем водорода. . Позже он же обратил внимание на то, что при отбеливании воска хлором последний поглощается воском, который при этом теряет равный хлору объем водорода.
В 1821 г. Фарадеем было показано, что масло голландских химиков (дихлорэтан) при продолжительном действии на него хлора превращается в новый продукт — шестихлористый углерод 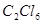 , известный в настоящее время под названием гексахлорэтана. В этом случае было также обращено внимание на замену водорода равным объемом хлора. , известный в настоящее время под названием гексахлорэтана. В этом случае было также обращено внимание на замену водорода равным объемом хлора.
Исследуя бензольные соединения, Велер и Либих (1822 г.) установили, что хлор превращает соединение 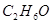 , называвшееся в то время гидридом бензоила в хлористый бензоил: , называвшееся в то время гидридом бензоила в хлористый бензоил: 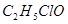 , с замещением одного атома водорода хлором и выделением эквивалентного количества хлористого водород. , с замещением одного атома водорода хлором и выделением эквивалентного количества хлористого водород.
Таким образом, уже в начале XIX столетия ученые располагали фактами, доказывающими способность водорода в органических соединениях замещаться хлором с выделением хлористого водорода и одновременным образованием соответствующих хлорорганических продуктов. Однако эти отдельные факты не были использованы для каких-либо обобщающих выводов.
В 1834 г. знаменитый французский химик Дюма обратил внимание на выделение хлористого водорода при горении свечей, сделанных из воска, предварительно обрабатывавшегося в те времена хлором для отбеливания. Сопоставляя наблюдаемое им явление с указанными выше фактами, открытыми до него другими химиками, Дюма впервые пытается обобщить эти явления и установить характеризующие их общие закономерности. Он приходит к формулировке эмпирического закона замещения, согласно которому «если тело, содержащее водород, подвергается дегидрирующему действию хлора (или другого галоида или кислорода), то на каждый потерянный атом водорода оно (тело) присоединяет один атом галоида (или половину атома кислорода)».
Реклама

Положения, высказанные Дюма, несомненно, способствовали появлению многих последующих теоретических и экспериментальных исследований по реакции замещения вообще и по хлорированию в частности.
Глава русской химической школы органиков А.М. Бутлеров, создавая теорию строения органических соединений и рассматривая разносторонние химические превращения их, большое внимание уделял реакциям галоидирования, в том числе хлорирования углеводородов и их производных.
Капитальным вкладом в разработку теоретических основ реакций хлорирования парафиновых углеводородов явились известные исследования В.В. Марковникова по теории взаимного влияния атомов в молекулах химических соединений. Пользуясь большим экспериментальным материалом, В.В. Марковников сформулировал ряд частных и общих закономерностей, скромно названных им «Правилами». Прежде всего, он обращает внимание на процессы замещения водорода в углеводородах хлором и кислородом.
|