| Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
«САМАРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Инженерно-технологический факультет
Кафедра органической химии
Синтез бензальанилина
Курсовая работа
Выполнила студентка
3 курса, 3 группы
Павлышина Наталья Владимировна
Научный руководитель
Д.х.н., профессор Ширяев А.К.
Работа защищена
«___»________________2007г.
Оценка____________________
Зав. кафедрой
Д.х.н., Климочкин Ю.Н.
САМАРА 2007
Цель работы: провести литературный обзор по аминам. Синтезировать бензальанилин.
Амины – производные аммиака, в которых атомы водорода замещены углеводородными группами. Атом азота в аминах может быть связан с одним, двумя или тремя углеводородными заместителями. Различают:
 первичные амины первичные амины
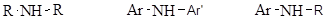 вторичные амины вторичные амины
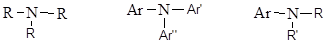 третичные амины третичные амины
где R, R’, R’’ – алкильные группы, а Ar, Ar’, Ar’’ – арильные группы.
Первичные и вторичные амины способны образовывать межмолекулярные водородные связи. Поэтому амины имеют более высокие температуры кипения, чем неполярные соединения с той же молекулярной массой. Спирты и карбоновые кислоты образуют более прочные водородные связи, чем амины. Поскольку третичные амины не содержат водородных атомов при атоме азота, они не образуют водородных связей. Низкомолекулярные амины смешиваются с водой в любых соотношениях.
Изомерия в ряду алифатических аминов связана с изомерией углеводородного радикала и количеством заместителей у атома азота (метамерия).
Амины, чаще в виде полифункциональных производных, находят применение, являясь обычно полупродуктами в органических синтезах. Получаются с применением аминов такие лекарственные препараты, как новокаин, спазмолитин, парацетамол, сульфаниламидные препараты. Широкое применение нашли соединения с упрощенной адреналиновой структурой, такие, как эфедрин (а), амфетамин (b), первитин (c) и т.д.

Эти соединения, обладая структурой близкой к структуре адреналина, оказывают стимулирующее, возбуждающее действие, но более сильное и продолжительное.
Термо- и светостабилизаторы [4]:

модификаторы резин, вулканизирующие агенты:

Мономеры для синтеза полиамидов [2,3]:

Красители:


Фотореактивы:
Реклама


Метиламин применяется в производстве инсектицидов, фунгицидов, ускорителей вулканизации, поверхностно-активных веществ, красителей, ракетных топлив, растворителей.
Триэтиламин применяется в производстве ускорителей вулканизации, ингибиторов коррозии, растворитель.
Анилин: производство N,N-диметиланилина, дифениламина, лекарственных средств, антиоксидантов, ускорителей вулканизации и фотоматериалов.
Некоторые амины применяются как селективные растворители для извлечения урана из сернокислых растворов. Амины, обладающие запахом рыбы, используются как приманка в борьбе с полевыми грызунами.
Третичные амины и соли четвертичных аммониевых оснований получили широкое распространение в качестве катализаторов межфазного переноса в органическом синтезе.
2.
ЛИТЕРАТУРНЫЙ ОБЗОР
2.1. Методы синтеза аминов
2.1.1. Получение первичных аминов
1. Восстановление нитросоединений (реакция Зинина)
В качестве восстановителей используются железо и соляная или серная кислоты, олово и соляная кислота, сероводород и сернистые щелочи, гидросульфиты, водород в присутствии катализаторов. Восстановление также можно осуществить электролитически.
Ar-NO2 + 2 H2 → Ar-NH2 + 2 H2O
Например нитробензол восстанавливается до анилина гидросульфидом натрия в воде или хлоридом олова с соляной кислоте.

2. Аммонолиз арилгалогенидов (алкилирование аммиака арилгалогенидами)
Ароматические амины получают из арилгалогенидов и аммиака:
Ar-Cl + 2 NH3 → Ar-NH2 + NH4Cl
Вследствие малой подвижности галогена реакцию приходится вести при высоких давлениях, температурах, в присутствии катализаторов - меди и ее солей. Только в тех случаях, когда в о- или п-положении к галогену находятся сильно электроноакцепторные группы, например, нитрогруппа, галоген легко замещается на аминогруппу.

Ароматические вторичные амины получают нагреванием ароматических аминов с их солями:
Ar-NH2 + Ar-NH2∙HCl → Ar2NH + NH4Cl
Вторичные жирноароматические амины получают алкилированием первичных ароматических аминов галогенпроизводными или спиртами.
2.1.3. Получение третичных аминов
Третичные ароматические амины получают алкилированием или арилированием первичных или вторичных аминов:
C6H5-NH2 + 2 CH3OH → C6H5-N(CH3)2 + 2 H2O
Менее доступные третичные ароматические амины получают нагреванием вторичных аминов с арилиодидами в присутствии медного порошка:
(C6H5)2NH + C6H5I → (C6H5)3N + HI
Химические свойства аминов определяются наличием и характером (первичная, вторичная, третичная) аминогруппы [5].
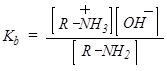
Увеличение Кb означает повышение основности
Реклама

Таблица 1. Константы основности аммиака и некоторых аминов
| Вещество
|
Кb
|
| Аммиак
|
1,8·10-5
|
| Метиламин
|
4,5·10-4
|
| Этиламин
|
5,1·10-4
|
| Диэтиламин
|
10,0·10-4
|
| Триэтиламин
|
5,6·10-4
|
Как видно из этого примера, замена атомов водорода на алкильные группы увеличивает основность азота. Это согласуется с электронно донорной природой алкильных групп, стабилизирующих сопряженную кислоту амина R3NH+ и тем самым повышающим его основность. Дополнительная стабилизация сопряженной кислоты амина происходит за счет эффекта сольватации молекулами растворителя. Триэтиламин обладает несколько меньшей основностью, чем диэтиламин. Полагают, что это вызвано уменьшением эффекта сольватации. Поскольку пространство вокруг атома азота занято алкильными группами, стабилизация на нем положительного заряда молекулами растворителя затруднена. В газовой фазе, где нет влияния молекул растворителя, триэтиламин обладает большей основностью, чем диэтиламин.
2.2.1. Химические свойства ароматических аминов
Ароматические амины имеют менее выраженный основный характер, чем алифатические. Так, Кb метиламина составляет 4,5·10-4, тогда как для анилина 3,8∙10-10. Уменьшение основности анилина по сравнению с алифатическими аминами объясняется взаимодействием неподеленной пары электронов азота с электронами ароматического ядра - их сопряжением. Сопряжение уменьшает способность неподеленной электронной пары присоединять протон.
Присутствие электроноакцепторных групп в ядре уменьшает основность. Например, константа основности для о-, м- и п-нитроанилинов составляет соответственно 1∙10-14, 4∙10-12 и 1∙10-12. Ведение второго ароматического ядра также заметно уменьшает основность (для дифениламина ~7,6∙10-14). Дифениламин образует сильно гидролизующиеся в растворах соли только с сильными кислотами. Трифениламин основными свойствами практически не обладает.
С другой стороны, введение алкильных групп (электронодонорные группы) увеличивает основность (Кb N-метиланилина и N,N-диметиланилина равны соответственно 7,1∙10-10 и 1,1∙10-9)
1. Алкилирование ароматических аминов
Ароматические амины способны замещать водород аминогруппы на алкилы. Эта реакция приводит к вторичным и третичным аминам:
C6H5NH2 + CH3I → C6H5-NH-CH3 + CH3I → C6H5-N(CH3)2
Алкилирование ведут спиртами или хлоралаканами, в качестве катализаторов используют соли одновалентной меди в виде аммиачных комплексов. Важно, что процесс алкилирования является последовательно-параллельным. Это обусловлено тем, что образовавшийся амин, в свою очередь, способен реагировать с алкилирующим агентом. Состав продуктов зависит от соотношения реагентов.
2. Ацилирование ароматических аминов
При действии ацилирующих агентов (кислоты, ангидриды, хлорангидриды) водородные атомы аминогруппы замещаются на ацильные остатки.

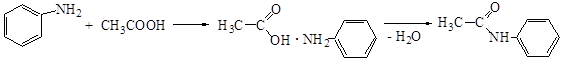
Ацильные производные не обладают основными свойствами. Они обладают устойчивостью к окислителям и потому используются в качестве промежуточных веществ в реакциях аминов в присутствии окислителей, например, нитрования.
3. Синтез азометинов (оснований Шиффа)
При слабом нагревании ароматических первичных аминов с ароматическими альдегидами легко образуются так называемые основания Шиффа или азометины:
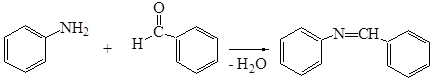
Под действием разбавленных кислот основания Шиффа гидролизуются до альдегида и амина.
4. Реакции аминов с азотистой кислотой
Первичные ароматические амины с азотистой кислотой при 0 – 5°С образуют соли диазония:

Вторичные амины при взаимодействии с азотистой кислотой образуют N-нитрозо-N-метиланилины:

Третичные амины с азотистой кислотой вступают в реакцию электрофильного замещения:

Фталимид получают при нагревании фталевого ангидрида с аммиаком:

Фталимид обладает кислотными свойствами из-за делокализации отрицательного заряда имид-аниона на двух ацильных атомах кислорода Он теряет протон, связанный с азотом, при взаимодействии с основанием типа гидроксида калия. В результате этой реакции образуется фталимид-ион - анион, который стабилизируется:


5.Нитрование Ариламинов сопровождается сильным осмолением, вплоть до самовозгорания. Ацилирование аминогруппы снижает реакционную способность кольца и защищает от окисления.
3. О
БСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Реакция синтеза бензальанилина относится к виду «присоединение-отщепление N-нуклеофилов»[1,6]. Механизм этой реакции можно показать в 5 стадиях:
Стадия 1: Медленное присоединение нуклеофила к атому углерода карбонильной группы:
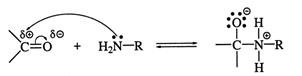
Стадия 2: перенос протона с атома азота на атом кислорода:

Стадия 3: протонированеие аддукта по гидроксильной группе:

Стадия 4: отщепление молекулы воды:
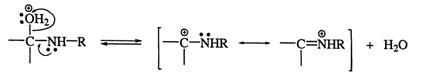
Стадия 5: дипротонирование аддукта с образованием продукта реакции:
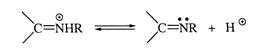
4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
4.1. Реагенты и оборудование
Реагенты:
1) Бензальдегид С7Н6О М =106; т.пл.-260С, т.кип. =178-179 0С, d201.044
2) Анилин С6Н7N М=93; т.пл.=-6,15 0С т.кип. =184,130С; d20 1.0217
3) Этанол С2Н6О М= 46; т.пл.113,30С т.кип.= 78,50С; d20 0.7893; 95%-ный.
Рекомендуется применять свежеперегнанные бензальдегид и анилин.
Оборудование:
круглодонная колба,
электрическая мешалка,
химический стакан,
водяной вакуумный насос,
воронка Бюхнера и колба Бунзена,
4.2. Синтез бензальанилина
Реагенты: бензальдегид 3.0мл, анилин 2.5мл, этанол.

В колбу, снабженную мешалкой к 3.0мл (0.03 моль) бензальдегида при хорошем перемешивании прибавляют 2.5мл (0.03 моль) анилина. Реакция сопровождается разогреванием и выделением воды. Дают выдержку 1 час, смесь выливают в химический стакан, содержащий 4,6 мл 95% спирта. Через некоторое время наблюдается выпадение кристаллов. Раствор охлаждают льдом, осадок отфильтровывают, сушат.
Выход 4.6 г (85% от теоретического), т.пл. 520С.
Рассмотрены методы синтеза и химические свойства аминов.
Бил синтезирован бензальанилин с достаточно большим выходом.
Реакции ароматических аминов с ароматическими альдегидами применяют для защиты аминогруппы.
1.Травень В.Ф. «Органическая химия» изд-во «Наука/Интерпереодика» М.2004
2.Баумгартен Г.Э., Петерсон Д.М., «Синтезы органических препаратов» изд-во «Мир», М., 1964
3.Кэмпбелл К.,СоммерсА., Кэмпбелл Б., «Синтезы органических препаратов», ИЛ, М., 1953
4.Дж.Теддер, А.Неуватл, А Джубб «Промышленнаяорганическая химия».
5. Н.С.Вульфсон «Препаративная органическая химия» М.,1959
6. Губен-Вейль «Методы органической химии» 1967.
|