Двухкомпонентные системы
На рис. представлены фазовые диаграммы двухкомпонентных систем вода - ПАВ: в обоих случаях использованы ионные ПАВ с одной алкильной цепью одинаковой длины. Фазовые диаграммы двухкомпонентных систем обычно представляют следующим образом: на оси ординат откладывают температуру, а на оси абсцисс - состав. Состав можно выражать различными способами: мольным отношением, мольными долями, весовыми долями или массовыми процентами. Традиционно состав выражают массовыми процентами, реже пользуются мольными соотношениями. Такие диаграммы имеют тот недостаток, что невозможно непосредственно узнать молярный состав, но поскольку стехиометрические комплексы встречаются в данных системах довольно редко, это не так уж существенно. Массовые шкалы обеспечивают более удобное разделение площади диаграммы на зоны стабильности различных фаз. Кроме того, такое представление фазовой диаграммы единственно возможно в том случае, если состав ПАВ точно неизвестен.
Фазовая диаграмма хлорида додецилтриметиламмония соответствует случаю с относительно низкой точкой Крафта, следовательно, твердые фазы играют незначительную роль. Из диаграммы видно, что изотропная мицеллярная фаза устойчива при комнатной температуре вплоть до высоких концентраций. Следующая фаза, образующаяся в системе, - кубическая фаза, построенная из дискретных глобулярных мицелл. Между этими фазами имеется область, в которой сосуществуют две фазы. Из-за трудностей упаковки глобулярных мицелл при больших объемных долях мицеллы деформируются, становятся вытянутыми, и затем образуется гексагональная фаза. Далее происходит превращение гексагональной фазы во вторую кубическую, но уже биконтинуальную фазу. При очень большой концентрации ПАВ в некоторой области устойчива ламелярная фаза, а затем твердая фаза гидратированного ПАВ. Такая последовательность фаз типична для гидрофильных ПАВ.
При более высоких температурах относительная стабильность фаз изменяется. Исчезает первая кубическая фаза, а при еще более высокой температуре устойчивой оказывается единственная жидкокристаллическая фаза - ламелярная, характерная также для неразбавленного ПАВ. При самых высоких температурах устойчив только изотропный раствор, но структура агрегатов, естественно, зависит от состава.
Фазовая диаграмма ДСН в значительной степени похожа. Однако из-за более высокой точки Крафта при обычных температурах появляются разнообразные твердые фазы. Помимо гексагональной и ламелярной фаз наблюдается множество "промежуточных" жидкокристаллических фаз с очень узкими областями существования.

Фазовая диаграмма двухкомпонентной системы хлорид додециламмония - вода. Изотропные растворы устойчивы при низких концентрациях ПАВ и повышенных температурах. Кроме того, в системе образуются жидкокристаллические фазы, а при низких температурах - кристаллические фазы.

Фазовая диаграмма двухкомпонентной системы додецилсульфат натрия - вода. В этой системе главными жидкокристаллическими фазами являются гексагональная и ламелярная фазы. Другие фазы этой системы относятся к менее распространенным промежуточным жидкокристаллическим фазам и кристаллогидратам.
Реклама

В случае ПАВ с двумя неполярными цепями фазовые диаграммы принципиально изменяются. В качестве примера на рис. представлена фазовая диаграмма системы биссульфосукцината натрия - вода и системы хлорид диоктадецилдиметиламмония - вода.

На фазовой диаграмме бинарной системы биссульфосукцинат натрия - вода доминирует ламелярная фаза. Кроме нее определены области устойчивости изотропного раствора, биконтинуальной кубической и обращенной гексагональной фаз
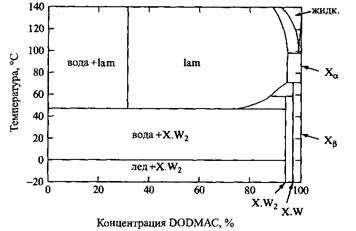
На фазовой диаграмме системы DODMAC - вода доминируют ламелярная фаза и кристаллогидраты, а также двухфазные области
Как и в случае одноцепочечных ПАВ, температура плавления цепи сильно зависит от ее длины. У DODMAC неполярные цепи длинные, и их плавление происходит при более высокой температуре. Наиболее важное свойство фазовых диаграмм ПАВ этого класса определяется низкой растворимостью в воде и, как следствие, неспособностью к мицеллообразованию. Для таких фазовых диаграмм типично наличие областей очень устойчивой ламелярной фазы и широкой двухфазной области, в которой сосуществуют разбавленный раствор и ламелярная фаза. Для ПАВ этого типа при более высоких концентрациях характерно также образование биконтинуальной кубической и обращенной гексагональной фаз.
На рис. указаны конноды, т.е. горизонтальные линии постоянных температур, связывающие две сосуществующие фазы. Конечные точки коннод дают составы сосуществующих фаз, находящихся в равновесии. Относительные количества фаз можно оценить, используя "правило рычага". Фазовые переходы в системах, содержащих ПАВ, обычно являются фазовыми переходами первого рода, откуда следует, что между двумя однофазными областями будет находиться двухфазная область. Иногда для простоты двухфазную область на фазовой диаграмме опускают, но о ее существовании забывать нельзя. Макроскопические свойства двухфазной системы, как правило, сильно отличаются от свойств обеих однофазных систем.
Трехкомпонентные системы
Для понимания фазовых диаграмм фундаментальное значение имеет правило фаз:
P+F=C+2
связывающее для любой точки фазовой диаграммы число сосуществующих фаз, число компонентов системы и число степеней свободы, к которым относятся переменные величины - температура, давление и состав. Для двухкомпонентной системы P + F = 4. При постоянном давлении число степеней свободы уменьшается на единицу. Тогда для одной фазы возможны не более двух степеней свободы. Таким образом, фазовая диаграмма может быть представлена в двух координатах. При наличии двух фаз F= 1, поэтому в двухфазной области варьировать можно только или температуру, или концентрацию.
Реклама

В трехкомпонентной системе при постоянном давлении система имеет максимум 3 степени свободы, т.е. можно варьировать температуру и две концентрации. Чтобы представить фазовую диаграмму на плоскости, можно выбрать разную стратегию в зависимости от системы и задачи, а именно зафиксировать температуру или одну из концентраций, или отношение количеств двух компонентов. Обычно определяют фазовые равновесия при постоянной температуре, используя треугольники Гиббса. Здесь вершины представляют три чистых компонента, а боковые стороны треугольника - три двухкомпонентные системы. Внутри треугольника присутствуют все три компонента и их количества считываются, как указано на рисунке. Чтобы проиллюстрировать влияние температуры на фазовое поведение, представляют множество изотермических треугольников в виде треугольной призмы.
Две трехкомпонентные фазовые диаграммы показаны на рис. Первая из них - это фазовая диаграмма системы, состоящей из воды и смеси ионного ПАВ с одним гидрофобным радикалом и слабополярного дифильного спирта в воде. На фазовой диаграмме представлены шесть различных фаз: две фазы изотропных растворов, три жидкокристаллические фазы и твердое ПАВ. В бинарной смеси с водой данное ПАВ образует только мицеллярную и гексагональную фазы. Введение деканола вызывает фазовый переход с возникновением ламелярной фазы, а при более высоких концентрациях спирта формируются обращенные структуры: обращенные гексагональная и мицеллярная фазы. Кроме однофазных областей возникает большое число двухфазных и трехфазных областей, в которых сосуществуют различные фазы.
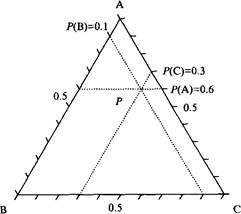
Фазовая диаграмма системы из трех компонентов А, В и С при постоянной температуре представлена треугольником Гиббса. Количество различных компонентов в точке P определяется расстоянием до противоположной стороны. Образец в точке P содержит 60% компонента А, 10% компонента В и 30% компонента С

Трехмерное представление фазовой диаграммы тройной системы, отражающее влияние дополнительной степени свободы - температуры.
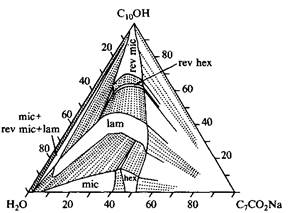
Фазовая диаграмма тройной системы, состоящей из октаноата натрия, деканола и воды при 25°С. Видно, что в системе образуются два изотропных раствора и три жидкокристаллических фазы.
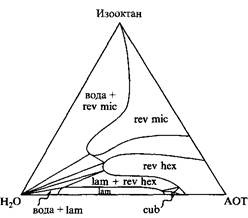
Тройная фазовая диаграмма: система состоит из анионного ПАВ с двумя неполярными "хвостами", изооктана и воды. Фазовые равновесия определены при 25°С. Наблюдаются две фазы изотропных растворов: вода и обращенная мицеллярная фаза, а также три жидкокристаллические фазы
Тройная фазовая диаграмма выглядит совершенно по-другому. Здесь представлено ионное ПАВ с двумя гидрофобными радикалами, которое в смеси с водой дает протяженную ламелярную фазу, а также биконтинуальную кубическую фазу и обращенную гексагональную фазу. Растворимость этого ПАВ в воде очень мала. При добавлении масла происходит фазовый переход ламелярной фазы в обращенную гексагональную фазу и затем в обращенную мицеллярную фазу.
Последовательность образования фаз с изменением концентрации ПАВ или при добавлении менее полярного компонента обычно следует простому ряду, установленному Фонтеллем. В зависимости от системы, температуры и других факторов образуется меньшее или большее число фаз. Например, в случае ПАВ с одним "хвостом" обычно реализуются структуры от зеркальной плоскости влево, а в случае двухцепочечного ПАВ - вправо.
Фазовая диаграмма характерна для смеси катионного и анионного ПАВ. На этой диаграмме появляются новые особенности, а именно области стабильных дисперсий везикул. В таких системах для стехиометрических смесей наблюдается выпадение твердых кристаллов. Кроме того, имеются области ламелярных и везикулярных фаз, образующиеся при избытке одного из ПАВ.

Фазовая диаграмма в области малых концентраций смеси ПАВ: катионного и анионного в воде. С разрешения. Copyright American Association for the Advancement of Science
Влияние геометрии молекул ПАВ и их упаковки на структуру агрегата: концепции параметра упаковки и спонтанной кривизны пленки ПАВ
Общее правило: ПАВ с одной гидрофобной цепью образуют мицеллы и другие прямые структуры, в то время как ПАВ с двумя гидрофобными цепями преимущественно образуют ламелярные фазы и обращенные структуры. Это легко понять, если попытаться построить пространственные модели агрегатов ПАВ различной структуры. При этом обнаружится, что из-за большого объема гидрофобных "хвостов" молекулы с двумя цепями нельзя упаковать в сферические мицеллы. Величина v/ должна быть для сферической мицеллы не более 1/3. Если удвоить параметр н введением второй алкильной цепи, оставляя другие параметры постоянными, то предпочтительными оказываются другие геометрические формы. Критический параметр упаковки можно рассматривать по-другому, а именно как отношение площадей поперечного сечения углеводородной цепи и полярной группы.
Поскольку взаимосвязь химической структуры и структуры агрегатов намного сложнее, чем такой простой геометрический анализ, он приведен лишь в качестве иллюстрации и служит отправной точкой, в частности для анализа тенденций в фазовом поведении. Образующаяся структура - это результат баланса между полярными и неполярными частями молекулы ПАВ. Этим объясняется интерес к шкалам гидрофильно-липофильного баланса. Эти шкалы являются удобными классификациями
ПАВ, полезными, кроме прочего, при подборе ПАВ для различных практических применений, но они не позволяют провести более глубокий анализ или достичь прогресса в понимании фазового поведения. Более новые подходы к проблеме основаны на концепциях упаковки молекул ПАВ и спонтанной кривизны пленки ПАВ.
Определение критического параметра упаковки или числа ПАВ, поясняется на рис. Анализ многочисленных геометрических форм агрегатов, подобный проведенному выше для сфер, привел к нескольким простым правилам, которые иллюстрирует рис.
В простой геометрической модели не учитываются два важных фактора, оказывающих большое влияние на структуру агрегата. Прежде всего это взаимодействие полярных групп в агрегате. Ясно, что сильное отталкивание между полярными головками ПАВ будет приводить к сдвигу агрегатов влево в схеме Фонтелля, тогда как сдвиг в противоположную сторону требует действия сил притяжения. Проблему можно преодолеть, оценивая "эффективную" площадь полярной группы. Так, для ионного ПАВ на взаимодействие полярных групп сильное влияние оказывает концентрация электролита, так что величина а уменьшается при добавлении электролита. Расчет расстояния между полярными головками на основе электростатических взаимодействий позволяет оценить значение КПУ или числа ПАВ и для этого случая. На взаимодействие полярных групп неионных ПАВ сильнее влияет температура, а не электростатические взаимодействия. Изменение температуры оказывается главным фактором, определяющим структуру агрегата.
Отвечая на вопрос, какие именно ПАВ относятся к различным категориям, представленным на рис., что КПУ <1/3 и сферические мицеллы характерны для ПАВ с одной неполярной цепью и сильнополярной "головкой", например ионогенной группой в отсутствие электролита. Сюда же попадают неионогенные ПАВ с большими полярными группами. Значениям КПУ в интервале от 1/3 до 1/2 и стержнеобразным агрегатам соответствуют ионогенные одноцепочечные ПАВ в присутствии электролита или с прочно связанными противоионами, а также неионогенные ПАВ с полярными группами среднего размера. Более высокие значения КПУ характерны для ПАВ с двумя неполярными цепями или для неионогенных ПАВ с небольшими полярными группами. К этому же типу относится большинство мембранных липидов. В случае ионогенных ПАВ добавление электролита еще больше увеличивает значение КПУ, что может вызвать переход от бислойных структур к обращенным структурам.
Критический параметр упаковки или число ПАВ выражает соотношение площади полярной группы, длины вытянутой гидрофобной цепи и объема гидрофобной части молекулы безразмерным числом КПУ.


Критические параметры упаковки молекул ПАВ и предпочтительные с геометрической точки зрения структуры агрегатов
Можно считать, что агрегаты ПАВ сформированы пленками ПАВ, причем в зависимости от кривизны пленки образуются разные структуры. Будем считать спонтанную кривизну положительной, если пленка искривляется вокруг неполярной части, и отрицательной при искривлении пленки в сторону полярной части.
Прямые мицеллы, таким образом, имеют положительную кривизну, а обращенные мицеллы - отрицательную. Кривизна плоских пленок, например в ламелярных фазах, равна нулю. Многие биконтинуальные структур характеризуются более сложной "седлообразной" геометрией с двумя главными радиусами кривизны противоположных знаков. Большой интерес представляет случай "минимальных" поверхностей, когда средняя кривизна равна нулю.
Спонтанная кривизна варьируется от величины, обратной длине молекулы ПАВ, до соответствующего отрицательного значения. Спонтанная кривизна уменьшается при введении в молекулу ПАВ второй неполярной цепи и при уменьшении отталкивания полярных групп, т.е. при добавлении электролита в систему, содержащую ионное ПАВ.
Мицелла с солюбилизированным маслом характеризуется положительной спонтанной кривизной. Обычно пленка ПАВ между маслом и водой обладает гибкостью и областями как положительной кривизны, так и отрицательной. Фазовое поведение полярных липидов - аналогия с фазовым поведением других дифильных веществ. Полярные липиды подчиняются тем же правилам, что и ПАВ, и обнаруживают сходное фазовое поведение. На рис. были приведены структурные формулы различных липидов; очевидно, что ассоциативное поведение в воде, например, существенно неполярных триглицеридов и сильнополярных солей желчных кислот совершенно разное. Действительно, три - и диглицериды недостаточно дифильны, чтобы растворяться в воде, и формируют самоассоциированные структуры. Другой предельный случай - соли желчных кислот, которые склонны к образованию лишь очень небольших агрегатов с большой положительной кривизной. Большинство других липидов по своим свойствам располагаются между указанными крайними случаями и образуют самоассоциированные структуры различных типов, как это следует из многочисленных фазовых диаграмм. Фосфолипиды, например лецитин, как и вообще ПАВ с двумя углеводородными цепями в молекуле, склонны к образованию ламелярных фаз. Ламелярная фаза может поглощать воду и набухать. При более высоком содержании воды система расслаивается на две сосуществующие фазы: ламелярную и очень разбавленный водный раствор. Моноолеин также образует ламелярную фазу, но только в очень ограниченном интервале концентраций и температур. Эта система весьма необычна, поскольку образует биконтинуальную кубическую фазу, которая, во-первых, устойчива в широкой области концентраций и температур и, во-вторых, сосуществует с избытком воды. В двухфазной области образуется дисперсия кубической фазы.
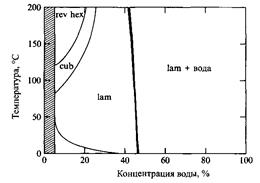
На фазовой диаграмме системы яичный лецитин - вода преобладает ламелярная фаза, которая при большом содержании воды находится в равновесии с очень разбавленным водным раствором.
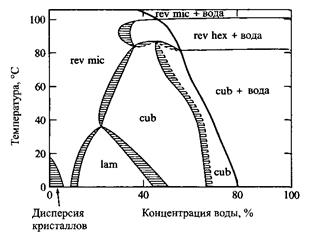
Фазовая диаграмма системы моноолеин - вода характеризуется большой областью биконтинуальной кубической фазы. Эта фаза может быть в равновесии с избытком воды. Кроме того, в определенных интервалах температуры и состава образуются ламелярная и обращенная мицеллярная фазы
Соли желчных кислот характеризуются очень низкими числами ПАВ. Поэтому они образуют только мицеллярные растворы в воде и почти никогда не образуют жидкокристаллических фаз. Если в систему, содержащую менее полярный липид, ввести соль желчных кислот, обнаруживаются ожидаемые изменения в структуре агрегатов. Например, ламелярная фаза лецитина поглощает некоторое количество соли желчных кислот, а затем трансформируется сначала в гексагональную фазу и потом в мицеллярную. Кубическая фаза моноолеина под действием солей желчных кислот превращается в ламелярную фазу, а затем в мицеллярную.
Жидкокристаллические фазы в неводных средах
Стремление ПАВ самоорганизовываться в мицеллы гораздо ярче выражено в воде, нежели в других полярных растворителях. Это в основном справедливо и для других типов агрегатов, как, например, это проиллюстрировано на рис. для бромида гексадецилтриметиламмония в различных полярных растворителях. Следует отметить, что область существования фазы изотропного раствора становится более широкой, чем в воде, в то время как жидкокристаллические фазы характеризуются более узкими областями стабильности.
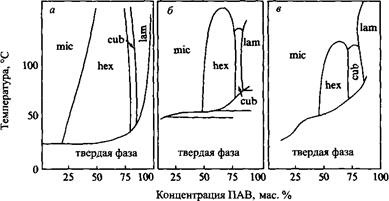
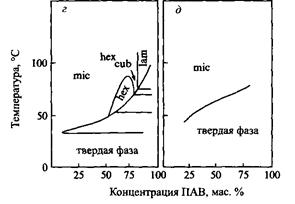
Бинарные фазовые диаграммы бромида гексадецилтриметиламмония с различными полярными растворителями: а - с водой; б - с глицерином; в - с формамидом; г - с этиленгликолем; д - с Н-метил формами дом. При увеличении концентрации ПАВ наблюдается переход от мицеллярного изотропного раствора к гексагональной, затем к кубической и ламелярной жидкокристаллическим фазам.
|