| . Электростатическая, ковалентная связь. Ковалентная связь в органических соединениях. Строение метана. Строение молекул с N, O-атомами с неподеленной парой электронов. Строение и физико-химические свойства органических соединений.

Связь между частицами лучше всего определять через энергию, которую система теряет при образовании соединения - аддукта.
1. Электростатическая связь
1.1 Ионная связь
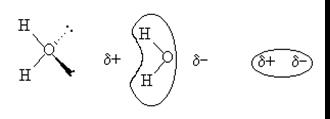
1.2 Ион-дипольное взаимодействие
1.3 Диполь-дипольное взаимодействие
ИОННАЯ СВЯЗЬ
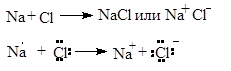
Ион-дипольное взаимодействие
Диполь-дипольное взаимодействие
2. КОВАЛЕНТНАЯ СВЯЗЬ
- связь, образованная двумя электронами
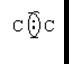
Переход от ковалентной связи к ионной
| ковалентная связь
|
полярная ковалентная связь
|
ионная связь
|
| А:А
|
d
+
В:Аd
-
|
М+
А-
|
2.1
Молекулярные орбитали - атомные орбитали
Молекула водорода Н2
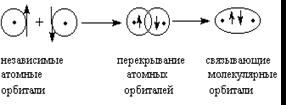
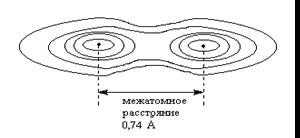
Длина связи
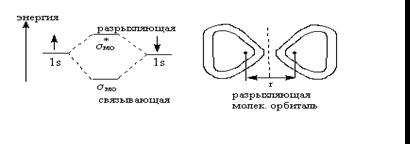
Энергетическая диаграмма для разрыхляющей и связывающей орбиталей
3. Структуры Льюиса
Связь между атомами обеспечивается электронными парами (американский химик Джилберт Льюис)
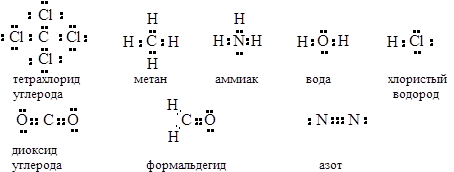
4.
Некоторые свойства ковалентных связей (длина связи, полярность связи и энергия связи)
4.1 Длина связи
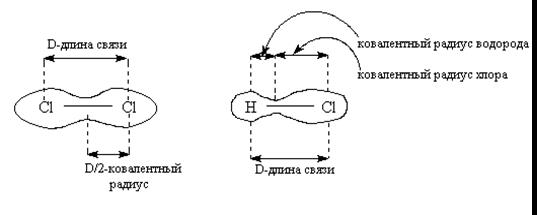
Минимальное расстояние между атомами отвечает минимальной потенциальной энергии системы.
Кривая потенциальной энергии (энергетический профиль)
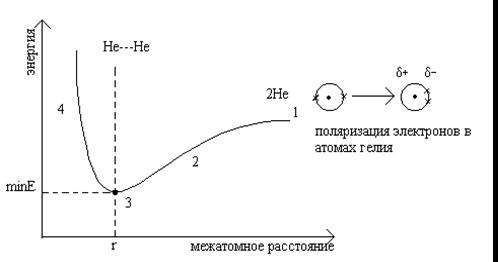
2 - участок притяжения, вызванного индуцированной поляризацией (дисперсионые силы Лондона).
Половина расстояния, разделяющего атомы в точке 3, соответствует вандерваальсову радиусу.
Вандерваальсовы радиусы
| Атом или группа
|
Вандерваальсов радиус, Е
|
| Br
|
1,35
|
| CH2
|
2,0
|
| CH3
|
2,0
|
| Cl
|
1,8
|
| F
|
1,35
|
| H
|
1,2
|
| I
|
2,15
|
| N
|
1,15
|
| O
|
1,4
|
4.2 Полярность связи
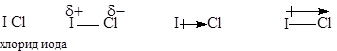
Диоксид углерода, представляющий собой линейную молекулу, имеет нулевой дипольный момент, а дипольный момент диоксида серы, нелинейной молекулы, равен 1,6 Д.

Дипольный момент может быть рссчитан по формуле:
m = e · l
e-элементарный заряд
l-расстояние между центрами положительных и отрицательных зарядов.
Дипольный момент измеряют в дебаях (Д). 1 дебай равен 10-18 е·см
Средняя величина дипольных моментов связей и функциональных групп
| Структурная единица
|
Дипольный момент, Д
|
| H-Br
|
0,74
|
| H-Cl
|
1,03
|
| H-N
|
1,3
|
| H-O
|
1,5
|
| H-S
|
0,7
|
| C-Cl
|
1,9
|
| C-N
|
1,0
|
| C-O
|
1,2
|
| C=O
|
2,7
|
| C-NO2
|
4,0
|
4.3. Энергия связи
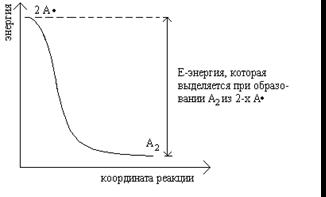
Процесс, в результате которого разрывается ковалентная связь и каждый из фрагментов сохраняет один электрон, называется «гомолизом» или «гомолитическим расщеплением».
X-Y ® X· + Y· гомолитическое расщепление
Энергия, требующаяся для гомолитического расщепления отдельной связи и образования двух нейтральных атомов, называется энергией диссоциации (ккал/моль).
Реклама

Средняя величина энергии, необходимая для разрыва отдельной связи называется энергией связи.
Энергия связей, ккал/моль
| H-C
|
99
|
| C-C
|
80
|
| C-O
|
81
|
| C-N
|
62
|
| C-S
|
65
|
| H-N
|
84
|
| C-F
|
102
|
| C-Cl
|
77
|
| C-I
|
56
|
| H-O
|
110
|
Энергетический профиль образования А2
5. Связь в органических соединениях
Ковалентная связь характерна для соединений углерода, именно эта связь имеет основное значение в химии органических соединений.
Примеры написания моделей связей.
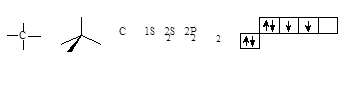
атомные орбитали углерода
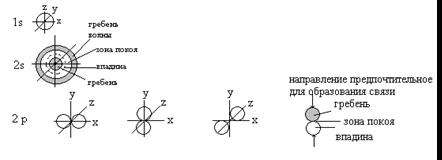
Элементы пространства, в котором наиболее вероятно нахождение электрона, называют орбиталью. Орбитали отличаются формой и энергией.
6.
Строение метана
Электронная конфигурация основного состояния изолированного атома углерода:
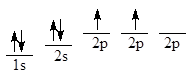
Рассмотрение электронного строения метана дает основание утверждать, что углерод 2-х валентен и должен образовывать соединения строения СН2, однако в метане углерод соединение 4 атомами углерода. Чтобы получить 4-х валентный углерод, необходимо иметь следующую схему распределения электронов:
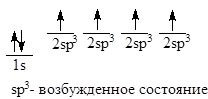

Возбужденное состояние атома включает образование четырех новых внешних орбиталей путем «гибридизации» 2s-орбитали и всех трех 2р-орбиталей. Четыре гибридные орбитали обладают одинаковой энергией, и каждая из них обозначается 2sp3. Гибридные орбитали обладают наибольшей степенью направленности, они точно эквивалентны друг другу. Главные оси четырех гибридных орбиталей направлены к углам правильного тетраэдра - расположение, при котором орбитали максимально удалены друг от друга.
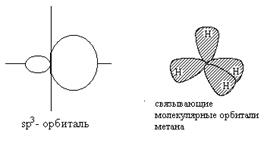
Угол связи (109,50) определяется условием максимального перекрывания гибридных орбиталей с орбиталями водорода.
Длина связи в метане 1,09 A.
Энергия связи 102 ккал/моль (417,05•103Дж/моль)
В отличии от ионной связи, прочность которой одинакова по всем направлениям, ковалентная связь является направленной.
Для углерода возможны три типа гибридизации:
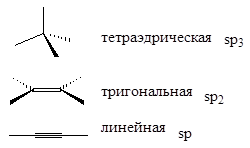
7. Строение молекул с n, o-атомами с неподеленной парой электронов
NH3
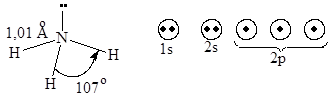
Энергия связи 103 ккал/моль (431,24•103Дж/моль)
Н2О
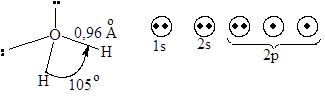
Энергия связи 103 ккал/моль (431,24•103 Дж/моль)
Наличие свободных электронов у аммиака и воды придает им основные свойства, более сильные у аммиака.
8. Строение и физико-химические свойства
Т пл., Т кип., растворимость.
Физические свойства дают информацию о строении вещества. Строение позволяет предсказать физические свойства.
Сравнить ионные и неионные соединения:
NaCl Т пл 8010
С
СН4
Т пл. -1830
С
Межмолекулярные силы
Реклама

Диполь-дипольное взаимодействие, вандерваальсовы силы (индуцир. диполь)
NaCl Т кип 14130
С (ионная пара - газообразное состояние)
CH4
Т кип -161,50
С
H2
O 1000
С
NH3
-330
С
Растворимость
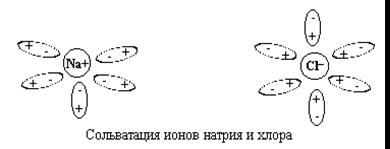
Ион-дипольное взаимодействие
Na+
НОН
сольватация гидратация

Подобное растворяется в подобном. Растворимость определяется полярностью.
СН4
и CCl4
нерастворимы в воде
СН3
ОН растворим в воде.
|