| Растворы и растворители. Участие растворителей в кислотно-основном взаимодействии. Протеолитическая теория кислот и оснований. Способы выражения концентрации растворов. Буферные растворы и вычисление их
pH
Растворы и растворители
В качестве растворителя в количественном химическом анализе в основном используют воду как наиболее доступный и дешевый растворитель, не требующий специальных условий работы с ним (например, вытяжных шкафов, защитной одежды и т.п.), легко поддающийся очистке дистилляцией. В аналитической практике используют дистиллят или бидистиллят воды (т.е. один раз или дважды продистиллированную воду) в зависимости от требуемой по методике анализа чистоты растворителя.
Анализ нерастворимых в воде веществ (например, органических) проводят в неводных средах с использованием неводных растворов кислот, оснований и т.п.
При классификации растворителей прежде всего выделяют характер их участия в процессе кислотно-основного взаимодействия. По этому признаку выделяют апротонные
и протолитические
растворители.
Молекулы апротонных растворителей не ионизированы, поэтому в кислотно-основных взаимодействиях они ведут себя как химически инертные вещества, не отдавая и не принимая протон, как безпротонные, что отражено в их названии. К апротонным растворителям относят углеводороды, например гексан, бензол и их галогенопроизводные (хлороформ, тетрахлорид углерода и др.)
К протолитическим относят растворители способные к ионизации и отдаче или присоединению протона. Кислотно-основное равновесие в этих растворителях осуществляется с их участием.
Это участие является основой идеей протолитической (протонной
)
теории кислот и оснований Бренстеда и Лоури (1927г.). В отличие от теории электролитической диссоциации Аррениуса - Оствальда (1887 г.), в которой растворитель считался инертной средой, с точки зрения протонной теории кислота не выделяет протон самопроизвольно, а участвует в его переносе совместно с основанием, в качестве которого могут быть молекулы растворителя. Согласно протонной теории процесс передачи протона от кислоты к основанию называется протолизом,
причем кислотой считают любое вещество, способное отдавать протон, а основанием - его принимать. Ионно-молекулярное равновесие, устанавливающееся после передачи протона, называют протолитическим
или кислотно-основным.
Реклама

Кислотно-основное взаимодействие по этой теории состоит в обратимом переносе протона от кислоты к основанию. В результате такого процесса образуется пара новых частиц, одна из которых опять способна отдавать протон, а другая - его присоединять. Таким образом, кислота оказывается в равновесии с сопряженным основанием, а основание - с сопряженной кислотой:
НА + В НВ+
+А-
Кислотаоснование сопряженная сопряженное
кислота основание
Например, НСN + NaOHH2
O + NaCN
или в ионном виде НСN + OH-
H2
O + CN-
Кислоты и основания, теряющие и приобретающие протоны, называют протолитами.
Протолитические растворители, ведущие себя в процессе растворения вещества как кислота, отдавая протон, называют протогенными
(от лат. «протонорождающие»). К ним относят жидкие галогеноводороды (HCl, HBr), серную, безводную муравьиную и уксусную кислоты и др. Они увеличивают основные свойства растворенных в них веществ и уменьшают кислотные. Например, слабое основание анилин в среде безводной уксусной кислоты является сильным.
Протофильные
(от лат. «протонолюбящие») растворители способны принимать протоны в процессе растворения. Это, например, жидкий аммиак, пиридин, гидразин и др. Они увеличивают кислотность растворенных веществ.
Амфипротонные
растворители способны как отдавать, так и принимать протоны (вода, спирты, кетоны, нитрилы и др.). Вещества с такими свойствами называют амфолитами
или амфипротонными
. С учетом амфипротонных свойств воды кислотно-основное взаимодействие является суммарным результатом следующих процессов передачи протона:
НА + H2
O H3
O+
+ А-
В + H2
O НВ+
+OH-
НА+ В НВ+
+ А-
Например, взаимодействие циановодородной кислоты со щелочью можно изобразить так:
НСN + H2
O H3
O+
+ CN-
OH-
+ H2
O H2
O + OH-
НСN + OH-
H2
O + CN-
Для простоты промежуточные уравнения реакции, показывающие участие воды в установлении кислотно-основного равновесия, опускают, изображая кислотно-основную реакцию результирующим уравнением.
Амфипротонные свойства воды позволили объяснить щелочную среду водных растворов солей, образованных сильным основанием и слабой кислотой (Na2
CO3
, KCN, Na2
HPO4
и др.) и кислую среду растворов солей слабых оснований (NH4
Cl) и многоосновных слабых кислот (NaH2
PO4
, KHSO4
и др.). Их химическое взаимодействие с водой приводит к накоплению в растворе ионов H+
или OH-
, определяющих кислотность их среды.
Реклама

Например КСN + H2
O КОH + НCN
или в ионном виде CN-
+ H2
O OH-
+ НCN,
откуда видно, что гидролиз этой соли приводит к щелочной среде раствора КСN. Таким образом, реакция гидролиза - частный случай протолиза.
Обладая амфипротонными свойствами молекулы воды могут вступать во взаимодействие друг с другом, как кислота со щелочью, образуя ион гидроксония H3
O+
и гидроксид - ион OH-
:
H2
O + H2
O H3
O+
+ OH-
Этот процесс называется автопротолизом
, он свойственен и другим амфипротонным растворителям.
Для простоты автопротолиз H2
O записывают в виде диссоциации воды:
H2
O Н+
+ OH-
По закону действующих масс константа равновесия процесса диссоциации воды равна
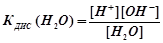
Измерениями доказано, что для чистой воды [H2
O] =55,85моль/л и [Н+
]= [OH-
]=10-7
моль/л, следовательно,
К
ДИС
(H2
O) [H2
O] =[Н+
] [OH-
] = const .
Произведение равновесных концентраций ионов воды при данной температуре есть величина постоянная, называемое ионное произведение воды
КW
:
КW
= [Н+
][OH-
] = 10-14
моль/л .
Понятие о рН и рОН среды раствора
Концентрация ионов водорода в водных растворах изменяется приблизительно от 1 моль/л в 1М растворе сильной кислоты (например, HCl) до 10-14
моль/л в 1М растворе сильной щелочи (например, NaOH).
Этот интервал 10-14
< [Н+
] < 1 очень широк и неудобен для характеристики кислотности среды, поэтому шведский ученый Сорренсон в 1909 г ввел шкалу кислотности, основанную на отрицательном десятичном логарифме от граничных значений этого интервала:
0 < - ℓg[Н+
] <14 .
Обозначив «-ℓg» через «р», а [Н+
] через «Н» он получил водородный показатель среды раствора рН. По аналогии рОН = -ℓg[ОН-
] - гидроксильный показатель. Таким образом, 0 < рН < 14. Раствор с рН = 0…7 имеет кислую среду, при рН = 7 среда раствора нейтральная, при рН = 7…14 - щелочная.
Возьмем отрицательный десятичный логарифм от КW
:
-ℓg КW
= -ℓg[Н+
] - ℓg[ОН-
],
следовательно, 14 = рН + рОН, а рН = 14 - рОН.
Буферные растворы
Большинство аналитических реакций в водных растворах проводят при определенных значениях рН. Для поддержания заданного значения рН используют специальные буферные растворы (БР). БР содержат двойные смеси сопряженных кислот и оснований. Приготовленные БР специально вводят в реакционную систему, но БР могут и сами образовываться в ней за счет химических реакций слабых кислот (слабых оснований) или гидролизующихся солей с сильными основаниями (сильными кислотами). БР обладают способностью не изменять заметно рН при их разбавлении, а также препятствовать изменению рН реакционной системы, в которую введен (или образовался) БР, при добавлении к ней небольших количеств сильной кислоты или оснований. Сущность буферного действия БР заключается в том, что его сопряженная кислота может связывать ОН-
- ионы, а сопряженное основаниеН+
- ионы в молекулы слабого электролита (воду, слабую кислоту или слабое основание). рН системы при этом меняется незначительно. Во всех реакциях один компонент БР вступает во взаимодействие, а другой является ее продуктом (табл. 1.4.2).
Таблица 1.4.2
| Буферный раствор и его рН
|
Химическая реакция
|
| |
при добавлении кислоты
|
при добавлении основания
|
| Ацетатный БР (СН3
СООН + СН3
СООNa) pH = 4,7
|
СН3
СООNa + HCl = СН3
СООН + NaCl
|
СН3
СООН + NaОН = СН3
СООNa + H2
О
|
| Аммиачный БР (NH4
OH + NH4
Cl) рН = 9,3
|
NH4
OH + HCl = NH4
Cl + H2
О
|
NH4
Cl + NaОН = NH4
OH + NaCl
|
| Карбонатный БР (Na2
CO3
+ NaHCO3
) рН = 10,3
|
Na2
CO3
+ HCl = NaHCO3
+ NaCl
|
NaHCO3
+ NaОН = Na2
CO3
+ H2
О
|
| Фосфатный БР (Na2
HPO4
+ NaH2
PO4
) рН = 8
|
Na2
HPO4
+ HCl = NaH2
PO4
+ NaCl
|
NaH2
PO4
+ NaОН = Na2
HPO4
+ H2
О
|
Уравнение для вычисления рН БР, состоящих из слабой кислоты НАn и ее соли МАn, можно вывести следующим образом.
Слабая кислота НАn диссоциирует с образованием сопряженного основания Аn-
: НАn Н+
+ Аn-
по ЗДМ:
Для слабой кислоты концентрацию недиссоциированных молекул можно принять равной концентрации кислоты, т.е. [НАn] = c (НАn). Содержащаяся в БР соль МАn диссоциирует нацело (полностью), поэтому концентрация сопряженного основания Аn-
, образовавшегосявследствие диссоциации соли МА, значительно больше, чем вследствие диссоциации слабой кислоты НАn, поэтому можно считать, что[Аn-
] = c (МАn). Подставим полученное в уравнение для К(НАn)
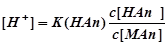
Отсюда ,
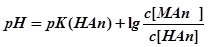
следовательно, .
Последняя формула доказывает, что при разбавлении БР его рН не изменяется, так как при этом меняются только значения с(НАn) и с (МАn), а их соотношение сохраняется.
Аналогично для БР, состоящего из слабого основания ВОН и его соли ВА, можно получить
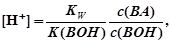
так как то
отсюда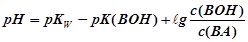
Буферирующая способность БР количественно определяется буферной емкостью.
= с / рН
.
Она соответствует количеству эквивалентов сильной кислоты или сильного основания, которое вызывает изменение на единицу рН БР. Максимальную буферную емкость имеют БР с соотношением компонентов 1:1.
В большинстве случаев рассчитывается по упрощенной формуле
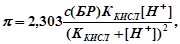
где с(БР) - общая концентрация компонентов БР при их соотношении 1:1.
Пример.
Рассчитайте, как изменится рН 1 л БР, состоящего из 0,1 н. СН3
СООН и 0,1 н. СН3
СООNa при добавлении 0,01 моль HCl.
Решение.
Общая концентрация БР равна с(БР) = [СН3
СООН] + [СН3
СООNa] = 0,1 + 0,1 =0,2 моль/л. По справочнику рК(СН3
СООН) = 1,75·10-5
.
Найдем [H+
], pH и исходного БР до добавления кислоты: [H+
] = 1,75 · 10-5
· (0,1/0,1) = 1,75 · 10-5
моль/л. рН = -ℓg1,75 · 10-5
= = 4,75.
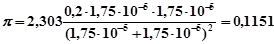
Найдем изменения рН БР после добавления кислоты:
рН = -с/ = - 0,01/0,1151 = - 0,09.
знак «-» взят в формуле, так как при добавлении сильной кислоты рН уменьшается. Таким образом, при добавлении кислоты рН уменьшится и станет равным 4,75 - 0,09 = 4,66.
Реакции, позволяющие получить внешний эффект с определяемым веществом, называют аналитическими
, а добавляемое для этого вещество - реагентом
. Аналитические реакции, проводимые между твердыми веществами, относят к реакциям «сухим путем
», а в растворах - «мокрым путем
».
К реакциям «сухим путем» относятся реакции, выполняемые путем растирания твердого исследуемого вещества с твердым реагентом, а также путем получения окрашенных стекол (перлов) при сплавлении некоторых элементов с бурой.
Значительно чаще анализ проводят «мокрым путем», для чего анализируемое вещество переводят в раствор. Реакции с растворами могут выполняться пробирочным, капельным и микрокристалли-ческим
методами. При пробирочном полумикроанализе его выполняют в пробирках вместимостью 2-5см3
. Для отделения осадков используют центрифугирование, а выпаривание ведут в фарфоровых чашечках или тиглях. Капельный анализ (Н.А. Тананаев, 1920 г.) осуществляют на фарфоровых пластинках или полосках фильтрованной бумаги, получая цветные реакции при добавлении к одной капле раствора вещества одной капли раствора реактива. Микрокристаллический анализ основан на обнаружении компонентов с помощью реакций, в результате которых образуются соединения с характерным цветом и формой кристаллов, наблюдаемых в микроскоп.
Для качественного химического анализа используют все известные типы реакций: кислотно-основные, окислительно-восстановительные, осаждения, комплексообразования и другие.
Качественный анализ растворов неорганических веществ сводится к обнаружению катионов и анионов. Для этого используют общие
и частные
реакции. Общие реакции дают сходный внешний эффект (АС) со многими ионами (например, образование катионами осадков сульфатов, карбонатов, фосфатов и т.д.), а частные - с 2-5 ионами. Чем меньше число ионов дают сходный АС, тем селективнее (избирательнее) считается реакция. Реакция называется специфической
, когда позволяет обнаружить один ион в присутствии всех остальных. Специфической, например, на ион аммония является реакция:
NH4
Cl + KOH NH3
+ KCl + H2
O
Аммиак обнаруживают по запаху или по посинению красной лакмусовой бумажки, смоченной в воде и помещенной над пробиркой.
Селективность реакций можно повысить, изменяя их условия (рН) или применяямаскирование. Маскирование
заключается в уменьшении концентрации мешающих ионов в растворе меньше предела их обнаружения, например путем их связывания в бесцветные комплексы.
Если состав анализируемого раствора несложен, то его после маскировки анализируют дробным
способом. Он заключается в обнаружении в любой последовательности одного иона в присутствии всех остальных с помощью специфических реакций, которые проводят в отдельных порциях анализируемого раствора. Поскольку специфических реакций немного, то при анализе сложной ионной смеси используют систематический
способ. Этот способ основан на разделении смеси на группы ионов со сходными химическими свойствами путем перевода их в осадки с помощью групповых реактивов, причем групповыми реактивами воздействуют на одну и ту же порцию анализируемого раствора по определенной системе, в строго определенной последовательности. Осадки отделяют друг от друга (например, центрифугированием), затем растворяют определенным образом и получают серию растворов, позволяющих в каждом обнаружить отдельный ион специфической реакцией на него.
Существует несколько систематических способов анализа, называемых по применяемым групповым реактивам: сероводородный, кислотно-основный, аммиачно-фосфатный
и другие. Классический сероводородный способ основан на разделении катионов на 5 групп путем получения их сульфидов или сернистых соединений при воздействии H2
S, (NH4
)2
S, NaS в различных условиях.
Более широко применяемым, доступным и безопасным является кислотно-основный метод, при котором катионы разделяют на 6 групп (табл. 1.3.1.). Номер группы указывает на последовательность воздействия реактивом.
|