Защитное свойство боли
Боль – сложная интегративная реакция организма на повреждающий стимул, включает в себя перцептуальный, двигательный, эмоциональный и др. компоненты. Именно перцептуальный компонент отражает собственно болевое специфическое возбуждение, остальные формируются на его основе и являются неспецифическими. Боль формируется как ответная реакция организма на разрушающие его раздражители. Формирование чувства боли является приспособительным свойством, содействующим выживанию и выработанным в процессе эволюции живых существ. Болевое возбуждение имеет прежде всего сигнальное значение, предупреждающие о нарушении двух жизненно важных констант организма: целостности защитных покровных оболочек, обеспечивающих постоянство внутренней среды, и определённого уровня окислительных процессов тканей, обеспечивающих их нормальную жизнедеятельность.
Защитное свойство боли как сигнала опасности может проявляться только тогда, когда она возникает в ответ на действие именно вредоносного раздражителя. По-видимому, именно поэтому в эволюции был выработан и генетически закреплён определённый биологически целесообразный порог болевой чувствительности, обеспечивающий возникновение болевого ощущения в ответ только на вредоносные раздражители.
В отличие от других сенсорных модальностей боль дает мало сведений об окружающем нас мире, а скорее сообщает о внешних или внутренних опасностях, грозящих нашему телу. Тем самым она защищает нас от долговременного вреда и поэтому необходима для нормальной жизни. Если бы боль нас не предостерегала, уже при самых обыденных действиях мы часто наносили бы себе повреждения и вскоре стали бы калеками.
Следовательно, боль повышает наши шансы на выживание и в этом отношении сходна с другими чувствами. По многим своим физиологическим свойствам она также полностью сравнима с ними, хотя и отличается широким спектром особенностей.
В настоящее время нет общепринятого определения боли. В узком смысле боль
(от лат. dolor) – это неприятное ощущение, возникающее при действии сверхсильных раздражителей, вызывающих структурно-функциональные изменения в организме. В этом смысле боль является конечным продуктом деятельности болевой сенсорной системы (анализатора, по И.П. Павлову). Известно много попыток точно и кратко охарактеризовать боль. Вот формулировка, опубликованная одним международным комитетом экспертов в журнале «Pain» 6 (1976 г.): «Боль – неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения». По этому определению боль, как правило, нечто большее, чем чистое ощущение, поскольку обычно сопровождается неприятным аффективным переживанием. В определении также четко отражено, что боль ощущается тогда, когда сила стимуляции ткани тела создает опасность её разрушения. Далее, как указано в последней части определения, хотя всякая боль связана с разрушением ткани или с риском такового, для болевого ощущения совершенно неважно, происходит ли повреждение в действительности.
Реклама

Имеются и другие определения боли: «психофизиологическое состояние», «своеобразное психическое состояние», «неприятное сенсорное или эмоциональное состояние», «мотивационно-функциональное состояние» и т.д. Различие понятий о боли, вероятно, связаны с тем, что она запускает в ЦНС несколько программ ответа организма на боль и, следовательно, имеет несколько компонентов.
Теории боли
До настоящего времени единой теории боли, объясняющей различные ее проявления, не существует. Наиболее важное значение для понимания механизмов формирования болевых ощущений имеют следующие современные теории боли.
Теория интенсивности была предложена английским врачом Э. Дарвином (1794), согласно которой боль не является специфическим чувством и не имеет своих специальных рецепторов, а возникает при действии сверхсильных раздражителей на рецепторы пяти известных органов чувств. В формировании боли учавствуют конвергенция и суммация импульсов в спинном и головном мозге.
Теория специфичности была сформулирована немецким физиком М. Фреем (1894). В соответствии с этой теорией боль является специфическим чувством (шестое чувство), имеющим собственный рецепторный аппарат, афферентные пути и структуры головного мозга, перерабатывающего болевую информацию. Теория М. Фрея в дальнейшем получила более полное экспериментальное и клиническое потверждение.
Теория «воротного контроля» Мелзака и Уолла. Популярной теорией боли является теория «воротного контроля», разработанная в 1965 году Мелзаком и Уоллом. Согласно ей, в системе афферентного входа в спинном мозге действует механизм контроля за прохождением ноцицептивной импульсации с периферии. Такой контроль осуществляется тормозными нейронами желатинозной субстанции, которые активируются импульсацией с периферии по толстым волокнам, а также нисходящими влияниями со стороны супраспинальных отделов, в том числе коры головного мозга. Этот контроль представляет собой, образно говоря, «ворота», которые регулируют поток ноцицептивной импульсации.
Реклама

Патологическая боль, с позиций данной теории, возникает при недостаточности тормозных механизмов Т-нейронов, которые растормаживаясь и активируясь различными стимулами с периферии и из других источников, посылают интенсивную восходящую импульсацию.
В настоящее время гипотеза о системе «воротного контроля» пополнилась многими деталями, при этом важная для клинициста сущность заложенной в этой гипотезе идеи сохраняется и имеет широкое признание. Однако теория «воротного контроля», по признанию самих авторов, не может объяснить патогенез боли центрального происхождения.
Теория генераторных и системных механизмов Г.Н. Крыжановского. Наиболее приемлемой для понимания механизмов центральной боли является теория генераторных и системных механизмов боли, развитая Г.Н. Крыжановским (1976), который считает, что сильная ноцицептивная стимуляция, поступающая с периферии, вызывает в клетках задних рогов спинного мозга каскад процессов, которые запускаются возбуждающими аминокислотами (в частности, глутамином) и пептидами (в частности, субстанцией Р). Кроме того, болевые синдромы могут возникать вследствие деятельности в системе болевой чувствительности новых патологических интеграции — агрегата гиперактивных нейронов, который является генератором патологически усиленного возбуждения и патологической алгической системы, представляющей собой новую структурно-функциональную организацию, состоящую из первично и вторично измененных ноцицептивных нейронов, и являющуюся патогенетической основой болевого синдрома.
Теории, рассматривающие нейрональные и нейрохимические аспекты формирования боли. Каждый центральный болевой синдром имеет свою алгическую систему, в структуру которой обычно включается поражение трех уровней ЦНС: нижний ствол, промежуточный мозг (таламус, сочетанное поражение таламуса, базальных ганглиев и внутренней капсулы), кора и прилежащее белое вещество мозга. Характер болевого синдрома, его клинические особенности определяются структурно-функциональной организацией патологической алгической системы, а течение болевого синдрома и характер приступов боли зависят от особенностей ее активации и деятельности. Сформированная под влиянием болевой импульсации эта система сама, без дополнительной специальной стимуляции способна развивать и усиливать свою активность, приобретая устойчивость к влияниям со стороны антиноцицептивной системы и к восприятию общего интегративного контроля ЦНС.
Развитие и стабилизация патологической алгической системы, а также формирование генераторов объясняют тот факт, что хирургическая ликвидация первичного источника боли далеко не всегда эффективна, а иногда приводит лишь к кратковременному уменьшению выраженности боли. В последнем случае через некоторое время активность патологической алгической системы восстанавливается и возникает рецидив болевого синдрома.
Существующие патофизиологические и биохимические теории дополняют друг друга и создают цельное представление о центральных патогенетических механизмах боли.
Типы боли
Боль как модальность можно отнести к тому или иному типу, исходя из места её возникновения. Эта классификация показана на рис.1.
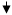 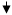
| СОМАТИЧЕСКАЯ |
ВИСЦЕРАЛЬНАЯ |
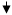 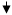 
| ПОВЕРХНОСТНАЯ |
ГЛУБОКАЯ |
ВИСЦЕРАЛЬНАЯ |
   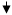
| КОЖА |
Соединительная ткань, мышцы, кости, суставы |
Внутренние органы |
| УКОЛ, ЩИПОК |
Мышечная судорога, головная боль |
Желчная колика, язвы, аппендецит |
Рис. 1. Типы боли и области происхождения каждой из них с примерами специфических форм боли.
Соматическая боль. Если она возникает в коже, её называют поверхностной; если в мышцах, костях, суставах или соединительной ткани – глубокой. Таким образом, поверхностная и глубокая боль
– это два (под)типа соматической боли. Поверхностная боль, вызываемая уколом кожи булавкой, представляет собой «яркое» по характеру, легко локализуемое ощущение, которое с прекращением стимуляции быстро угасает. За этой ранней болью часто следует поздняя с латентным периодом 0,5-1,0 с. Поздняя боль по характеру тупая (ноющая), её труднее локализовать, и она медленнее угасает.
Глубокая боль. Боль в скелетных мышцах, костях, суставах и соединительной ткани называют глубокой. Её примеры – острые, подострые и хронические боли в суставах, одни из самых обычных у человека. Глубокая боль тупая, как правило трудно локализуемая, и имеет тенденцию к иррадиации в окружающие ткани.
Висцеральная боль. Висцеральную боль можно вызвать, например, быстрым сильным растяжением полых органов брюшной полости (скажем, мочевого пузыря или почечной лоханки). Спазмы или сильные сокращения внутренних органов тоже болезненны, особенно когда связаны с неправильным кровообращением (ишемией).
Острая и хроническая боль. Кроме места возникновения важный момент описания боли – её продолжительность. Острая боль (например, от ожога кожи) обычно ограничена поврежденной областью; мы точно знаем, где она возникла, и её сила прямо зависит от интенсивности стимуляции. Такая боль указывает на грозящее или уже происшедшее повреждение ткани и поэтому обладает четкой сигнальной и предупреждающей функцией. После устранения повреждения она быстро исчезает. Острая больопределяется как краткая по времени проявления боль с легко идентифицируемой причиной. Острая боль — это предупреждение организму о существующей в данный момент опасности органического повреждения или заболевания. Часто стойкая и острая боль сопровождается также ноющей болью. Острая боль обычно концентрируется в определённом участке перед тем, как она каким-то образом распространится шире. Этот тип боли обычно хорошо поддаётся излечению.
С другой стороны, многие виды боли долго сохраняются (например, в спине или при опухолях) либо более или менее регулярно повторяются (например, головные боли, называемые мигренью, боли с сердце при стенокардии). Её устойчивые и рецидивирующие формы вместе называют хронической болью. Обычно такой термин применяют, если боль длится более полугода, однако это всего лишь условность.Часто она более трудная для излечения, чем острая боль.
Зуд. Зуд – это еще недостаточно изученный тип кожного ощущения. Он по меньшей мере связан с болью и может быть особой её формой, возникающей в определенных условиях стимуляции. Действительно, ряд вызывающих зуд стимулов высокой интенсивности приводит к болевым ощущениям. Однако, исходя из других соображений, зуд – это ощущение, независимое от боли, возможно, со своими собственными рецепторами. Например, его удается вызвать только в самых верхних слоях эпидермиса, тогда как боль возникает и в глубине кожи.Некоторые авторы считают, что зуд — это боль в миниатюре.В настоящее время установлено, что зуд и боль тесно связаны друг с другом. При кожной боли первое движение связано с попыткой удалить, сбросить, стряхнуть боль, при зуде — потереть, почесать зудящую поверхность. «Имеется много данных,— говорит выдающийся английский физиолог Эдриан,— указывающих на общность их механизмов. Зуд, конечно, не так мучителен, как боль. Однако во многих случаях, особенно при длительном и упорном чесательном рефлексе, человек испытывает тягостное ощущение, очень похожее на болевое.
Компоненты боли
В отличие от других видов ощущения, боль – это нечто большее, чем простое ощущение, она имеет многокомпонентный характер. В разных ситуациях компоненты боли могут иметь неодинаковую выраженность.
Сенсорный компонентболи характеризует её как неприятное, тягостное ощущение. Он состоит в том, что организм может установить локализацию боли, время начала и окончания боли, интенсивность болевого ощущения.
Аффективный (эмоциональный) компонент. Любое сенсорное ощущение (тепло, вид неба и т.п.) может быть эмоционально нейтральным или вызывать удовольствие или неудовольствия. Болевое ощущение всегда сопровождается возникновением эмоций и всегда неприятных. Вызываемые болью аффекты, или эмоции, почти исключительно неприятные; она портит наше самочувствие, мешает жить.
Мотивационный компонент
боли характеризует её как отрицательную биологическую потребность и запускает поведение организма, направленное на выздоровление.
Моторный компонент
боли представлен различными двигательными реакциями: от безусловных сгибательных рефлексов до двигательных программ антиболевого поведения.Он проявляется в том, что организм стремится устранить действие болевого раздражителя (рефлекс избегания, рефлекс защиты). Двигательная реакция развивается еще до того, как произойдет осознание боли.
Вегетативный компонент
характеризует нарушение функций внутренних органов и обмена веществ при хронических болях (боль – болезнь).Проявляется в том, что сильное болевое ощущение вызывает ряд вегетативных реакций (тошнота, сужение/расширение сосудов и т.п.) по механизму вегетативного рефлекса.
Когнитивный компонент
связан с самооценкой боли, боль при этом выступает как страдание.
Обычно все компоненты боли возникают вместе, хотя и в разной степени. Однако их центральные проводящие пути местами совершенно раздельны, и связаны они с различными частями нервной системы. Но, в принципе, компоненты боли могут возникать изолированно друг от друга.
Болевые рецепторы
Рецепторы боли - ноцицепторы.
По механизму возбуждения ноцицепторы можно выделить два типа. Первый - это механорецепторы
, их деполяризация происходит в результате механического смещения мембраны. К ним относятся следующие:
1. Ноцицепторы кожи с афферентами А-волокон.
2. Ноцицепторы эпидермиса с афферентами С- волокон.
3. Ноцицепторы мышц с афферентами А-волокон.
4. Ноцицепторы суставов с афферентами А-волокон.
5. Тепловые ноцицепторы с афферентами А-волокон, которые возбуждаются на механические раздражения и нагревание 36 - 43 С и не реагируют на охлаждение.
Второй тип ноцицепторов - это хеморецепторы
. Деполяризация их мембраны возникает при воздействии химических веществ, которые в подавляющем большинстве нарушают окислительные процессы в тканях. К хемоноцицепторам относятся следующие:
1. Подкожные ноцицепторы с афферентами С- волокон.
2. Ноцицепторы кожи с афферентами С- волокон, активирующиеся механическими стимулами и сильным нагреванием от 41 до 53 С
3. Ноцицепторы кожи с афферентами С- волокон, активирующиеся механическими стимулами и охлаждением до 15 С
4. Ноцицепторы мышц с афферентами С- волокон.
5. Ноцицепторы внутренних паренхиматозных органов, локализующиеся, вероятно, главным образом в стенках артериол.
Большинство механоноцицепторов имеют афференты А-волокон, и они расположены так, что обеспечивают контроль целостности кожных покровов организма, суставных сумок, поверхности мышц.
Хемоноцицепторы расположены в более глубоких слоях кожи и передают импульсацию преимущественно через афференты С-волокон.
Афферентные волокна передающие ноцицептивную информацию.
Передача ноцицептивной информации от ноцицепторов в ЦНС осуществляется через систему первичных афферентов по А- и С-волокнам, согласно классификации Гассера: А-волокна - толстые миелинизированные волокна со скоростью проведения импульсации 4 - 30 м/с; С волокна - немиелинизированные тонкие волокна со скоростью проведения импульсации 0,4 - 2 м/с. С волокон в ноцицептивной системе гораздо больше чем А-волокон.
Болевая импульсация идущая по А- и С-волокнам через задние корешки вступают в спинной мозг и образуют два пучка: медиальный, входящий в состав задних восходящих столбов спинного мозга, и латеральный, переключающийся на нейронах расположенных задних рогах спинного мозга. В передаче болевой импульсации на нейроны спинного мозга принимают участие рецепторы NMDA, активация которых потенцирует передачу болевой импульсации в спинной мозг, а также рецепторы mGluR1/5, т.к. их активация играет роль в развитии гиперальгезии.
Проводящие пути болевой чувствительности
От болевых рецепторов туловища, шеи и конечностей Аδ- и С-волокна первых чувствительных нейронов (их тела находятся в спинальных ганглиях) идут в составе спинномозговых нервов и входят через задние корешки в спинной мозг, где разветвляются в задних столбах и образуют синаптические связи прямо или через интернейроны со вторыми чувствительными нейронами, длинные аксоны которых входят в состав спиноталамических путей. При этом они возбуждают два вида нейронов: одни нейроны активируются только болевыми стимулами, другие – конвергентные нейроны – возбуждаются также и неболевыми стимулами. Вторые нейроны болевой чувствительности преимущественно входят в состав боковых спиноталамических путей, которые и проводят большую часть болевых импульсов. На уровне спинного мозга аксоны этих нейронов переходят на сторону, противоположную раздражению, в стволе головного мозга они доходят до таламуса и образуют синапсы на нейронах его ядер. Часть болевой импульсации первых афферентных нейронов переключаются через интернейроны на мотонейроны мышц-сгибателей и участвуют в формировании защитных болевых рефлексов. Основная часть болевой импульсации (после переключения в задних столбах) поступает в восходящие пути, среди которых главными являются боковой спиноталамический и спиноретикулярный.
Боковой спиноталамический путь образуется проекционными нейронами I, V, VII, VIII пластин, аксоны которых переходят на противоположную сторону спинного мозга и направляются в таламус. Часть волокон спиноталамического пути, которую называют неоспиноталамическим путём
(его нет у низших животных), заканчивается преимущественно в специфических сенсорных (вентральных задних) ядрах таламуса. Функция этого пути состоит в локализации и характеристике болевых стимулов. Другая часть волокон спиноталамического пути, которую называют палеоспиноталамическим путем
(имеется также у низших животных), оканчивается в неспецифичных (интраламинарных и ретикулярных) ядрах таламуса, в ретикулярной формации ствола, гипоталамусе, центральном сером веществе. Через этот путь проводится «поздняя боль», аффективно-мотивационные аспекты болевой чувствительности.
Спиноретикулярный путь образуют нейроны, расположенные в I, IV-VIII пластинах задних столбов. Их аксоны оканчиваются в ретикулярной формации ствола мозга. Восходящие пути ретикулярной формации следуют к неспецефическим ядрам таламуса (далее в новую кору), лимбическую кору и гипоталамус. Этот путь учавствует в формировании аффективно-мотивационных, вегетативных и эндокринных реакциях на боль.
Поверхностная и глубокая болевая чувствительность лица и полости рта (зона тройничного нерва) передается по Аδ- и С-волокнам первых нейронов ганглия V нерва, которые переключаются на вторые нейроны, расположенные преимущественно в спинальном ядре (от рецепторов кожи) и мостовом ядре (от рецепторов мышц, суставов) V нерва. От этих ядер болевая импульсация (аналогично спиноталамическим путям) проводится по бульботаламическим путям. По этим путям и часть болевой чувствительности от внутренних органов по сенсорным волокнам блуждающего и языкоглоточного нервов в ядро одиночного пути.
Роль структур головного мозга в формировании боли
Полноценное чувственное восприятие боли организмом без участия коры головного мозга невозможно. Ретикулярная формация ствола
(РФ) передает болевую информацию в неспецефические ядра таламуса, затем в кору, а также в гипоталамус и лимбическую систему, усиливает и пролонгирует защитные реакции спинного мозга и ствола, вовлекает в ответ вегетативную (особенно симпатическую) нервную систему. Повышение активирующего влияния восходящей РФ вызывает реакции возбуждения, настораживания.
Первичное проекционное поле болевого анализатора находится в соматосенсорной коре задней центральной извилины
. Оно обеспечивает восприятие «быстрой» боли и идентификацию места ее возникновения на теле. Для более точной идентификации локализации боли в процесс обязательно включается и нейроны моторной коры передней центральной извилины.
Вторичное проекционное поле расположенов соматосенсорной коре на границе пересечения центральной борозды с верхним краем височной доли
. Нейроны данного поля имеют двусторонние связи с ядрами таламуса, что позволяет этому полю избирательно фильтровать, проходящие через таламус возбуждения болевого характера. А это в свою очередь позволяет данному полю вовлекаться в процессы, связанные с извлечением из памяти энграммы необходимого поведенческого акта, его реализации в деятельности эффекторов и оценки качества достигнутого полезного результата. Двигательные компоненты болевого поведения формируются в совместной деятельности моторной и премоторной коры, базальных ганглиев и мозжечка.
Таламус
учавствует в передаче и переработке болевой информации: специфические ядра таламуса обеспечивают анализации болевого раздражения, его силы и длительности, неспецифические ядра таламуса учавствуют в формировании мотивационно-аффективного аспекта боли.
Лобная кора
играет важную роль в восприятии боли. Она обеспечивает самооценку боли (ее когнитивный компонент) и формирование целенаправленного болевого поведения.
Лимбическая система
(поясная извилина, гиппокамп, зубчатая извилина, миндалевидный комплекс височной доли) получает болевую информацию от передних ядер таламуса и формирует эмоциональный компонент боли, запускает вегетативные, соматические и поведенческие реакции, обеспечивающие приспособительные реакции к болевому раздражителю.
Классическая классификация боли
Боль можно классифицировать следующим образом:
1. Ноцигеная.
2. Нейрогенная.
3. Психогенная.
Ноцигеная боль.
Когда при раздражении кожных ноцицепторов, ноцицепторов глубоких тканей или внутренних органов тела, возникающие импульсы, следуя по классическим анатомическим путям, достигают высших отделов нервной системы и отображаются сознанием, формируется ощущение боли. Боль от внутренних органов возникает вследствие быстрого сокращения, спазма или растяжения гладких мышц, поскольку сами гладкие мышцы нечувствительны к жару, холоду или рассечению. Боль от внутренних органов, особенно имеющих симпатическую иннервацию, может ощущаться в определённых зонах на поверхности тела. Такая боль называется отражённой
. Наиболее известные примеры отражённой боли - боль в правом плече и правой стороне шеи при поражении желчного пузыря, боль в нижней части спины при заболевании мочевого пузыря и, наконец, боль в левой руке и левой половине грудной клетки при заболеваниях сердца. Нейроанатомическая основа этого феномена не совсем понятна. Возможное объяснение состоит в том, что сегментарная иннервация внутренних органов та же, что и отдалённых областей поверхности тела.
Нейрогенная боль
. Этот тип боли может быть, определён, как боль вследствие повреждения периферической или центральной нервной системы и не объясняется раздражением ноцицепторов. Такая боль имеет ряд особенностей, отличающих её, как клинически, так и патофизиологически от ноцигенной боли:
1. Нейрогенная боль имеет характер дизестезии. Хотя дескрипторы: тупая, пульсирующая или давящая являются наиболее частыми для подобной боли, патогномоничными характеристиками для неё считаются определения: обжигающая и стреляющая.
2. В огромном большинстве случаев нейрогенной боли отмечается частичная потеря чувствительности.
3. Характерны вегетативные расстройства, такие как снижение кровотока, гипер и гипогидроз в болевой области. Боль часто усиливает или сама вызывает эмоционально-стрессовые нарушения.
4. Обычно отмечается аллодиния (означающая болевое ощущение в ответ на низко интенсивные, в нормальных условиях не вызывающие боли раздражители). Например, лёгкое прикосновение, дуновение воздуха или причёсывание при тригеминальной невралгии вызывает в ответ “болевой залп”. Более ста лет назад Trousseau (1877) отметил сходство между пароксизмальной стреляющей болью при тригеминальной невралгии и эпилептическими припадками. В настоящее время известно, что все стреляющие нейрогенные боли могут лечиться антиконвульсантами.
Нейрогенная боль имеет много клинических форм. К ним можно отнести некоторые поражения периферической нервной системы, такие как постгерпетическая невралгия, диабетическая невропатия, неполное повреждение периферического нерва, особенно срединного и локтевого (рефлекторная симпатическая дистрофия), отрыв ветвей плечевого сплетения. Нейрогенная боль вследствие поражения центральной нервной системы обычно бывает обусловлена цереброваскулярной катастрофой. Это то, что известно под классическим названием “таламического синдрома”, хотя недавние исследования показывают, что в большинстве случаев очаги поражения расположены в иных областях, чем таламус.
Многие боли клинически проявляются смешанными - ноцигенными и нейрогенными элементами. Например, опухоли вызывают повреждение тканей и компрессию нервов; при диабете ноцигенная боль возникает вследствие поражения периферических сосудов, нейрогенная - вследствие нейропатии; при грыжах межпозвонкового диска, компримирующих нервный корешок, болевой синдром включает жгучий и стреляющий нейрогенный элемент.
Психогенная боль
. Утверждение что боль может быть исключительно психогенного происхождения, является дискуссионным. Широко известно, что личность пациента формирует болевое ощущение. Оно усилено у истерических личностей, и более точно отражает реальность у пациентов неистероидного типа.
Люди различных этнических групп отличаются по восприятию послеоперационной боли. Пациенты европейского происхождения отмечают менее интенсивную боль, чем американские негры или латиноамериканцы. У них также отмечается низкая интенсивность боли по сравнению с азиатами, хотя эти отличия не очень значительны.
Любое хроническое заболевание или недомогание, сопровождающееся болью, влияет на эмоции и поведение личности. Боль часто ведёт к появлению тревожности и напряжённости, которые сами увеличивают восприятие боли. Это поясняет важность психотерапии в контроле над болью. Биологическая обратная связь, релаксационный тренинг, поведенческая терапия и гипноз применяются в качестве психологического вмешательства и могут оказаться полезными в некоторых упорных, рефрактерных к лечению случаях. Лечение может быть более эффективным, если учитывает психологическую и другие системы (окружающую среду, психофизиологию, познавательную, поведенческую), которые потенциально влияют на болевое восприятие. Обсуждение психологического фактора хронической боли ведётся на основе теории психоанализа, с бихевиористских, когнитивных и психофизиологических позиций.
Поскольку эта тенденция имеет вышеупомянутые этнические и культуральные особенности, она кажется врождённой. Поэтому так заманчивы перспективы исследований, проводимых в настоящее время и направленных на поиск локализации и выделение “гена боли”.
Противоболевая (антиноцицептивная) система
В организме существует не только болевая (ноцицептивная), но также эндогенная антиноцицептивная морфофункциональная система, поддерживающая и регулирующая порог болевой чувствительности на необходимом функциональном уровне. Данная система имеет сложное строение и гетерогенна по своим механизмам. Наиболее изучены три её механизма: опиоидный, серотонинэргический и адренэргический, каждый из которых имеет свои морфологические и физиологические особенности.
Порог болевой чувствительности коррелирует с интегративным возбуждением, идущим по А - и С-волокнам, что связано с возбуждением не только механо-, но и хемоноцицепторов. В свою очередь порог возбуждения хемоноцицепторов зависит от воздействующих на них химических веществ, постоянно присутствующих в организме, в частности в плазме крови и спинномозговой жидкости. К ним относятся, с одной стороны, алгогенные вещества типа простагландинов, кининов, гистамина, субстанции Р и др., повышающие чувствительность хемоноцицепторов, с другой - вещества, понижающие их чувствительность, в первую очередь - опиоидные пептиды, которые могут угнетать образование первых веществ, например, брадикардина.
Предполагается, что алгогенные вещества и опиоидные пептиды воздействуют на один и тот же рецептор, что, в частности, постулируется для опиоидов и простогландинов. Уровень соотношения этих веществ, который в нормальном организме относительно постоянен, по-видимому, и определяет порог возбуждения ноцицепторов и тем самым порог болевой чувствительности.
Смещение соотношения эндогенных веществ в ту или иную сторону приводит к изменению порога боли.
Опиоидный механизм.
Опиоиды (эндорфины, энкефалины)- это вещества, которые подавляют болевое ощущение, практически не затрагивая другие сенсорные модальности. Их действие высоко специфично благодаря наличию особых опиоидных рецепторов на нейронах ноцицептивной системы. Известны по меньшей мере 4 их подтипа, различающихся своей чувствительностью к опиоидам и другим эндогенным веществам.
Содержание опиоидных пептидов в организме генетически заданной величиной. В тоже время установлено, что порог боли не является абсолютно стабильной величиной, а подвержен функциональным колебаниям, в частности суточным, это также коррелирует с изменениями содержания опиоидных пептидов. Порог боли, связанный с содержанием опиоидных пептидов, регулируется центральными механизмами, так как разрушение структур, в которых синтезируются опиоиды, ведёт к гиперальгезии,а их активация - к анальгезии. Это свидетельствует о том, что в организме человека и животных существует определённая функциональная система, регулирующая уровень содержания опиоидных пептидов.
Основной функцией опиоидного механизма эндогенной антиноцицептивной системы является поддержание и функциональное регулирование генетически заданного порога болевой чувствительности.
Опиоидная система оказывает также нарастающие тормозное влияние на проведение ноцицептивной импульсации на уровне интернейронов в ответ на нарастающий по интенсивности стимул для ограничения уровня возбуждения ноцицептивной афферентной системы, что не допускает её перегрузки. Примечательно, что энкефалины блокируют проведение не только ноцицептивной, но и сенсорной импульсации. Это указывает на то, что опиоидная система выполняет роль "ограничителя" возбуждения по отношению к любой афферентации.
Серотонинергический механизм
эндогенной антиноцицептивной системы связан с активностью нейров ядер шва и центрального серого околоводопроводного вещества (ЦСОВ).
В организме существует определенный уровень серотонина и понижение этого уровня, вызванное, например, введением деплеторов его синтеза, или разрушение серотонинергических структур ведёт к гипералгезии.
Между опиоидным и серотонинергическим механизмами антиноцицептивной системы существует определённый синергизм действия, что указывает на сходство их функций в регуляции болевого порога. Однако (в отличие от энкефалических нейронов) серотонинергические нервные клетки тормозятся в ответ на ноцицептивный раздражитель, что показано на нейронах ядер шва. Следовательно серотонинергическая антиноцицептивная система не может выполнять функции "ограничителя" возбуждения афферентных систем, в частности для ноцицептивной импульсации.
Опиоидная и серотонинергическая антиноцицептивные системы выполняют ещё одну функцию - информативную. Через эти системы формируется информация о биологически неопасном для организма значения воздействующего раздражителя.
Адренергический механизм
регуляции болевой чувствительности связан с активацией эмоциогенных зон ствола мозга и гипоталамуса. Фазический фактор данного механизма позволяет организму более быстро изменять пороги болевой чувствительности, как в сторону её снижения, так и повышения, что имеет важное приспособительное значение: организм либо более успешно выделяет опасные для него раздражители, либо пренебрегает ими ради удовлетворения других, более важных в тот или иной момент его биологических потребностей.
Адренергическая и серотонинергическая системы находятся в тесном взаимодействии друг с другом. Так имплантация кортикостерона в ЦСОВ вызывала снижение болевой чувствительности у крыс, снижение которой наблюдалось и при стимуляции ЦСОВ. Адренэктомия блокировала анальгетический эффект электрической стимуляции ЦСОВ, что свидетельствует о взаимодействии адренергической и серотонинергической систем.
Болевая чувствительность организма зависит от взаимодействия всех функционирующих механизмов, как ноцицептивных, так и антиноцицептивных, которые могут ослаблять или усиливать друг друга.
Список использованной литературы
1. Брин В.Б. Физиология человека в схемах и таблицах. «Феникс» – Ростов н/д., 1999. С. 243-282.
2. Грин Н., Стаут Т., Тейлор Д., Биология. «Мир» - М., 1990, в 3-х т.
3. Кассиль ГН. Наука о боли. «Медицина» - М., 1975.
4. Крик Ф. Мысли о мозге. Сборник «Мозг». «Мир» – М., 1980
5. Михайлович В.А., Игнатова Ю.Д. Болевой синдром. «Медицина» - М, 1990.
6. Покровский В.М., Коротько Г.Ф. Физиология человека. «Медицина» - М., 1997, в 2-х т.
7. Сборник статей по исследованиям психических явлений. Физиология центральной нервной сиситемы. (электронный ресурс // http://www.scorcher.ru)
8. Смирнов В.М., Яковлев В.Н. Физиология центральной нервной системы. Издательский центр «Академия» - М., 2004
9. Шмидт Р. и Тевс Г. Физиология человека. В 3-х т. «Мир» – М., 1996
|