| КУРСОВАЯ РАБОТА
«Методы выделения и анализа кумаринов в ЛРС».
Оглавление
Введение
1.Основная часть
1. Общая характеристика кумаринов
2. Классификация производных кумарина
3. Краткая характеристика методов выделения и анализа
4. Методы выделения кумаринов
5. Методы анализа кумаринов
Заключение
Литература
Условные обозначения
ЛВ – лекарственное вещество
ЛФ – лекарственная форма
ЛРС – лекарственное растительное сырьё
ТСХ – хроматография в тонком слое сорбента
УФ область – ультрафиолетовая область
ГЖХ – газожидкостная хроматография
ВЭЖХ – высокоэффективная жидкостная хроматография
Введение
Физиологическая роль кумаринов до конца не установлена. Известно, что они участвуют в регуляции роста растений, являясь антагонистами ауксинов; поглощают ультрафиолетовые лучи, защищая молодые растения от чрезмерного солнечного облучения; предохраняют растения от вирусных заболеваний.
Одним из характерных фармакологических свойств производных кумарина является антикоагулирующее действие, также известны коронарорасширяющие, бэта-блокирующие и желчегонные свойства кумаринов. Многие фурокумарины обладают фотосенсибилизирующей способностью и спазмолитической активностью. Ряд кумаринов и фурокумаринов проявляют бактериостатические и антимитозные свойства. У куместрола и родственных ему соединений отмечено выраженное эстрогенное действие. Имеются литературные данные об анти-ВИЧ активности некоторых синтетических и природных производных кумарина.(6)
Собственно кумарин (лактон цисо-гидроксикоричной кислоты) широко применяется в парфюмерной промышленности. Установлена его эффективность при некоторых видах лимфедемы, почечной карциноме и меланоме. Однако известно, что в экспериментах на печени крыс кумарин проявляет гепатотоксичность, а при длительном применении в высоких дозах сам является канцерогеном.
К числу растительных объектов, содержащих кумарин, следует отнести донник лекарственный (Melilotus officinalis (L.) Pall.). Проводимыми исследованиями установлено наличие у травы донника лекарственного антигипоксической, антиишемической и других видов кардиотропной активности, что явилось основанием для разработки технологии и методов стандартизации сухого экстракта, таблеток, мази и суппозиториев на его основе, а также жидкого экстракта травы донника лекарственного и препарата "Флокрамел". Однако все предложенные методы оценки качества разработанных преператов (УФ-спектрофотометрия, ВЭЖХ, ТСХ) требуют наличия стандартного образца веществ класса кумаринов.(11)
Реклама

При изучении НД на стандартные образцы, применяемые для оценки качества лекарственного растительного сырья (ЛРС) и фитопрепаратов, установлено, что стандартные образцы на производные собственно кумарина отсутствуют. Существующие стандартные образцы фурокумаринов псоралена, ксантотоксина, фловерина (сумма пиранокумаринов — дигидросамидина и виснадина) неприемлемы для оценки качества лекарственного растительного сырья, содержащего лактон цисо-гидроксикоричной кислоты и его замещенные аналоги.
В связи с этим представляет интерес обзор возможных методов выделения, а также синтеза и последующего анализа данного класса природных веществ с целью разработки адекватных методов получения стандартного образца и использования его для оценки качества ЛРС, фитосубстанций и препаратов, содержащих экстракты травы донника лекарственного. (7)
Основная часть
1. Общая характеристика кумаринов
Кумарины – природные кислородсодержащие гетероциклические соединения, в основе структуры которых лежит бензо-а-пирон (лактон цис-орто-гидроксикоричной кислоты).
Кумарины представляют собой производные 2Н-1-бензопиран-2-она. Они наиболее широко распространены в семействах Apiaceae Lindl., Rutaceae Juss., Fabaceae Lindl., Hippocastanaceae DC, при этом место их локализации различно: плоды, подземные органы, кора, листья, стебли и т.д. Количественное содержание кумаринов в растениях колеблется от 0,5 до 2 %, нередко достигая 5 - 6 % . Кумарины представляют собой бесцветные или окрашенные в желтый цвет кристаллические вещества, хорошо растворимые в органических растворителях — хлороформе, диэтиловом эфире, этиловом спирте, а также в жирах и жирных маслах. При нагревании до 100° С возгоняются.(1,2)
2. Классификация производных кумарина:
1. Незамещенные кумарины:
кумарин
2. Гидрокси-, метокси(алкокси)- и метилендигидроксикумарины и их гликозиды:
2.1. С гидроксильными или алкоксильными группами в бензольном кольце;
R1
= Н, R2
= ОН умбеллиферон
R1
, R2
= ОН эскулетин
R1
= ОСН3
R2
= ОН скополетин
2.2. С гидроксильными или алкоксильными группами в пироновом кольце (галфордин);
Реклама

2.3. Алкилированные в бензольном или пироновом кольце гидрокси- или метоксикумарины.
3. Фурокумарины:
3.1. Производные псоралена:

R1
= Н R2
= Н псорален
R1
= Н R2
= ОСНз ксантотоксин
R1
– OCH3
R2
= Н бергаптен
R1
– ОСН3
R2
= ОСН3
изопимпинеллин
3.2. Производные ангелицина:
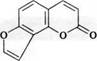
ангелицин
4. Пиранокумарины:
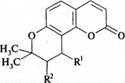
виснадин
5. 3,4-бензокумарины:
эллаговая кислота
6. Куместаны: куместрол и др.
7. Другие более сложные соединения, в состав которых входит кумариновая система (новобиоцин, афлатоксин и др.) (2,7)
3. Краткая характеристика методов выделения и анализа
Экстракция – метод разделения, основанный на использовании экстрагента, не смешивающегося с исходной фазой и легко отделяющегося от неё и от экстрагируемых компонентов. В зависимости от исходной фазы различают эстракцию из твёрдого твёрдого вещества и экстракцию из раствора (жидкостную). По количеству операций экстракция может быть однократной и многократной.
Хроматографические методы разделения веществ основаны на их распределении между двумя фазами: подвижной и неподвижной. Подвижная фаза – жидкость или газ; неподвижная – твёрдое вещество или жидкость, адсорбированная на твёрдом носителе. Относительная скорость перемещения частиц вдоль пути разделения зависит от их взаимодействия с неподвижной фазой. Поэтому каждое вещество проходит на носителе определенный путь. Отношение пути перемещения вещества к пути перемещения растворителя есть величина постоянная, обозначаемая Rf. Она является константой для данных условий разделения и используется для идентификации ЛФ.
Хроматография на бумаге. Носителем неподвижной фазы (например, воды) служит специальная хроматографическая бумага. Распределение происходит между водой, находящейся на поверхности бумаги, и подвижной фазой, которая представляет собой систему из нескольких растворителей. Проводят испытания. Для подтверждения подлинности одновременно хроматографируют испытуемое вещество и стандартный образец. Если они идентичны, то пятна на хроматограммах будут иметь одинаковый вид и равные значения Rf.Хроматографию используют при испытании на чистоту.
Хроматография в тонком слое сорбента (ТСХ) отличается от хроматографии на бумаге тем, что процесс хроматографирования происходит на носителе (сорбенте), нанесенном тонким слоем на инертную поверхность. Твердый сорбент может быть закрепленным или незакрепленным на этой поверхности. Сорбентом служит силикагель или оксид алюминия. Для закрепления добавляют небольшие количества крахмала или сульфата кальция, Используют также пластинки промышленного изготовления типа «Силуфол УФ-254», «Сорбфил» и др.
Преимуществами ТСХ является простота приемов и оборудования, более высокая чувствительность, чем у бумажной хроматографии, устойчивость пластинок к температурным и химическим воздействиям, значительно большие возможности процессов разделения, детектирования, элюировання, меньшая продолжительность выполнения испытания. Все это создает широкие возможности в использовании ТСХ для выполнения испытаний на подлинность, на чистоту, для количественного определения ЛВ в ЛФ.
Двумерное хроматографирование отличается повторным (после высушивания) пропусканием той же или иной подвижной фазы, но в перпендикулярном по отношению к первоначальному направлению. При этом используют квадратные пластины или листы бумаги.
В фармацевтическом анализе широко применяют сочетание ТСХ с физико-химическими методами анализа. Такие комбинированные методы, как хромато-спектрофотометрия, хромато-флуориметрия, хромато-масс-спектроскопия, особенно эффективны в анализе ЛРС и препаратов, содержащих большое число сопутствующих компонентов.
Гравиметрический метод – основан на измерении массы вещества. Сущность определения состоит в последовательном выполнении реакций осаждения, отделения, высушивании и взвешивании осадка.
Перманганатометрия основана на использовании окислительных свойств титранта – перманганата калия в кислой среде.(2)
Колориметрический метод основан на способности веществ вступать во взаимодействие с солями диазония. В качестве реагентов применяют диазотированный п-нитроанилин, сульфаниловую кислоту,сульфаниламид.
Спектрофотонетрия в УФ- и видимой областях—один из наиболее широко используемых физико-химических методов в фармацевтическом анализе.
Анализируемые ЛВ должны иметь в структуре молекулы хромофорные группы (сопряженные связи, ароматическое ядро и др.), обуславливающие различные электронные переходы в молекулах и поглощение электромагнитного излучения.
Кривая зависимости интенсивности светопоглощения от длины волны (нм) называется спектром поглощения вещества и является его специфической характеристикой. Измерение спектров поглощения растворов анализируемых веществ в ультрафиолетовой (190-380 нм) и видимой (380-780 мм) областях производят с помощью спектрофотометров различных марок (СФ-26, СФ-46 и др.). В качестве растворителей используют свободные от примесей воду, растворы кислот и щелочей, этанол, хлороформ и другие органические растворители.
Слектрофотометрической константой является удельный показатель поглощении (Е1см
1%
) , который рассчитывают по формуле:
(1) Е1см
1%
= А/С * l
Удельный показатель поглощения E1см
1%
представляет собой величину оптической плотности раствора, содержащего 1,0 г вещества в 100 мл раствора, измеренную в кювете с рабочей длиной 1 см. Установив по стандартному образцу величину Е1см
1%
и преобразовав эту формулу, можно рассчитать концентрацию анализируемого вещества с относительной погрешностью до ±2%.
Идентификацию ЛВ можно провести по Е1см
1%
, характеру спектральных кривых в различных растворителях, положению максимума и минимума светопоглощения или их отношению (при различных длинах волн). Для количественного спектрофотометрического анализа важен выбор аналитической полосы поглощения. Последняя должна быть свободна от наложения полос поглощения других компонентов смеси и иметь достаточно высокий удельный показатель поглощения анализируемого вещества.(2)
Фотоколориметрия отличается от спектрофотометрического анализа тем, что анализируемое вещество с помощью какого-либо реагента переводят (количественно) в окрашенное соединение. Вначале получают окрашенные растворы, используя растворы стандартных образцов (ГСО или РСО). Измерение оптической плотности производят на фотоколориметрах. Затем строят калибровочный график зависимости интенсивности поглощения окрашенных растворов от концентрации, по которому рассчитывают содержание ЛВ в испытуемых образцах ЛВ или ЛФ.
Флуоресцентные методы основаны на способности веществ флуоресцировать в УФ-свете, обусловленной либо химической структурой самих органических веществ, либо продуктов их диссоциации, сольволиза, других превращений. Способностью флуоресцировать обладают обычно органические соединения с симметричной структурой молекул, в которых имеются сопряженные связи (нитро-, нитрозо-, азо-, амидные, карбонильные или карбоксильные группы).
Полярография — метод, основанный на измерении силы тока, возникающего на микроэлектроде, при электровосстановлении анализируемого вещества в растворе. Растворителем служит вода, или органические и смешанные растворители. Электролиз проводят в полярографической ячейке, состоящей из электролизера и двух микроэлектродов: ртутного капающего и внешнего насыщенного каломельного. При соблюдении идентичных условий измерений для идентификации используют величину потенциала полуволны, а для количественного определения — высоту волны (измерение предельного диффузного тока). Количественный анализ выполняют методами калибровочных кривых с использованием стандартных растворов и методом добавок.(1,2)
Газожидкостная хроматография (ГЖХ) основана на распределении компонентов смеси между газовой и жидкой или твердой фазами. Распределение происходит в результате многократных актов сорбции и десорбции анализируемых веществ, которые вводятся в поток газа-носителя, испаряются и в парообразном состоянии проходят через колонку с сорбентом. Поэтому метод ГЖХ применим для анализа летучих веществ или веществ, которые могут быть переведены в газообразное состояние. Разделенные вещества элюируются из колонки потоком газа-носителя, регистрируются детектором и фиксируются на хроматограмме в виде пиков, по которым можно идентифицировать или определять содержание каждого компонента смеси.
Газовый хроматограф включает в себя систему измерения и регулирования скорости потока газа-носителя, систему ввода пробы испытуемого образца, газохроматографическую колонку, систему термостатирования и контроля температуры в различных узлах прибора и систему детектирования, регистрации и обработки информации, полученной на приборе.
Подлинность ЛВ методом ГЖХ можно подтвердить либо с помошью свидетелей, либо методом относительных удерживаний, В первом случае доказательством идентичности служит совпадение времени удерживания вешества-свидетеля и одного из компонентов смеси ЛВ при хроматографировании каждого в отдельности в одинаковых условиях. Во втором случае вещество-свидетель добавляют к пробе, затем анализируют по рекомендуемой методике. Рассчитывают по формуле величину относительного удерживания, которая является постоянной для ЛВ в конкретных условиях. Количественный анализ выполняют в тех же условиях, используя для расчетов такие параметры, как площадь или высота пиков ЛВ. Площадь пиков устанавливают на хроматограмме с помощью планиметра, интегратора или умножением высоты пика на его полуширину.
Высокоэффективная жидкостная хроматография (ВЭЖХ) отличается от ГЖХ тем, что подвижной фазой служит не газ, а жидкость, причем она проходит через колонку, наполненную сорбентом, с большой скоростью за счет значительного давления. Поэтому ВЭЖХ позволяет разделять многокомпонентные смеси на индивидуальные вещества высокой степени чистоты. ВЭЖХ отличается высокой чувствительностью {до 10 6 г). На разделение 10-15 компонентов затрачивается 20-30 мин.
Жидкостный хроматограф включает такие узлы, как дозатор, насос высокого давления, высокоэффективная колонка, детектор с регистрирующим устройством. Колонки изготавливают из нержавеющей стали, они имеют длину 10-25 см, внутренний диаметр 0,3-0,8 см и плотно набиваются адсорбентом с размером частиц 5-10 мкм. В качестве элюента используют различные углеводороды в сочетании с этанолом. Детектором обычно служит спектрофотометр с переменной длиной волны (190-900 нм), но существуют также флуориметрические. электрохимические и другие детекторы.
Подлинность испытуемых ЛВ подтверждают по времени выхода каждого компонента смеси из колонки, которое будет стабильно при одинаковых условиях проведения эксперимента. Количественное содержание рассчитывается по площади пика, которая пропорциональна количеству ЛВ в пробе.(2)
4. Методы выделения кумаринов
Для выделения кумаринов из растений обычно применяются различные растворители: этанол, метанол, бензол, хлороформ, диэтиловый и петролейный эфиры или их комбинации.
4.1. Наиболее полная экстракция кумаринов (в свободной форме и в форме гликозидов) достигается при использовании спирта этилового различных концентраций, как на холоду, так и при нагревании. Для очистки суммы кумаринов от сопутствующих веществ густой экстракт, полученный после отгонки экстрагента, обрабатывают хлороформом, диэтиловым или петролейным эфиром. При использовании в качестве экстрагента петролейного эфира хорошо извлекается смесь фурокумаринов, которые после концентрирования экстракта можно выделить в кристаллическом состоянии. В ряде случаев дополнительно проводится обработка экстракта активированным углем, кипящей водой с последующим сгущением и дальнейшим извлечением гидроксилированных и метоксилированных кумаринов хлороформом, этилацетатом и бутанолом, непосредственная обработка сухого остатка смесью хлороформа — этиловый спирт (97:3) (для выделения аналогичных производных) или же используется само спиртовое извлечение. Например, для извлечения суммы 7-гидроксилированных кумаринов из корней Helianthus annum L. предложено проводить последовательную экстракцию ацетоном, смесью ацетон — метанол (1:1) с последующим освобождением от пигментов в делительной воронке смесью гексан — эфир (6:4). Иногда целесообразно растительный материал обрабатывать петролейным эфиром, а затем исчерпывающе экстрагировать хлороформом или метанолом. Для выделения пеуцеданина применяют экстракцию метанолом в аппарате Сокслета, аналогичным способом с использованием последовательной экстракции семян Angelica archangelica L. н-гексаном, дихлорметаном и метанолом и последующей препаративной ТСХ были выделены шесть производных фурокумарина. Эти же экстрагенты позволяют получить сумму кумаринов и фурокумаринов из растения Metrodorea flavida. Для выделения гидрокси-, алкоксикумаринов и их гликозидов из семян Aesculus hippocastanum L. применяется экстракция 80 % этиловым спиртом с последующей обработкой горячей водой, фильтрованием и многократным извлечением веществ хлороформом, этилацетатом и бутанолом. Эскулин и фраксин из коры каштана получали путем экстракции из метанола. В гексановых и метанольных извлечениях из побегов Kielmeyera reticulata Saad., полученных последовательно, обнаружены 4-фенилкумарины и 4-н-пропилкумарины.
4.2. Для очистки кумаринов от сопутствующих веществ возможно использование метода омыления. Для выделения кумаринов проводят:
1. Экстракцию ЛРС органическим растворителем (эфиром) получают сумму кумаринов и балластных веществ.
2. Эфирный слой отделяют, отработанное сырьё выбрасывают.
3. Полученное эфирное извлечение обрабатывают 0,5% водным раствором КОН для очистки от фенолов и кислот.
4. Затем это же извлечение обрабатывают 10% спиртовым раствором КОН. Происходит разрыв лактонного кольца и образуются кумарины, которые переходят в водный слой. А в органическом растворителе остаются балластные вещества (смолы, стерины, спирты), органическую фазу выбрасывают.
5. Водно-щелочной слой подкисляют разбавленной НСl. Происходит замыкание лактонного кольца, образуются кумарины, которые экстрагируют органическим растворителем.
6. Органический слой отгоняют - получают сумму кумаринов, которую разделяют хроматографически.
Существенными недостатками этого метода являются возможность образования вторичных продуктов распада кумаринов, дегидратации и изомеризации некоторых оксикумаринов.
Дальнейшие операции, как правило, направлены на разделение суммы кумаринов и выделение индивидуальных соединений. В ранних исследованиях использовались кристаллизация, фракционная перегонка или сублимация в высоком вакууме. Однако многие кумарины обладают сходной растворимостью в органических растворителях, поэтому даже многократная перекристаллизация не позволяет достичь надежного результата.
Поэтому дальнейшее развитие химии кумаринов привело к использованию для этих целей различных видов хроматографии, лишенных вышеуказанных недостатков.(6,7)
4.3 Хроматографическое определение:
Для обнаружения кумаринов в растениях и сырье используются лактоновые свойства кумаринов, их способность флуоресцировать при ультрафиолетовом освещении и давать окрашенные растворы со специальными реактивами, микросублимацию и хроматографический анализ экстрактов сырья.(1):

На пластинку "Силуфол" или хроматографическую бумагу наносят исследуемые экстракты и помещают в хроматографическую камеру с системой, указанной в НД на исследуемое сырье. Хроматограммы после высушивания просматривают в УФ-свете. Флуоресцирующие пятна кумаринов отмечают простым карандашом и хроматограммы обрабатывают щелочью. После этого их высушивают в сушильном шкафу при t=120°C и вновь просматривают в УФ-свете. Затем хроматограмму обрабатывают диазотированным сульфаниламидом, от действия которого кумарины в зависимости от структуры окрашиваются в оранжевый, красно-оранжевый, фиолетовый цвета.
В некоторых случаях после просматривания хроматограммы в УФ-свете ее обрабатывают реактивом Драгендорфа (Bil3 в KI) или парами иода. Кумарины проявляются в виде пятен, окрашенных в коричневый цвет.
В первую очередь, проводят колоночную хроматографию с использованием различных сорбентов и систем растворителей.(5)
Так, для разделения гидрокси- и алкоксикумаринов, замещенных в бензольном цикле, предлагается применять колонку, заполненную силикагелем, и проводить последовательное элюирование гексаном, смесью гексан — хлороформ (с увеличением концентрации хлороформа), смесью хлороформ — метанол (9:1; 8:2; 7:3) или смесью хлороформ — этанол (97:3) . В других случаях для этих же целей берут оксид алюминия и смесь этилацетат — бензол (2:1) или бензол, силикагель и системы: хлороформ — бензол (1:1), хлороформ, хлороформ — этанол (98:2; 99:1; и т.д. до 90:10), бензол - бутанол (4:1; 3:1). Для разделения 4-фенил, 4-н-пропилкумаринов и 4-н-пропил-пиранокумаринов используют силикагель и элюируют последовательно системами гексан — этилацетат (градиент), метанол — вода — дихлорэтан, гексан — ацетон.
Фурокумарины фракционируют на оксиде алюминия (III степень активности) при помощи петролейного эфира, смеси петролейный эфир - хлороформ (2:1), хлороформа, смеси хлороформ — этанол (9:1, 4:1, 2:1), а также на силикагеле — смеси гексан — хлороформ и хлороформ — этанол с постепенным увеличением содержания более гидрофильного компонента.
О присутствии кумаринов свидетельствует характерная флуоресценция в УФ-свете отдельных зон сорбента, содержащих эти соединения, или же положительный эффект химических реакций, проводимых с элюатами.
При слабом сродстве вещества к сорбенту необходимо использовать активные слои и слабополярные растворители, а при сильном — малоактивные слои и сильнополярные растворители. В частности, кумарины с фенольными или спиртовыми гидроксилами активнее сорбируются на окиси алюминия и элюируются большими объемами полярных растворителей (этанол), иногда с добавлением 0,5 % уксусной или хлористоводородной кислоты; метилированные производные и пиранокумарины слабее удерживаются на сорбенте. В процессе элюирования целесообразно постепенно заменять гидрофобные растворители гидрофильными.
Для разделения суммы кумаринов, в том числе при их сочетании с другими низкомолекулярными БАВ, их очистки и анализа в настоящее время предложена колоночная хроматография с использованием сорбентов аффинного типа на основе фенольных и полифенольных лигандов. Рекомендованы эпоксиактивированные сорбенты с матрицей HW-35, содержащей резорциновые и катехиновые лиганды. В качестве подвижной фазы используются вода, водные растворы этанола, минеральных кислот, нейтральных солей и различных их сочетаний. Установлено, что при использовании данных типов сорбентов результаты значительно превосходят те, которые были получены при использовании классических кремнеземных, полиамидных и декстрановых сорбентов.
Контроль за эффективностью колоночной хроматографии осуществляется с использованием бумажной (БХ), а чаще — тонкослойной (ТСХ) хроматографии, что позволяет быстро устанавливать однородность исследуемых веществ и обнаруживать даже незначительные их количества. Для ТСХ наиболее часто применяются пластинки Силуфол или Сорбфил, иногда используется оксид алюминия II степени активности, силикагель, а в качестве систем растворителей — смеси бензола и ацетона (1:2), бензола, метанола и ацетона (8:2:10), гексана и хлороформа, толуола и н-бутанола (гидрокси- и метоксикумарины), спирта этилового и хлороформа (5,5:4,5), хлороформа и формамида (скополетин), этилацетата и бензола (1:2), диэтилового и петролейного эфира (фурокумарины) и другие.
Наилучшим сорбентом для разделения суммы кумаринов методом ТСХ считается оксид алюминия, при этом в качестве элюентов используют смеси: петролейный эфир — этилацетат (2:1), петролейный эфир — хлороформ, циклогексан — этилацетат (3:1), бензол — этилацетат в различных соотношениях и бензол.
В бумажной хроматографии используются различные марки бумаги. Следует отметить, что ввиду избирательной растворимости кумаринов в водных и неполярных растворителях, применяется метод импрегнирования хроматографической бумаги 20 % водными растворами этиленгликоля или пропиленгликоля, раствором формамида (или диметилформамида) в метаноле или ацетоне, растворами бората или фосфата натрия. В первом случае гидроксилсодержащие кумарины остаются на линии старта, поэтому используется пропитывание бумаги другими растворами или проводится хроматографирование в системе БУВ без импрегнирования бумаги .
Детекция кумаринов на хроматограммах чаще всего проводится по флуоресценции в УФ-свете при характерных длинах волн до и после обработки хроматограммы водно-спиртовыми растворами гидроксида калия, парами аммиака, а также по другим цветным реакциям. Цвет флуоресценции не позволяет с достаточной степенью точности определить структуру кумаринов, но в ряде случаев по нему можно судить о наличии и примерном расположении функциональных группировок.
Индивидуальные вещества выделяют с использованием препаративной ТСХ. Идентичность выделенного вещества устанавливают по таким характеристикам, как температура плавления, ИК-, ЯМР- и масс-спектры . ИК-спектры кумаринов имеют характерные полосы поглощения при 1750-1700 см -1
(-С=О группы) и при 1620- 1470 см -1
(для –С=С- ароматического кольца). При исследовании кристаллической структуры синтетических веществ данного класса возможно использование кристаллографического анализа с применением программного обеспечения SHELXL97. В качестве характеристики кумаринов с боковой цепью, содержащей асимметрические атомы углерода, хиральных атомов углерода фуранового цикла замещенного дигидроангелицина и пиранового цикла замещенного келлактона может использоваться величина удельного вращения.
Для подтверждения структуры выделенных из растений кумаринов возможно использование встречного синтеза. Среди методов синтеза следует отметить конденсацию Перкина (из салицилового альдегида и уксусного ангидрида), реакции Пехмана (из фенола и яблочной кислоты или Р-кетоэфиров), реакцию Кневе-нагеля (конденсация о-гидроксибензальдегидов с эфирами малоновой и других кислот).(7)
5. Методы анализа кумаринов
5.1 Титриметрический метод количественного определения производных кумарина основан на способности а-пиронового кольца раскрываться под действием щелочи, но в настоящее время он практически не используется. Избыток щелочи затем оттитровывают хлороводородной или серной кислотой. В связи с получением заниженных результатов была разработана модифицированная методика с использованием оксида ртути, которая исключает преждевременное замыкание лактонного кольца. Существенным достоинством титриметрического метода является отсутствие потребности в стандартных образцах кумаринов, недостатком — низкая специфичность и токсичность соединений ртути. Тем не менее, эта методика использовалась в нормативной документации на псорален и его лекарственные формы.
5.2. Одним из вариантов применения лактонной пробы является гравиметрический метод. Несмотря на несомненное достоинство — высокую точность, сравнимую со спектрофотометрическим определением, — он не получил широкого применения из-за трудоемкости и длительности.
5.3. Имеются литературные данные о применении перманганатометрии при количественном определении кумарина, однако этот метод дает недостаточно точные результаты.
5.4. Кислотные свойства природных гидроксикумаринов были изучены при помощи метода потенциометрического титрования в воде и некоторых неводных растворителях. Влияние строения кумаринов на характер кривых потенциометрического титрования позволяет использовать последние для установления структуры соединений наряду со спектрами их поглощения.
5.5. Колориметрические методы количественного определения кумаринов.
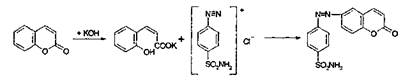
К спиртовому извлечению прибавляют 10% спиртовой раствор КОН, нагревают – раствор желтеет, прибавляют свежеприготовленный диазореактив (смесь равных объёмов пара-нитроанилина и раствора нитрита натрияв концентрированной НСl) при наличии кумаринов раствор приобретает окраску от коричневой до вишнёвой. Данный метод был применен для анализа кумаринов Heracleum sp., бергаптена в плодах Pastinaca sativa L., псоралена в субстанции и лекарственных препаратах, атамантина в корнях Peucedanum oreoselinum L. (Moench.), ксантотоксина и бергаптена в плодах Ammi majus L. и в препарате "Аммифурин".(11) (2):
| 
|
5.6 Имеются данные о применении фотоколориметрического метода для количественного определения синтетического антикоагулянта синкумара. Однако необходимо отметить, что реакция азосочетания не является специфичной для кумаринов и их производных (сходные эффекты способны давать фенолы, ароматические амины и флавоноиды). Перед проведением фотоколориметрии необходима тщательная очистка от сопутствующих веществ. Кроме того, диазопроизводные кумаринов имеют различия в спектрах поглощения, обусловленные спецификой строения исходного вещества.
5.7 Спектрофотометрический метод основан на способности кумаринов к поглощению в УФ-области спектра. Показано, что основные полосы поглощения в спектрах кумаринов и фурокумаринов обусловлены переходами 7г-электронов со связанных молекулярных орбиталей на разрыхляющие. Наличие нескольких характерных полос высокой интенсивности в диапазоне 220 - 350 нм позволяет использовать УФ-спектрофотометрию для количественного определения содержания кумаринов. Характерные максимумы поглощения приведены, в частности, в работах отечественных исследователей.
Из групповых методов анализа кумаринов УФ-спектрофотометрический метод является наиболее перспективным, т.к. позволяет проводить компонентный анализ на основе различий спектров поглощения, не требует предварительного разделения и относительно прост в аппаратурном оформлении. Однако при его применении желательно наличие стандартных образцов, позволяющих более точно, чем в случае использования калибровочных графиков и удельных показателей поглощения, устанавливать содержание целевых компонентов.
Методом УФ-спектрофотометрии установлено, что в спектрах поглощения синтетических антикоагулянтов — дикумарина, фепромарона и синкумара — наблюдаются две характерные полосы в области 280 и 306 нм, первая из которых имеет колебательную природу, а вторая соответствует р-п-сопряжению бензольного и пиронового циклов.
5.8 Прямая спектрофотометрия при длине волны 352 нм с использованием рабочего стандартного образца ксантотоксина была предложена для оценки качества препарата "Аммифурин". Совместное применение ТСХ и спектрофотометрии делает методику более точной. Возможно использование ТСХ на силикагеле КСК254 5/40 в системе петролейный эфир — этилацетат (1:1), после элюирования пятен этиловым спиртом определяется оптическая плотность. Применим аналогичный метод с использованием бумажной хроматографии на бумаге, импрегнированной метанольным раствором формамида в системе растворителей гептан - бензол (4:1). В работе рассмотрена возможность проведения количественного определения пеуцеданина в растительном сырье и препарате с использованием ТСХ на пластинке с незакрепленным силикагелем в системе петролейный эфир — диэтиловый эфир (1:2). Элюирование пятен осуществляют этанолом. При длине волны 298 нм проводят определение удельного показателя поглощения вещества, который используют для расчета его содержания. Существенным преимуществом применения спектрофотометрии в данном случае стала возможность определения примеси ореозелона, поглощающего при 345 нм. Количественное содержание птериксина в корнях Libanotis densiflora и в препарате "Либоверин" предложено определять по следующей методике: ТСХ на силикагеле КСК в системе н-гексан — бензол — метанол (5:4:1), элюирование пятен этиловым спиртом и измерение оптической плотности элюата при длине волны 322 нм. Расчет проводят по удельному показателю поглощения птериксина.
5.9 Хроматоспектрофотометрические методики разработаны также для определения количественного содержания псоралена и суммы фурокумаринов в плодах Psoralea drupacea Bge. с использованием стандартных образцов псоралена и ангелицина. С использованием удельного показателя поглощения ксантотоксина возможен и спектрофотометрический метод оценки качества плодов Pastinaca sativa L..
Псорален и бергаптен в препарате "Фурален" можно определить количественно, без разделения суммы кумаринов, при длине волны 297,5 нм, либо при двух длинах волн. Последний принцип положен в основу анализа листьев Ficus carica L., субстанции псоберана и его препаратов. Предложенный метод основан на модификации хроматоспектрофотометрического метода: при 298 нм определяется сумма фурокумаринов, а при 246 и 268 нм, где наблюдается наибольшая разность в интенсивности поглощения — содержание псоралена. Количество бергаптена определяется по разности. В качестве стандартного образца используется псорален.
При помощи УФ-спектрофотометрии возможно также определение молекулярной массы кумаринов и фурокумаринов. УФ-спектры могут быть использованы как один из методов идентификации выделенных из растения кумаринов, а также при исследовании их физиологической роли. Описано использование данного метода для оценки биодоступности дикумарола.
5.10 Полярографический метод применяется для анализа готовых лекарственных форм фурокумаринов и обусловлен их восстановлением на ртутно-капельном электроде в а-пироновом кольце по двойной связи в положении 3,4. На основании изучения физико-химических свойств природных кумаринов предложены методики качественного, количественного и функционального анализа, которые вошли в фармакопейные статьи на келлин, псорален, виснадин, пастинацин, некоторые виды лекарственного растительного сырья и лекарственные формы. В частности, для контроля качества плодов Pastinaca sativa L. были использованы полярографический и хроматополярографический методы с использованием стандартного образца ксантотоксина. При сочетании полярографии и хроматографии изучался химический состав кумаринов ряда растений и природных продуктов. Имеются литературные данные о методике количественного определения кумарина и коричной кислоты, применяемых в качестве стабилизаторов в инъекционном растворе ФиБС. Несомненным достоинством метода является возможность быстро и точно анализировать сумму кумаринов без предварительного выделения отдельных компонентов, однако следует учитывать, что из-за высокой чувствительности к электрохимически активным примесям требуется тщательная предварительная подготовка.
В настоящее время для анализа кумаринов метод полярографии практически не используется.
5.11 Флуоресцентный анализ
Многие кумарины и фурокумарины проявляют характерную (желтую, зеленую, голубую или фиолетовую) флуоресценцию при УФ-возбуждении в нейтральных спиртовых растворах, в растворах щелочей и концентрированной серной кислоте в видимой и ультрафиолетовой областях спектра. Флуоресценция усиливается в щелочной среде за счет образования хиноидной структуры, в кислой среде флуоресценция менее выражена. По величине стоксового сдвига и максимуму флуоресценции предлагается проводить идентификацию фитохимических препаратов. Для кумаринов и фурокумаринов получены спектры флуоресценции и установлена линейная зависимость ее интенсивности от концентрации, что позволило применить метод флуороденситометрии для количественного определения фурокумаринов псоралена и ангелицина в препарате псорален. Образование флуоресцирующих соединений компонентов препаратов "Аммифурин", "Бероксан" и "Пастинацин" с насыщенным раствором брома в щелочной среде позволило идентифицировать их на основании одинаковых максимумов возбуждения (380 нм) и флуоресценции (480 нм).
Предложен флуориметрический метод определения количественного содержания фурокумаринов в плодах Pastinaca sativa L. при длине волны возбуждения 350 нм и флуоресценции 470 нм. Аналогичная методика приведена и для близкого структурного аналога кумаринов, келлина, в плодах Ammi visnaga L. (Lam.).
Также предложен селективный способ количественного определения неодикумарина путем последовательной обработки анализируемой пробы в диметилформамиде раствором аммиака и насыщенным раствором магния хлорида в этом же растворителе.
Флуоресценция производных кумарина зависит от концентрации водородных ионов, поэтому данные об изменении окраски и интенсивности флуоресценции в различных пределах рН, а также в зависимости от строения кумаринов могут оказаться необходимыми при использовании флуориметрических методов. Количественный анализ с использованием данного метода не получил широкого распространения из-за не всегда проявляющейся линейной зависимости интенсивности флуоресценции от концентрации.
В литературе имеются данные об использовании 7-(2-бромэтокси) кумарина в качестве флуоресцентной метки для количественного флуориметрического анализа лекарственных препаратов, содержащих третичный атом азота.
Возможно применение флуоресцентной микроскопии для локализации и определения количества гидроксилированных производных кумарина, выполняющих роль фотопротекторов, в зеленых водорослях Da-sycladis vermicularis (Scopoli) Krasser.
Интерес представляет флуоресцентный экспресс-метод обнаружения кумарина в топливе, основанный на реакции его щелочного гидролиза с образованием о-кумаринат-ионов и последующим их превращением в о-кумарат-ионы, обладающие интенсивной флуоресценцией.
5.12 Бумажная хроматография чаще всего сочетается с другими физико-химическими методами. Например, после разделения суммы кумаринов на бумаге (петролейный эфир; ДМФА в ацетоне) возможно полярографическое определение суммы фурокумаринов в плодах Pastinaca sativa L. и в препарате "Бероксан". Сочетание бумажной хроматографии с фотоколориметрическим определением на основе реакции с диазотированной сульфаниловой кислотой используют для анализа фурокумаринов Psoralea drupacea Bge., псоралена и бергаптена в листьях Ficus carica L.. Этот же метод использован для определения фурокумаринов в некоторых видах зонтичных. К существенным недостаткам БХ относятся длительность проведения анализа и необходимость концентрирования вытяжки из-за малой сорбционной емкости бумаги.
5.13 Метод тонкослойной хроматографии в значительной степени лишен указанных недостатков, т.к. позволяет относительно быстро производить разделение компонентов смеси. Как и БХ, его можно использовать для идентификации кумаринов в исследуемых препаратах.
Имеются данные о колориметрических методах количественного определения пеуцеданина в корнях Ре-ucedanum morrissonii Bess., основанных на реакции азосочетания, с разделением на тонком слое оксида алюминия в системе гексан — бензол — метанол (5:4:1), и для анализа бероксана, пастинацина и псоралена. Также описано колориметрическое определение ксантотоксина, императорина и бергаптена в Ammi majus L. после хроматографирования на си-ликагеле, импрегнированном формамидом, в системе дибутилового эфира. Предложена методика определения псоралена и суммы псоралена и бергаптена, по отдельности, в листьях Ficus carica L.. При этом очищенный от балластных веществ экстракт хроматографируют в тонком слое оксида алюминия в диэти-ловом эфире, а затем при помощи УФ-спектрофотометрии устанавливают содержание кумаринов. Имеются литературные данные о возможности использования двумерной хроматографии в слое силикагеля для определения бергаптена в системах гексан — четыреххлористый углерод — трет-бутиламин (180:12:9) и гексан — толуол — этилацетат - уксусная кислота (100:10:10:0,5) в сочетании со спектрофлуориметрией.
Последнее десятилетие характеризуется широким использованием ГЖХ и ВЭЖХ для решения задач, связанных с разделением и оценкой качества различных соединений класса кумаринов.
5.14 Газожидкостная хроматография (ГЖХ) применяется в основном для идентификации и количественного анализа фурокумаринов в препаратах и растительном сырье. Установлено различие во временах удерживания для замещенных фурокумаринов. Из общих закономерностей следует упомянуть следующие: при переходе от гидрокси- к метоксикумаринам время удерживания уменьшается (снижается возможность сорбции за счет водородных связей), а фурокумарины с О-алкильным заместителем при С5 регистрируются позже, чем 8-гидроксиизомеры. Кроме того, отмечено, что величина десятичного логарифма относительного времени удерживания линейно зависит от молекулярной массы вещества. Полученные данные могут быть использованы при определении структуры или времени удерживания сходных кумаринов.
Описано также определение псоберана в субстанции методом ГЖХ.
Для анализа корней Phlojodicarpus sibiricus и фловерина предлагается ГЖХ методом абсолютной калибровки после экстракции кумаринов хлороформом в сравнении со стандартным образцом фловерина. При этом дигидросамидин и виснадин выходят одним симметричным пиком. Сравнение проводят со стандартным образцом фловерина. Раздельное определение виснадина и дигидросамидина возможно после предварительного переведения солей, образовавшихся при щелочном гидролизе, в свободные кислоты. Кислоты экстрагируют эфиром и хроматографируют. Аналогичный метод применяют для анализа аммифурина и плодов Ammi majus L. после экстракции их этиловым спиртом. В качестве внутреннего стандарта используют стандартный образец ксантотоксина.
Метод газовой хроматографии также применяется для обнаружения кумарина и его метаболитов в печени животных и человека.
5.15 Широкое распространение в анализе производных кумарина и фурокумарина в настоящее время получила высокоэффективная жидкостная хроматография (ВЭЖХ). Описано одновременное количественное определение методом ВЭЖХ действующих веществ семян Coronilla varia L. (кумаринов — скополетина, дафноретина и умбеллиферона и кардио-тонических гликозидов). Влияние метоксалена (ксантотоксина) на метаболизм никотина также проводилось при помощи этого метода.
Имеются данные об исследовании содержания кумарина в зависимости от времени заготовки южноамериканского растения Mikania laevigata, применяемого метода экстракции и экстрагента. Предложено использовать ВЭЖХ в изократическом режиме для разделения, одновременного качественного и количественного анализа кумаринов коры Aesculus hyppocasta-пит L. без предварительной очистки, для количественной оценки кумарина в листьях Mikania glomera-ta Spreng . Известна методика определения кумаринов с помощью ВЭЖХ в градиентном режиме (флуоресцентный детектор) при изучении биохимических функций кумаринов в корнях подсолнечника (Heliant-hus annum L.).
Весьма перспективным методом является сочетание ВЭЖХ и масс-спектрометрии. Предложены соответствующие методики определения антикоагулянтов непрямого действия и родентицидов кумаринового ряда (производные 4-гидроксикумарина) в плазме крови в практике токсикологического анализа. Определенный интерес представляет использование хроматомасс-спетрометрии для определения наличия кумарина в табачной продукции.(7)
Заключение
Для выделения суммы кумаринов из ЛРС было предложено использовать экстракцию этиловым спиртом различных концентраций с последующей очисткой хлороформом. Изучение качественного состава кумаринов проводили с использованием различных методов хроматографии — бумажной, тонкослойной и ВЭЖХ.
Качественный анализ производных кумарина, содержащихся как в экстракте, так и в лекарственных формах можно проводить, используя для этих целей как химические, так и физико-химические методы.
В качестве химических методов идентификации кумаринов используется общепринятая реакция азосочетания, лактонная проба, а также другие цветные реакции. Эти способы могут быть использованы в методах ТСХ и БХ, а также непосредственно путем проведения химических реакций с извлечением.
Качественное определение суммы кумаринов предложено проводить методом ТСХ на пластинках Сорбфил в системе бензол - этилацетат (1:2) с последующей обработкой раствора спиртовым раствором щелочи. Пятна идентифицируют по величине Rf и желтой окраске. Однако как уже было отмечено, реакция с диазореактивами неспецифична для кумаринов, к тому же значения Rf не всегда воспроизводимы, поэтому целесообразно применение ТСХ со стандартным образцом преобладающих соединений данного класса.
При использовании УФ-спектрофотометрии идентификацию кумаринов проводят по наличию полос поглощения при определенных длинах волн. ВЭЖХ предполагает нахождение параметров удерживания.
Для количественного определения суммы кумаринов в ЛРС были предложены такие методы, как титриметрия, гравиметрия, фотоколориметрия, УФ-спектрофотометрия и ВЭЖХ.(5,7)
Литература
1. Арзамасцев, А.П. Фармацевтическая химия – М.:Гэотар-мед,2004.-635 с.
2. Беликов, В.Г. Фармацевтическая химия – Пятигорск, 2003. – 715 с.
3. Государственная фармакопея СССР XI издание / 1 и 2 т. – М.: Медицина,1987. – 334 с., 1990. – 398 с.
4.Кемертелидзе, Э.П. Физико – химические методы анализа некоторых биологически активных веществ растительного происхождения – Тбилиси, 1976. – 198 с.
5. Коноплёва, М.М. Фармакогнозия: Природные биологически активные вещества – Витебск 2007. – 272 с.
6. Кузнецова, Г.А. Природные кумарины и фурокумарины – Л., 1967, 28 с.
7. Ложкин, А.В. Природные кумарины: методы выделения и анализа /А.В. Ложкин, Е.И. Сакалян // Хим. – фарм. журн. – т.40, №6 – 2006 – с 47 - 57
8. Машковский, М.Д. Лекарственные средства – Москва 2005
9. Справочник Видаль. Лекарственные препараты в России. – М.: АстраФармСервис, 1995 - 2007
10. Фармакопея РБ, 1т.
11. Шелюто, В.Л. Фармакогнозия – Витебск,2003 – 490 с.
|