СОДЕРЖАНИЕ
Введение
1. ХАРАКТЕРИСТИКА АМИНОКИСЛОТ.
2. ПРОДУЦЕНТЫ АМИНОКИСЛОТ.
3. БИОСИНТЕЗ АМИНОКИСЛОТ.
3.1 Одноступенчатый метод получения аминокислот.
3.2 Двухступенчатый метод получения аминокислот.
3.3 Получение лизина.
3.4 Получение аминокислот с помощью иммобилизованных ферментов и клеток.
3.5 Технология получения глутамата.
4. ПРОМЫШЛЕННЫЙ СИНТЕЗ АМИНОКИСЛОТ.
4.1 Микробиологический синтез.
4.2 Химический синтез.
5. ПРИМЕНЕНИЕ АМИНОКИСЛОТ. Заключение.
Список использованных источников.
Введение
Современный уровень развития биотехнологии обусловлен общим прогрессом науки и техники, особенно - в течении последних 50 лет. Достаточно отметить лишь такие события, как установление структуры и функций нуклеиновых кислот, обнаружение ферментов рестрикции ДНК и выявление их значения в жизни клеток с последующим использованием в генно - инженерных работах, создание гибридом и получение моноклональных антител, внедрение ЭВМ и компьютерной техники в биотехнологические процессы.
Промышленный биосинтез аминокислот относится к микробиотехнологии. По сути своей микробиотехнология тождественна промышленной (технической) микробиологии. Ее объектами являются микробы - вирусы ( включая вироиды и фаги ), бактерии, грибы, лишайники, протозоа. В ряде случаев биообъектами являются первичные метаболиты микробного происхождения - ферменты, каталитическая активность которых лежит в основе инженерной энзимологии.
В сравнении с растительным и животным клеткам микробы размножаются, как правило, быстрее и, следовательно, у них быстрее протекают все метаболические (обменные) процессы. Относительные преимущества большинства микробов как биообъектов следующие:
1) большая « простота» организации генома,
2) достаточно легкая приспособляемость (лабильность) к среде обитания в естественных и искусственных условиях,
3) выраженные скорости протекания ферментативных реакций и нарастания клеточной массы в единицу времени.
Первое преимущество обеспечивает микробным клеткам лучшие возможности для измерения и перестроек наследственного материала, например, включение в него чужеродной генетической информации, привнесение в клетки или, напротив, элиминации из них плазмид.
Реклама

Второе преимущество, связанное с лабильностью микробов, можно показать на примере бактерий и грибов. Так, применительно к температуре микробы подразделяются на психофилыу
мезофиллы и термофилы.[1]
1. ХАРАКТЕРИСТИКА АМИНОКИСЛОТ.
Аминокислоты играют большую роль в здравоохранении, животноводстве и легкой промышленности. По значению для макроорганизма аминокислоты подразделяют на заменимые и незаменимые. К незаменимым относятся те аминокислоты, которые не синтезируются в животном или человеческом организме, они должны быть привнесены с пищей или кормом для животным (табл. 1 ).
Таблица 1
Заменимые и незаменимые аминокислоты.
| Незаменимые |
Заменимые |
| Аргинин |
Аланин |
| В алии |
Аспарагин |
| Гистидин |
Апарагиновая кислота |
| Изолейцин |
Глицин |
| Лейцин |
Глутамин |
| Лизин |
Глутаминовая кислота |
| Метионин |
Пролин |
| Треонин |
Серии |
| Триптофан |
Тирозин |
| Фенилаланин |
Цистеин |
Заменимые синтезируются invivo из аммиака и различных источников углерода. Микроорганизмы сами синтезируют все необходимые им аминокислоты из аммиака и нитратов, а углеродные « скелеты » - из соответствующих интермедиаторов.
Исходя из оценки аминокислот, ученые давно стремятся использовать способности микроорганизмов продуцировать заменимые и незаменимые аминокислоты в ощутимых количествах.
Потребность людей в аминокислотах достаточно велика и этим определяется уровень их производства в мире (порядка 500 тыс. тонн в год).
Большинство микроорганизмов и зеленые растения способны синтезировать denovo все двадцать аминокислот. Углеродные скелеты аминокислот образуются из промежуточных продуктов обмена.
Исходным материалом для синтеза аминокислот служат простые промежуточные продукты катаболизма (пируват, 2 - оксиглутарат, оксалоацетат и фумарат, эригрозо - 4 - фосфат, рибозо - 5 - фосфат и АТР ). При синтезе большинства аминокислот аминогруппа вводится только на последнем этапе путем трансаминирования. Некоторые аминокислоты образуются в результате ряда превращений других аминокислот, и в этих случаях трансаминирование не требуется.
Белки синтезируются на рибосомах из аминокислот по информации м - РНК, которая переписана (путем транскрипции ) с генов ДНК.[1,5]
2. ПРОДУЦЕНТЫ АМИНОКИСЛОТ
Специфические ферменты, регулирующие биосинтез аминокислот, широко распространены у бактерий; они с определенной глубиной изучены у Escherichiacoli. Salmonellatyphimurium, Bacillussubtilis и прочие. У грибов, на аминокислотное лимитирование, отмечается некоординированное, параллельное возрастания уровня ферментов, катализирующих реакции биосинтеза различных аминокислот. Этот « общий контроль биосинтеза аминокислот » был также назван « метаболическим интерблоком », или « перекрестнопутевой регуляцией », впервые выявленной у Neurosporacrassa в 1965 году М. Карсиотисом и сотрудниками, а позднее - у Saccharomycescerevisiae, Aspergillusnidulas и других грибов.
Реклама

В гиперпродукции отдельных аминокислот культурами Escherichiacoli, Serratiamarcescens и другие важную роль играют Feedak - репрессия, например, при биосинтезе ароматических аминокислот на последних стадиях.
В любом живом организме аминокислоты расходуются прежде всего на биосинтез первичных метаолитов - ферментных и неферментных белков. Следовательно, кроме биосинтеза аминокислот denovo, возможен другой путь их получения, а именно - из гидролизатов соответствующих белков ( триптофан разрушается при кислотном гидролизе ), в том числе из нативной биомассы микробных клеток.
Природные аминокислоты являются, как правило, оптически активными L - и D - формами, которые трудно разделить. Вот почему микробный синтез с помощью коринебактерий и некоторых других микробов является ныне основным и экономически выгодным. Первое место здесь по праву занимает Япония, где лишь глутаминовой кислоты изготавливается свыше 100 тысяч тонн в год; большинство природных незаменимых аминокислот производит фирма «Такеда». С. Киношита, впервые в 50-е годы открывший и доказавший перспективность микробного синтеза, уже 1963 году признавал: «Мало сомнения в том, что недалеко то время, когда с помощью микроорганизмов будет возможно производить все известные аминокислоты». Это время наступило уже к 70 -м годам. Получены микробы - суперпродуценты из родов Brevibacterium, Corynebacterium, Micrococcus и другие, с помощью которых освоено крупнотоннажное производство не только глутамата, но и L - лизина, L - валина, L - гистидина и других. При суперпродукции уровень экспрессии клонированного гена выражается в синтезе специфического белка в количестве 2 % от всех растворимых белков клетки - хозяина. В настоящее время имеются продуценты, у которых количество синтезируемого специфического белка достигает 10-15% (здесь важнейшую роль играют многокопийные плазмиды, несущее встроенный гены). Генно - инженерными методами во ВНИИ генетики и селекции промышленных микроорганизмов ( Москва ) был получен штамм Escherichiacoli, обладающий сверхпродукцией L - треонина (30 г / л за 40 часов ферментации ).
С любым штаммом - продуцентом какой - либо аминокислоты необходимо внимательное и бережное обращение в целях поддерживания ее в активном состоянии в течении длительного времени.
Получен штамм Escherichiacoli, продуцирующий за 48 часов 27 г / л L - пролина, и штамм, продуцирующий до 22,4 г / л L - фениланина.
С помощью Corynebacteriumsp. можно получигь алкапосодержащих средах L - тирозин (до 19 г/л ); с помощью Corynebacteriumglutamicum на глюкозной среде - L - валин (до 11 г / л; L - аргинин, L - гистидин, L - изолейцин - 15 - 20,8 г / л.
3. БИОСИНТЕЗ АМИНОКИСЛОТ
Технология получения аминокислот базируется на принципах ферментации продуцентов и выделении вторичных метаболитов, то есть размножают маточную культуру вначале на агаризованной среде в пробирках, затем - на жидкой среде в колбах, инокуляторах и посевных аппаратах, а затем в головных (основных ) ферментаторах. Обработку культуральных жидкостей и выделение аминокислот проводят по схеме, аналогичной схеме получения антибиотиков. Изолированные чистые кристаллы целевого продукта обычно высушивают под вакуумом и упаковывают.
3.1 Одноступенчатый метод получения аминокислот
Известны два способа получения аминокислот: одноступенчатый и двухступенчатый. Согласно первому способу, например, мутантный полиауксотрофный штамм - продуцент аминокислоты культивируют на оптимальной для биосинтеза среде. Целевой продукт накапливается в культуральной жидкости, из которой его выделяют согласно схеме на рисунке d

1 - ферментатор,
2 - охладитель, 3,9 - рефрижераторы,
4 - емкость для предварительной обработки,
5 - центрифуга,
6 - вакуум - упариватель,
7 - аппарат прямой
8 - барабанный фильтр, А,Б - пути ( при необходимости смыкающиеся ),
10 - аппарат для ультрофилырации,
11 - емкость для консервации раствора фермента,
12 - мембранный фильтр,
13 - накопитель жидкого консерванта, 14-емкость для осаждения фермента,
15 - фильтр - пресс,
16 - распылительная сушилка,
17 - накопитель сухого концентрата.
Рисунок №1 Примерная технологическая схема получения аминокислот.
3.2 Двухступенчатый метод получения аминокислот
В двухступенчатом способе микроб - продуцент культивируют в среде, где он получается и синтезирует все необходимые ингредиенты для последующего синтеза ( в идиофазу ) целевого продукта.
Если ферменты биосинтеза аминокислоты накапливаются внутриклеточно, но после 1 - ой ступени клетки сепарируют, дезинтегрируют и применяют клеточный сок. В других случаях для целей биосинтеза целевых продуктов применяют непосредственно клетки.
3.3 Получение лизина
Если аминокислота предусмотрена в качестве добавки к кормам, то биотехнологический процесс кормового продукта включает следующие стадии: ферментацию, стабилизацию аминокислоты в культуральной жидкости перед упариванием, вакуум - упаривание, стандартизацию упаренного раствора при добавлении наполнителя, высушивание и упаковку готового продукта, в котором должно содержатся не более 10 % основного вещества. Например, в промышленности изготавливают сухой кормовой и жидкий кормовой концентраты лизина наряду с кристаллическим лизином.(рис. 2)
Рисунок №2
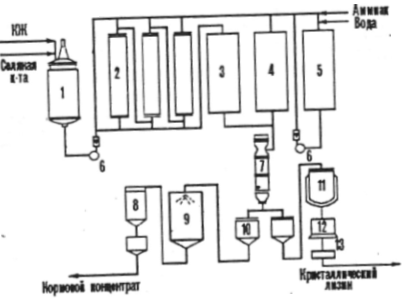
1 - емкость для культуральной жидкости (КЖ),
2 - ионообменные колонны,
3 - сборник злюата,
4 - сборник фильтрата,
5 - емкость для элюата,
6 - насос,
7 - вакуум - выпарной аппарат,
8 - циклон,
9 - сушилка кормового концентрата,
10 - сборник,
11 - реактор - кристаллизатор,
12 - центрифуга,
13 - сушилка.
Если концентрат содержит 70 - 80 % сухих веществ, то достаточно устойчив против микробной порчи за счет повышенной осмотической концентрации ингредиентов.[5]
3.4 Получение аминокислот с помощью иммобилизованных ферментов и клеток
Экономически целесообразным являются способы получения аминокислот с помощью иммобилизованных ферментов и клеток. Сравнительно давно реализован процесс получения L - аспаргиновой кислоты из фумаровой и аммиака в одну стадию с помощью иммобилизованных клеток Е. coli или Pseudomonasaeruginosa, обладающая аспартазной активностью (см схему)

Аспартаза катализирует реакцию присоединения аммиака к фумаровой кислоте. Фермент в иммобилизованном состоянии сохраняет активность на исходном уровне 2 -2,5 недель и более.
L - Аспаргиновую кислоту можно получить и с помощью иммобилизованных клеток, что существенно повышает длительность функционирования системы, производительность которой по целевому продукту составляет около 2000 кг с 1м реактора. Периодические ферментации используют при получений других L - аминокислот (глутаминовой, фенилаланина, лизина, триптофана и др. ). При этом культивируют обычно специальные мутантные штаммы, метаболизм которых по целевому продукту изучен достаточно полно. Так, например, установлено, что лимитирующем агентом коринебак герий, образующих глутаминовую кислоту, является биотип в дозе 1 - 5 мкг/ л. Биотин индуцирует структурно - функциональные изменения в клеточной мембране, благодаря чему увеличивается ее проницаемость для глутаминовой кислоты, выходящей из клетки в культуральную жидкость. Отдельные штаммы продуцентов способны накапливать ее более 50 г/л на мелассных средах.
Роль биотина аналогична в случае получения пролина, являющимся производным глутаминовой кислоты.
Несложность этой технологии и ее преимущества по сравнению с глубинной ферментацией наглядно иллюстрируют опыт японской фирмы «Танабе Сейяку ». В 1973 году эта фирма разработала способ получения аспарагиновой кислоты при помощи иммобилизованных бактериальных клеток, обладающих аспартазной активностью. Аспартаза катализирует присоединение аммиака по двойной связи фумаровой кислоты, т.е. аспарагиновая кислота образуется в одной стадии и данный биотехнологический процесс можно отнести к категории биотрансформации органических соединений. Иммобилизованный в геле фермент функционировал хорошо, длительность его полуинактивации составила 1 месяц. Затем в геле иммобилизовали клетки продуцента, дополнительно стабилизируя их путем химического связывания между собой и с гелем. Длительность полуинактивации клеток в этом случае увеличивалась до 4 месяцев. Технологию биотрансформации фумаровой кислоты, таким образом, можно представить в такой последовательности:
выращивание клеток методом глубинной ферментации и их выделение центрифугированием;
иммобилизация клеток биокатализатора в геле в виде гранул размером 2 -3 мм;
биотрансформация фумарата аммония в колонке с катализатором в проточном режиме и получение раствора аспарагиновой кислоты;
кристаллизация, центрифугирование и промывка кристаллов.
Производительность системы биотранеформации аспарагиновой кислоты 1 м биореактора 1700 кг.
3.5. Технология получения глутамата.
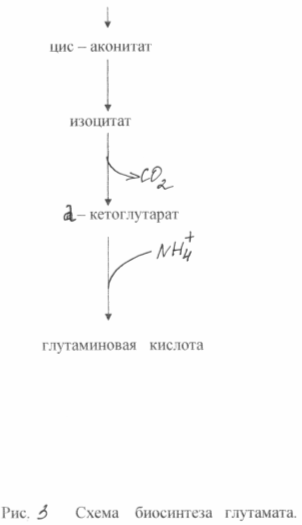
В основе сверхсинтеза глутаминовой кислоты из глюкозы у этих бактерий лежат два биохимических принципа: недостаток фермента а - кетоглутаратдегидрогеназы и блокировка биосинтеза биотина. Неспособность клеток синтезировать биотин приводит к увеличению проницаемости цитоплазмотической мембраны, что повышает экскрецию глутамата. Он образуется в результате аминирования а - кетоглутарата, неспособного к дальнейшим превращениям в цикле трикарбоновых кислот. Схема биосинтеза глутамата из глюкозы у данного типа мутантов показана на рис. 3
При биосинтезе глутаминовой кислоты очень большое значение имеет концентрация биотина в среде. Необходимо обеспечить его концентрацию 1 - 5 мкг /л. В этом случае нарушается нормальный синтез фосфолипидов мембраны и последняя становится проницаемой для глутамата. При концентрации биотина 15 мкг/л наблюдается интенсивный рост биомассы. Проницаемость цитоплазмотической мембраны для глутамата можно снизить также при помощи пенициллина, добавляя его к среде во время логарифмической фазы роста. В этом случае фосфолипиды экстрагируются из мембраны и транспорт глутамата может осуществляться в течение 40 - 50 часов. Бактериальный синтез глутамата позволяет получать примерно 50 % - ный выход продукта из сахара и накапливать в среде ферментации до 200 г/л глутамата. Известны методы получения глутамата на этанольных средах ( до 60 г/л ) или на ацетате (до 98 г/ л ).[6]

4. ПРОМЫШЛЕННЫЙ СИНТЕЗ АМИНОКИСЛОТ
Промышленное производство аминокислот осуществляется двумя способами: микробиологическим и химическим.
4.1 Микробиологический синтез
Микробиологический синтез основан на выращивании определенных видов микроорганизмов на питательных средах, имеющих подходящий источник углерода. Чаще всего это сахара, содержащиеся, например, в патоке. Мутированные микроорганизмы с нарушенным азотным обменом выделяют в раствор большое количество какой-либо одной аминокислоты. После окончания процесса ферментации аминокислоту выделяют из раствора химическими методами
Путем микробиологической ферментации получают основное количество глутаминовой кислоты и весь лизин. У этого процесса свои преимущества и свои недостатки. С одной стороны, в нем мало стадий и требуется относительно простая и универсальная аппаратура. С другой стороны, живые микроорганизмы, с которыми приходится работать, очень чувствительны к малейшему изменению условий, а концентрация целевого продукта получается низкой, что ведет к увеличению размеров аппаратуры.
Существует способ микробиологического получения фенилаланина при помощи тирозин - и метиониндефицитного мутанта Brevibacteriumlactofermentum. В периодическом процессе ферментации достигнута концентрация продукта 24,8 г/л. Однако для данного процесса требуются сложные и дорогие среды. Определенный интерес представляют биосинтез фенилаланина ауксотрофным мутантом Е. coli, который можно культивировать в глюкозной среде с фосфатами. Процесс ферментации осуществляют доливным методом с рециркуляцией биомассы. Биомасса в реакторе 60 - му часу достигает 45 - 50 г/л, а концентрация фенилаланина - 22,4 - 22,8 г/л. Продуктивность системы 0,72-0,86 г/( лч ); выход продукта 0,11г.
4.2 Химический синтез
Химический синтез более универсален, чем микробиологический, и позволяет получать соединения любой возможной структуры. Здесь используется непищевое минеральное сырье, достигается любая концентрация продукта, однако, как правило, процесс многостадиен и требует более сложной аппаратуры.
Оба способа обеспечивают получение природных аминокислот необходимой степени химической и оптической чистоты. Так что в конечном счете, когда речь идет о промышленном производстве, последнее слово остается за экономикой: по данным зарубежных специалистов, при больших масштабах химические методы становятся более рентабельными.
Наиболее широко разработан промышленный синтез метионина- аминокислоты, главным потребителем которой является птицеводство. Исходным веществом служит пропилен - продукт крекинга нефти. Пропилен окисляется до акролеина, который в результате серии реакций, превращается в рацемический метионин.

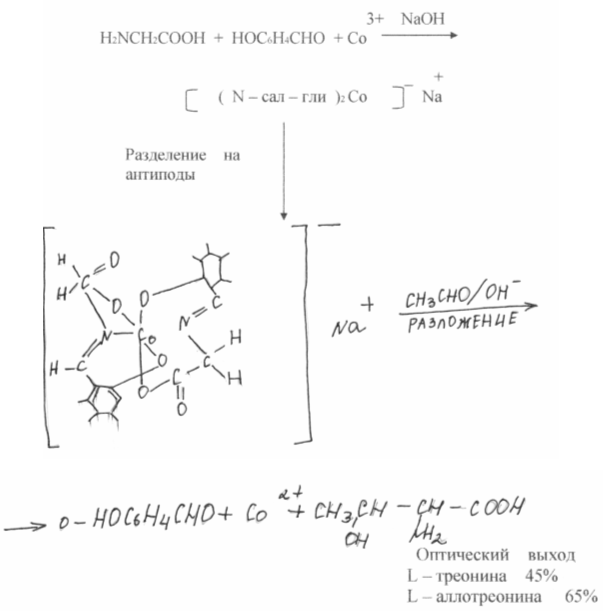
В результате химического синтеза обычно получается смесь равных количеств L и D - изомеров аминокислот, в то время как в состав белков входят исключительно L-изомеры. Эти же изомеры питательны. D-изомеры организмом, как правило, не усваиваются и являются балластом. Следовательно, необходимо разделение, что неминуемо отрицательно сказывается на экономике. В последнее время в области расщепления рацемических смесей аминокислот достигнуты серьезные успехи. В работах СВ. Рогожина и В.А. Даванкова показано, что оптически неактивные аминокислоты, будучи ковалентно присоединены к нерастворимому полимерному носителю, легко образуют комплексы с медью, никелем и т.п. другая рацемическая аминокислота, находящаяся в растворе, занимает два вакантных координационных места у атома металла, причем прочность комплексов L - и D - изомеров различна. Сколь ни мало это различие, будучи повторенным многократно в процессе хромотографии, оно обеспечивает полное или частичное разделение оптических антиподов. Наилучшие результаты получены с DL - пролином, который может быть препаративно разделен на оптические изомеры.
Усилие многих исследователей направлены также на разработку такого химического синтеза, который давал бы только один желаемый природный оптически активный изомер - изомер, синтезируемый живой природой, - ассиметрического синтеза. В этом направлении за последние годы достигнуты серьезные успехи. В работах А. Кагана (Франция ) и Е, Корна ( США ) достигнуты практически количественные оптические выходы. Чрезвычайно заманчивым представляется воспроизведение путей синтеза аминокислот природными ферментными системами. Большое количество таких синтезов осуществляется пироксальзависимыми ферментами, причем сразу получается нужный оптический изомер аминокислоты. Большой вклад в изучение этих процессов сделан академиком А.Е. Браунштейном (Россия) и профессором Ю. Снеллом (США).
Российские ученые поставили своей целью найти химические системы, которые могли бы не только моделировать биохимические реакции, но и осуществлять процессы, не проходящие в живом организме. В качестве такой системы были выбраны комплексы шиффовых оснований аминокислот с ионами переходных металлов. Предпологалось, что салициловый альдегид в этих комплексах будет играть роль лиридоксаля, увеличивая реакционную способность С - Н - связи аминокислоты, ион металла будет делать тоже самое, но еще удерживать систему в жестком плоском состоянии, что в природе обеспечивает белок фермента. Общая диссимметрия комплекса позволяла надеяться, что в природе обеспечивает белок фермента. Общая диссиметрия комплекса позволяла надеяться, что реакция может быть проведена стереоспепифически, т.е. в результате дать оптически активную кислоту.
Такие реакции в природе не идут, а практическая ценность их заключается в том, что при этом сразу получается глутаминовая кислота. Таким образом, открывается путь нового общего синтеза аминокислот, проходящего в чрезвычайных условиях.
Несравненно сложнее оказатось воспроизвести другую сторону действия природных ферментов - ассиметричеекий синтез. Для этого комплексы были разделены на оптически активные антиподы.
5. ПРИМЕНЕНИЕ АМИНОКИСЛОТ
Белки всех организмов от вируса до человека состоят из 21 аминокислоты, которые по своей биологической ценности делятся на заменимые ( их для построения белков организм может синтезировать сам с достаточной скоростью ) и незаменимые (их он синтезировать не может и должен получать из вне из пищи ). Каждый белок содержит определенное количество каждой аминокислоты. Если в потребляемом белке какой - либо незаменимой аминокислоты нет или мало, белок организма не будет построен. Отсюда необходимость балансирования рациона, что приводит к увеличению их питательной ценности.
На рисунке (4) в качестве этанола взят казеин- питательный животный белок. Заштрихованная в линейку часть каждой колонки соответствует питательной ценности природного белка в единицах КЭБ ( коэффициент эффективности белка). Добавление в продукт некоторого количества лизина, первой лимитирующей аминокислоты, приводит к резкому увеличению питательности, добавление второй лимитирующей аминокислоты повышает питательность до уровня животных белков.
Рис. 4 Увеличение питательной ценности белка добавлением лимитирующих аминокислот в единицах КЭБ

Балансирование рациона широко используется в сельском хозяйстве. По данным М.Ф. Томмэ, И.Ф. Ткачева, включение 0,2 - 0,5 % лизина в рацион поросят и цыплят позволяет снизить расход кормового белка на 25 % и повысить продуктивность животных на 10-13 %. Обобщая результаты исследований, как российских, так и зарубежных авторов получаем, что при организации производства 20 тысяч тонн лизина в год можно получить дополнительно 1,2 миллиона тонн мяса и сэкономить 3,6 миллионов тонн белкового корма. По мнению голландского экономиста Н. Маргудера, 0,125% лизина в корме свиней, состоящем из кукурузной муки и земляного ореха, дают чистую прибыль 100%.
Балансирование зерновых продуктов чистыми аминокислотами пока не нашло себе широкого применения в пищевой промышленности, хотя оно улучшает питательные свойства растительного белка, и, следовательно, увеличивает количество белка, пригодного для использования в пищу. Последнее особенно важно, так как появляется реальная возможность обеспечить быстро растущие потребности в пищевом белке без одновременных изменений характера рационов и органолептических свойств продуктов Не менее успешно применяются аминокислоты в медицине. После тяжелых операции, ожогов и т.п. организм человека очень часто не может усваивать белок в количестве, необходимый для процессов регенерации, и это приводит к ухудшению состояния больного. Тогда прибегают к аминокислотному питанию. Прекрасный терапевтический эффект, достигаемый в этих случаях, вызывает большую потребность в смесях аминокислот. Смесью, не содержащей фенилаланина, кормят детей, страдающих фенилпировиноградной олигофренией.
Аминокислоты служат исходными веществами для синтеза полипептидов, многие из которых являются сильнейшими физиологически активными соединениями, а также для создания других лекарственных препаратов.
Наконец, в процессе поликонденсации аминокислоты образуют полимеры, которые, не обладая биологической активностью белков, похожи на них своим строением и лимитируют некоторые их важные физические свойства. Искусственные шерсть, шелк и кожа, полученные с участием аминокислот по эксплуатационным показателям не уступают естественным материалам.
Несмотря на широкое использование аминокислот в медицине, промышленности и сельском хозяйстве, главным их потребителем остается пищевая промышленность. Так, глутамат натрия ( натриевая соль глутаминовой кислоты ) - мощный усилитель вкуса. Во многих странах его добавляют во все продукты при консервировании, замораживании, при длительном хранении; он находит применение и в общественном питании и в домашнем хозяйстве в виде смеси со столовой поваренной солью. Из смеси из аминокислот составляют также композиции, имитирующие вкус и запах пищевых продуктов.
Потребление аминокислот в мире возрастает ежегодно на 10 %. Их производство характеризуется следующими цифрами
| Аминокислота |
м/тод |
Цена, долл/год |
Метод. |
| L - глутаминовая кислота |
180000 |
0,5- 1 |
Микробиологический, химический. |
| DL - метионин |
32000 |
3 |
Микробиологический. |
| L - лизин |
8000 |
3 |
Химический. |
| Глицин |
2000 |
Химический. |
| L - триптофан |
20 |
Химический. |
| L - треогшн |
20 |
10 |
Химический, микробиологический. |
Заключение
Данная курсовая работа посвящена промышленному биосинтезу аминокислот. Благодаря этой работе я выяснила, что существуют следующие способы получения аминокислот:
1. Биосинтез аминокислот, который включает в себя одноступенчатый и двухступенчатый методы;
2. Промышленный синтез аминокислот - микробиологический и химический синтез.
Рассмотрели получение аминокислот с помощью иммобилизованных ферментов и клеток, а также технологию получения лизина и глутамата.
Установила применение аминокислот не только в медицине, но и в сельском хозяйстве для того чтобы снизить расход кормового белка; и в пищевой промышленности в качестве консервантов и усилителей вкуса
Список использованных источников
1. Е.А. Строев. Биологическая химия. М., Высшая школа, 1986.
2. М.Е. Беккер, Г.К. Лиепинын, Е.П. Райпулис. Биотехнология. М., ВО Агропромиздат, 1990.
3. У.Э. Виестур, И.А. Шмите, А.В. Жилевич. Биотехнология. Био технологические агенты, технология, аппаратура. Рига, Зинатне, 1987.
4. Г.К. Лиепинын, М.Э. Дунцэ. Сырье и питательные субстраты для промышленной биотехнологии. Рига, Зинатне, 1986.
5. Н.П. Блинов. Основы биотехнологии. СПБ., Наука, 1995.
6. Л.И. Воробьев. Промышленная микробиология. М., МГУ, 1989.
7. С.Д. Варфоломеев, С.В. Калюжный. Биотехнология. Кинетические основы микробиологических процессов. М., Высшая школа, 1990.
8. В.М. Беликов. Аминокислоты, их химический синтез и применение. Вестн. АН СССР, 1973.
9. Дж. Бейли, Д. Оллис. Основы биохимической инженерии, т. 1. М„ Мир, 1989.
10. Г.С. Муровцев, Р.Г. Бутенко, Т.Н. Тихоненко, М.И. Прокофьев. Основы сельскохозяйственной биотехнологии. М., ВО Агропромиздат, 1990.
11. Биотехнология: принципы и применение. Под ред. И. Хиггинса, Д.Беста, Дж. Джонса. М., Мир, 1988.
|