.
О. В. МОСИН
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, 117571, г. Москва, просп. Вернадского, д.86.
Представлены данные по биосинтезу [2
H6
] - L-фенилаланина, продуцируемого экзогенно штаммом факультативных метилотрофных бактерий Brevibacterium methylicum
, способного ассимилировать метанол (или его дейтерий-меченный аналог) в качестве источника углерода и энергии. Микробную биоконверсию C2
H3
O2
H проводили на минимальной среде, содержащей 98 об.% 2
Н2
O. Выход L-фенилаланина при этом составил 1 г/л. Анализ степени дейтерированности L-фенилаланина проводили методом масс-спектрометрии электронного удара после препаративного разделения методом обращенно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) в виде метилового эфира дансил - фенилаланина и карбобензокси-фенилаланина. Согласно полученным данным, степень изотопного включения дейтерия в фенилаланин составила 75 %, что свидетельствует о высокой эффективности мечения L-фенилаланина в этих условиях. Полученный [2
H6
]- фенилаланин может быть использован для диагностики наследственной фенилкетонурии.
ВВЕДЕНИЕ
Метод мечения стабильными изотопами является ключевым направлением в разнопрофильных биомедицинских исследованиях с использованием аминокислот и других биологически активных соединений (БАС) [1, 2]. Тенденции к предпочтительному применению стабильных изотопов по-сравнению с радиоактивными аналогами обусловлены отсутствием радиационной опасности и возможностью определения локализации метки в молекуле методами высокого разрешения, включая спектроскопию ядерного магнитного резонанса (ЯМР) [3], инфракрасную [4] и лазерную спектроскопию [5] и масс-спектрометрию (МС) [6]. Развитие этих методов детекции стабильных изотопов за последние годы позволило значительно усовершенствовать проведение многочисленных биологических исследований с участием аминокислот de novo, а также изучать их метаболизм, механизм действия, внутриклеточный транспорт и т.п. [7,8]. Аминокислоты, меченные стабильными изотопами 2
Н, 13
С, 15
N широко применяются как во врачебной практике и в медицинской диагностике, так и в биохимических исследованиях разнообразного характера [9, 10], а также в химических синтезах широкого круга изотопно - меченных соединений на их основе, например, меченный L-фенилаланин в синтезах пептидных гормонов и нейротрансмиттеров [11]. Изотопно-меченные аналоги L-фенилаланина находят всё большее применение в диагностических целях, например, для выявления наследственной фенилкетонурии и других заболеваний, связанных с нарушением метаболизма аминокислот в организме [12].
Реклама

В настоящее время биотехнологический потенциал метилотрофных бактерий для получения аминокислот, меченных дейтерием общепризнан [13]. Традиционным подходом при этом является культивирование штаммов - продуцентов на средах, содержащих С2
Н3
О2
Н и 2
Н2
О с последующим фракционированием культуральной жидкости. Раннее нами была изучена возможность использования штамма факультативных метилотрофных бактерий B. methylicum для получения фенилаланина [14-15]. В отличие от традиционных штаммов-продуцентов фенилаланина, у которых нарушены активности префенатдегидратазы или дезоксиарабиногептулозофосфатсинтетазы, уникальность этого штамма состоит в том, что для биосинтеза L-фенилаланина необходим L-лейцин.
Целью данной работы было изучение принципиальной возможности получения дейтерированного L-фенилаланина с высокой степенью изотопного обогащения за счёт использования штамма факультативных метилотрофных бактерий Brevibacterium methylicum .
УСЛОВИЯ ЭКСПЕРИМЕНТА
.
Бактериальные штаммы
. Исследования проводили с L-лейцин-зависимым штаммом факультативных метилотрофных бактерий B. methylicum
, продуцентом L-фенилаланина. Штамм был получен из коллекции культур Всероссийской коллекции промышленных микроорганизмов (ВКПМ) Государственного научно-исследовательского института генетики и селекции промышленных микроорганизмов.
В работеиспользовали 2
Н2
O (99,9% 2
Н), С2
Н3
О2
Н (97,5 % 2
Н), полученные из Российского научно-исследовательского центра “Изотоп” (Санкт-Петербург, РФ), а также N-диметиламинонафталин-5-сульфохлорид (дансилхлорид) (Sigma, CША). Для получения производных аминокислот использовали N-диметиламинонафталин-5-сульфохлорид (дансилхлорид) (Sigma, CША), карбобензоксихлорид (химзавод им. Войкова) и диазометан. Диазометан получали из N-нитрозометилмочевины (Мerck, Германия).
Условия адаптации
.
Адаптацию штамма к дейтерию проводили на агаризованных средах (2 %-ный агар), содержащих тяжёлую воду. При этом использовали рассев культур до отдельных колоний на средах, содержащих ступенчато увеличивающиеся концентрации тяжёлой воды [9].
Реклама

Культивирование бактерий проводили на минеральной среде М9 [16], как описано в работе [9].
Получение дансиламинокислот культуральной жидкости
. К 200 мг лиофилизованных препаратов культуральной жидкости в 5 мл 2 м. NaHCO3
(2 10-3
моль) рН 9-10 дробными порциями при перемешивании добавляли 320 мг (1,2 10-3
моль) дансилхлорида в 5 мл ацетона. Реакционную смесь выдерживали при перемешивании при 400
С в течении часа, затем подкисляли 2 м. раствором HCL до рН 3,0 и экстрагировали этилацетатом (3 раза по 5 мл). Объединенный экстракт промывали водой до значения рН 7,0, сушили безводным сульфатом натрия, растворитель удаляли при 10 мм. рт. ст.
Дансиламинокислоты в составе белковых гидролизатов B. methylicum получали как описано в работе [9].
Получение метиловых эфиров дансиламинокислот
. К 20 мл 40 %-ного КОН в 40 мл эфира добавляли 3 г влажной нитрозометилмочевины и перемешивали на водяной бане со льдом в течении 15-20 мин. После интенсивного газовыделения эфирный слой отделяли и промывали ледяной водой до рН 7,0, сушили безводным NaSO4
и обрабатывали им препараты дансилпроизводных аминокислот в составе культуральной жидкости и гидролизатов белка биомассы.
Аналитическое и препаративное разделение Dns-Phe-OMe проводили методом обращённо-фазовой ВЭЖХ на жидкостном хроматографе “Knauer” (ФРГ), снабженным насосом“Knauer”, УФ-детектором “2563” и интегратором “С-R 3A” (Shimadzy, Япония). Использовали неподвижную фазу: Separon SGX C 18, 7 мкм, 150 x 3,3 мм (Kova, Чехословакия). Элюирование проводили в системе растворителей: (А) - ацетонитрил-трифторуксусная кислота (20:80 об/об) и (В) - ацетонитрил. Использовали градиентное элюирование: от 20% В до 100%В в течение 30 мин, при 100% В в течение 5 мин, от 100% В до 20% В в течение 2 мин, при 20% В в течение 10 мин.
Количественное определение L-фенилаланина в культуральной жидкости проводили на приборе “Beckman DU- 6” (США) при 540 нм, после обработки препаратов культуральной жидкости нингидрином.
Масс-спектры электронного удара получены на приборе “MB-80A” (Hitachi, Япония) при энергии ионизирующих электронов 70 эВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
.
Получение дейтерий-меченного [2
H6
]- L-фенилаланина и масс-спектрометрический анализ
. Как известно, большинство микроорганизмов, распространённых в природе не могут служить хорошими продуцентами аминокислот, вследствие наличия эффективных механизмов регуляции биосинтеза этих соединений в клетке, хотя эта способность проявляется у ряда их мутантных форм [17]. Активными микробными продуцентами L-фенилаланина являются, как правило, мутанты, у которых снят негативный контроль со стороны таких ключевых ферментов биосинтеза этой аминокислоты, как префенатдегидратаза и дезоксиарабиногептулозофосфатсинтетаза (рис.1) [18, 19].
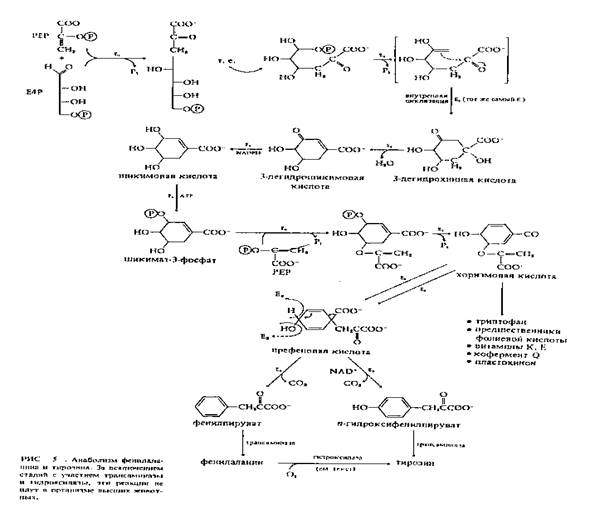
Определённый интерес в связи с этим представляет исследование способности продуцировать L-фенилаланин лейцинзависимым метилотрофным мутантом B. methylicum, достаточно удобным, хотя и малоизученным объектом для биотехнологического использования. Поэтому начальный этап биохимических исследований со штаммом метилотрофных бактерий B. methylicum
был связан с получением ауксотрофных мутантов, для которых в большинстве случаях характерны ограниченный спектр мутантных фенотипов и кроме того довольно высокий уровень реверсий [20]. Исходный L-лейцинзависимый штамм B. methylicum
, продуцент L-фенилаланина был отобран в лаборатории генетики метилотрофов “ГосНИИ генетики и селекции промышленных микроорганизмов”
на предыдущем этапе работы после обработки родительского штамма нитрозогуанидином. Скрининг нужных клонов проводили по признаку устойчивости к аналогу фенилаланина - метафторфенилаланину (50 мкг/мл). Выделенные на селективных средах аналогорезистентные мутанты конвертировали метанол и накапливали при этом фенилаланин в ферментационной среде. Сравнительные анализы (ТСХ, МС) показали, что фенилаланин, продуцируемый данным штаммом метилотрофных бактерий полностью идентичен природному L-фенилаланину.
С целью увеличения эффективности изотопного мечения L-фенилаланина и интенсификации роста бактерий на полностью дейтерированной среде мы адаптировали полученный мутант B. methylicum к росту и биосинтезу в полностью дейтерированных средах. К данному штамму метилотрофных бактерий был применён специальный подход по адаптации (таблица), который заключался в серии из пяти адаптационных пассажей исходной культуры на агаризованных средах (с добавкой 2 об. % C2
HO2
H) при ступенчатом увеличении концентрации тяжёлой воды в них (от 0; 24,5; 49,0; 73,5 об% до 98 об% 2
Н2
О). При этом последовательно отбирали отдельные колонии, выросшие на средах, содержащих дейтерий. Затем их пересевали на среды с большей степенью дейтерированности, включая среду с 98 об.% 2
Н2
О (степень выживаемости бактерий на конечной полностью дейтерированной среде составила 40%).
Таблица.
Изотопный состав ростовых сред и биосинтетические характеристики B. methylicum
 Номер опыта Номер опыта |
Компоненты среды, об.%
H2
O 2
H2
O Метанол [U-2
H]
Метанол
|
Лаг-период, ч |
Выход микробной биомассы, % от контроля |
Время генерации, ч |
| 1 |
98 |
0 |
2 |
0 |
20 |
100 |
2.2 |
| 2 |
98 |
0 |
0 |
2 |
30 |
92.3 |
2.4 |
| 3 |
73.5 |
24.5 |
2 |
0 |
32 |
90.6 |
2.4 |
| 4 |
73.5 |
24.5 |
0 |
2 |
34 |
85.9 |
2.6 |
| 5 |
49.0 |
49.0 |
2 |
0 |
40 |
70.1 |
3.0 |
| 6 |
49.0 |
49.0 |
0 |
2 |
44 |
60.5 |
3.2 |
| 7 |
24.5 |
73.5 |
2 |
0 |
45 |
56.4 |
3.5 |
| 8 |
24.5 |
73.5 |
0 |
2 |
49 |
47.2 |
3.8 |
| 9 |
0 |
98.0 |
2 |
0 |
58 |
32.9 |
4.4 |
| 10 |
0 |
98.0 |
0 |
2 |
60 |
30.1 |
4.9 |
| 10’ |
0 |
98.0 |
0 |
2 |
40 |
87.0 |
2.8 |
Кривые, отражающие динамики роста исходного и адаптированного к 2
Н2
О штамма B. methylicum
и максимальному уровню накопления L-фенилаланина в культуральной жидкости на минимальных средах с добавкой 2 об.% СН3
ОН/С2
Н3
О2
Н и 98 об.% 2
Н2
О представлены на рис. 2.
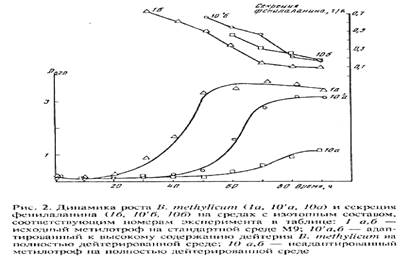
Выход биомассы, время клеточной генерации и максимальный уровень накопления L-фенилаланина в культуральной жидкости исходным мутантом (б) и мутантом, адаптированным к высокому содержанию дейтерия в среде (в) на средах, максимально насыщенных дейтерием, приведены в гистограмме относительно контрольного микроорганизма на протонированной среде (а). Сравнивали ростовые данные адаптированного к дейтерию микроорганизма и секрецию L-фенилаланина (б) с исходным B. methylicum на протонированной среде М9 (а) и на полность дейтерированной среде (98 об.% 2
Н2
О) с 2 об.% С2
Н3
О2
Н (б). Как видно из представленных данных, в отсутствии дейтерий-меченных субстратов продолжительность лаг-фазы не превышала 24 ч (рис. 2, а). С увеличением концентрации 2
Н2
О в среде продолжительность лаг-фазы увеличивалась до 64,4 ч на средах с 98 об.% 2
Н2
О и 2 об.% С2
Н3
О2
Н (рис. 2, б). Отмечено, что длительность времени клеточной генерации с увеличением степени изотопного насыщения среды дейтерием постепенно увеличивается, достигая 4,9 часов на максимально дейтерированной среде (рис. 2, опыт б). Как видно из рис. 2, опыт б, С2
Н3
О2
Н не вызывал существенного ингибирования роста и не оказывал влияния на выходе микробной биомассы, в то время как на средах с 98 об.% 2
Н2
О микробный рост подавлялся. Так, на среде, содержащей 98 об.% 2
Н2
О и 2 об.% С2
Н3
О2
Н, выход микробной биомассы был снижен в 3,3 раза по-сравнению с контролем. Важно то, что, выход микробной биомассы, время клеточной генерации и уровень накопления L-фенилаланина в культуральной жидкости при росте адаптированного к 2
H2
O штамма B. methylicum
на среде, содержащей 98 об.% 2
Н2
О и 2 об.% С2
Н3
О2
Н изменяются незначительно (гист., опыт б).
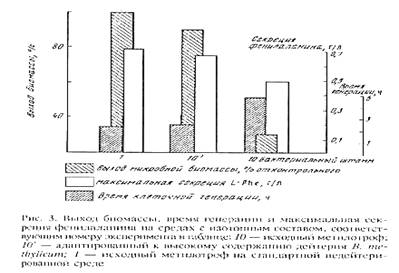
Общей особенностью биосинтеза L-фенилаланина было значительное увеличение его продукции на ранней фазе экспоненциального роста B. methylicum
, когда выход микробной биомассы был незначителен (рис. 3
). Во всех экспериментах наблюдалось ингибирование биосинтеза фенилаланина на поздней фазе экспоненциального роста и снижение его концентрации в ростовых средах. Согласно данным по микроскопическому исследованию растущей популяции микроорганизмов, подобный характер динамики секреции фенилаланина не коррелировал с качественными изменениями ростовых характеристик культуры на различных стадиях роста, что служило подтверждением морфологической однородности микробной популяции. Мы предположили, что накопленный в процессе роста фенилаланин ингибировал ферменты собственного пути биосинтеза. Кроме того, мы не исключаем возможность, что при ферментации без рН-статирования может происходить обратное превращение экзогенного фенилаланина в интермедиаторные соединения его биосинтеза [21]. При обсуждении механизма биосинтеза L-фенилаланина следует отметить, что он синтезируется в клетках микроорганизмов из префеновой кислоты, которая через стадию образования фенилпирувата превращается в фенилаланин под действием клеточных трансаминаз [22] (схема 1
). Данные тонкослойной хроматографии (ТСХ) и масс-спектрометрического анализа культуральной жидкости показали, что кроме L-фенилаланина данный штамм B. methylicum
синтезирует и накапливает экзогенно другие аминокислоты: аланин, валин, лейцин, изолейцин.
Эффективность использования дансильных и Z-производных аминокислот для масс-спектрометрических исследований была показана раннее [10, 16]. В данной работе уровни включения изотопа 2
Н в L-фенилаланин в составе культуральной жидкости определяли методом масс-спектрометрии электронного удара метилового эфира дансил-фенилаланина или в виде Z-производного фенилаланина после их препаративного разделения методом обращённо-фазовой ВЭЖХ.
Производные аминокислот при этом получали прямой обработкой препаратов культуральной жидкости дансилхлоридом (DnsCl) или карбобензоксихлоридом (Zcl). Реакцию проводили в щелочной среде в водно-органическом растворителе в соотношении карбобензоксихлорид (дансилхлорид)-аминокислота, равным 2:1. Летучесть дансилпроизводных аминокислот при масс-спектрометрическом анализе повышали за счет дополнительной дериватизации по карбоксильной группе (этерификации) диазометаном. Выбор диазометана как этерифицирующего реагента был обусловлен необходимостью проведения реакции в мягких условиях, исключающих изотопный (1
Н-2
Н) обмен в ароматических аминокислотах.
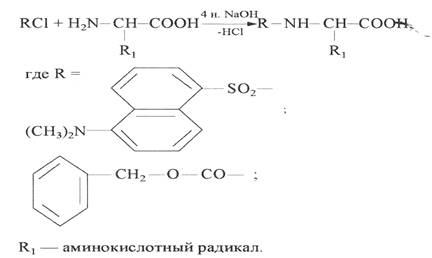
В качестве примера на рисунке показана фрагментация метилового эфира дансилфенилаланина при электронном ударе. В масс-спектрах этого производного, как правило, четко детектируется пик молекулярного иона метилового эфира дансилфенилаланина М+. с m/z 412. Пик аминного фрагмента А имеет невысокую интенсивность, а пик аминоацильного фрагмента В крайне низкую или вообще отсутствует (см. рис. 1). Кроме вышеобозначенных пиков, в масс-спектрах электронного удара Dns-Phe-OMe фиксируются пики с массовым числом m/z 250, 234, 170, которые соответствуют дансильному фрагменту и продуктам его распада до N-диметиламинонафталина .
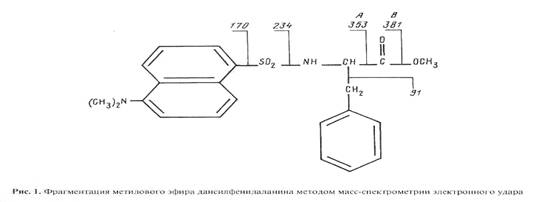
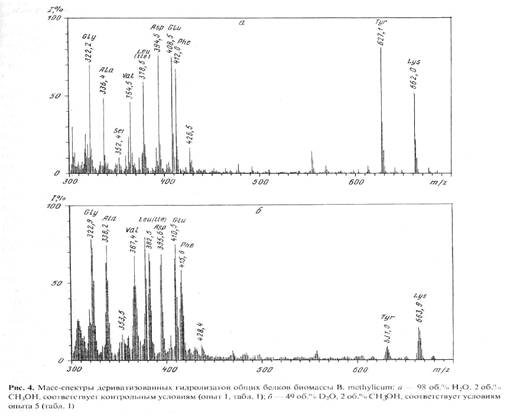
Масс-спектр фенилаланина, выделенный из культуральной жидкости, содержащей 98 об.% 2
Н2
О показан на рис. 4,б (спектр приведен относительно контрольных условий (а), где использовали обычную воду и метанол). Из рис.2,б видно, что величина пика молекулярного иона производного фенилаланина (М+. с m/z 418,0) увеличивается по сравнению с контрольными условиями (М+. с m/z 412,0) на 6 единиц, что составляет 75 % от общего количества атомов водорода в молекуле. Очевидно, что вышеобозначенные атомы дейтерия включились в молекулу фенилаланина за счет процесса биосинтеза de novo, т. е. по углеродному скелету молекулы, так как маловероятно, что они заместились в в ходе выделения аминокислоты из культуральной жидкости или при химической модификации фенилаланина (протоны (дейтероны) при гетероатомах в NH2
-, и -COOH группах фенилаланина за счёт лёгкости диссоциации не учитывались). Пик с m/z 432, зафиксированный в масс-спектре культуральной жидкости (рис.4,б) вероятнее всего соответствует продукту дополнительного метилирования фенилаланина по а-NH2
- группе. В масс-спектре фиксируется пик обогащённого дейтерием бензильного фрагмента с m/z 97 (вместо 91 в контроле), что указывает на то, что местами локализации атомов дейтерия в молекуле фенилаланина являются положения С1-С6 ароматических атомов и сопредельное с ними положение при углеродном атоме b. Причем, как миниум четыре из них могут быть локализованы в самом бензольном кольце молекулы фенилаланина. Полученный результат по степени дейтерированности фенилаланина важен для его использования в медицинской диагностике, где необходимо применять соединения с высокими степенями изотопного обогащения.
Таким образом, в результате несложного селекционного подхода удалось получить штамм факультативных метилотрофных бактерий B. methylicum, адаптированный к высокому содержанию 2
Н2
О в ростовой среде. Преимуществами данного штамма для получения [2
H6
]-фенилаланина являются улучшенные ростовые и биосинтетические способности этого метилотрофа на максимально дейтерированной среде. За счёт использования штамма B. methylicum
удалось получить около 1 грамма [2
H6
]-фенилаланина из 1 л культуральной жидкости (фенилаланин был также выделен из культуральной жидкости B. methylicum
методом обращенно-фазовой ВЭЖХ в виде метилового эфира дансил-L-фенилаланина со степенью хроматографической чистоты 99 % и выходом 89 %). В заключение следует отметить, что более высокая эффективность мечения фенилаланина может быть обеспечена за счёт полной замены протонированных солей в составе ростовой среды на их дейтерированые аналоги, а также используя лейцин, униформно меченный дейтерием, который в принципе можно выделять из гидролизатов суммарных белков биомассы данного микроорганизма.
ЛИТЕРАТУРА
.
1. Patel G.B., Sprott G.D., Ekiel I. // Appl. Environ. Microbiol. - 1993. - V. 59. - N. 4. - P. 1099-1103.
2. John Colby, Howard Dalton. // Ann. Rev. Microbiol. - 1979. - V. 33. - P. 481-517.
3. Skladnev D.A., Baev M.V., Shilova S.Yu., et al. // Proceedings of 6th Europ. Conf. on Biomass for Energy. - Industry and Environment. - Athens. - 1991. - P. 47-51.
4. Katz J., and Crespi H. L. // Pure Appl. Chem. - 1972. - V. 32. - P. 221-250.
5. Crespi H. L. // Biosynthesis and uses of per-deuterated proteins. in: Synthesis and Applications of Isotopically labeled Compounds, Proceedings of the Second Inter. Symp. - Elsevier. - 1986. - P. 111-112.
6. Karnaukhova E.N., Reshetova O.S., Semenov S.Y., Skladnev D.A., Tsygankov Y.D. // Amino Acids. - 1994. - V. 6. - P. 165-176.
7. Мосин О.В., Карнаухова Е.Н., Пшеничникова А.Б.,Складнев Д.А., Акимова О.Л. // Биотехнология. - 1993. - N. 9. - С. 16-20.
8. Егорова Т.А., Мосин О.В., Еремин С.В., Карнаухова Е.Н.,Звонкова Е.Н., Швец В.И. // Биотехнология. - 1993. - N. 8. - С. 21-25.
9. Karnaukhova E.N., Mosin O.V., Reshetova O.S. // Amino Acids. - 1993. - V. 5. - P. 125.
10. Мосин О.В., Складнев Д.А., Егорова Т.А., Юркевич А.М., Швец В.И. // Биотехнология. - 1996. - N. 3. (в печати).
11. Миллер Дж. Эксперименты в молекулярной генетике. - М.: Мир, - 1976. - С. 393.
12. Звонкова Е.Н., Зотчик Н.В., Филлипович Е.И., Митрофанова Т.К., Мягкова Г.И., Серебренникова Г.А // Химия биологически активных природных соединений. - М.: Химия, 1970. - С. 65-68.
13. Bligh E.G., Dyer W.J. // Can. J. Biochem. Physiol. - 1959. - V. 37. - N. 8. - P. 911-918.
14. Егорова Т.А., Ерёмин С.В., Митснер Б.И., Звонкова Е.Н., Швец В.И. // Биотехнология. - N5. - 1993. - С. 30-35.
15. Egorova T.A., Eremin S.V., Mitsner B.I., Zvonkova E.N., Shvets V.I. // J. of Chromatography B. - 1995. - V. 665. - P. 53-62.
16. Daniely B. et al. // J. Org. mass spectrometry. - 1989. - 24. - P. 225-229.
Oleg V. Mosin
Department of Biotechnology, M. V. Lomonosov State Academy of Fine Chemical Technology, Vernadskogo Prospekt 86, 117571, Moscow, Russia
Deuterium labelled L-phenylalanine prodused by methylotrophic bacterium Brevibacterium methylicum for biomedical diagnostics.
The data on biosynthesis [2H6] - L-phenylalanine, produced by facultative methylotrophic bacteriaBrevibacterium methylicum
, capable to assimilate methanol (or its deuterated analogue) as a source of carbon and energy are submitted. Microbic bioconversion of deuterated methanol was carried out on the minimal growth medium containing 98 % of heavy water. The level of L-phenylalanine output has made 1 gramm from 1 liter of growth medium. The analysis of deuterium enrichment level was carried out with using a method of electron impact mass-spectrometry after preparative separation of methyl ether of N-Dns-Phenylalanine by a method of inverted - phase highly effective liquid chromatography. According to the received data, the degree of isotope inclusion of deuterium into molecule of phenylalanine has made 75 % that testifies to high efficiency of deuterium labelling of phenylalanine in these conditions. Biosynthetically received [2H6] - phenylalanine can be used for biomedical diagnostic studies.
|