Зміст
Вступ
Розділ 1. Поширеність вірусів рослин та боротьба з ними
Розділ 2. Х-вірус картоплі: характеристика, особливості
2.1 Характеристика вірусу
2.2 Способи передачі вірусу
Розділ 3. Використання Х-вірусу в сучасних дослідженнях
3.1 Метод отримання препаратів Х-вірусу картоплі для виробництва діагностичної сироватки
3.2 Електронномікроскопічні дослідження апікальних меристем картоплі та вплив хіміотерапії на процес оздоровлення
Висновок
Список використаної літератури
Вступ
Віруси не можуть самостійно поширюватись у природі. Допомагають їм у цьому насамперед комахи-переносники (віроформні комахи). Фітопатогенні віруси найчастіше переносять попелиці, трипси, цикади, кліщі й деякі листогризучі комахи. Наприклад, відомо понад 200 видів попелиць — переносників 160 видів вірусів.
Для багатьох вірусів рослин характерний ґрунтовий спосіб поширення, їх поширюють нематоди, які пошкоджують кореневі системи хворих і здорових рослин, а також гриби. Наприклад, гриб ольпідій капустяний може поширювати вірус некрозу тютюну за допомогою своїх зооспор. Чимало вірусів передається насінням, бульбами, коренями, цибулинами тощо. Виявлено також, що біля 50 вірусів можуть переноситись повитицею, коли цей бур'ян-паразит перекидається з хворої рослини на здорову. Слід додати, що сама людина сприяє поширенню багатьох вірусів. Це відбувається під час проведення різноманітних агротехнічних заходів: щепленні та обрізуванні дерев, пікіруванні розсади, пасинкуванні рослин тощо, коли сік з випадково поранених хворих рослин потрапляє на руки, одяг або знаряддя праці робітників і переноситься у такий спосіб на поранені здорові рослини. Нарешті, віруси звичайної мозаїки квасолі та мозаїки в'яза можуть поширюватись разом з пилком.
Вірусні хвороби рослин спричиняють значні втрати врожаю та зниження якості сільськогосподарської продукції. Необхідність вивчення фітовірусів на Україні визначається, в першу чергу, тим, що більша частина території України – це райони інтенсивного землеробства. Розробка високочутливих та специфічних методів діагностики фітовірусів і ефективних заходів боротьби з ними потребує детального вивчення їх біологічних та структурно-функціональних характеристик. Цінну інформацію щодо структури вірусних білків, організації вірусної частки, деяких функціональних характеристик вірусів рослин можна одержати шляхом вивчення їх антигенної структури. Одним з критеріїв оцінки ступеню спорідненості вірусів рослин є їх антигенні властивості.
Реклама

Мета роботи полягала в аналізі біології Х-вірусу картоплі та сучасних досліджень, які проводяться з використанням цього вірусу.
Завдання роботи були наступними:
1) дати коротку характеристику поширеності вірусів рослин та боротьби з ними;
2) охарактеризувати Х-вірус картоплі та його особливості;
3) проаналізувати перспективи використання Х-вірусу в сучасних дослідженнях.
У літературі описано близько 700 вірусних захворювань рослин. Серед збудників цих хвороб добре вивчено понад 150. В Україні зареєстровано понад 115 вірусів рослин. Тривалий час віруси вважались високоспецифічними агентами. Тепер уже відомо, що специфічність їх є досить умовною.
Великої шкоди завдають вірусні хвороби злаковим культурам. В Україні відомо їх понад 10, а всього в літературі описано близько 60 вірусних хвороб злаків. Найбільшої шкоди зерновому господарству завдають смугаста мозаїка пшениці, мозаїка озимої пшениці, штрихувата мозаїка ячменю, мозаїка кукурудзи тощо. Щороку вони призводять до значних втрат урожаю, а в окремі роки, коли спостерігаються масові епіфітотії, втрачаються тисячі тонн зерна.
Останнім часом поширилась і завдає значної шкоди картоплярству України готика картоплі. Характерною ознакою цієї хвороби є розміщення листків під більш гострим кутом до стебла, що надає рослинам готичного вигляду. Вірус готики передається при різанні бульб ножем, під час щеплень, через бульби, комахами тощо. Найбільш уражується готикою картопля в Сумській, Чернівецькій, Полтавській та південних областях України. Зниження урожайності від цієї хвороби сягає подекуди понад 60 %.
Вибір та застосування різних заходів боротьби з вірусними хворобами залежить насамперед від виду хвороби і видів рослин, на які вона поширюється. Загальними для боротьби з вірусними хворобами рослин є такі заходи: 1) виведення і впровадження у виробництво стійких проти вірусів сортів рослин; 2) знищення комах та інших переносників вірусів; 3) ліквідація джерел поширення вірусів у природі (це передусім своєчасне лущення стерні і зяблева оранка, знищення бур'янів на полях, межах, узбіччях доріг, які є джерелом інфекції; дотримання оптимальних строків сівби і проведення противірусного прополювання насіннєвих посівів); 4) використання для сівби здорового безвірусного насінного матеріалу.
Реклама

Останніми роками серед профілактичних заходів, які запобігають зараженню рослин вірусами, поширення набуває вакцинація рослин (переважно закритого грунту) ослабленими штамами вірусів. Інтенсивно проводяться також роботи з оздоровлення рослин методами термотерапії (з використанням спеціальних термокамер), щоб отримати безвірусні клони, хіміотерапії, культур верхівкових меристем тощо.
Збудник: potato X potexvіrus.
Симптоми: хворі рослини мають пригнічений вигляд і погано цвітуть. Краї листків загнуті донизу, листки мають мозаїчне задарвлення.
Х-вірус картоплі (ХВК), типовий представник групи потексвірусів. Міжклітинний транспорт геномної РНК ХВК через плазмодесми клітин рослини-хазяїна забезпечується трьома вірусними транспортними білками: ТБ1, ТБ2 і ТБ3. Для міжклітинного транспорту ХВК необхідний також білок оболонки (БО); однак роль БО і всіх трьох ТБ у міжклітинному транспорті ХВК залишається нез`ясованою.
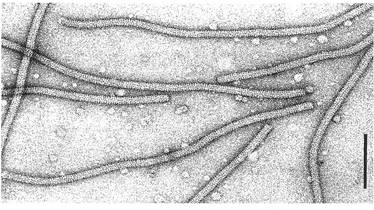
Рис. 1. Х-вірус картоплі (ХВК), типовий представник групи потексвірусів
Очевидно, геномна РНК ХВК транспортується через плазмодесми у вигляді віріонів або рибонуклеопротеїдів, що містять як БО, так і ТБ1. Відомо, що РНК потексвірусів у складі вірусних часток нетрансльована іn vіtro. У той же час очевидно, що транспортна форма ХВК повинна бути доступна для рибосом для розвитку інфекції.
Інкубація часток ХВК із транспортним білком ТБ1 переводить РНК у складі виріонів з нетрансльованої іn vіtro форми в трансльовану. Результати імуноелектронної мікроскопії преінкубованих препаратів ХВК-ТБ1 свідчать про те, що транспортний білок вибірково зв'язується з одним з кінців вірусної частки (приблизно відповідним 5′-кінцеві вірусної РНК). Можна припустити, що взаємодія з ТБ1 дестабілізує кінець вірусної частки.
Також були отримані результати, що вказують на існування другого способу трансляційної активації віріонної РНК ХВК. Показано, що фосфорилювання білка оболонки ХВК також створює доступну для рибосом іn vіtro РНК у складі вірусних часток.
Приведені вище дані дозволяють припустити існування двох різних механізмів переходу РНК у складі вірусних часток ХВК у трансльовану форму: перший - фосфорилювання БО вихідних віріонів, що попадають у первинно інфіковані клітини, і другий - взаємодія новосинтезованих вірусних часток, призначених для транспорту через плазмодесми, із транспортним білком ТБ1.
У порівнянні з передачею вірусів у польових умовах за допомогою безхребетних або в результаті вегетативного розмноження передача механічним шляхом звичайно відіграє меншу роль. Однак для деяких вірусів цей спосіб передачі має велике практичне значення. Так, віруси можуть поширюватися на плантаціях, легко забруднюючи інструменти, руки й одяг працюючих там людей. Цей спосіб передачі вірусу має особливо велике практичне значення на ранніх етапах росту польових культур, зокрема при висаджуванні рослин. Рослини, інфіковані в ранній період росту, є джерелом поширення вірусу надалі, що відбувається або під час проведення необхідних для даної культури заходів, наприклад видалення бруньок, або в результаті зіткнення хворих і здорових рослин при вітрі. Х-вирус картоплі також легко може передаватися, забруднюючи знаряддя виробництва й обробні машини; передача здійснюється робітниками або тваринами, що раніше контактували з хворими рослинами, причому в деяких випадках вірус може зберігатися в такий спосіб протягом декількох тижнів.
Х-вірус картоплі може передаватися на здорові рослини як у результаті безпосереднього контакту між листками сусідніх рослин, так і в тому випадку, якщо листки таких рослин не контактують один з одним. Припускають, що передача в цьому випадку здійснюється в результаті контакту між коренями сусідніх рослин, однак не можна виключити і можливості того, що визначену роль при цьому грають деякі переносники, що живуть у ґрунті.
Існує ще багато хвороб, що, як уже відомо або як припускають, викликаються якимсь вірусом, однак самі вірусні частки не виділені і не ідентифіковані як инфицирующего агента. У цих випадках, щоб установити вірусну природу якогось визначеного захворювання за допомогою непрямих методів, необхідно насамперед передати захворювання на здорові рослини (часто це приходиться робити за допомогою щеплення, якщо всі інші способи виявляються безуспішними) і потім показати, що це захворювання по викликане клітинними паразитами або іншими агентами невірусної природи. Деякі умови, що можуть стимулювати вірусну інфекцію. Оскільки токсини також можуть передаватися шляхом щеплення, цю операцію, особливо на першому пасажі інфекційного матеріалу, необхідно здійснювати при повній відсутності клітинних паразитів або комах, що повиннео забезпечити елімінацію токсинів як можливої причини захворювання. Так, вірус великих жилок салату-латуку передавався при шести послідовно проведених щепленнях, і при цьому ступінь виразності симптомів не знижувалася. Цей факт виключає можливість того, що симптоми цього захворювання, викликані токсином, продуцируемым.
Міжклітинний транспорт вірусів рослин здійснюється за допомогою одного або декількох вірусспецифічних транспортних білків (ТБ). Саме транспортні білки відіграють ключову роль у переносі вірусного генома усередині інфікованої клітини до плазмодесм, далі в поширенні вірусної інфекції через плазмодесми по клітинах паренхіми і, у випадку деяких вірусів, у транспорті вірусного генома по судинах флоеми. Очевидно, що прогрес у дослідженні вірусних ТБ, їх взаємодій з вірусними нуклеїновими кислотами і різними вірусними і клітинними білками відкриває широкі перспективи для створення нових методів боротьби з вірусними інфекціями рослин.
Х-вірус картоплі (ХВК) є одним з розповсюджених патогенів картоплі в усіх зонах вирощування культури. На Поліссі України спричинювані ним втрати врожаю становлять в середньому 40,8 % [1]. ХВК превалює у посівах в моноінфекції чи в комплексі з іншими мозаїчними вірусами (64 % обстежених зразків) при ступені ураженості сортозразка 5-100% [2]. Контроль насіннєвого матеріалу показує, що у відкритий грунт висаджується здоровий пробірковий матеріал, який у процесі подальшого розмноження зазнає реінфекції: ураженість клонового матеріалу становить 13-57 % залежно від імунологічних характеристик сорту, досягаючи 100 % на окремих сортах.
При аналізі відібраного в полі матеріалу виявляється латентна інфекція в 20-70 % зразків, що вказує на необхідність використання імунологічних методів діагностики вірусу для отримання об'єктивної інформації щодо якості матеріалу в насінницькій, селекційній роботі, ефективності захисних заходів, при вивченні циркуляції вірусу в природних умовах. Біологічні особливості ХВК дають можливість виявляти його у вегетуючих рослинах методом крапельної аглютинації [3] при чутливості методу 1-100 мкг/мл, а також методом імуноферментного аналізу.
Контроль фітопатогенних вірусів потребує методичного забезпечення. Пошук нових методичних підходів при розробці і виробництві засобів діагностики з урахуванням особливостей патогенів спрямований на створення ефективних діагностикумів фітопатогенних вірусів.У представленій роботі ми ставили за мету розробити метод отримання чистих препаратів ХВК для виробництва діагностичної антисироватки.
ХВК накопичували на рослинах томатів сорту Перемога, які вирощували в умовах вегетаційної камери при 20 °С і фотоперіоді 16 годин. Заражали рослини в фазі 3-4 справжніх листків методом механічної інокуляції з попереднім опудрюванням карборундом. Строк максимальної концентрації вірусу в рослинах томату — 21-25 днів після інокуляції.
При розробці методу очищення використовували відомі методики [5-8] та прилад для препаративного електрофорезу [9,10], сконструйований в нашому інституті.
Контроль етапів отримання чистих препаратів проводили з використанням реакції крапельної аглютинації [3] та електронної мікроскопії нативних препаратів, контрастованих 2%-ним розчином фосфорно-вольфрамової кислоти, рН 6,0. Досліджували препарати за допомогою елек-троного мікроскопа Tesla-540 при інструментальному збільшенні 22-30 тис.
Спектри поглинання УФ-світла препаратами МВК реєстрували на однопроменевому спектрофотометрі СФ-46.
Для виділення препарату ХВК листя томатів відбирали на 21-25-й день після зараження.
Проводили інфільтрацію в 0,3 М трис-гліциновому буферному розчині, рН 8,3 з додаванням 0,1 %-ного 2-меркаптоетанолу (ME) та 0,01 М ЕДТА протягом 12 годин за температури +4 °С.
Попередня інфільтрація рослинного матеріалу сприяла підвищенню ефективності екстракції вірусу, блокуючи дію ферментів рослинного соку.
Після інфільтрації листя подрібнювали на вальцевому пресі ПВЛ-1 в присутності 0,3 М трис-гліцинового буфера, рН 8,3 у співвідношенні 1:2. Отриманий гомогенат віджимали через капронове сито. Екстракт в трис-гліциновому буферному розчині містив менше пігменту, ніж при використанні фосфатного чи цитратного буферних розчинів, що значно поліпшувало наступні етапи очистки.
Освітлювали екстракт шляхом центрифугування за 15 000 об/хв протягом 20 хв. До надосадової рідини додавали краплями 20 %-ний розчин тритон Х-100 до кінцевої концентрації 0,5% та інкубували 30 хв., не застосовуючи на цьому етапі органічних розчинників, які різко знижують вихід вірусу [11, 12]. Додавання тритон-Х 100 зумовлює розчинення клітинних мембран і хлоропластів перед осадженням поліетиленгликолем (ТТЕГ).
Первинне концентрування вірусу проводили шляхом додавання до екстракту 20 %-ного розчину поліетиленгліколю (м.в. 40000) та NaCl до кінцевої концентрації 8 % та 1,5 %, відповідно. Витримували 1 годину при температурі +4 °С. Преципітат відділяли центрифугуванням за 6000 об/хв протягом 20 хв.
Після центрифугування при 6000 об/хв в надосадковій рідині вірус серологічно не виявлявся. Для повної екстракції вірусу необхідно було проводити декілька послідовних ресуспендувань осаду 0,01 М трис-гліциновим буфером, рН 8,3, кожен раз освітлюючи екстракт низькошвидкісним центрифугуванням. На цьому етапі загальний об'єм отриманого препарату вірусу не перевищував 1/10 від початкового об'єму рослинного екстракту.
Після осадження ПЕГ екстракція ХВК із преципітата, який містить значну кількість білків рослини-хазяїна, ускладнена. Це потребує застосування ряду циклів екстракції вірусу із осадів та контролю на кожному етапі для уникнення значної втрати вірусу. Екстракція МВК з осадів проходить більш ефективно, якщо для гомогенізації рослинної тканини використовувати трис-гліциновий буфер, а не фосфатний чи цитратний. При використанні трис-гліцинового буфера основна кількість вірусу екстрагується при перших двох етапах ресуспендування.
Остаточне очищення препарату ХВК здійснювали за допомогою приладу для препаративного електрофорезу із застосуванням 40%-ної сахарозної подушки.
При проведені препаративного електрофорезу ХВК необхідно було підібрати оптимальні умови для очищення вірусу: рН та іонну силу буферних розчинів, температурний режим, напругу електричного поля, тривалість, концентрацію сахарозної подушки, кількість антигену; який можна розділити [12].
Сконцентрований осадженням ПЕГ препарат вірусу нашаровували на 40%-у сахарозну подушку висотою 10 см та діаметром 1,5 см, яка була сформована в електрофоретичній колонці.
Електрофорез вели в лужній системі буферів за температури 16-20 °С, сили струму 8-10 мА та напрузі 380-400 в протягом 3 годин.
При відпрацюванні цього етапу отримання препарату МВК виявили, що електрофорез в 40 % сахарозі є ефективним прийомом дляконцентрування ХВК та очищення його від рослинних компонентів.
В роботі ми використовували 0.01М трис-гліциновий буфер, рН 8,3, який найбільше підходить як для екстракції ХВК, так і для електрофорезу. Виходили з того, що буферний розчин, який використовується при електрофорезі, повинен мати низьку іонну силу (0,005-0,02), що дозволяє застосовувати високі градієнти напруги вздовж колонки при мінімальному утворенні тепла. Крім того, мають бути підібрані такі значення рН буферних розчинів, щоб різниця в зарядах між компонентами суміші, яка розділяється, була максимальною [7, 12].
Напругу поля належить підтримувати настільки високою, наскільки можливо за умов мінімального утворення та розсіювання тепла. При розробці нашого методу мінімальний нагрів і конвекцію спостерігали при силі струму 8-10 мА та напрузі 380-400 в.
Важливим фактором при препаративному електрофорезі в 40%-ній сахарозі є температура: якщо охолодження недостатнє, то це призводить до нерівномірного розподілу фракцій.
Експериментальним шляхом визначали тривалість електрофорезу препарату ХВК. Після 1; 2; 3 годин електрофорезу зразки проби та сахарозної подушки перевіряли методами серології та електронної мікроскопії на наявність антигену. Встановлено, що після трьох годин електрофорезу вірус повністю осідав на поверхні пробки ПААГ.
Візуальне спостереження за перебігом електрофорезу показало, що через 30 хвилин після включення струму від зони проби починають відділятися пластівчасті утворення, які осідають на пробці ПААГ, формуючи ледве помітний шар. Вірогідно, це є агрегати ХВК, які утворилися після осадження ПЕГ і можуть містити залишки клітинного дебрису. При застосуванні диференційного центрифугування сконцентрованого ПЕГ препарату віруси, які перебувають в агрегованому стані, неминуче втрачаються [5], внаслідок чого знижується загальний вихід вірусу. За розробленою нами методикою, агрегати ХВК зберігаються саме завдяки відсутності проміжних циклів диференційного центрифугування.
Електрофоретична рухомість агрегатів у 40 %-ній сахарозі за створених нами умов є вищою за рухомість одиничних часток вірусу; можливо, швидкість міграції агрегатів вірусу збільшується за рахунок сили тяжіння.
Після проходження сахарозної подушки частки вірусу та агрегати утворюють шар на поверхні пробки 10 %-ного ПААГ, яка непроникна для ХВК. Тому, залишаючись на поверхні гелю, антиген додатково піддається електродіалізу, завдяки чому відокремлюються низькомолекулярні домішки рослинного походження. Крім того, під час електродіалізу збільшується розчинність агрегатів вірусу. ХВК переходить у фізрозчин у вигляді препарату достатньо високого ступеня чистоти.
Після закінчення електрофорезу препарат вірусу змивали фізіологічним розчином з поверхні пробки 10%-ного поліакріламідного гелю, яка відділяє робочий об'єм від нижнього електродного буфера. Верхній шар гелевої пробки діставали з електрофоретичної колонки, розтирали у фізрозчині, витримували 12 годин при температурі 4 °С та центрифугували із швидкістю 15000 об/хв. Надосадову рідину аналізували на присутність вірусу, об'єднували із змивом з поверхні ПААГ. Отриманий препарат використовували для проведення електронномікроскопічних та спектрофотометричних досліджень та як антиген для імунізації кролів.
Частина вірусу неминуче адсорбується на поверхні ПААГ, утворюючи нерозчинні комплекси за рахунок гідрофобних та ковалентних зв'язків, але наявність ПААГ в антигені може слугувати ад'ювантом при імунізації тварин, що підвищує титр антисироваток (8).
Препарати ХВК, отримані за розробленим нами методом, як показало електронномікроскопічне дослідження, містили типові для даного вірусу одиничні частки, а також агрегати віріонів з переважанням агрегатів вірусу. Це, на наш погляд, пояснюється відсутністю циклів диференційного центрифугування, коли більшість агрегатів вірусу втрачається.
Очищені препарати М-вірусу картоплі характеризувалися типовим для карлавірусів спектром поглинання УФ-світла з мінімумом поглинання при 247 нм та максимумом - при 270 нм. Вихід вірусу становив 500 мг/кг листя.
Таким чином, поєднання освітлення рослинних екстрактів тритоном Х-100 з наступним осадженням вірусу за допомогою поліетиленгліколю та очищення з використанням препаративного електрофорезом в 40 %-ному розчині сахарози дало можливість отримати чисті препарати ХВК. При цьому є можливість скоротити необхідні об'єми вирощування рослин-накопичувачів вірусів та відмовитися від використання ультрацентрифуг для очищення вірусного антигену. Препарати ХВК, отримані за розробленим методом, характеризуються високим ступенем чистоти та підвищеним виходом вірусу, що робить метод придатним для виготовлення антигену ХВК та отримання специфічних антисироваток. Результати добре відтворюються, що є важливим при виробництві імунодіагностикумів.
Більшість районованих сортів картоплі уражені вірусами, які нерівномірно розповсюджуються в рослинах. Так, верхівки пагонів картоплі - меристеми містять безвірусну зону і величина цієї зони варіює залежно від сорту і ступеня ураженості вихідного матеріалу [1]. Цю особливість покладено в основу методу культури апікальної меристеми, який широко застосовується для оздоровлення картоплі. Відомо, що найбільш ефективним способом одержання вільних від вірусів рослин є культивування експлантів розміром не більше 100 мкм [2], але приживлення таких меристем дуже низьке.
Рядом дослідників досягнуто певних успіхів в оздоровленні картоплі шляхом культивування меристем розміром 300-400 мкм. Такі меристеми можуть забезпечити оздоровлення від L, Y, А-вірусів, проте вони не ефективні для оздоровлення від X, М, S-вірусів, які можуть проникати в меристему на різну глибину [3,4].
Найефективнішим способом оздоровлення картоплі є метод із застосуванням культури меристеми в поєднанні з термотерапією і хіміотерапією. Відомо, що вплив антивірусних речовин на звільнення рослин від вірусів у поєднанні з культурою меристеми специфічний. Оздоровлення залежить як від препарату, так і від біологічних властивостей сорту, а також від штамового складу вірусів та комбінаціївірусів у змішаних інфекціях [5,6,7].
За допомогою електронної мікроскопії ультатонких серійних зрізів апікальної меристеми вивчають структуру меристеми картоплі, враженої X-вірусами, визначають рівень локалізації вірусних включень, встановити залежність локалізації вірусів від розвитку плазмодесм.
Досліджування проводились на картоплі сортів Приєкульська рання, Пекуровська, Розара, Синьоглазка, Луговська і Альвара, вражених Х-вірусами в моноінфекції. Рослини вирощували у вегетаційній кімнаті. Перед виділенням меристем проводили тестування імунологічними та електронномікроскопічними методами. Для отримання ультратонких зрізів виділяли меристеми розміром 300-400 мкм, як контроль використовували меристеми безвірусних рослин.
Вивчали локалізацію X-вірусів у стеблових верхівках районованих сортів картоплі (Приєкульська рання, Пекуровська, Розара, Синьоглазка) методом ультратонких зрізів. Меристеми фіксували у 6,5%-ному розчині глютаральдегіда 3 години, 2%-ним OsO4
2 години, проводили дегідратацію в серії спиртів, заливали в ЕПОН-812. Одержували ультратонкі зрізи на ультрамікротомі УМТП-2 з вершини меристеми, серії зрізів (125-250) товщиною 0,005 мкм, після забарвлення 1%-ним розчином уранілацетату та розчином цитрату свинцю за Рейнольдсом [8] досліджували в електронному мікроскопі ЕМ-125. При визначенні розмірів зрізаної меристеми, а також рівня залягання вірусних включень, ураховували ступінь стискання тканин меристеми після заливки (в межах 25 %).
Для діагностування вірусів у меристематичних тканинах використовували експрес-метод, який полягав в тому, що на сіточки-бленди з формваровою плівкою-основою наносили краплю стерильної дистильованої води, в яку занурювали зрізаною основою меристему різних розмірів (від 66 до 375 мкм). Через 30-40 сек меристеми знімали, а препарат контрастували 2 %-ним ФВК, рН 7,0-7,2. Препарати досліджували в електронному мікроскопі при інструментальному збільшенні 20-25 тисяч разів.
В дослідах по оздоровленню методом культури меристеми в поєднанні з хіміотерапією як модельну систему використовували Х-вірус картоплі, слабо- і сильнопатогенні штами на рослинах картоплі різних сортів (Луговська, Альвара). Провели випробування антифітовірусної дії двох нових синтетичних речовин: АВР1 і АВР2. Ці речовини є похіднимиімідазотриазолу.
Досліджували 2 концентрації нових речовин - 0,1 і 0,05 г/л, використовуючи двофазну дію: у першу фазу витримували частинки зелених пагонів картоплі в рідкому розчині антивірусних речовин протягом 2 діб; у другу фазу виділяли експланти розміром 300 - 500 мкм і висаджували їх на поживне середовище з додаванням АВР.
Як контроль під час порівняння ефективності антивірусної дії використовували антивірусний комплекс, який складався із 2,4-діоксогекса-гідро-1.3,5-триазину (ДГТ), ціаногуанідину і розгалуженого манану (РМ) - полісахариду, виділеного із дріжжів роду Candida sp. (клітинні дріжжові манани).
Проводили комплексне тестування отриманих ліній рослин-регенерантів, використовуючи методи імуноферментного аналізу, електронної мікроскопії і рослин-індикаторів.
Електронномікроскопічні дослідження ультратонких зрізів меристемних тканин картоплі дають певне уявлення про розвиток вірусної інфекції в них, а також можливість виявити деякі деталі механізму розвитку інфекції.
При вивченні меристем досліджували такі питання: характер будови та ультраструктурну організацію клітин меристематичної тканини картоплі по зонах; наявність плазмодесм в клітинах на різних рівнях; розподіл і спосіб локалізації вірусних включень у меристематичних клітинах.
Деталі ультраструктурної організації меристемних клітин були встановлені на прикладі сорту Приєкульська рання. В результаті проведених досліджень серій ультратонких зрізів встановлено, що меристемні тканини в зоні 10-15 мкм від верхівки складаються з клітин без вакуолей, цитоплазма має рівномірний гомогенний матрикс із слабо диференційованими клітинними органелами. Починаючи з зони 20-30 мкм вже спостерігається диференціація клітинних органоїдів. З'являються вакуолі, матрикс ядра більш просвітлений. Характерним для цих ділянок тканин є наявність у вакуолях більшості периферійних клітин порівняно великих глобулярних тіл, можливо, саме там накопичуються в клітині рістактивуючі речовини (рис. 2). Ядерця в клітинах, як правило, мали центральні просвітлені зони, які не спостерігалися в ядерцях звичайної листової тканини.
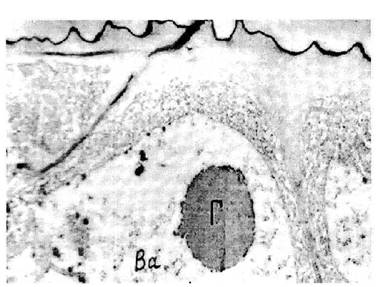
Рис. 2. Глобулярні включення у вакуолях меристематичних клітин. Зона розміром близько 30 мкм від верхівки. Ва - вакуоль, Г - глобули. Збільшення -19000.
Особливий інтерес для розуміння механізм)' проникнення вірусів у клітини меристемних тканин викликає процес формування плазмодесм, які є своєрідними каналами розповсюдження вірусів у звичайних рослинних тканинах. Відсутністю плазмодесм окремі дослідники пояснюють відсутність вірусу в меристемній тканині [9].
Дослідження показали, що перші плазмодесми, ще не зовсім сформовані, виявляються вже в зоні близько 30 мкм, добре сформовані плазмодесми виявляли в зоні близько 60 мкм.
Із всіх досліджених вірусів досить легко виявляли МВК в меристематичних тканинах, починаючи із зони 80-90 мкм. Локалізація вірусних включень є доволі різною: загальною тенденцією є те, що віруси зустрічаються здебільшого біля ядра. Форма і розмір вірусних включень теж різні, від невеликих включень, до масових. Потрібно відмітити здатність М-вірусу утворювати кристалічні структури по типу паракристалів (рис.3). Як правило, такий спосіб локалізації в клітині характерний для жорсткопа-личкоподібних вірусів і, зокрема, для вірусу тютюнової мозаїки.
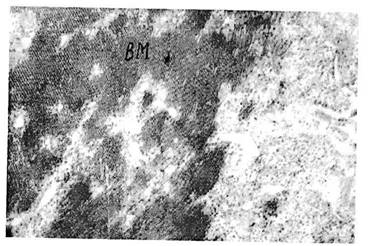
Рис. 3. Локалізація Х-вірусу картоплі в клітинах меристемної тканини картоплі сорту Пекуроеська. ВМ - вірусні маси. Збільшення 63000.
У серійних зрізах рослин, вражених Х-вірусом картоплі, вірусні включення були виявлені в зоні 90-95 мкм. Особливістю локалізації цього вірусу в уражених клітинах є тісний його зв'язок цього вірусу з хлоропластами. Вірусні маси зустрічаються також у цитоплазмі, головним чином у вигляді невеликих компактних агрегатів. Х-вірус картоплі в ультратонких зрізах меристеми, як правило, виявляли в зоні 200-250 мкм, в окремих випадках — у зоні 130-150 мкм.
При виявленні вірусів у меристемах розміром від 66 до 375 мкм було апробовано експрес-метод. Він дозволяє зберегти життєздатність меристем і після аналізу використовувати їх для культивування на стерильному поживному середовищі. Було проведено дослідження велику кількість меристем, виділених із різних сортів картоплі, враженої Х-вірусами (табл.1).
Таблиця 1Результати виявлення X-вірусів у меристемах різних сортів картоплі експрес-методом
| Сорт картоплі |
Вірус |
Загальна кількість меристем, шт. |
Розміри уражених вірусами меристем, мкм |
| min* |
max* |
безвірусні |
вірусні |
| Приєкульська рання |
Х |
75 |
66 |
197 |
66 |
75 |
| Пекуровська |
Х |
15 |
66 |
179 |
78-80 |
83 |
| Розана |
Х |
22 |
88 |
158 |
88 |
94 |
| Синьоглазка |
Х |
30 |
200 |
375 |
375 |
200 |
*min, max - мінімальний та максимальний розмір виділених меристем.
Встановлено, що в меристемах розміром 66 мкм, виділених із картоплі сорту Пекуровська, ХВК виявляється в меристемах картоплі сорту Розара розміром 94 мкм, в меристемах картоплі сорту Синьоглазка розміром 200 мкм.
Аналіз отриманих даних свідчить, що Х-віруси картоплі можуть локалізуватися на різних рівнях меристематичної тканини картоплі. З усіх досліджених меристем розміром до 100 мкм близько 50 % були безвірусними.
В результаті цих досліджень розроблено електронномікроскопічний експрес-метод визначення вірусів у меристемах, який дає можливість визначати безвірусну зону меристем. Метод може бути використаним для одержання безвірусного матеріалу. Він дозволяє зберігати життєздатність меристем і після аналізу використовувати їх для культивування на стерильному поживному середовищі.
Враховуючи те, що меристеми розміром менше 100 мкм погано приживаються на поживному середовищі, в практиці оздоровлення картоплі виділяють меристеми розміром близько 300 мкм, при цьому рослини піддають термообробці і хіміотерапії. Для оздоровлення сортів картоплі Альвара і Луговська від ХВК ми використовували антивірусні речовини (АВР1, АВР2), похідні імідазотриазолу.
Дослідження з пошуку ефективної концентрації АВР 1 проводили на сильнопатогенному і слабопатогенному штамах ХВК, якими була інфікована картопля сорту Луговська. Визначили, що речовина АВР1 має антивірусну дію тільки при застосуванні її в концентрації 0,05 г/л.
Ефективність АВР1 і АВР2 (в концентрації 0.05 г/л) досліджувалина картоплі сорту Альвара, враженій МВК. Встановили, що АВР1 проявляє незначний фітотоксичний ефект, в той час як АВР2 не знижує приживлюваність меристем у порівнянні з контролем. Із застосуванням обох АВР регенерація рослин відбувається швидше, ніж в контролі, а ефективність оздоровлення збільшується до 80,0-83,3 % проти 33,3 % в контролі.
В ультратонких зрізах стеблових верхівок картоплі частки Х-вірусів картоплі виявлено в зоні 90-100 мкм. ХВК відстає від цих вірусів і знаходиться в зоні 200-250 мкм. В окремих випадках маси цього вірусу зустрічаються в зоні 130-150 мкм.
Загальна тенденція локалізації вірусу в клітинах меристеми нагадує локалізацію його в звичайних клітинах. Це свідчить про те, що в клітинах меристемної тканини іде активний синтез вірусу.
Використані нові антивірусні речовини АВР1 і АВР2, що є похідними імідазотриазолу, підвищують ефективність оздоровлення методом культури меристеми при застосуванні їх в концентрації 0,05 г/л, а також можуть збільшувати вихід безвірусних рослин до 83,8%, в порівнянні із контролем.
1) Х-вірус картоплі (ХВК), типовий представник групи потексвірусів. Міжклітинний транспорт геномної РНК ХВК через плазмодесми клітин рослини-хазяїна забезпечується трьома вірусними транспортними білками. Міжклітинний транспорт вірусів рослин здійснюється за допомогою одного або декількох вірусспецифічних транспортних білків (ТБ).
2) Х-вірус картоплі може передаватися на здорові рослини як у результаті безпосереднього контакту між листками сусідніх рослин, так і в тому випадку, якщо листки таких рослин не контактують один з одним. Х-вірус картоплі (ХВК) є одним з розповсюджених патогенів картоплі в усіх зонах вирощування культури.
3) На сучасному етапі розвитку науки проводяться на прикладі Х-вірусу наукові дослідженння. Зокрема, були проведені дослідження щодо розробки методу отримання препаратів Х-вірусу картоплі для виробництва діагностичної сироватки та електронномікроскопічні дослідження апікальних меристем картоплі та вплив хіміотерапії на процес оздоровлення.
1. Атабеков И.Г. Практикум по общей вирусологии. — М.: Из-во Московского университета, 1981. — 191 с.
2. Бойко А.Л. Экология вирусов растений. — К.: Вища школа, 1990. — 167 с.
3. Борьба с вирусными болезнями растений. / Под ред. Х.Кеглер. М.: Агропромиздат. — 1986. — 326 с.
4. Вірусні та мікоплазмові хвороби польових культур. / Під ред. Ж.П.Шевченко. — К.: Урожай, 1995. — 304 с
5. Вірусні хвороби сільськогосподарських культур/ Московець С.Н., Бобирь А.Д., Глушак Л.Е. / Під ред. Бобиря А.Д. — К.: Урожай, 1975. — С.72-80.
6. Власов Ю. И., Рядко Т.А., Лытаева Г.К. Вирусные болезни овощных культур. — Л.: Колос,1973. — 73с,
7. Власов Ю.И. Вирусные и микоплазменые болезни растений. — М.: Колос, 1992. — 207с.
8. Власов Ю.И., Ларина Э.И. Сельскохозяйственная вирусология. — М.: Колос, 1982. — С. 150-156.
9. Гиббс А., Харрисон Б. Основы вирусологии растений: Пер. с англ. — М.: Мир, 1978. — 430 с.
10. Гнутова Р.В. Серология и иммунохимия вирусов растений. — М.: Наука, 1993. — 300 с.
11. Дунин М.С., Попова Н.М. Капельный метод анализа в растениеводстве. - М: Сельхозгиз., 1973.-45с.
12. Коломієць Л.ГТ. Фітосанітарний стан агроекосистем як фактор продуктивності сільськогосподарського виробництва // Лідер України. -2005.-№ 12. - С 124-126.
13. Новиков В.К., Атабеков И.Г., Агур М.О. и др. Метод получения препарата Y-вируса картофеля и приготовление диагностических антисывороток // Сельскохозяйственная биология. - 1982. - 17, № 5. - С. 706-711.
14. Пат. 20194 Україна, МПК5
С 12 N 7/00, А 01 № 63/00. Штам М-вірусу картоплі для виробництва діагностичної сироватки / Коломієць Л.П., Козар Ф.Ю., Лебідь Л.М., Погорілько М.Я. // Заявл. 29.07.88; Опубл. 25.12.97, Бюл.-№ 6
15. Рудишин С.Д. Основи біотехнології рослин. - Вінниця, 1998. - 224 с.
16. Ситченко I.Р., Марков І.Л. Шкідливість і поширення вірусу М на картоплі в Поліській зоні УРСР // Картоплярство. - 1980. - Вип. 11. - С 78-80.
17. Трофимец Л.Н., Хижняк П.А., Кучумов А.П., Методы лечения картофеля, зараженного вирусными болезнями. — М.: ВАСХНИЛ, 1978. - 64 с.
18. Трускинов Э.В. Опыт оздоровления от вирусов коллекционных образцов картофеля путем культуры меристемной ткани /У Современные методы получения безвирусного картофеля. - М: ВАСХНИЛ, 1975. - 96 с.
19. Шалабай В.И., Жук И.П. Величина терминальной безвирусной зоны у растений картофеля // Современные методы получения безвирусного картофеля. - М.: ВАСХНИЛ, 1975. - 96 с.
|