Биосинтез 2
h-меченого инозина высокого уровня дейтерированности
О. В. МОСИН
*
*
Московская государственная академия тонкой химической технологии им. М. В. Ломоносова, 117571 Москва, просп. Вернадского, 86.
Осуществлен биосинтез 2
Н-меченого пуринового рибонуклеозида инозина (выход 3.9 г c 1 л ростовой среды) с использованием адаптированного к дейтерию штамма Bacillus subtilis
в тяжеловодородной среде высокого уровня дейтерированности (89-90 ат.% 2
Н) с 2% гидролизатом биомассы метилотрофной бактерии Brevibacterium methylicum
как источника 2
Н-меченых ростовых субстратов (условия синтеза: синтетическая среда М9 с 98% 2
Н2
О и 2% [U-2
H]метанолом, инкубационный период 5-6 сут при 370
С). Исследование уровня дейтерированности биосинтетического инозина методом масс-спектрометрии FAB выявило полиморфизм включения дейтерия в молекулу (изотопный состав инозина: 4 ат. 2
Н, 20%; 5 ат. 2
Н, 38%; 6 ат. 2
Н, 28%; 7 ат. 2
Н, 14%) с включением дейтерия в рибозный и гипоксантиновый фрагменты молекулы.
Ключевые слова: Bacillus subtillis; 2
Н-меченый инозин; биосинтез; масс-спектрометрия FAB.
ВВЕДЕНИЕ
В настоящее время во всем мире растет интерес к получению природных биологически активных соединений (БАС), меченных стабильными изотопами (2
Н, 13
С, 15
N, 18
О и др), которые необходимы для многочисленных биохимических и диагностических целей [1], структурно-функциональных исследований [2], а также для изучения клеточного метаболизма [3]. Тенденции к предпочтительному использованию стабильных изотопов по сравнению с радиоактивными аналогами обусловлены отсутствием радиационной опасности и возможностью определения локализации метки в молекуле спектроскопией 1
Н ЯМР [4, 5], ИК- и лазерной спектроскопией [6], а также масс-спектрометрией [7]. Развитие технической и компъютерной оснащенности аналитических методов позволило существенно повысить эффективность проведения биологических исследований de novo
, а также изучать структуру и механизм действия БАС на молекулярном уровне [8]. Большое научно-прикладное значение в этом аспекте имеют соединения нуклеиновой природы, содержащие дейтериевую метку в углеродном скелете молекулы [9]. В частности, 2
Н-меченые рибонуклеозиды в ближайшем будущем смогут найти применение в матричных синтезах молекул дейтерированных РНК для изучения их пространственной структуры и конформационных изменений [10].
Реклама

Важным моментом в исследованиях с применением изотопно меченых БАС является их доступность. Дейтериймеченые БАС могут быть синтезированы с использованием химических, ферментативных и биосинтетических методов [11, 12]. Однако химические синтезы часто многостадийны, требуют больших расходов ценных реагентов и меченых субстратов и приводят к конечному продукту, представляющему собой рацемическую смесь D
- и L
-форм, для разделения которых требуются специальные методы [13]. Более тонкие синтезы меченых БАС связаны с комбинацией химических [14] и ферментативных подходов [15, 16]. Стратегия синтеза изотопно-меченых БАС более подробно освещена в работе ЛеМастера [17].
Для многих научно-практических целей биотехнология предлагает альтернативный химическому синтезу биосинтетический метод получения дейтериймеченых БАС, который приводит к высоким выходам синтезируемых продуктов, к эффективному включению дейтерия в молекулы и к сохранению природной конфигурации синтезируемых соединений [18]. Традиционным подходом при этом остается предложенный Креспи метод выращивания штаммов-продуцентов в средах с максимальными концентрациями дейтерия [19]. Однако основным препятствием является недостаток 2
Н-меченых ростовых субстратов с высоким уровнем дейтерированности. Прежде всего это связано с ограниченной доступностью и дороговизной самого высокоочищенного дейтерия, выделяемого из природных источников. Природная распространенность дейтерия составляет лишь 0.015% (относительно общего количества элемента), однако несмотря на невысокое содержание дейтерия в пробах разработанные в последние годы методы обогащения и очистки позволяют получать 2
Н-меченые субстраты высокого уровня изотопной чистоты [20].
Начиная с первых экспериментов Даболла и Кокса по выращиванию природных объектов в тяжелой воде, разрабатываются подходы с использованием гидролизатов 2
Н-меченой биомассы как ростовых субстратов для синтеза штаммов-продуцентов БАС [21, 22]. Однако эксперименты обнаружили бактериостатический эффект 2
Н2
О, заключающийся в ингибировании жизненно-важных функций клетки, оказываемой 40% 2
Н2
О на растительные клетки [23] и 80-90% 2
Н2
О на клетки простейших и бактерий [24]. Попытки использовать для синтеза в 2
Н2
О природных объектов различной таксономической принадлежности, включая бактерии, микроводоросли [25] и дрожжи [26] предпринимались в течение длительного времени. Однако широкого распространения в биотехнологии они не получили ввиду трудности синтеза, использования сложных комплексных ростовых сред, сложности технологической схемы синтеза и т. п. Поэтому целый ряд практических вопросов биосинтеза 2
Н-меченых БАС в 2
Н2
О остается не выясненным.
Реклама

Более перспективны схемы синтеза с использованием в качестве 2
Н-меченых ростовых субстратов биомассы метилотрофных бактерий, ассимилирующих метанол по рибулозо-5-монофосфатному (РМФ) и сериновому пути фиксации углерода, интерес к которым возрастает благодаря интенсивному развитию технологии химического синтеза метанола [27, 28]. Уровень ассимиляции биомассы метилотрофов клетками простейших организмов и эукариот составляет 85-98%, а их производительность, измеренная по уровню биоконверсии метанола в клеточные компоненты, достигает 50% [29]. Как было показано нами раннее, метилотрофные бактерии очень неприхотливые объекты, растут на минимальных средах с 2-4% метанолом, в которых другие контаминантные бактерии не размножаются и достаточно легко адаптируются к максимальным концентрациям 2
Н2
О, что существенно для синтеза 2
Н-меченых БАС [30, 31]. Большой научно-практический интерес к использованию дейтерированной метилотрофной биомассы для синтеза продуцентов рибонуклеозидов определил цель настоящей работы, связанной с изучением принципиальной возможности биосинтеза 2
Н-меченого инозина штаммом Bacillus
subtilis
за счет использования гидролизата факультативных метилотрофных бактерий Brevibacterium methylicum.
Таблица 1.
Изотопный состав ростовых сред и биосинтетические характеристики B. methylicum
 Номер опыта Номер опыта |
Компоненты среды, об.%
H2
O 2
H2
O Метанол [U-2
H]
Метанол
|
Лаг-период, ч |
Выход микробной биомассы, % от контроля |
Время генерации, ч |
| 1 |
98 |
0 |
2 |
0 |
20 |
100 |
2.2 |
| 2 |
98 |
0 |
0 |
2 |
30 |
92.3 |
2.4 |
| 3 |
73.5 |
24.5 |
2 |
0 |
32 |
90.6 |
2.4 |
| 4 |
73.5 |
24.5 |
0 |
2 |
34 |
85.9 |
2.6 |
| 5 |
49.0 |
49.0 |
2 |
0 |
40 |
70.1 |
3.0 |
| 6 |
49.0 |
49.0 |
0 |
2 |
44 |
60.5 |
3.2 |
| 7 |
24.5 |
73.5 |
2 |
0 |
45 |
56.4 |
3.5 |
| 8 |
24.5 |
73.5 |
0 |
2 |
49 |
47.2 |
3.8 |
| 9 |
0 |
98.0 |
2 |
0 |
58 |
32.9 |
4.4 |
| 10 |
0 |
98.0 |
0 |
2 |
60 |
30.1 |
4.9 |
| 10’ |
0 |
98.0 |
0 |
2 |
40 |
87.0 |
2.8 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для синтеза 2
Н-меченого инозина использовали мутантный штамм грамположительных бактерий Bacillus subtilis
(предварительно адаптированный к дейтерию скринингом до отдельных колоний), который из-за нарушения метаболических путей регуляции биосинтеза пуриновых рибонуклеозидов синтезирует в стандартных условиях выращивания (дрожжевая среда, поздний экспоненциальный рост, 32-340
С) 17 г инозина на 1 л культуральной жидкости (КЖ) [32]. Максимальный выход инозина достигался при использовании природной протонированной среды, содержащей в качестве в качестве источников ростовых факторов и аминного азота 2% БВК дрожжей, а в качестве источника углерода и энергии глюкозу (не менее 12 мас.%). При проведении синтеза требовалось заменить протонированные ростовые субстраты их дейтерированными аналогами, а также использовать 2
Н2
О высокого уровня изотопной чистоты. Для решения поставленной задачи использовали адаптированный к дейтерию штамм факультативных метилотрофных бактерий Brevibacterium methylicum
с 50% уровнем биоконверсии метанола (при эффективности конверсии 15.5-17.3 г сух. биомассы на 1 г потребленного субстрата) [33]. Проведение адаптации для B. methylicum
определялось необходимостью улучшить ростовые характеристики штамма в максимально дейтерированной среде, поэтому использовали ступенчато-увеличивающийся градиент концентрации 2
Н2
О в ростовых средах в присутствии 2% метанола (табл. 1). Для изучения влияния уровня дейтерированности источника углерода на ростовые параметры штамма в опытах (1, 3, 5, 7 и 9) использовали протонированный метанол, а в опытах (2, 4, 6, 8 и 10) [U-2
Н]метанол. Согласно полученным данным замена протонированного метанола его дейтерированным аналогом в условиях одинаковой концентрации 2
Н2
О в среде приводила к небольшим уменьшениям ростовых характеристик штамма (табл. 1, опыты 2, 4, 6, 8 и 10). Поэтому в дальнейших опытах использовали среды с 2
Н2
О и [U-2
Н]метанолом. На контрольной протонированной среде (1) с водой и метанолом продолжительность лаг-периода и времени клеточной генерации B. methylicum
составили 20 и 2.2 ч, а выход микробной биомассы 200 г с 1 л КЖ (табл. 1, опыт 1). В промежуточных опытах (2-10) биосинтетические параметры изменялись пропорционально концентрации 2
Н2
О. Найденная закономерность заключалась в увеличении продолжительности лаг-периода и времени клеточной генерации при уменьшении выходов микробной биомассы с фиксированием самых низких значений этих параметров в максимально дейтерированной среде с 98% 2
Н2
О и 2% [U-2
H]метанолом (табл. 1, опыт 10). За ходом адаптации, условия которой показаны в опыте 10’ (табл. 1) наблюдали, снимая динамики роста исходного (б
) и адаптированного к дейтерию (в
) штамма в максимально дейтерированной среде М9 (рис. 1, контроль (а
) получен в протонированной среде), а также по изменению продолжительности лаг-периода, времени генерации и выходов микробной биомассы (рис. 2). В отличие от адаптированного штамма (в
), ростовые динамики исходного штамма (б
) в максимальной дейтерированной среде ингибировались дейтерием (рис. 1).
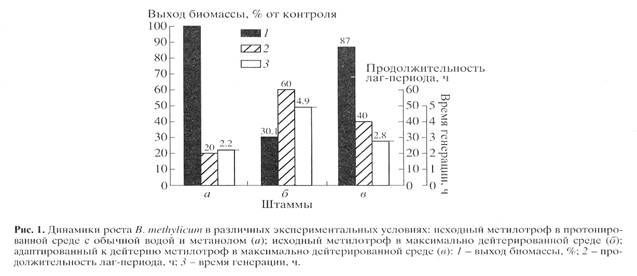
Выход микробной биомассы у адаптированного штамма (в) уменьшался на 13% по сравнению с контрольными условиями (рис. 2, а
) при увеличении времени генерации до 2.8, а продолжительности лаг-периода до 40 ч (рис. 2, в
). Адаптированный штамм возвращался к нормальному росту при переносе в протонированную среду после пролонгированного лаг-периода, что доказывает фенотипическую природу феномена адаптации, хотя теоретически не исключается, что эффект реверсии стабильно сохраняется при росте в 2
Н2
О, но маскируется при переносе клеток в протонированную среду. Улучшенные ростовые характеристики адаптированного метилотрофа существено упрощают схему синтеза 2
Н-меченой биомассы, оптимальным условиям которой удовлетворяет максимально дейтерированная среда М9 с 98% 2
Н2
О и 2% [U-2
Н]метанолом с инкубационным периодом 5-6 сут при 370
С.
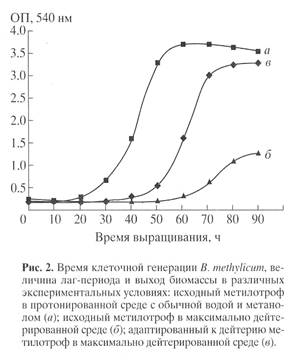
Схема синтеза 2
Н-меченого инозина разрабатывалась с учетом способности метилотрофных бактерий синтезировать большое количество белка (выход 50% от веса сухого вещества), 15-17% полисахаридов, 10-12% липидов (в основном, фосфолипиды) и 18% зольных веществ [34]. Гидролиз биомассы проводили автоклавированием в 0.5 н. 2
НCl (в 2
Н2
O), чтобы обеспечить высокие выходы этих соединений и минимизировать реакции обратного (1
Н-2
Н) обмена в аминокислотных остатках молекул белков. Качественный и количественный состав ароматических аминокислот метилотрофного гидролизата изучали в дейтерированной среде М9 на катионообменной колонке Biotronic LC-5001 (ФРГ) с сульфированной смолой UR-30, а уровни дейтерированности молекул масс-спектрометрией электронного удара метиловых эфиров N-диметиламинонафталин-5-сульфонильных производных аминокислот. Гидролизат представлен пятнадцатью идентифицированными аминокислотами (за исключением пролина, который детектировался при 440 нм) при выходах аминокислот, сопоставимом с потребностями штамма в источниках углерода и аминного азота (табл. 2). При этом индикатором, определяющим высокую эффективность включения дейтерия в синтезируемый продукт служит высокий уровень дейтерированности молекул аминокислот, который варьирует от 49% для лейцина/изолейцина до 97.5% для аланина (табл. 2).
Биосинтетические характеристики штамма B. subtilis
снимали в протонированной дрожжевой среде с обычной водой и синтетической тяжеловодородной среде с 2
Н2
О и 2% 2
Н-меченым метилотрофным гидролизатом B. methylicum
(рис. 3). Отмечена корреляция в характере изменения ростовых динамик (рис. 3, 1а
, 2а
), выхода инозина (рис. 3, 1б, 2б
) и ассимиляции глюкозы (рис. 3, 1в
, 2в
). Максимальный выход инозина (17 г/л) зафиксирован в опыте 1б
(рис. 3, 1б
) на протонированной среде при уровне ассимилируемой глюкозы 10 г/л (рис. 3, 1в
). На тяжеловодородной среде выход инозина снижался в 4.4 (3.9 г/л) (рис. 3, 2б
), а уровень ассимиляции глюкозы в 4 раза, о чем свидетельствует 40 г/л неассимилируемой глюкозы в КЖ (рис. 3, 2в
).
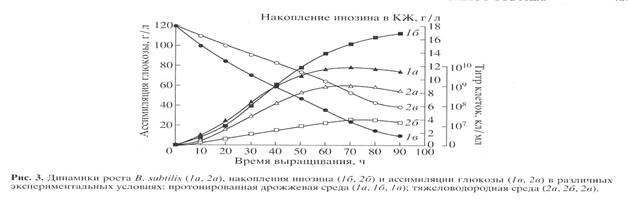
Таблица 2.
Аминокислотный состав метилотрофного гидролизата и уровни дейтерированности молекул
| Аминокислота |
Выход, % от сухого веса 1 г биомассы |
Величина молекулярного иона Мr
|
Количество включенных атомов дейтерия
в углеродный скелет молекулы
|
Уровень дейтерированности молекул, % от общего количества атомов водорода |
| Глицин |
9.69 |
324 |
2 |
90.0 |
| Аланин |
13.98 |
340 |
4 |
97.5 |
| Валин |
3.74 |
369 |
4 |
50.0 |
| Лейцин |
7.33 |
383 |
5 |
49.0 |
| Изолейцин |
3.64 |
383 |
5 |
49.0 |
| Фенилаланин |
3.94 |
420 |
8 |
95.0 |
| Тирозин |
1.82 |
669 |
7 |
92.8 |
| Серин |
4.90 |
355 |
3 |
86.6 |
| Треонин |
5.51 |
не детектировался |
- |
- |
| Метионин |
2.25 |
не детектировался |
- |
- |
| Аспарагин |
9.59 |
396 |
2 |
66.6 |
| Глутаминовая кислота |
10.38 |
411 |
4 |
70.0 |
| Лизин |
3.98 |
632 |
5 |
58.9 |
| Аргинин |
5.27 |
не детектировался |
- |
- |
| Гистидин |
3.72 |
не детектировался |
- |
- |
Полученный результат требовал изучение содержания глюкозы в биомассе штамма после гидролиза, осуществленное методом обращенно-фазовой ВЭЖХ (табл. 3). Смесь гидролизных сахаров в табл. 3 (нумерация приведена по последовательности их элюции с колонки) составляли моно-(глюкоза, фруктоза, рамноза, арабиноза), ди-сахариды (мальтоза, сахароза), а также четыре других неидентифицированных сахара с временами удерживания 3.08 (15.63%), 4.26 (7.46%), 7.23 (11.72%) и 9.14 (7.95%) мин (не показаны). Выход глюкозы в дейтерированном гидролизате составляет 21.4% от сух. веса, то есть выше, чем фруктозы (6.82%), рамнозы (3.47%), арабинозы (3.69%) и мальтозы (11.62%). Их выхода существенно не отличались от контроля на Н2
О, за исключением сахарозы, не детектируемой в дейтерированном гидролизате.
Таблица 3.
Состав сахаров гидролизата штамма-продуцента
 Сахар Выход, % от сухого веса 1 г биомассы Сахар Выход, % от сухого веса 1 г биомассы
протонированная среда тяжеловодородная среда
|
| Глюкоза |
20.01 |
21.4 |
| Фруктоза |
6.12 |
6.82 |
| Рамноза |
2.91 |
3.47 |
| Арабиноза |
3.26 |
3.69 |
| Мальтоза |
15.3 |
11.62 |
| Сахароза |
8.62 |
- |
Применение сложных физико-химических методов для выделения биосинтетически 2
Н-меченого инозина из КЖ диктовалось необходимостью получать инозин высокой степени хроматографической чистоты. Поскольку в КЖ наряду с синтезируемым продуктом присутствуют примеси неорганических солей, белков и полисахаридов, а также сопутствующие вторичные метаболиты нуклеиновой природы (аденозин, гуанозин) и непрореагировавшие субстраты (глюкоза, аминокислоты), проводили ступенчатое фракционирование КЖ. Повышенная чувствительность инозина к кислотам и щелочам и его нестабильность при выделении диктовали использование кислотных и щелочных растворов низкой концентрации, а также по-возможности проводить выделение при низких температурах, избегая длительного перегрева реакционной смеси. Фракционирование КЖ заключалось в низкотемпературном осаждении высокомолекулярных примесей органическими растворителями ацетоном и метанолом, твердофазной адсорбции/десорбции на поверхности активированного угля, экстрактивного извлечения продукта, перекристаллизации и ионообменной хроматографии. Белки и полисахариды удаляли низкотемператрным осаждением ацетоном при -40
С, проводя последующую адсорбцию суммы рибонуклеозидов активированным углем на холоду. Десорбированные рибонуклеозиды извлекали из прореагировавшей твердой фазы элюцией этанольно-аммиачным раствором при 600
С, а сам инозин экстракцией 0.3 М NH4
-формиатным буфером (рН 8.9) с последующей перекристаллизацией в 80% этаноле. Окончательная стадия очистки заключалась в колоночной ионообменной хроматографии на катионообменнике AG50WX 4, уравновешенным 0.3 М NH4
-формиатным буфером с 0.045 М NH4
Cl с ТСХ контролем при Rf
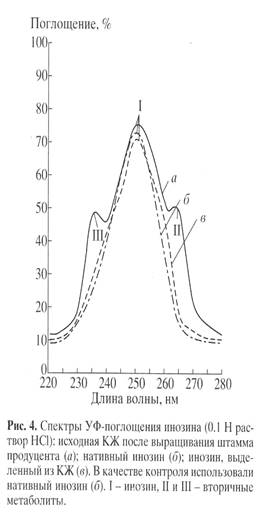
0.5. Данные по выделению инозина из КЖ штамма-продуцента представлены в виде спектров УФ-поглощения на рис. 4, а-в
. Наличие в синтетическом образце (в
) основной полосы поглощения I, соответствующей нативному инозину (lmax
249 нм, e249
7100 М-1
см-1
) и отсутствие вторичных метаболитов II и III неоспоримо доказывает его однородность и тем самым эффективность разработанного метода выделения со степенью хроматографической чистоты 92%.
Уровень дейтерированности инозина исследовали методом масс-спектрометрии FAB из за высокой чувствительности, позволяющей детектировать 10-8
-10-10
моль вещества в пробе, что существенно выше чем при использовании 1
Н ЯМР-спектроскопии [7]. Пути фрагментации молекулы методом FAB приводят к распаду инозина на фрагмент рибозы А
с Мr
при массовом соотношении m/z
133 и гипоксантиновый фрагмент Б
c Мr
m/z
136 (их распад сопровождался миграцией протона Н+
), который в свою очередь расщепляется на ряд менее низкомолекулярных осколочных фрагментов В
, Г
, Д
, Е
и Ж
при m/z
109, 108, 82, 81 и 54 за счет элиминирования НСN и СО из гипоксантина (схема).
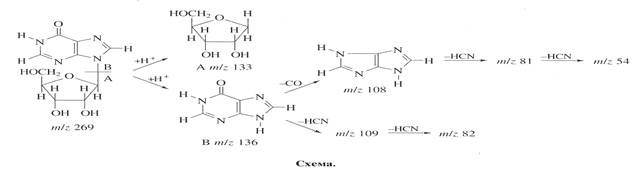
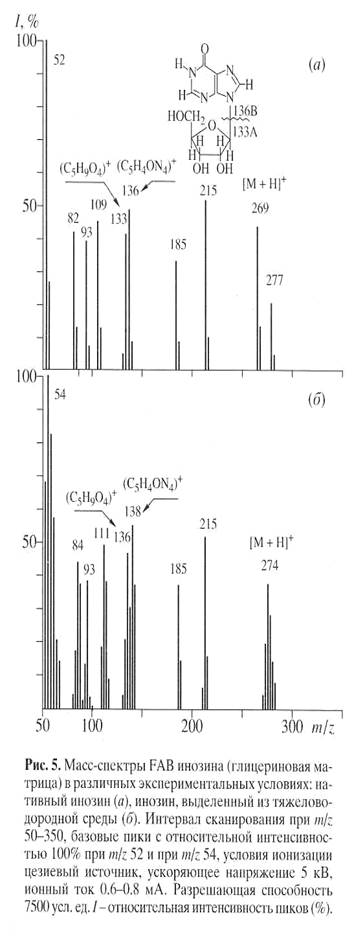
Биосинтетический 2
Н-меченый инозин (масс-спектр приведен на рис. 5, б
относительно контроля (а
)), представлен смесью изотопнозамещенных форм молекул с различным количеством атомов водорода, замещенных на дейтерий. Подсчет уровня дейтерированности молекулы инозина определяли, сравнивая величины пиков молекулярных ионов Мr
инозина дейтерированного и протонированного образцов (формирование пика молекулярного иона инозина сопровождалось миграцией протона Н+
). Пик (М+Н)+
полиморфно расщеплялся на отдельные кластеры с примесью молекул со статистическим набором массовых чисел m/z
с различным вкладом в суммарный уровень дейтерированности с включением четырех (m/z
273, 20%), пяти (m/
z 274, 38%), шести (m/z
275, 28%) и семи атомов дейтерия (m/z
276, 14%) (табл. 4).
Суммарный уровень дейтерированности молекулы (УД), вычесленный по приводимой ниже формуле составил 61% от общего количества атомов водорода в углеродном скелете молекулы.
Mr1
C1
+ Mr2
C2
+ ....... +Mrn
Cn
УД = ______________________________
SCn
(Mr
- величины пиков молекулярных ионов инозина; Сn
- вклад в уровень дейтерированности, мол.%).
Анализ масс-спектра FAB выявил включение атомов дейтерия в рибозный и гипоксантиновый фрагменты молекулы, что подтверждено присутствием двух “тяжелых” пиков фрагментов рибозы А
m/z
136, 46% (вместо m/z
133, 41%) и гипоксантина Б
m/z
138, 55% (вместо m/z
136, 48%), а также пиков низкомолекулярных фрагментов, продуктов распада гипоксантина В
m/z
111, 49% (вместо m/z
109, 45%) и Г
m/z
84, 43% (вместо m/z
82, 41%) (рис. 5).
Таблица 4.
Величины пиков (М+Н)+
в масс-спектрах FAB и уровни дейтерированности инозина
Величина пика (М+Н)+
|
Вклад в уровень дейтерированности, мол.% |
Количество атомов дейтерия |
Уровень дейтерированности, % от общего количества атомов водорода |
| 273 |
20 |
4 |
20.0 |
| 274 |
38 |
5 |
62.5 |
| 275 |
28 |
6 |
72.5 |
| 276 |
14 |
7 |
87.5 |
Эффект множественного мечения определяется способом получения дейтерированных молекул и свидетельствует о недостаточно высокой селективности биосинтетической схемы, повысить которую возможно контролем изотопного состава синтетической ростовой среды и исключения источников дополнительных протонов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования проводили с генетически маркированным штаммом грамположительных бактерий Bacillus subtilis
ВКПМ В-3157, продуцентом инозина, адаптированным к дейтерию рассевом до отдельных колоний на 2% агаре с 2
Н2
О и последующей селекции по признаку устойчивости к 2
Н2
О.
В работе использовали 2
Н2
О (99.9 ат.% 2
Н), 2
НСl (95.5 ат.% 2
Н) и [U-2
H]метанол (97.5 ат.% 2
Н) (ЗАО Изотоп, Санкт-Петербург, РФ). Неорганические соли и D, L
- глюкозу (Reanal, Венгрия) предварительно перекристаллизовывали в 2
Н2
О, 2
H2
O дистиллировали над перманганатом калия с последующим контролем изотопной чистоты 1
Н ЯМР-спектроскопией на приборе Brucker WM-250 (ФРГ) (Частота 70 МГц). Масс-спектры электронного удара ЭУ получены на приборе МB-80A (Hitachi, Япония) с двойным фокусированием (энергия ионизирующих электронов 70 эВ, ускоряющее напряжение 8 кВ, температура катодного источника 180-2000
С) после модификации в метиловые эфиры N-диметиламинонафталин-5-сульфонильных производных аминокислот по разработанной раннее методике [7]. Масс-спектры FAB получены на импульсном масс-спектрометре VG-70 SEQ (Fisons, VG Analitical, США), снабженным цезиевым источником Cs+
на глицериновой матрице с ускоряющем напряжением 5 кВ и ионным током 0.6-0.8 мА. УФ-спектры регистрировали на программируемом спектрофотометре Beckman DU-6 (США) в диапазоне длин волн 220-280 нм. Центрифугирование осуществляли на центрифуге Т-24 (ФРГ) с охлаждением при -40
С.
Аналитическую обращенно-фазовую ВЭЖХ проводили на жидкостном хроматографе Knauer (ФРГ), снабженным насосом Gilson (ФРГ) и рефрактометром Waters K-401 (ФРГ) на колонке Separon С18 (250 x10 мм), элюция смесью ацетонитрил : вода, 75 : 25, об.%, скорость элюирования 0.6 мл/мин. Ионообменную хроматографию осуществляли на катионообменной колонке Biotronic LC-5001 (ФРГ) (230 x 3.2) с сульфированной стирольной (7.25% сшивки) смолой UR-30 (Beckman-Spinco, США); рабочее давление 50-60 атм; скорость подачи Na+
-цитратного буфера 18.5; нингидрина 9.25 мл/ч; детекция при 570 нм. Уровень биоконверсии углеродного субстрата определяли, используя глюкозооксидазу (КФ 1.1.3.4) как описано в работе [35].
Биосинтетический 2
Н-меченый инозин.
Получен с выходом 3.9 г/л на синтетической тяжеловодородной среде (89-90% ат. 2
Н), используя в качестве источника 2
Н-меченых ростовых субстратов гидролизат биомассы метанол-ассимилирующего штамма факультативных метилотрофных бактерий Brevibacterium methylicum
ВКПМ B-5662 (условия получения: автоклавирование в 0.1 н. 2
НСl30-40 мин при 08 ати), выделенный скринингом в условиях многостадийной адаптации на твердой среде М9 (2% агар) с 2% [U-2
Н]метанолом со ступенчато увеличивающимся градиентом концентрации тяжелой воды (от 0 до 98% 2
Н2
О). Состав синтетической тяжеловодородной среды (мас.%): глюкоза - 12; 2
Н-меченый гидролизат B. methylicum
- 2; NH4
NO3
- 2; MgSO4
.
7H2
O - 1; Са2
СО3
- 2. Синтез проводили в колбах Эрленмейера вместимостью 500 мл (наполнение средой 100 мл) в течение 5-6 сут при 30-320
С в условиях интенсивной аэрации реакционной смеси на орбитальном шейкере S-380 (Венгрия).
Очистка
2
Н-меченого инозина.
Пробы КЖ центрифугировали при 2000 g
, 10 мин, концентрировали при 10 мм рт. ст., добавляли ацетон при 00
С (3 x 5 мл). Смесь выдерживали 14-15 ч при -40
С, осадок отделяли центрифугированием при 1200 g
, 5 мин. К супернатанту добавляли 10 г активированного угля, выдерживали 2 сут при 40
С. Водную фракцию отделяли фильтрованием, к твердой фазе добавляли 20 мл 50% этанола в 25% аммиаке (1 : 1, об.%), кипятили при 600
С с обратным водяным холодильником. Через 2-3 ч смесь фильтровали и упаривали при 10 мм рт. ст. Продукт экстрагировали 0.3 М NH4
-формиатным буфером (рН 8.9), промывали ацетоном (2 x 10 мл), сушили над безводным СaCl2
. Инозин перекристаллизовывали из 80% этанола, очищали методом ионообменной хроматографии на откалиброванной колонке Biorad (150 x 10 мм) с катионообменной смолой АG50WX 4 (Pharmacia, США), уравновешенной 0.3 М NH4
-формиатным буфером (рН 8.9) c 0.045 М NH4
Cl в условиях изократической элюции (хроматографическая чистота 92%). Контроль чистоты проводили методом ТСХ с использованием стандартного набора рибонуклеозидов фирмы Beckman-Spinco (США) на хроматографических пластинках (150 x 150 мм) с закрепленным слоем флуоресцентного носителя Silufol UV-254 (Чехословакия) в системе растворителей: H
-бутанол : уксусная кислота : вода, 2 : 1 : 1, об.%. Выход 2.5 г/л (64%). Т. пл. 68-700
С. [a]D
20
1.610
(с
1.5 этанол). Rf
0.5. рКa
1.2 (фосфатный буфер, рН 6.87). УФ-спектр(0.1 н. НСl) (lmax
249 нм, e249
7100 М-1
см-1
); FAB-спектр (глицериновая матрица Cs+
, ускоряющее напряжение 5 кВ, ионный ток 0.6-0.8 мА): (M+H)+
m/z
(I
,%): 273, 20% (4 ат. 2
Н); 274, 38% (5 ат. 2
Н); 275, 28% (6 ат. 2
Н); 276, 14% (7 ат. 2
Н), (А
+ H)+
136, 46%; (Б
+ Н)+
138, 55%; (Б
- НCN)+
111, 49%; (В
- HCN)+
84, 43%.
СПИСОК
ЛИТЕРАТУРЫ
1. Young V.R., Yu Y.M., Krempf M.
Protein and amino acid turnover using the stable isotopes 15
N, 13
C, and 2
H as probes. in: New techniques in nutritional research // Whitehead R. G. (ed). Acad. Press. N. Y. 1990. V. 9. Р. 17-72.
2. Hruby V.J.
// Synth. and Appl. Isot. Label. Compounds. 1985. V. 4. ¹1. Р. 287-292.
3. Nelson J.E., Ruo T.I.
// Clinica Chemica Acta. 1988. V. 175. ¹ 3. Р. 59-65.
4. Stockman B.J., Reily M.D., Westler W.M., Ulrich E.L., Markley J.L.
// Biochemistry. 1989. V. 28. ¹ 7. Р. 230-236.
5. McIntosh L.P., Dahlquist F.W.
// Quart. Rev. Biophys. 1990. V. 23. ¹ 1. Р. 1-38.
6. Argade P.V., Rothschild K.J., Kawamoto A.H., Herzfeld J., Herlihy W. C.
// Proc. Natl. Acad. Sci. USA. 1981. V. 78.
№3. P. 1643-1646.
7. Мосин О.В., Складнев Д.А., Егорова Т.А., Швец В.И.
// Биоорган. химия. 1996. Т. 22. ¹ 10-11. С. 856-869.
8. Darmaun D., Robert J. J., Bier D.M., Mathews D.E., Young V.R.
// Annales-d’ Endocrinologie. 1985. V. 46. ¹ 4. Р. 355-356.
9. Shvets V.I., Yurkevich A.M., Mosin O.V., Skladnev D.A.
// Karadeniz Journal of Medical Sciences, 1995. V. 8. ¹ 4. P. 231.
10. Fesik S.W., Zuderweg E.R.P.
// Quart. Rev. Biophys. 1990. V. 23. № 2. Р. 97-131.
11. Мосин О. В., Складнев Д. А., Егорова Т. А., Швец В. И.
//Биотехнология. 1996. № 10. С. 24-40.
12. Пшеничникова А.Б., Карнаухова Е.Н., Звонкова Е.Н., Швец В.И.
// Биоорган. химия. 1995. Т. 21. ¹ 3. С. 163-178.
13. Daub G. H
. Syntheses with stable isotopes. in: Stable Isotopes, Proc. of the 3d Intern. Conference // Klein E. R. (ed). Academic Press. N. Y. 1979. Р. 3-10.
14. van der Berg E.M.M., van Liemt, Willem B.S
// Recl. Trav. Chim. Pays-Bas. 1989. V. 108. ¹ 9. Р. 304-313.
15. Walker T. E., Matheny C.
// J. Org. Chem. 1986. V. 51. Р. 1175-1179.
16. Фалеев Н.Г., Рувинов С. В., Сапоровская Н. В., Беликов В. М., Закомырдина Л.Н.
// Изв. Ан. СССР. Сер. хим. 1989. Т.
10. Вып. 3. С. 2341-2343.
17. LeMaster D.
// Quart. Rev. Biophys. 1990. V. 23. ¹ 2. Р. 133-174.
18. Mosin O.V., Skladnev D.A., Shvets V.I
. // Bioscience, biotechnology, and biochemistry. V. 62. ¹ 2. P. 225-229.
19. Crespi H.L., Marmur J., Katz J.J.
// Nature. 1962. V. 84. ¹ 1. Р. 3489-3491.
20. Crespy H.L.
Stable Isotopes in the Life Sciences. International atomic energy agency Press. Vienna. 1977. Р. 111-121.
21. Daboll H.F., Crespi H.L., Katz J.J.
// Biotechnol. Bioengineer. 1962. V. 4. ¹ 5. Р. 281-297.
22. Cox J., Kyli D., Radmer R
. // Trends Biotechnol. 1988. V. 6. № 12. Р. 279-282.
23. Мосин О.В., Складнев Д.А., Швец В.И.
// Изв. РАН. Сер. биол. ¹ 3. С. 1-10.
24. Thomson J. F.
Biological effects of deuterium. Pergamon Press. N. Y. 1963. P. 1-133.
25. Еремин В.А., Чекулаева Л.Н., Харатьян Е.Ф., Островский Д.Н.
// Микробиология. 1978. Т. 32. Вып. 4. С. 629-636.
26. Busujima U.K., Shimiba S., Narita K., Okada S.
// Chem. Pharm. Bull. 1988. V. 36. ¹ 4. P. 1828-1832.
27. Colby J, Dalton H.
// Ann. Rev. Microbiol. 1979. V.33. ¹ 6. P.481-517.
28. Karnaukhova E.N., Reshetova O.S., Semenov S.Y., Skladnev D.A., Tsygankov Y.D.
// Amino Acids. 1994. V.6. ¹ 2. P.165-176.
29. Skladnev D.A., Tsygankov Y.D.
Convertion of stable isotope labeled methanol to components of bacterial biomass, in: 6 th Eur. Conf. of Biomass for Energy. Athens. Greece, 1991. P. 234.
30. Мосин О.В., Складнев Д.А., Егорова Т.А., Швец В.И
. // Биотехнология. 1996. № 3. С. 3-12.
31. Складнев Д.А., Мосин О.В., Егорова Т.А., Еремин С.В., Швец В.И.
// Биотехнология. 1996. № 5. С. 25-34.
32. Мосин О.В., Казаринова Л.А., Преображенская К.А., Складнев Д.А., Чеботаев Д.В., Юркевич А.М., Швец В.И.
// Биотехнология. 1996 г. № 4. C. 19-27.
33. Мосин О.В., Карнаухова Е.Н., Пшеничникова А.Б.,Складнев Д.А., Акимова О.Л.
// Биотехнология. 1993. № 9. С. 16-20.
34. Зорина А.В, Бабусенко Е.С.
Химический состав биомассы метилотрофных бактерий. Современные проблемы биотехнологии микроорганизмов. // Тезисы докл. молодых ученых. Рига. 1987. Т. 1. № 2. С.35-40.
35. Полюдек-Фабини Р., Бейрих Т.
Органический анализ. Руководство по анализу органических соединений. Л.: Химия, 1981. 514 c.
THE BIOSYNTHESIS OF 2
H-LABLED INOSINE WITH HIGH LEVEL OF DEUTERIUM ENRICHMENT
О
. V. MOSIN
М
oscow State Academy of Fine Chemical Technology named after
М
.V. Lomonosov, 117571 Moscow, Vernadskogo Pr., 86;
The biosynthesis of 2
Н
-labeled purine ribonucleoside inosine (yeald 3/9 g/l) with using an adapted to deuterium strain of Bacillus subtilis
on heavy water medium with highly level of deuteration (89-90 at.% 2
H2
O), containing 2% hydrolyzate of biomass of methylotrophic bacterium Brevibacterium methylicum
as a source of 2
H-labeled growth substrates (the biosynthetic conditions: synthetic medim M9 with 98% 2
Н
2
O and 2% [U-2
Н
]methanol, the incubation period 5-6 days at 370
C) was carried out. The studyng of the level of deuterium enrichment of inosine by a method of FAB mass-spectrometry found out the polymorhysm of isotopic introduction into the molecule (isotopic composition of inosine: 4 at. 2
H, 20%, 5 at. 2
H, 38%, 6 at. 2
H, 28%, 7 at. 2
H, 14%) with deuterium introduction to ribose and hypoxantinefragments of the molecule.
|