Контрольная работа
по биологии
2009
Содержание
1. Методы определения аффинности антител................................................ 3
2. Способы расчета констант комплексообразования реакции антиген—антитело 7
3. Кинетические закономерности реакции взаимодействия антиген—антитело 15
1. Методы определения аффинности антител
Определение аффинности антител в сыворотке или выделенных в очищенном виде представляет собой сложную экспериментальную и теоретическую задачу. Трудности обусловлены следующими обстоятельствами.
Во-первых, гетерогенностью антител по физико-химическим свойствам, в том числе по сродству к антигену. Во-вторых, сложностью определения общего количества антител, а также отдельных фракций. В-третьих, в случае поливалентных антигенов возможностью образования комплексов сложного состава, в том числе циклической структуры, в которых проявляется кооперативность взаимодействия активных центров антител. Все это не позволяет применить традиционные методы для расчета истинных значений констант связывания. Более надежные данные могут быть получены для моноклональных антител и их Fab-фрагментов, так как в этом случае могут быть выделены индивидуальные антитела в гомогенном виде.
Истинные значения констант связывания важны для определения термодинамических характеристик процесса взаимодействия · антиген — антитело. Для практических целей, в частности для разработки методов иммуноферментного анализа, достаточно знать эффективные значения, характеризующие свойства используемых антител.
Рассмотрим принципиальные подходы к определению констант равновесия. Из уравнения следует, что для расчетов необходимо знать концентрации свободного и связанного с антителами антигена в условиях равновесия. Обычно для этого используют антигены, меченные маркером, который с высокой чувствительностью может быть определен одним из доступных физико-химических методов.
Все методы, позволяющие определять концентрации свободного и связанного антигена, можно условно разбить на две большие группы. К первой относятся методы, в которых стадия разделения свободного и связанного антигена осуществляется путем избирательного осаждения, аффинного связывания или гельфильтрации. Если реагенты достаточно сильно различаются своими молекулярными массами и размерами, то процедура разделения существенно упрощается. В случае корпускулярных антигенов оставшиеся несвязанные антитела могут быть отделены либо центрифугированием, либо пропусканием смеси через фильтр, задерживающий антиген. Для низкомолекулярных антигенов используется равновесный диализ.
Реклама

Вторая группа включает методы, базирующиеся на изменении физико-химических свойств антигенов при комплексообразовании с антителами: тушении или усилении флуоресценции, изменении степени поляризации флуоресценции, ингибировании ферментативной активности.
Равновесный диализ — наиболее распространенный метод изучения реакции антиген — антитело. Метод основан на различной способности антител и гаптена проходить через полупроницаемые мембраны. Раствор каждого реагента известной концентрации в одном и том же растворителе с одинаковой ионной силой и значением рН помещают по разные стороны мембраны. Молекулы гаптена диффундируют в раствор антител и связываются с ними. При достижении равновесия концентрация свободного гаптена выравнивается по обе стороны мембраны. Измерив равновесную концентрацию гаптена, можно рассчитать количество гаптена, связанного с антителами, и определить по уравнению константу связывания.
Как правило, метод равновесного диализа применяется для низкомолекулярных соединений с Afr
<3000. Это обстоятельство существенно ограничивает область использования метода. К недостаткам метода надо также отнести относительно большое время достижения равновесия и необходимость учета эффектов, вызываемых присутствием мембраны, в результате чего необходимо работать с достаточно высокими концентрациями реагентов, что значительно понижает чувствительность определения константы связывания.
Методы фракционного осаждения используются для разделения комплексов антиген — антитело и несвязавшегося антигена. Они основаны на способности высокомолекулярных комплексов антиген—антитело избирательно осаждаться различными реагентами. При установлении в системе равновесия осаждающий реагент добавляют в такой концентрации^ при которой комплекс антиген—антитело и несвязавшиеся антитела становятся нерастворимыми и выпадают в осадок, который легко может быть удален центрифугированием.
Методы, не включающие фазовое разделение вступившего и не вступившего в реакцию антигена, относятся к группе гомогенных методов.
Реклама

Флуоресцентные методы основаны на способности остатков триптофана в молекулах белков флуоресцировать при возбуждении УФ светом. Взаимодействие ряда антигенов с антителами приводит к изменению интенсивности флуоресценции, что может быть использовано для оценки количества антигена, вступившего в реакцию с антителами. В зависимости от химической структуры антигена может наблюдаться как усиление, так и гашение флуоресценции. Степень гашения интенсивности свечения зависит от концентрации активных центров антител, константы их ассоциации с антигеном и пропорциональна концентрации образовавшихся специфических комплексов. Методы флуоресценции просты, не занимают много времени и имеют высокую чувствительность, что сокращает расход реагентов.
Таблица 1. Методы определения аффинности антител
| Методы |
Используемые антигены |
Равновесный диализ Осаждение глобулиновой фракции сульфатом аммония
Осаждение углем, модифицированным декстраном
Осаждение антиглобулинами
Гельфильтрация, разделение по молекулярной массе
Тушение флуоресценции
Усиление флуоресценции Поляризация флуоресценции Спектральные методы Тушение биолюминесценции
|
Гаптены, диализуемые антигены Гаптены, антигены, растворимые
при 50%-ном насыщении сульфатом
аммония Гаптены
Гаптеиы, белки, полисахариды Гаптены, белковые полисахариды
Гаптены и антигены со специфическими флуоресцентными свойствами Гаптеиы, белки Гаптены, белки
Гаптены, связанные с красителем Гаптены, белки
|
Метод деполяризации флуоресценции основан на измерении поляризации флуоресценции антигена, меченного красителем, до взаимодействия с антителами и после комплексообразования. Поляризация флуоресценции определяется молекулярным объемом частицы и степенью ее асимметрии. Комплексообразование антигена с антителом сопровождается резким изменением поляризации флуоресценции красителя, который играт роль метки антигена или антитела. Предел обнаружения антигена этими методами достаточно мал. Недостатками методов, основанных на измерении флуоресценции, являются необходимость работы с препаратами очищенных антител и строгие требования к структуре изучаемых антигенов. Вследствие этого флуоресцентные методы не являются универсальными и могут быть применены для ограниченной группы антигенов.
Методы тушения биолюминесценции основаны на использовании в качестве маркера АТР, пришитой к' молекуле антигена. В составе такого комплекса молекула АТР сохраняет активность в реакции биолюминесценции, катализируемой светлячковой люциферазой. При добавлении антител образуется комплекс с антигеном, в котором молекула АТР становится недоступной ферменту, в результате чего ингибируется реакция биолюминесценции. Указанный метод обладает высокой чувствительностью, что позволяет измерять константы ассоциации до 10-12
М.
Перечень экспериментальных методов определения аффинности взаимодействия антиген — антитело приведен в табл. 1.
2. Способы расчета констант комплексообразования реакции антиген — антитело
Взаимодействие одной субпопуляции антител с моновалентным антигеном. Этот наиболее простой случай реализуется, например, при связывании гаптена с Fab-фрагмента-ми моноклональных антител и описывается простейшей схемой.
Из системы уравнений материального баланса
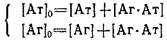
с учетом для константы равновесия комплексообразования можно легко получить выражения равновесной концентраций образовавшегося комплекса
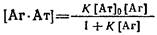
1. Один из часто используемых способов расчета константы состоит в исследовании зависимости образующегося комплекса от общей концентрации антигена о. Если при достаточно больших концентрациях антигена в системе выполняется условие, то принимает вид
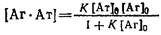
Эта зависимость является аналогом изотермы адсорбции Лэнгмюра в теории адсорбции или уравнения Михаэлиса-Ментеи в ферментативной кинетике. Из выражения следует, что при предельных значениях концентрации 0
концентрация комплекса стремится к общей концентрации центров связывания 0
. Для вычисления К определяют концентрацию антигена 'о, при которой половина антител находится в виде комплекса с антигеном. С учетом выражений и можно получить
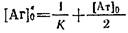
Из выражения следует, что '0 = 1/К при условии 1/К">о. При обратном соотношении данный метод определения К неприемлем.
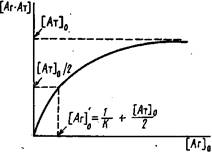
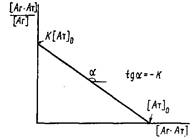
Зависимость концентрации образующегося комплекса от общей концентрации антигена в растворе
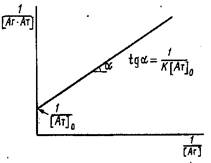
Графическое определение константы связывания в двойных обратных координатах
2. Иногда для вычисления константы связывания К используют представление экспериментальных данных зависимости концентрации комплекса от концентрации свободного антигена в системе двойных обратных координат:
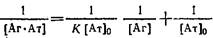
При постоянной концентрации антител в системе варьируют начальную концентрацию антигена и в условиях равновесия определяют концентрацию свободного и связанного в комплекс антигена. График в двойных обратных координатах представляет собой прямую линию с тангенсом угла наклона, отсекающую на оси ординат отрезок 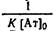
В условиях избытка антигенаанализ проводят в координатах 1/0
.
3. Наиболее часто для анализа комплексообразования используют метод Скэтчарда, основанный на исследовании зависимости отношения равновесной концентрации комплекса к концентрации свободного антигена от концентрации комплекса.
Аналитический вид уравнения Скэтчарда легко получить из выражения для константы комплексообразования и уравнения материального баланса:
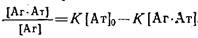
В литературе часто эти координаты обозначают в символах.B/F-i-B. Зависимость Скэтчарда имеет вид прямой с тангенсом угла наклона — К, отсекающей на оси ординат отрезок К о, а на оси абсцисс 0
. Графическая обработка экспериментальных данных в координатах Скэтчарда позволяет вычислить не только равновесную константу связывания, но и концентрацию активных центров антител 0
в системе.
На практике при нахождении константы данным способом проводят серию опытов по определению равновесной концентрации свободного антигена при различных начальных концентрациях антигена и постоянной концентрации антител в системе.
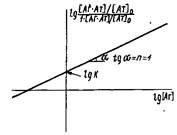
4. В качестве еще одного преобразования уравнений и используют следующее:
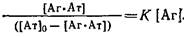
Разделив числитель и знаменатель части равенства на концентрацию антител 0
и логарифмируя выражение, получаем
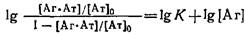
В координатах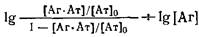 , называемых координатами Хилла, должна получаться прямая с тангенсом угла наклона, равным единице, пересекающая ось ординат в точке IgK. , называемых координатами Хилла, должна получаться прямая с тангенсом угла наклона, равным единице, пересекающая ось ординат в точке IgK.
Взаимодействие одной субпопуляции антител с поливалентным антигеном. Рассматриваемый ниже случай может реализоваться, например, при связывании Fab-фрагментов моноклональных антител с клетками, вирусными частицами и т. д., имеющими на своей поверхности большое число одинаковых центров связывания. Выражение для константы равновесия взаимодействия антитела, имеющего позэпитопов, записывается следующим образом:
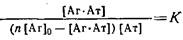
Уравнение Скэтчарда в этом случае принимает вид
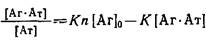
Варьируя концентрацию антител в системе при постоянной концентрации о, можно определить константу комплексообразования К и число мест связывания 6 антигене п.
Так как молекулы антител обладают, по крайней мере, двумя центрами связывания, то при взаимодействии с поливалентным антигеном возможно образование так называемых комплексных связей, когда после взаимодействия одного активного центра молекулы антитела с одним из эпитопов второй активный центр взаимодействует с расположенным поблизости вторым эпитопом той же молекулы антигена. Общая эффективность взаимодействия в этом случае существенно возрастает; в частности, эффективная константа комплексообразования для молекулы IgG может в 103
раз и более превышать Ко одиночных связей. Частота образования таких связей зависит от концентрации реагентов и может колебаться от нуля до максимальной, соответствующей общему количеству молекул IgG в Системе.
Взаимодействие двух субпопуляций антител с моновалентным антигеном. Одним из простых приближений при описании реальных систем взаимодействия моновалентного антигена с антителами может быть модель, согласно которой набор популяций антител заменяется двумя — высокоаффинной и низкоаффинной, каждая из которых характеризуется собственной константой комплексообразования —Кйи Кг. Задача определения констант и концентраций каждой из фракций антител перед экспериментаторами возникает часто. Знание численных значений этих параметров весьма важно для разработки конкретных наборов для иммуноферментного анализа и выбора схемы проведения иммуноанализа с целью достижения требуемой чувствительности определения антигена и специфичности анализа.
В условиях равновесия рассматриваемая схема взаимодействия
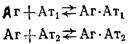
описывается системой следующих алгебраических уравнений:
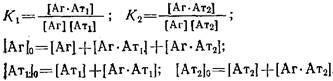
Опуская алгебраические преобразования, дадим окончательное выражение зависимости, описывающей связь параметров системы в координатах Скэтчарда:
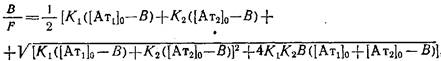
гдеВ = Вй-\-В2
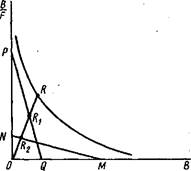
=+; F=. Графическая зависимость B/Fот В имеет вид гиперболы. Таким образом, получаемая при анализе зависимости связывания неизвестной популяции антител с антигеном в координатах Скэтчарда вогнутая кривая может свидетельствовать о существовании двух фракций антител — высокоаффинной и низкоаффинной.
Для определения четырех неизвестных параметров —Кй, Кг, 0
и о можно воспользоваться одним из следующих методов.
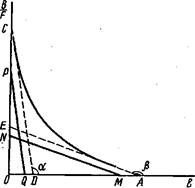
1. Параметры можно оценить по углам наклона асимптот гиперболы и отрезкам, отсекаемым ими на оси абсцисс и ординат. Для построения асимптот используют следующий прием. По концевым участкам экспериментальной кривой проводят прямые, которые дают первоначальное приближение констант Кйи Кя.Путем параллельного перемещения прямых подбирают такое их положение, чтобы сумма отрезков, отсекаемых ими на осях координат', была равна соответствующим отрезкам на тех же осях, отсекаемых самой кривой при экстраполяции ее к осям координат:
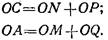
Отрезки на оси абсцисс ОМ и оси ординат CW дают оценочные значения для0
и о соответственно. Подставляя оценочные значенияКй, Кз, 0
в выражения дляВйи В2
находят приближенные параметры В\ и В% и В=В1
-\-В2
при различных концентрациях Аг.
С использованием полученных значений строят теоретическую зависимость B/Fот В, сравнивают ее с экспериментальной и подбирают новые оценочные параметры до наилучшего совпадения теоретической и экспериментальной кривой.
2. Для нахождения асимптот гиперболы можно воспользоваться чисто графическим методом, заключающимся в построении двух прямых PQиНМ, для которых выполняется соотношение
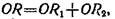
т. е. отрезок OR, соединяющий начало координат с любой точкой R, находящейся на гиперболе, равен сумме отрезков ORiи OR2, соединяющих начало координат с точками пересечения отрезка ORс асимптотами.
3. Для оценки параметров Ки Кг,п и о часто используют следующий метод, основанный на анализе графической зависимости B/Fот В. Из экспериментально полученной кривой связывания путем экстраполяции находят точки пересечения кривой с осями абсцисс и ординат. Проводят касательные в этих точках к кривой до пересечения их с осями абсцисс и ординат в точках Dи Е„
Можно показать, что численные значения искомых параметров определяются по следующим алгебраическим формулам:
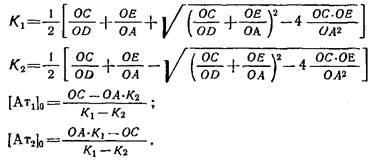
3. Кинетические закономерности реакции взаимодействия антиген — антитело
Образование комплекса антиген—антитело является обратимым процессом, т. е. равновесная константа связывания данного комплекса определяется отношением константы скорости ассоциации kiк константе скорости диссоциации. Исследование кинетики процесса комплексообразования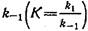 антигенов с центрами связывания антител в широком диапазоне концентраций, включая избыточные концентрации каждого из реагентов, позволяет определить значения кинетических констант скоростей ассоциации и диссоциации, рассчитать время, необходимое для достижения системой равновесия. - антигенов с центрами связывания антител в широком диапазоне концентраций, включая избыточные концентрации каждого из реагентов, позволяет определить значения кинетических констант скоростей ассоциации и диссоциации, рассчитать время, необходимое для достижения системой равновесия. -
Реакция антиген—антитело в диапазоне таких концентраций реагентов, которые регистрируются обычны» ми физнко-химическимн методами, протекает очень быстро, что затрудняет ее изучение с помощью традиционных кинетических.методов,
При высоких концентрациях реагентов лимитирующим фактором является время смешивания растворов, так как равновесие устанавливается за время, которое не позволяет определять изменения концентраций реагентов.
Для нахождения кинетических констант реакции антиген—антитело могут быть применены два экспериментальных подхода. Первый из них состоит в использовании специальных приемов для изучения быстрых реакций — метода температурного скачка и метода остановленной струи. Второе направление связано с применением реагентов, позволяющих следить за реакцией комплексообразования в области ультранизких концентраций реагентов. Переход к низким концентрациям реагентовдает возможность значительно понизить скорость реакции и использовать для расчетов традиционные кинетические методы.
Основная часть кинетических экспериментов, приведенных в литературе, выполнена, для взаимодействия гаптенов, главным образом ДНФ-лигандов. Лишь очень небольшое количество работ посвящено кинетическому исследованию взаимодействия антител с антигенами белковой природы. Это связано с тем, что кинетические данные, полученные в опытах со сложными антигенами, трудно интерпретировать.
Как для белковых антигенов, так и для гаптенов установлены достаточно высокие значения констант скоростей ассоциации, приближающиеся к диффузионно контролируемому пределу. В случае белковых антигенов их значения приблизительно на 2 порядка меньше и колеблются от 5-105
до 5-Ю6
М-1
-с-1
, что объясняется более сложной структурой антигенной детерминанты белковых антигенов.
Имеющиеся данные свидетельствуют о том, что наблюдаемые различия в аффинности антител обусловлены, в основном, значениями константы скорости диссоциации. Это было наглядно продемонстрировано в экспериментах с серией гомологичных гидрофобных ДНФ-лигандов, в которых десятикратное увеличение константы аффинности для двух перекрестно реагирующих ли-гандов обусловлено различием в константах скоростей диссоциации, а не ассоциации. Эти и другие результаты показывают, что именно константа скорости диссоциации определяет сродство антитела к гаптену. Этот вывод, однако, нельзя считать окончательным, поскольку количество экспериментальных данных, полученных к настоящему времени, ограничено.
Экспериментальные методы определения кинетических констант. Метод температурного скачка. Этот метод является одним из релаксационных методов, основанных на принципе зависимости времени достижения нового равновесного состояния системы, обусловленного быстрым внешним воздействием, от констант скоростей прямой и обратной реакций. Можно показать, что если в начальном состоянии система
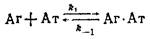
находится в равновесии, то после быстрого изменения температуры кинетика реакции достижения нового положения равновесия описывается дифференциальным уравнением, решение которого представляет собой экспоненту, в которой показатель экспоненты связан с элементарными константами скоростей реакции уравнением
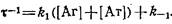 , ,
Величина ф называется временем релаксации. Анализ зависимости в координатах 1 / ч -— -~ позволяет найти по тангенсу угла наклона прямой значение ki,а по отрезку, отсекаемому на оси ординат, k-i.
Определение констант скоростей комплексообразования с использованием меченых реагентов. Этот метод, нашел большое применение в связи с развитием высокочувствительных методов иммуноанализа, основанных на использовании меченых реагентов: радиоиммунологического, иммунофер-ментного и других -методов. Кинетические закономерности простейшей схемы взаимодействия антиген — антитело описывает система дифференциальных уравнений:
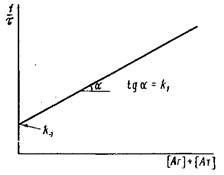
Определение кинетических констант взаимодействия моновалентного антигена с субпопуляцней антител по методу температурного скачка
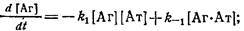
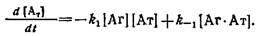
С учетом уравнения материального баланса
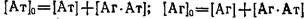
н начальных условий можно получить решение системы
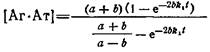
где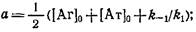
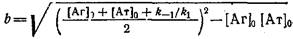
Весьма существенным параметром в «ммуноферментном анализе является время установления равновесия в системе. Если считать, что ^равн определяется условием
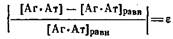 7 7
то время установления равновесия можно найти по формуле
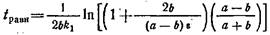
Так как для вычисления времени необходимо точное значение констант скоростей k\и k-i,которые часто неизвестны, то это уравнение обычно используют лишь для самой грубой оценки времени установления равновесия.
Определение константы скорости ассоциации. 1. Наиболее простой метод основан на регистрации начальной скорости V<> образования комплексаБг·Бф, тогда
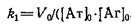
Однако метод недостаточно точен, так как определение о н У о обычно производится с большой ошибкой. Для повышения точности при расчетах используют несколько начальных.концентраций реагентов.
2. Для нахождения k\и k-\эксперимент проводят в условиях избыточной концентрации одного из реагентов. В случае применения меченого антигена используют большой избыток соответствующих антител. Выражение для концентрации Комплекса в этом случае принимает следующий вид:
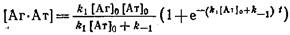
Как видно из этого выражения, зависимость равновесной концентрации комплекса от времени описывается моноэкспоненциальной кривой с предэкспоненциальным множителем
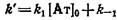 * *
соответствующим эффективной константе скорости ассоциации.
Спрямляя зависимость одним из известных способов, например, в координатах
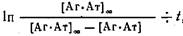 > >
по тангенсу угла прямой вычисляют k'при заданной концентрации 0
.
Откладывая графически k'от концентрации 0
,получаем прямую, тангенс угла наклона которой дает ki,а отрезок, отсекаемый на оси ординат, k-i.Данный способ расчета пригоден, когда k-\сравнима с &i0
. В противном случае что позволяет определить по тангенсу угла наклона только бимолекулярную константу скорости Бй.
Определение константы скорости диссоциации. Обычно константу скорости диссоциации находят путем прямого измерения скорости процесса диссоциации. комплекса в условиях его необратимости. Для этого используют один из следующих подходов.
1. После установления равновесия в системе проводят разбавление системы большим избытком буфера. Так как скорость образования комплекса пропорциональна произведению концентраций каждого из реагентов, а скорость диссоциации комплекса — его концентрации в первбй степени, то при сильном разбавлении
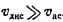
В этом случае процесс диссоциации комплекса Аг-Ат будет описываться экспоненциальной кривой. Спрямлением ее в логарифмических координатах можно получить константу скорости k-u
2. В систему вносят вещества, способные быстро и полностью связывать или удалять свободный лиганд. Если скорость удаления свободного лиганда будет существенно больше скорости диссоциации комплекса, то наблюдаемая скорость распада комплекса описывается реакцией первого порядка с k-\.
3. После установления равновесия в системе антитела — меченый антиген в нее вводят избыток свободного немеченного антигена. В этих условиях процесс изменения концентрации комплекса также описывается кинетикой первого порядка константа скорости которого соответствует k-i.
|