Реферат
по биологии
на тему:
"Антигены"
2009
Антигенами называют биополимеры или их синтетические аналоги, способные при введении в организм или в культуре лимфоидных клеток вызвать иммунный ответ: продукцию антител, появление клеток-эффекторов тимического происхождения, формирование иммунологической памяти. Антитела или клетки, появляющиеся в ходе иммунного ответа, специфически взаимодействуют с антигеном или химическими веществами сходного строения. Последние могут не обладать свойством вызыватьиммунный ответ. Такие вещества называют гаптенами. При определенных условиях антигены способны вызвать состояние специфической безответственности — иммунологической толерантности.
Антигенами являются, как правило, чужеродные для реципиента вещества, к которым принадлежат белки, полисахариды, нуклеиновые кислоты и их комплексы. Изменяя путем химической модификации природные биополимеры, можно получить так называемые конъюгиро-ванные антигены. Конъюгированные антигены могут быть получены на основе белков, принадлежащих самому реципиенту. Аутологичные белки, денатурированные физическими или химическими методами, также приобретают антигенные свойства.
Синтетические полипептиды как аналоги белковых антигенов способны индуцировать иммунный ответ, но при этом совсем не обязательно они должны быть подобны по первичной и пространственной структуре какому-то определенному белку. Существенным для появления у них антигенных свойств является формирование устойчивой пространственной структуры. По этой причине гомополимеры, т. е. полимеры, образованные только из одной аминокислоты, антигенными свойствами не обладают. Эти свойства появляются у полипептидов, в образовании которых участвуют две аминокислоты и более различного строения.
В классической иммунологии словом антиген обозначают в том числе целые клетки бактериального или животного происхождения. С химической точки зрения это неверно, так как клетка состоит из большого числа белков, нуклеиновых кислот, полисахаридов. Каждый из этих полимеров, полученный в очищенном виде, может быть использован для индукции иммунного ответа, специфичного в отношении этого полимера. Рассматривая очищенный биополимер как индивидуальный антиген, любое сочетание последних в какой-либо надмолекулярной структуре, например клеточной мембране, следует характеризовать как семейство индивидуальных антигенов. Этот термин может быть использован и для обозначения спонтанно агрегирующего индивидуального антигена. Так флагеллин — сократительный белок из жгутиков грамотрицательных бактерий рода Salmonellaможет находиться в мономерной форме и в полимеризо-ванном виде. В обоих случаях этот индивидуальный антиген способен индуцировать образование антител, хотя условия для этого различны: мономер флагеллина является тимусзависимым. а полимер — тимуснезависимым антигеном.
Реклама

Несомненно существует связь между молекулярной массой биополимера и его антигенной активностью, но такую связь можно установить, только сравнивая вещества одного класса, например, различные белки с однотипной 'вторичной и третичной структурами: глобулярные или фибриллярные. При соблюдении этих условий удается установить прямую зависимость между молекулярной массой и способностью биополимера индуцировать образование антител. Эта закономерность не абсолютна •и зависит от ряда других свойств антигена, как биологических, так и химических.
Выраженность антигенных свойств белков как наиболее обширного и значимого класса антигенов зависит от того, насколько удалены в эволюционном отношении донор, от которого получен белок, и реципиент, которому этот белок вводят в качестве антигена. Сравнительный анализ будет корректен лишь в том случае, когда для сравнения используют однотипные белки. Так, если иммунизировать мышей альбумином из сыворотки человека и крысы, то на альбумин человека будет более выраженный ответ, чем на альбумин крысы.
В том случае когда биополимер обладает высокой чувствительностью к расщеплению, его антигенные свойства выражены в меньшей степени, чем у более устойчивого к ферментативному гидролизу вещества. Так, при использовании в качестве антигенов синтетических полипептидов или конъюгатов белков с олигопептидами более выраженный ответ получают на полипептид, в состав которого входят неприродные D-аминокислоты.
Иммунный ответ в решающей степени зависит от генотипа реципиента. Эта проблема будет рассмотрена ниже.
Участки молекулы биополимера, его синтетического аналога или конъюгированного антигена, распознаваемые антигенсвязывающими рецепторами В-лимфоцитов и антителами, обозначают как детерминантные группы. В молекуле антигена, как правило, содержится несколько различных по строению детерминантных групп, каждая из которых может повторяться по нескольку раз. Если в молекуле какого-либо вещества существует только одна детерминантная группа определенного строения, образования антител против этой детерминанты не произойдет. По мере увеличения в молекуле антигена числа идентичных детерминантных групп иммунный ответ на эту детерминанту растет, но до определенного предела, вслед за чем снижается и может вовсе не наблюдаться. Это явление было изучено при использовании конъюгированных антигенов с различным числом заместителей, выполняющих функцию детерминантной группы. Исчезновение иммунного ответа на антигены с очень высокой эпитопной плотностью связано с механизмом активации В-лимфоцитов.
Реклама

1. Конъюгированные антигены
Исследование этого класса антигенов сыграло важную роль для понимания организации детерминантных групп природных антигенов, реальной оценки информационной «емкости» иммунной системы в филогенезе и онтогенезе.
Ниже приведен пример синтеза конъюгированного антигена на основе реакции азосочетания диазобензолсульфоновой кислоты с остатками тирозина в молекуле белка, например, бычьего сывороточного альбумина:

При иммунизации кроликов таким конъюгатом образуется несколько видов антител, реагирующих как с белком, так и с остатком сульфаниловой кислоты. Наличие антител к сульфанилату можно установить, синтезировав тест-антиген и аналог детерминантной группы — гаптен.
Тест-антиген получают, конъюгировав с диазобензол-сульфоновой кислотой другой тирозинсодержащий белок; последний не должен иметь сходства антигенной структуры с белком — носителем детерминантной группы, использованным для иммунизации. В избранном нами случае таким белком может быть яичный альбумин. Если при добавлении тест-антигена к исследуемой антисыворотке образуется преципитат, существование антител против сульфаниловой кислоты можно считать доказанным.
Для точной оценки структуры детерминантной группы синтезируют гаптены. В рассматриваемом примере гаптеном послужит конъюгат тирозина с сульфаниловой кислотой. Такой гаптен не преципитирует антител, но, соединяясь с ними, блокирует активные центры. В результате антитела утратят способность взаимодействовать с тест-антигеном. Реакция ингибирования — эффективный метод тестирования антител против простых по химическому строению гаптенов.
Реакцию низкомолекулярного гаптена с антителами можно оценить с помощью прямых реакций, среди которых наибольшее применение получил метод равновесного диализа. Полученные в эксперименте данные позволяют рассчитать константу равновесия в системе гаптен-антитело. Если определять величины константы равнозесия при реакции антител к определенному конъюгированному антигену с рядом сходных по строению гаптенов, можно оценить вклад каждого радикала в структуру детерминантной группы. При этом удобно сопоставлять сродство к антителу какого-то аналога детерминантной группы со сродством наиболее близкого к ней по строению гаптена. Таким способом получают относительную величину константы связывания: ДотН
= = Kx/Kv
.T
, где Кх
— константа связывания исследуемого аналога, Ср
.г
— константа связывания референс-гаптена.
Ниже приведены величины /Сотн
для ряда нитрофе-нильных производных, реагирующих с антителами кролика против динитрофенилированного гемоцианина, т. е. степень сродства антидинитрофенильных антител кролика к различным гаптенам. Антиген получали, модифицируя белок по е-аминогруппам лизина динитрофенилсульфоно-вой кислотой. Поскольку е-динитрофениллизин наиболее близок по строению детерминантной группе использованного конъюгированного антигена, его использовали в качестве референс-гаптена.
Из анализа приведенных ниже данных следует, что антитела распознают как ДНФ-группу, так и аминокислотный остаток, к которому эта группа присоединена. При замене лизина на любую другую аминокислоту сродство антител к гаптеиу резко снижается. Даже в случае использования в качестве гаптена е-динитрофениллизина, в котором взят неприродный оптический изомер, отчетливо заметно снижение константы связывания. Особенно низкая константа связывания найдена в случае отсутствия в молекуле гаптена аминокислотного остатка (динитрофенол). Практически не связываются с изучаемыми антителами мононитрофенильные производные аминокислот. Данные были получены и для других антител к конъюгированным антигенам.

Необходимость стерического соответствия антигенной детерминанты и активного центра — антидетерминанты — антитела со всей очевидностью вытекает, в частности, из того факта, что антитела, направленные к орто-, мета- и пара-аминобензойным кислотам, практически не реагируют перекрестно. Антитела также отчетливо различают право- и левовращающие изомеры виннокаменной кислоты. Менее очевидным является факт строгой специфичности распознавания антителами р-аминобензойной и р-аминофенилсульфоновой кислот:
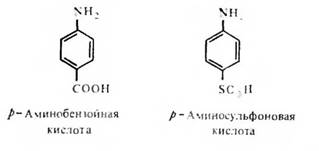
Оба ароматических соединения имеют в параположении отрицательно заряженный заместитель. Заместители отличаются степенью своей нуклеофильности, которая у сульфогруппы ощутимо выше, чем у карбоксильной группы, что приводит к более выраженному смещению облака я-электронов ароматического кольца в направлении заместителя, представленного сульфогруппой в сравнении с карбоксильной группой. Это обстоятельство и различия в размере замещающей группы достаточны, очевидно, для того, чтобы каждое соединение реагировало только с направленным к нему антителом.
Вопрос о размере детерминантной группы конъюги-рованного антигена, вкладе в ее специфичность различных радикалов был изящно проанализирован П. Шехтером. В качестве антигена использовали конъюгаты белка с олиго-О-аланином. Реакцию между антителами к поли-О-аланину и тест-антигеном ингибировали с помощью различных по размеру олигопептидов из D- и L-аланнна. Как оказалось, ингибирующий эффект гаптенов нарастал от ди- к тетра-О-аланнну. Дальнейшее увеличение длины пептида не усиливало его ннгибирующих свойств. Тетра-Ь-аланин был совершенно не активен как ингибитор. Эти данные означают, во-первых, что антитела четко различают олигопептиды из право- и левовращающих аминокислот, не имеющие регулярной вторичной структуры. Во-вторых, очевидно, что активный центр антитела соответствует по размеру тетрапептиду.
Дальнейшие опыты показали, что вклад каждого остатка аланина в связывание тетрапептида антителом далеко не одинаков. Были синтезированы аналоги гаптена, в которых один из остатков аланина заменяли на глицин. В случае замены N-концевого аланина на глицин константа связывания такого гаптена по сравнению с тетрааланином уменьшалась в 100 раз. Напротив, замена С-концевого аналина на глицин почти не сказывалась на величине константы связывания. Поскольку пептиды присоединяли к белку-носителю через С-концевую группу, можно заключить, что решающий вклад в связывание гаптена антителом вносит наиболее удаленный от молекулы белка-носителя участок присоединенного к ней пептида: в рассматриваемом случае метильная группа N-концевого аланина. Такая группа в молекуле гаптена получила название иммунодоминантной.
Таблица 1. Исследование специфичности антител к поли-Ь-алани-ну с помощью тетрапептидов различного строения

Конъюгированные антигены оказались весьма полезными для изучения многих ключевых проблем клеточной иммунологии, вопросов регуляции иммунного ответа.
2. Белки и синтетические полипептиды
Изучение антигенной структуры белков осуществляют с помощью нескольких методов: 1) исследованием продуктов ограниченного протеолиза, 2) химической модификацией различных боковых аминокислотных остатков с последующим анализом антигенного строения образующегося продукта, 3) разрушением присущей данному белку вторичной и третичной структуры. Каждый из перечисленных методов имеет свои ограничения, в силу чего достаточно полная информация о строении детерминантных групп белков может быть получена лищь при сочетании ряда методов.
При расщеплении мономера флагеллина по остаткам метионина с помощью бромциана образуются 4 фрагмента, размер которых
приведен на рис. Фрагмент А, составляющий менее половины молекулы, имеет в своем составе все антигенные детерминанты этого белка, так как полностью ингибирует реакцию антител против нативного флагеллина с нерасщепленным флагеллином. Существенно, что указанный фрагмент в отличие от остальной части молекулы содержит относительно резистентные к действию пепсина и трипсина участки полипептидной цепи. Это согласуется с заключением, согласно которому резистентность к ферментативному гидролизу служит фактором, благоприятствующим проявлению антигенных свойств биополимера.
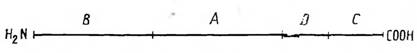
Фрагменты, образующиеся при расщеплении флагеллина бромцианом
У глобулярных белков с большим содержанием а-спиральных участков антигенные детерминанты располагаются в местах изгиба скрученной в спираль цепи. Так, в миоглобине кашалота детерминанты располагаются между остатками 15—29, 56—69, 70—76, 77—89, а также в С-концевой части молекулы. Эти данные были получены при анализе продуктов гидролиза миоглобина трипсином и химотрипсином.
Как и в молекуле миоглобине, у стафилококковой нуклеазы антигенные детерминанты расположены на поверхности молекулы преимущественно в тех участках, где между спирализованными отрезками пептидной цепи находятся неспиралнзованные участки.
При антигенном анализе продуктов протеолиза белков желательно использовать антисыворотки от нескольких животных, полученные в различные сроки после иммунизации. Так, в случае изучения антигенной структуры белка вируса табачной мозаики было установлено, что индивидуальные антисыворотки кроликов реагируют, как правило, с С-концевым декапептидом, но часть антисывороток содержит антитела против N-концевого дека-пептида. Антитела к С-концевому декапептиду от некоторых кроликов взаимодействуют с пептидом, от которого отщеплен С-концевой аргинин, в то время как антитела от других кроликов распознают детерминанту только при наличии С-концевиго аргинина. Для наглядности приводим структуру указанного пептида:
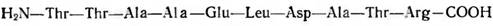
Полученные в ранние сроки после иммунизации антитела кролика против растворимого коллагена из кожи крыс реагируют с детерминантами в С-концевой части молекулы, а «поздние» антитела взаимодействуют также с N-концевым участком.
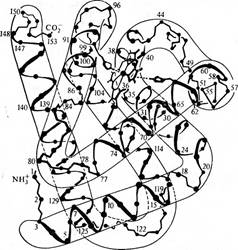
Строение молекулы миоглобина кашалота
При иммунизации кроликов лизоцимом из яиц кур антитела появляются впервые через 10 дней. Но только через 2—3 месяца накапливаются определимые их количества, реагирующие с пептидами, которые включают остатки с 1 по 20 и с 60 по 83, поперечно связанные дисульфидной связью с остатками 123—129.
Закономерен вопрос, нельзя ли избежать отмеченных выше трудностей антигенного анализа, отказавшись от традиционной техники получения антител в результате иммунизации и оперируя вместо этого моноклинальными антителами, полученными с помощью гибридомной техники. Очезидно, что для детального анализа антигенной структуры, например белков, необходимо использование большого числа индивидуальных клонов. Чтобы учесть генетические особенности иммунного ответа индивидуальных реципиентов, придется производить слияние с клетками плазмацитомы лимфоидных клеток от генетически неидентичных особей, отбор которых может быть лишь случайным. Тем самым степень неопределенности задачи не уменьшится.
Продолжив рассмотрение вопроса о строении детерминантных групп белков, проанализируем один из широко применявшихся для этих целей методов, связанных с химической модификацией боковых аминокислотных остатков в глобулярных белках. Такое воздействие оказывает влияние на их антигенные свойства. В результате модификации изменяется, как правило, конформация молекулы. Так, модификация с помощью ангидрида янтарной кислоты 32 и 57 аминогрупп в молекуле бычьего сывороточного альбумина уменьшает способность белка взаимодействовать с антителами на 8 и 65% соответственно. Измерение при этом объема молекулы модифицированного альбумина, оцененное по величине стоксовского радиуса, показало, что в первом случае он возрастает на 27%, а во втором — уже на 78%. Следовательно, увеличение степени гидратации модифицированного белка за счет роста его отрицательного заряда при определенной степени модификации несомненно связано со значительным изменением нативной конформации. Последнее выражается и в разрушении детерминантных групп. То, что это заключение справедливо и инактивация белка как антигена в описанном выше примере не обусловлена лишь замещением аминогрупп, подтверждается данными, полученными при антигенном анализе бычьего сывороточного альбумина, в молекуле которого было амидинировано 58 аминогрупп. При таком способе модификации заряд белковой молекулы не изменяется. Не изменяется при этом и гтоксовский радиус. Антигенная структура модифицированного таким способом белка также практически полностью сохраняется.
Убедительные свидетельства существования как в глобулярных, так и в фибриллярных белках антигенных детерминант, структура которых зависит от пространственной конформации молекулы, были получены при сравнении антигенных свойств нативных и денатурированных белков.
В случае восстановления внутрицепьевых дисульфидных связей в молекуле рибонуклеазы в присутствии концентрированной мочевины такой белок утрачивает, по данным физических методов исследования, нативную конформацию. Одновременно происходит разрушение его антигенных детерминант, поскольку денатурированный белок не реагирует с антителами против нативного белка. Однако восстановление двух из четырех дисуль-фидных связей в молекуле рибонуклеазы, выполненное в отсутствие денатурирующих агентов, не сказывается на антигенных свойствах фермента. Аналогичные данные были получены при изучении пепсина, папаина, иммуноглобулина G. Следовательно, сама по себе дисульфидная связь не определяет структуры антигенных детерминант, если при ее разрыве не разрушают стабилизирующих вторичную и третичную структуру нековалентных связей.
Не только третичная, но и четвертичная структура белков определяет их антигенное строение. Детерминанты, в образовании которых участвуют две или три полипептидные цепи, в том числе цепи различного строения, найдены, в частности, в молекуле гемоглобина, коллагена, иммуноглобулина G. При диссоциации молекулы белка на изолированные цепи такие детерминанты разрушаются. В случае спонтанной рекомбинации пептидных цепей с восстановлением активной конформации восстанавливается также структура антигенных детерминант, в образовании которых участвуют две или 'более цепей.
Даже незначительные изменения конформации белка способны повлечь за собой ощутимые изменения его антигенной структуры. Так, удаление тема из молекулы метмиоглобина приводит к появлению свободного от гена белка — апомиоглобина. Последний отличается от нативного белка уменьшением содержания а-спиральных участков с 56—64 до 42—49%. Одновременно происходит небольшое набухание молекулы, увеличение ее асимметрии. Увеличивается чувствительность белка к протео-лизу, доступность для модификации остатков тирозина и гистидина. Эти и другие данные указывают на меньшую конформационную устойчивость апомиоглобина по сравнению с метмиоглобином. Антитела к метмиоглобину имеют низкую степень сродства к апомиоглобину. Если путем добавления гема к апомиоглобину реконструировать молекулу метмиоглобина, восстанавливается также и его антигенная структура.
Вообще спонтанное восстановление конформации денатурированного белка ведет к восстановлению его антигенной структуры. Это продемонстрировано на совершенно различных по степени сложности структурной организации белках, в том числе на таких, как рибонук-леаза и иммуноглобулин G. Тем самым антигенный анализ может служить одним из надежных методов оценки степени ренатурации белка.
Особо следует рассмотреть вопрос о специфичности антител, образующихся при иммунизации денатурированными белками. Они взаимодействуют только с денатурированным белком, причем антитела к одному из денатурированных белков взаимодействуют с другим денатурированным белком. Это наблюдается и в том случае, когда изучаемые белки в нативном виде не имеют антигенного родства. Здесь надо иметь в виду, что, утратив определенную конформацию вследствие денатурации, белок приобретает некоторую другую конформацию, чаще всего хаотического клубка, которая допускает возникновение у разных белков статистически вероятных пространственных структур, мало зависящих от их первичной структуры. Скорее всего именно благодаря этим структурам возникает антигенное родство различных денатурированных белков.
Конъюгированные антигены, имеющие в качестве детерминантных групп пептиды, например пептиды из D-аланина, индуцируют образование антител, реагирующих с тетра- и даже триаланином. Подобные пептиды не имеют устойчивой конформации. Следовательно, антитела в этом случае распознают лишь определенную аминокислотную последовательность. Такого типа детерминанты, получившие название секвенциальных, по-видимому, крайне редко встречаются в глобулярных белках. Даже короткие отрезки пептидных цепей глобулярных белков, с которыми реагируют антитела, например, С-концевой гептапептид многлобина, имеют определенную пространственную конформацию. Однако в фибриллярных белках есть участки пептидных цепей, лишенные вторичной структуры. Так, большая часть кроличьих антител против гетерологичного коллагена направлена против коротких неспиральных N-концевых участков цепей. Эти антитела реагируют также с N-концевыми участками полипептидных цепей денатурированного растворимого коллагена.
Одним из основных доказательств принадлежности антигенной детерминанты белка к секвенциальному типу служит наличие иммунодоминантной группы в виде концевого аминокислотного остатка. Иммунизируя кролика Fab-фрагментом аутологичного иммуноглобулина G, можно получить антитела, реагирующие только с этим фрагментом, но не с целой молекулой иммуноглобулина. Антитела практически полностью утрачивают способность реагировать с фрагментом после обработки последнего карбоксипептидазой. В использованных для протеолиза условиях от одной из пептидных цепей Fab-фрагмента отщепляется только С-концевой лейцин. Последний служит иммунодоминантной группой детерминанты секвенциального типа, находящейся в С-концевой части фрагмента.
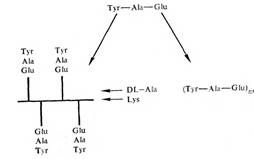
Важным подтверждением существования антител против конформационных и секвенциальных детерминант послужили эксперименты с синтетическими полипептидами, выполненные в лаборатории М. Села. Были использованы два типа пептидов, каждый из которых имел в своем составе трипептид: Туг — Ala — Glu. Один пептид обладал разветвленной структурой, будучи образован сополимером аланина и лизина, к е-аминогруппам которого апериодически были присоединены указанные трипептиды —TAG. Второй пептид представлял собой периодический полимер в форме а-спирали с формулой. Как видно из рис., при различной структуре оба полипептнда имели в своем составе блоки TAG; они характеризовались сходными молекулярными массами.*
Каждый из полипептидов был использован в качестве антигена для иммунизации кроликов. Полученные антитела не реагировали перекрестно со сравниваемыми полимерами. Трипептид—TAG блокировал реакцию между разветвленным полимером —А—L— и антителами к нему, но не влиял на реакцию n
с направленными к нему антителами. В качестве гаптенов — аналогов „ — синтезировали олигопептиды с различным числом регулярно повторяющихся блоков TAG. Выраженной способностью связываться с антителами против „ обладал пептид из 9 блоков, т.е. Разветвленный полипептид на основе поли-D, L-аланина и лизина и периодический полимер
Такой петид еще не формирует устойчивой а-спирали. Но согласно данным, полученным методом циркулярного дихроизма, взаимодействие g с антителами ведет к его спирализации. Следовательно, антитела способны оказать конформирующее влияние на гаптен 13).
Совокупность данных о строении ряда белков, локализации в их молекулах детерминантных групп, общих представлений об организации антигенных детерминант белков позволили синтезировать пептиды, соответствующие детерминантным группам природных белков. Эти пептиды либо индуцировали образование антител, реагирующих с нативным белком, либо реагировали с антителами к нативному белку. Так, периодический полимер из трипептидов: Pro — Gly — Pro, формировавший характерную для коллагена тройную спираль, индуцировал образование антител, реагировавших с коллагеном, выделенным от рыб, крысы и морской свинки. На твердофазном носителе был синтезирован пептид, воспроизводящий последовательность с 64-го по 82-й остатки лизоцима из куриного яйца. Полуцистиновые остатки в позициях 64 и 80 были замкнуты в дисульфидную связь, после чего образовавшуюся петлю присоединяли к носителю в виде линейного полимера. В результате иммунизации таким антигеном были получены антитела, реагировавшие с нативным лизоцимом, а в пределах его молекулы именно с тем участком, который соответствовал синтезированной петле. В свою очередь антитела к нативному лизоциму реагировали с синтезированным пептидом. Восстановление внутрицепьевой дисульфидной связи, превращавшей синтезированный пептид в петлю, так изменяло его конформацию, что он утрачивал способность реагировать не только с антителами против нативного лизоцима, но и с антителами, полученными против того же пептида, но в виде петли. Следовательно, пептид в форме петли представляет собой типичную конформационную детерминанту.
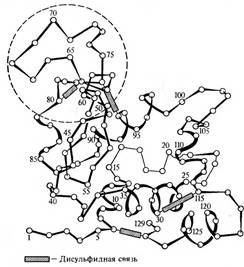
Структура молекулы лизоцима куриного яйца. Окружностью отмечена петля полипептидной цепи, стабилизированная внутрицепьевой дисульфидной связью
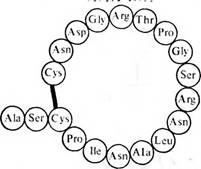
Структура петли молекулы лизоцима
Оцепить размер конформационной детерминанты достаточно сложно. Ее могут образовывать аминокислотные остатки, удаленные друг от друга в первичной структуре, но сближенные в пространстве после образования третичной структуры. Так, замена двух аминокислотных остатков в молекуле легкой цепи иммуноглобулина G человека сопровождается изменением структуры только одной антигенной детерминанты. Указанные остатки находятся в двух различных петлях пептидной цепи, однако они сближены в пространстве таким способом, что контактируют между собой. Из рассматриваемого примера следует, что у конформационной детерминанты есть остов, или каркас, который стабилизирует в пространстве расположенные на поверхности молекулы боковые аминокислотные остатки, определяющие специфичность детерминанты.
Определить размер детерминант секвенциального типа значительно проще, используя, например, технику ингибирования реакции между исследуемым антигеном и антителами к нему с помощью различных по размеру.
Таблица 2. Размер секвенциальных детерминант

|