Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
государственный технический университет
кафедра химической технологии
КУРСОВАЯ РАБОТА
по дисциплине «Общая химическая технология»
на тему: «Производство, технологические свойства и применение фосфорной кислоты».
2007 г.
Введение
Фосфорная кислота имеет большое значение как один из важнейших компонентов питания растений. Фосфор используется растениями для построения своих самых жизненно важных частей - семян и плодов.
Производные ортофосфорной кислоты очень нужны не только растениям, но и животным. Кости, зубы, панцири, когти, иглы, шипы у большинства живых организмов состоят, в основном, из ортофосфата кальция. Кроме того, ортофосфорная кислота, образуя различные соединения с органическими веществами, активно участвуют в процессах обмена веществ живого организма с окружающей средой. В результате этого производные фосфора содержатся в костях, мозге, крови, в мышечных и соединительных тканях организмов человека и животных. Особенно много ортофосфорной кислоты в составе нервных (мозговых) клеток, что позволило А.Е. Ферсману, известному геохимику, назвать фосфор «элементом мысли».
Получение фосфорной кислоты в последнее время превращается в важное звено всей отрасли, связанной с производством удобрении. Известно, что ортофосфорная кислота (Р2
О5
· ЗН2
О) при нагревании подвергается дегидратации, превращаюсь в пирофосфорную кислоту Р2
О5
· 2Н2
О. Дальнейшая дегидратация может привести к образованию триполифосфорной ЗР2
О5
· 5НО и других полифосфорных вплоть до метафосфорной кислоты НРО3
и ее полимеров (Р2
О5 · Н2
О)П
. В производстве эту смесь называют суперфосфорной кислотой. Она содержит до 80% Р2
О5
, что превращает ее в ценное сырье для получения высококонцентрированных фосфорных и сложных удобрений.
Для этих целей ежегодно добывается во всем мире фосфорсодержащей руды около 100 млн. т. Фосфорные удобрения не только способствуют повышению урожайности различных сельскохозяйственных культур, но и придают растениям зимостойкость и устойчивость к другим неблагоприятным климатическим условиям, создают условия для более быстрого созревания урожая в районах с коротким вегетативным периодом. Они также благоприятно действуют на почву, способствуя ее структурированию, развитию почвенных бактерий, изменению растворимости других содержащихся в почве веществ и подавлению некоторых образующихся вредных органических веществ.
Реклама

Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
В 2005 г. мировое производство фосфорной кислоты достигло 34.6 млн. т Р2О5, увеличившись на 3,6% по сравнению с уровнем 2004 г. Мировая торговля фосфорной кислотой в 2005 г. выросла на 3% - до 5,0 млн. т Р2О5.
В период с 2006 по 2010 гг. мировые мощности по производству фосфорной кислоты возрастут, согласно прогнозу, на 5,4 млн. т и достигнут значения в 48.5 млн. т Р2О5 к 2010 г. Основные проекты по их увеличению будут осуществлены в Алжире, Китае, Египте, Марокко, России, Саудовской Аравии и Тунисе.
Мировые поставки фосфорной кислоты оцениваются в 35,4 млн. т в 2006 г. и достигнут 40,7 млн. т Р2
О5
в 2010 (средний ежегодный рост - 3,7%). Принимая в расчёт использование фосфорной кислоты для производства удобрений и в других целях, средняя мировая потребность в ней будет расти на 3,3% в год и к 2010 г. достигнет 38,7 млн. т Р2О5. К 2010 г. превышение предложения фосфорной кислоты над спросом удвоится и достигнет 2,0 мл т Р2
О5
из-за ввода в строй новых мощностей.
По оценке Сельскохозяйственного Комитета IFA мировая потребность в фосфорных удобрениях (Р2
О5
) в 2005 г. календарном году составит 37,7 млн. т Р2
О5
, что на 3% больше уровня 2006 г. К 2010 г. мировая потребность в фосфорных удобрениях должна достичь 41,5 млн. т Р2
О5
(ежегодный прирост после 2007 г. - 2,5%).
Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств.
Реклама

Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
Все это позволяет сделать вывод, что фосфорная кислота является необходимым сырьем не только в химической промышленности, но и в пищевой.
1. Синтез ХТС
1.1 Обоснование создания эффективной ХТС
1.1.1 Производство фосфорной кислоты экстракционным методом
В технологии под фосфорной кислотой подразумевают ортофосфорную кислоту Н3
Р04
(Р2
05
-
ЗН2
0) с содержанием в ней 72,4% Р2
О5
. ортофосфорная кислота представляет собой бесцветные кристаллы с температурой плавления 42,4°С, гигроскопичные и расплывающиеся на воздухе. В переохлажденном состоянии — это густая маслянистая жидкость плотностью 1,88 т/м3
. Смешивается с водой во всех отношениях. При нагревании подвергается дегидратации с образованием полифосфорных кислот различного состава (Р2
О5·n Н2
О), где n<3; пирофосфорной Н4
Р2
О7
(Р2
О5
·2Н2
О), триполифосфорной Н5
Р3
О10
(ЗР2
О5
·5Н2
0) и т.д. Техническая полифосфорная кислота, содержащая 70 - 80% Р2
О5
и известная под названием суперфосфорной кислоты, имеет плотность 1,8 - 2,0 т/м3
и температуру затвердевания 3 - 8°С. Высокое содержание P2
O5
и способность образовывать растворимые комплексные соединения, позволяет использовать суперфосфорную кислоту для получения высококонцентрированных жидких и твердых фосфорных удобрений.
1.1.2 Физико-химические основы процесса
Экстракционный метод производства фосфорной кислоты основан на реакции разложения природных фосфатов серной кислотой. Процесс состоит из двух стадий: разложения фосфатов и фильтрования образовавшейся фосфорной кислоты и промывки сульфата кальция водой.
Сернокислотное разложение фосфата кальция представляет гетерогенный необратимый процесс, протекающий в системе «твердое тело - жидкость» и описываемый уравнением:
Ca5
(PO4
)3
F + 5H2
SO4
+ nH3
PO4
+ 5mH2
O = (n + 3)Н3
РО4
+ 5CaSO4
· mH2
O + HF
Для удобства записи и упрощения расчетов формула двойной соли фторапатита 3Са3
(РО4
)2
·СаF2
записывается в виде Ca5
(PO4
)3
F.
Часть образовавшейся фосфорной кислоты возвращается в процесс. Фактически фосфат разлагается смесью серной и фосфорной кислот. В зависимости от концентрации фосфорной кислоты в системе и температуры образующийся сульфат кальция может осаждаться в виде ангидрита (m = 0), полу гидрата (m = 0,5) и дигидрата (m = 2). В соответствии с этим различают три варианта экстракционного метода производства фосфорной кислоты: ангидридный, полугидратный и дигидратный. В табл. 1. приведены условия разложения фторапатита для каждого из вариантов этого процесса.
Таблица 1
Условия разложения фторапатита
| Тип процесса |
Температура,°С |
Концентрация Р2
О5
в жидкой фазе, % |
Теплота реакции, кДж/моль |
| Дигидратный |
70-80 |
25-32 |
384,4 |
| Полугидратный |
95-100 |
38-48 |
371,0 |
Температурный режим зависит от варианта экстракционного процесса. В дигидратном методе гидратированный сульфат кальция осаждается в форме дигидрата при 70 - 80°С и концентрации кислоты в реакционной смеси 20 -32% Р2
О5
, в полугидратном методе - в форме полугидрата при 90 - 100°С и концентрации кислоты 35 - 42% Р2
О5
.
Высокая степень разложения фосфатов, равная 0,99 дол. ед., достигается всего за 1 - 1,5 часа. Практически процесс экстракции продолжается до 4— 8 часов. Это необходимо для образования крупных кристаллов сульфата кальция, которые легко фильтруются и промываются для извлечения фосфорной кислоты небольшим количеством воды. Образование крупных кристаллов способствует также перемешивание системы, незначительный избыток серной кислоты, снижающий степень пресыщения раствора и постоянство температуры процесса.
Принципиальные схемы производства экстракционной фосфорной кислоты дигидратным и полугидратным методами идентичны. Однако полугидратный метод позволяет получать более концентрированную кислоту (см. табл. 1.); снизить потери сырья и обеспечить более высокие интенсивность и производительность аппаратуры. Принципиальная схема производства экстракционной фосфорной кислоты одностадийным полугидратным методом приведена на рис. 1. На рис. 2 представлена технологическая схема того же процесса.
Рис. 1. Принципиальная схема производства экстракционной фосфорной кислоты
Смесь серной кислоты и оборотного раствора фосфорной кислоты из сборника 2 и фосфат из бункера 1 подают в многосекционный экстрактор 3. По мере движения пульпы в экстракторе образуется фосфорная кислота и завершается процесс кристаллизации сульфата кальция. Из последней секции экстрактора пульпа поступает на трехсекционный вакуум-фильтр 4. Основной фильтрат Ф-1 из первой секции фильтра отводится как продукционная фосфорная кислота, причем часть ее добавляется к оборотному раствору, направляемому в сборник кислоты 2. Осадок кальция на фильтре промывается противотоком горячей водой, при этом промывной раствор Ф-3 используется для первой промывке во второй секции фильтра. Фильтрат первой промывки Ф-2 направляется в виде оборотного раствора в сборник 2.
Образовавшаяся фосфорная кислота (Ф-1) подогревается в подогревателе 5 паром и поступает в концентратор 6, где упаривается до заданной концентрации за счет прямого контакта с топочными газами и направляется на склад. Выделяющиеся из концентратора газы проходят промывной скруббер 7, в котором улавливаются соединения фтора и выбрасываются в атмосферу. Газы, выделяющиеся из экстрактора и содержащие фтористый водород и тетрафторсилан, поступают на абсорбцию в абсорбер, орошаемой водой или разбавленной кремнефтористоводородной кислотой. Основные аппараты в производстве экстракционной кислоты - экстрактор и вакуум-фильтр. Экстрактор - это железобетонный аппарат прямоугольного сечения, разделенный на 10 секций с мешалками, в котором пульпа последовательно перетекает из одной секции в другую. В другом варианте экстрактор составляют два сблокированных стальных цилиндра со многими мешалками. При рабочем объеме экстрактора 730 м3
производительность его равна 340 т/сутки РгО5
при интенсивности около 25 кг/м3
-ч.
Вакуум-фильтры применяют лотковые и ленточные. Лотковые (карусельные) фильтры состоят из 24 лотков (нутч-филътров), каждый их которых при работе фильтра последовательно проходят зоны фильтрации, пульпы, обезвоживания осадка, промывки сульфата кальция и его выгрузки. Фильтрующая поверхность их составляет от 80 до 160 м. Ленточные фильтры представляют бесконечную перфорированную ленту, на которую натянуто фильтрующее полотно. При движении ленты она сообщается последовательно с тремя вакуум-камерами, в которых собираются соответственно основной фильтрат (продукционная кислота), первый и второй промывные фильтраты.
Рис.2 Технологическая схема производства экстракционной фосфорной кислоты полугидратным методом: 1 - бункер фосфата, 2 - сборник серной кислоты, 3 - экстрактор, 4 - вакуум-фильтр, 5 - подогреватель фосфорной кислоты, 6 - концентратор, 7 - промывной скруббер, 8 -сборник промывной жидкости.
Действующие установки по производству фосфорной кислоты полугидратным методом имеют производительность до 350 тыс. тонн в год и характеризуются параметрами:
— температура процесса 80 - 100°С,
— отношение жидкой фазы к твердой 2,5:1,
— исходная концентрация серной кислоты 0,75 масс. долей,
— степень экстракции 0,98 дол. ед.,
— концентрация продукционной фосфорной кислоты 0,45 дол. ед. по Р2
О5
Всем вариантам экстракционного метода производства фосфорной кислоты свойственны общие недостатки:
— необходимость упаривания полученной фосфорной кислоты до концентрации, необходимой в производстве минеральных удобрений,
— сильная коррозия аппаратуры на стадии концентрирования,
— отложение кристаллов сульфата кальция и геля кремниевой кислоты на стенках аппаратуры.
1.2.
Производство фосфорной кислоты электротермическим методом
1.2.1 Физико-химические основы процесса
Электротермический метод производства фосфорной кислоты основан на восстановлении фосфатов до элементарного фосфора, его последующем окислении до оксида фосфора (V) и гидратации оксида до фосфорной кислоты:
Ca5
(PO4
)3
F→ Рn
→ Р2
О5
→ Н3
РО4
.
1. Получение фосфора. Восстановление фосфора из природных фосфатов представляет собой сложный многостадийный гетерогенный процесс, протекающий через стадии:
— нагревание компонентов шихты,
— поступление в расплав фосфата кальция и оксида кремния,
— диссоциация трикалъцийфосфата,
— диффузия продуктов диссоциации к поверхности частиц углерода,
— взаимодействие трикальцийфосфата с углеродом и образование фосфора, оксида углерода (II) и оксида кальция,
— удаление оксида кальция из зоны реакции в виде силикатов кальция.
В отсутствии флюсов реакция восстановления протекает при 1400°С в течение 20 минут. Для снижения температуры процесса и смещения равновесия реакции вправо в систему вводят оксид кремния, оксид алюминия или алюмосиликаты, связывающие образующийся оксид кальция в виде легко удаляемого шлака:
2Ca5
(PO4
)3
F + 15С + 6SiO2
↔ЗР2
+ 15СО + 3(3CaO·2SiO2
) + CaF2
+ DН
DН = 1730 кДж.
В присутствии флюсов реакция восстановления протекает с достаточно высокой скоростью при 1100 - 1300°С. Протекает в диффузионной области и ускоряется факторами, усиливающими диффузию в твердой фазе и в расплаве: повышением дисперсности компонентов шихты, образованием легкоплавких полиэвтектических систем и т.п. Для повышения подвижности расплава и облегчения выгрузки шлаков процесс восстановления ведут на практике при 1500°С.
2. Сжигание фосфора - гетерогенный экзотермический процесс, протекает по уравнению:
Р4
жидк
. + 5О2
газ
= Р4
О10
тв
- DН
DН = 753кДж
Степень окисления фосфора зависит от температуры в зоне горения и от скорости диффузии кислорода к поверхности жидкого фосфора. Чтобы обеспечить полноту сгорания и исключить возможность образования низших оксидов фосфора, процесс ведут при температуре 1000 - 1400°С и двукратном избытке воздуха.
3. Гидратация оксида фосфора (V) протекает через ряд стадии. На первой стадии процесса, вследствие высокой температуры в системе, взаимодействие паров оксида фосфора с водой дает метафосфорную кислоту.
Р4
Н10
+ 2Н2
О = 4НРО3
- DН.
При понижении температуры метафосфорная кислота через полифосфорные кислоты превращается в фосфорную (ортофосфорную) кислоту:
НРОз + Н2
О = Н3
РО4
- DН.
Процесс гидратации димера оксида фосфора (V) является экзотермическим и сопровождается выделением значительного количества тепла, что учитывается при организации этой стадии технологического процесса.
Технологический процесс производства фосфорной кислоты электротермическим методом может строиться по двум вариантам:
—по одноступенчатой схеме, без предварительной конденсации паров фосфора, с непосредственным сжиганием выходящего из стадии восстановления фосфорсодержащего газа;
—по двухступенчатой схеме, с предварительной конденсацией паров фосфора и последующей переработкой его в фосфорную кислоту (рис. 5.):
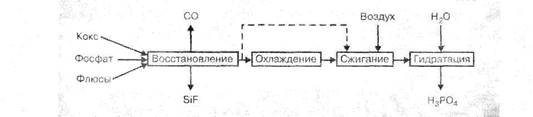
Рис. З. Технологические схемы производства фосфорной кислоты термическим методом: — двухступенчатая, одноступенчатая
При окислении фосфора и гидратации оксида фосфора (V) выделяется большое количество тепла, которое для поддержания оптимального теплового режима процесса должно отводиться из системы.
Наиболее распространены циркуляционно-испарительные схемы, в которых охлаждение газов происходит за счет теплообмена с циркулирующей фосфорной кислотой и в результате испарения из нее воды. Подобная технологическая схема установки производительностью 60 тыс. тонн в год 100% -ной кислоты или 2,5 т/час по сжигаемому фосфору, приведена на рис. 6.
В трехфазную электропечь РКЗ-72 Ф (руднотермическая, круглая, закрытая, мощностью 72 MB. А, фосфорная) с самоспекающимися анодами 1 поступает из бункера 2 шихта, состоящая из фосфата, оксида кремния (кварцита) и кокса. Выходящий из печи газ, содержащий 6—10% фосфора, проходит через газоотсекатель 3 в электрофильтр 4, где из него извлекается пыль. Очищенный газ направляется в конденсаторы - промыватели - горячий 5 и холодный 6, охлаждаемые разбрызгиваемой в них водой, которая циркулирует по замкнутому контуру. Сконденсировавшийся жидкий фосфор собирается в сборниках 7 и 8, откуда поступает в отстойник 9.
Степень конденсации фосфора из газа достигает 0,995. Выходящий из конденсаторов газ, содержащий до 85% об. оксида углерода используется в качестве топлива или сжигается. Шлаки, скапливающиеся в нижней части печи 1, непрерывно скачиваются и используются в производстве цемента и других строительных материалов. Из отстойника 9 расплавленный фосфор подается в башню сгорания 10, где распыляется форсунками в токе воздуха. В башню для охлаждения подается циркуляционная фосфорная кислота, охлаждаемая предварительно в холодильнике 11, часть ее в виде 75%-ной фосфорной кислоты, отводится в качестве продукционной и поступает на склад. Для пополнения в систему вводится необходимое количество воды. Из башни сгорания газ при температуре 100°С поступает в башню гидратации-охлаждения 12, орошаемую фосфорной кислотой, где заканчивается процесс гидратации. За счет орошения температура фосфорной кислоты на выходе снижается до 40 - 45°С. Циркулирующая в башне гидратации кислота охлаждается в холодильнике 13. Из башни гидратации 12 газ направляется в электрофильтр 14. Сконденсировавшаяся в нем из тумана фосфорная кислота поступает в сборник 15, а отходящие газы выбрасываются в атмосферу.
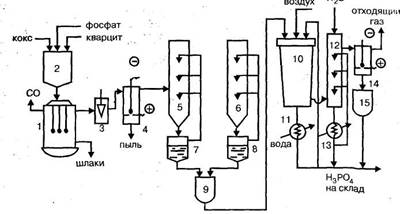 |
Рис. 4. Технологическая схема производства термической фосфорной кислоты двухстадийным методом: 1 - электропечь, 2 - бункер шихты, 3 - газоотсекатель, 4, 14 - электрофильтры, 5 -горячий конденсатор, 6 - холодный конденсатор, 7, 8 - сборник жидкого фосфора, 9 -отстойник жидкого фосфора, 10 - башня сгорания, 11, 13 - холодильники, 12 - башня гидратации, 15 - сборник фосфорной кислоты.
Расход циркулирующей фосфорной кислоты на охлаждение процессов сгорания и гидратации составляет: в башне сгорания 500 - 750 м3
/час, в башне гидратации 150м3
/час.
Основными аппаратами в производстве термической фосфорной кислоты являются башня сгорания (сжигания) и башня гидратации.
Башня сгорания полая, имеет коническую форму, диаметр около 4 м и высота около 14 м. Крышка башни охлаждается водой и имеет форсунку для распыления фосфора. Башня гидратации выполнена в виде цилиндра высотой 15 м и диаметром 3 м и содержит насадку из колец Рашига и три яруса форсунок для распыления кислоты.
По сравнению с электротермический методом производства фосфорной кислоты, экстракционным метод имеет следующие преимущества:
— возможность получения кислоты высокой концентрации, включая полифосфорные кислоты концентрацией до 115% Р2
О5
;
— высокая чистота продукта;
— возможность использования фосфатного сырья с низкой концентрацией фосфора без предварительного обогащения.
Представляет интерес, пока еще теоретический, проблема получения оксида фосфора (V) непосредственно из фосфатов термической диссоциацией трикалийфосфата:
Са3
(РО4
)2
® ЗСаО + Р2
О5
+ DН
по аналогии с промышленным процессом диссоциации карбоната кальция:
СаСОз ® СаО + СО2
+DН, где DН = 178 кДж.
Однако практическая реализация этого метода ограничена чрезвычайно высоким для практического использования значением теплового эффекта и связано с необходимостью обеспечения высоких температур и большой затратой энергии.
1.3. Изображение графических моделей ХТС
Химическая схема ХТС
Ca5
(PO4
)3
F + 5H2
SO4
+ nH3
PO4
+ 5mH2
O =
= (n + 3)Н3
РО4
+ 5CaSO4
· mH2
O + HF.
Смесь серной кислоты и оборотного раствора фосфорной кислоты из сборника 2 и фосфат из бункера 1 подают в многосекционный экстрактор 3. По мере движения пульпы в экстракторе образуется фосфорная кислота и завершается процесс кристаллизации сульфата кальция. Из последней секции экстрактора пульпа поступает на трехсекционный вакуум-фильтр 4. Основной фильтрат Ф-1 из первой секции фильтра отводится как продукционная фосфорная кислота, причем часть ее добавляется к оборотному раствору, направляемому в сборник кислоты 2. Осадок кальция на фильтре промывается противотоком горячей водой, при этом промывной раствор Ф-3 используется для первой промывке во второй секции фильтра. Фильтрат первой промывки Ф-2 направляется в виде оборотного раствора в сборник 2.
Технологическая схема ХТС
Рис.5. Технологическая схема производства экстракционной фосфорной кислоты полугидратным методом: 1 - бункер фосфата, 2 - сборник серной кислоты, 3 - экстрактор, 4 - вакуум-фильтр, 5 - подогреватель фосфорной кислоты, 6 - концентратор, 7 - промывной скруббер, 8 -сборник промывной жидкости
Образовавшаяся фосфорная кислота (Ф-1) подогревается в подогревателе 5 паром и поступает в концентратор 6, где упаривается до заданной концентрации за счет прямого контакта с топочными газами и направляется на склад. Выделяющиеся из концентратора газы проходят промывной скруббер 7, в котором улавливаются соединения фтора и выбрасываются в атмосферу. Газы, выделяющиеся из экстрактора и содержащие фтористый водород и тетрафторсилан, поступают на абсорбцию в абсорбер, орошаемой водой или разбавленной кремнефтористоводородной кислотой. Основные аппараты в производстве экстракционной кислоты - экстрактор и вакуум-фильтр. Экстрактор - это железобетонный аппарат прямоугольного сечения, разделенный на 10 секций с мешалками, в котором пульпа последовательно перетекает из одной секции в другую. В другом варианте экстрактор составляют два сблокированных стальных цилиндра со многими мешалками. При рабочем объеме экстрактора 730 м3
производительность его равна 340 т/сутки РгО5
при интенсивности около 25 кг/м3
-ч.
Операторная схема ХТС
Структурная схема ХТС
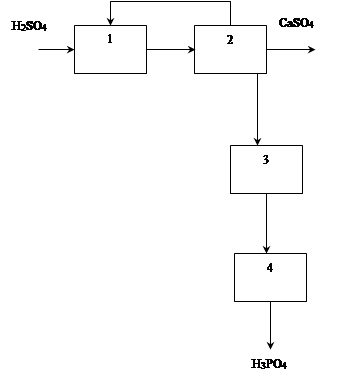
1 - экстрактор, 2 – вакуум-фильтр, 3 – подогреватель фосфорной кислоты, 5 – концентратор
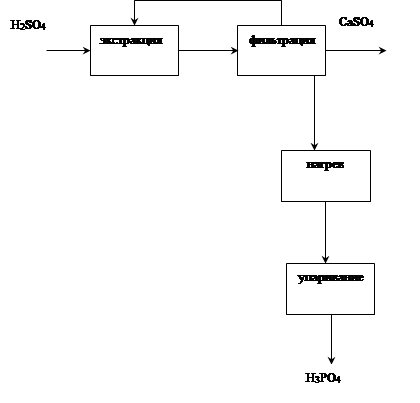 Функциональная схема ХТС Функциональная схема ХТС
Заключение
В данной курсовой работе рассмотрены методы получения экстракционной фосфорной кислоты. Наиболее перспективным является полугидратный способ получения фосфорной кислоты, так как дает возможность получения концентрированной фосфорной кислоты (35-37% Р2
О5
) и увеличение эффективности стадии фильтрации пульпы в 1,5-2 раза по сравнению с дигидратным способом.
В работе представлена характеристика исходного сырья и готовой продукции. Построены химическая, функциональная, структурная, операторная модели ХТС по получению фосфорной кислоты.
Задание
Определить, какое количество апатитового концентрата необходимо для получения 1 тонны 96% фосфорной кислоты, если известно, что апатитовый концентрат содержит 38% пустой породы, а степень его превращения составляет 86%.
Решение:
Для решения данной задачи необходимо сложить следующие реакции:
2Ca5
(PO4
)3
F + 15C + 6SiO2
→ 3P2
+ 15CO + 3(3CaO·2SiO2
) + CaF2
P4
+ 5O2
→ P4
O10
P4
H10
+ 2H2
O → 4HPO3
4HPO3
+ 4H2
O → 4H3
PO4
витогеполучим: 2Ca5
(PO4
)3
F + 15C + 6SiO2
+ P4
+ 5O2
+ 6H2
O → 3P2
+ 15CO + 3(3CaO·2SiO2
) + CaF2
+ 4H3
PO4
1. Рассчитаем количество H3
PO4
:
1 т – 100%
х - 96%
х = 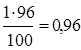 т т
2. Рассчитаем количество апатитового концентрата.
М(4H3
PO4
) = 392
М (2Ca5
(PO4
)3
F) = 1008
х - 1008
0,96 т – 392
х = 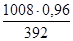 = 2,468 т = 2,468 т
3. С учетом степени превращения получим:
х = 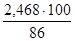 = 2,869 т = 2,869 т
4. Рассчитаем количество апатитового концентрата, с учетом пустой породы: 2,869 т – 62%
х - 100%
х = 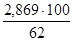 = 4,627 т = 4,627 т
Список используемой литературы
1. Абалонин Б. Е. Основы химических производств: учеб. / Б. Е. Абалонин, И. М. Кузнецова, X. Э. Харламниди. - М.: Химия. - 2001. - 472 с.
2. Балабеков О. С. Очистка газов в химической промышленности. Процессы иаппараты / О. С. Балабеков, Л. Ш. Балтабаев. - М.: Химия. - 1991. - 256 с.
3. Кафаров В. В. Принципы создания безотходных химических производств / В. В. Кафаров. - М.: Химия. - 1982. - 288 с.
4. Кнунянц И. Л. Химическая энциклопедия / И. Л. Кнунянц т. 5. - М.: Советская энциклопедия. – 1988. – 671с.
5. Соколов Р. С. Химическая технология: учеб. пособие для вузов / Р.С. Соколов т. 1. -М.: Владос-пресс. -2000. -516 с.
|