Кафедра
xxx
Аттестационная работа по теме:
«НАНЕСЕНИЕ МЕТАЛЛИЧЕСКИХ ПОКРЫТИЙ ХИМИЧЕСКИМ СПОСОБОМ»
на соискание степени бакалавра по направлению
xxx
«
xxx
»
Москва 2007
ОГЛАВЛЕНИЕ.............................................................................................. 2
1. ВВЕДЕНИЕ............................................................................................... 3
2. ОБЗОР ЛИТЕРАТУРЫ............................................................................. 5
2.1. Подготовка поверхности изделий перед нанесением покрытий.......... 6
2.1.1. Механическая подготовка................................................................... 7
2.1.2. Обезжиривание.................................................................................... 8
2.1.3. Предтравление.................................................................................. 10
2.1.4. Травление.......................................................................................... 10
2.1.5. Обезвреживание................................................................................ 17
2.1.5. Активирование.................................................................................. 18
2.2. Химическое никелирование................................................................. 23
2.2.1. Область применения и условия образования Ni – P–покрытий.
2.2.2. Структура и физико-химические свойства Ni — Р-покрытий........ 31
2.2.3. Технологические процессы осаждения Ni— Р-покрытий.............. 36
2.2.4. Химическое никелирование металлов.............................................. 39
2.2.5. Химическое никелирование неметаллических материалов (пластмасс и неорганических диэлектриков)................................................................... 45
2.3. Химическое кобальтирование............................................................. 50
2.3.1. Краткие сведения о структуре и свойствах Со—Р-покрытий......... 50
2.3.2. Условия образования, структура и свойства Со—В-покрытий.........
2.4. Осаждение никель-фосфорных и кобальт-фосфорных покрытий, легированных другими металлами..................................................................................... 58
Реклама

2.4.1. Ni—Со—Р-покрытия........................................................................ 58
2.4.2. Покрытия Ni—Сu—Р, Ni—Fe—Р, Ni—Re—Р, Ni—Со—Re—Р, Ni—W—Р, Со—W—Р и Ni—Со—W—Р...................................................................... 61
2.4.3. Покрытия Со—Zn—Р, Со—Fe—Р, Со—Re—Р, Со—Сu—Р, Со—Мо—Р, Со—Мn—Р.......................................................................................................... 63
2.5. Химическое меднение........................................................................... 65
2.5.1. Свойства покрытия и условия образования.................................... 65
2.5.2. Составы растворов химического меднения..................................... 68
2.6. Химическое осаждение драгоценных металлов.................................. 74
2.6.1. Химическое серебрение.................................................................... 74
2.6.2. Химическое золочение...................................................................... 77
2.6.3. Химическое палладирование и платинирование............................. 80
2.7. Оборудование для процессов химического осаждения металлических покрытий...................................................................................................................... 83
3. ВЫВОДЫ................................................................................................ 92
СПИСОК ЛИТЕРАТУРЫ........................................................................... 94
Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой. Покрывающий слой наносят различными методами [1]:
· горячее покрытие – кратковременное погружение в ванну с расплавленным металлом;
· изготовление биметаллических листов (железо и медь, алюминий и дюралюминий, углеродистая сталь и нержавеющая сталь и т.п.);
· гальваническое покрытие – электроосаждение из водных растворов электролитов;
· металлизация – напыление [2, 3];
· диффузионное покрытие – обработка порошками при повышенной температуре в специальном барабане;
· с помощью газофазной реакции, например:
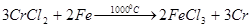 (в расплаве с железом). (в расплаве с железом).
Имеются и другие методы нанесения металлических покрытий. Например, разновидностью диффузионного способа является погружение изделий в расплав хлорида кальция, в котором растворены наносимые металлы. Для изучения экстерьерного характера применяется сусальное золочение и серебрение, наклеивание на поверхность изделия тончайших листочков золота или серебра.
Реклама

Своеобразным способом нанесения металлических покрытий являются металлизация – распыление расплавленной металлической проволоки струей сжатого воздуха.
В настоящее время широкое распространение получили новые технологии нанесения металлических покрытий за счет сверхзвукового удара частиц о поверхность [4, 5, 6]. Ускорение частиц до сверхзвуковых скоростей осуществляется сжатым воздухом. При этом обеспечивается нанесение металлических покрытий из порошковых материалов (алюминиевые, медные, цинковые, никелевые, оловянные, свинцовые, баббитовые) газодинамическим методом.
Преимущества данной технологии: – используется только сжатый воздух и электроэнергия; – нет нагрева и окисления металла частиц и подложки, деформаций, изменений структуры и фазового состава металлов; – нет вредных и агрессивных газов, веществ, излучений и других опасных факторов; – технологическая простота нанесения покрытий, – обуславливают широкое применение данного метода [6].
В крупномасштабном производстве для защиты металлов от коррозии, декоративной отделки изделий, придания поверхности изделий специальных свойств наиболее распространены покрытия, получаемые химическим или электрохимическим методами [1]. Гальванические металлопокрытия пластмасс и других диэлектриков получили широкое распространение для защитно-декоративной отделки разнообразных изделий и для технических целей при изготовлении различных машин и приборов (особенно радиотехнических и электронных). Область и масштабы применения этих покрытий с дальнейшим развитием техники постоянно увеличиваются, поскольку нанесение металлопокрытий позволяет получать материалы с очень ценным сочетанием физико-механических, химических и эксплуатационных свойств металла и диэлектрика в одной и той же детали [7].
Разнообразие современных химических методов нанесения металлических покрытий требует целенаправленного изучения и систематизации информации, накопленной в настоящее время, для оптимизации и дальнейшего эффективного использования, поэтому целью данной работы стал обзор химических методов нанесения металлических покрытий.
Процесс химического металлирования является каталитическим или автокаталитическим, а катализатором является поверхность изделия. Используемый раствор содержит соединение наносимого металла и восстановитель. Поскольку катализатором является поверхность изделия, выделение металла и происходит именно на ней, а не в объеме раствора. В настоящее время разработаны методы химического покрытия металлических изделий никелем, кобальтом, железом, палладием, платиной, медью, золотом, серебром, родием, рутением и некоторыми сплавами на основе этих металлов. В качестве восстановителей используют гипофосфит и боргидрид натрия, формальдегид, гидразин. Естественно, что химическим никелированием можно наносить защитное покрытие не на любой металл.
Металлические покрытия делят на две группы:
- коррозионностойкие;
- протекторные.
Например, для покрытия сплавов на основе железа в первую группу входят никель, серебро, медь, свинец, хром. Они более электроположительны по отношению к железу, то есть в электрохимическом ряду напряжений металлов стоят правее железа. Во вторую группу входят цинк, кадмий, алюминий. Они более электроотрицательны по отношению к железу.
В повседневной жизни человек чаще всего встречается с покрытиями железа цинком и оловом. Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое оловом – белой жестью. Первое в больших количествах идет на кровли домов, а второе – на изготовление консервных банок. Впервые способ хранения пищевых продуктов в жестяных банках предложил повар Н.Ф. Аппер в 1810 году. И то, и другое железо получают, главным образом, протягиванием листа железа через расплав соответствующего металла.
Металлические покрытия защищают железо от коррозии при сохранении сплошности. При нарушении же покрывающего слоя коррозия изделия протекает даже более интенсивно, чем без покрытия. Это объясняется работой гальванического элемента железо–металл. Трещины и царапины заполняются влагой, в результате чего образуются растворы, ионные процессы в которых облегчают протекание электрохимического процесса (коррозии).
Широко распространенный электрохимический способ имеет ряд существенных недостатков, ограничивающих его применение. К ним относятся неравномерность распределения покрытия на деталях сложного профиля, трудности при нанесении покрытия на узлы, элементы которых изготовлены из различных металлов и неметаллов Химический способ нанесения покрытий лишен указанных недостатков наиболее распространенным способом нанесения покрытий, а также химическому меднению, являющемуся основным процессом при металлизации пластмасс. В последнее время практическое применение получили химическое кобальтирование и осаждение некоторых драгоценных металлов. Существуют также многочисленные рекомендации составов растворов для нанесения химических покрытий олова, хрома, свинца и некоторых сплавов.
Подготовка поверхностей перед нанесением металлопокрытий состоит в удалении окалины, жиров, оксидов и заусенцев, облоя и других поверхностных дефектов механическими, химическими и электрохимическими методами, а также включает активацию поверхности различными способами. Таким образом, можно выделить следующие этапы подготовки изделия: механическая подготовка, обезжиривание, предтравление, травление, обезвреживание и активирование [7]. От тщательности проведения этих операций зависит качество покрытия, и в первую очередь сцепление его с основой. Рассмотрим каждый из этапов.
2.1.1 Механическая подготовка.
Механическая подготовка крупных и средних деталей, осуществляемая для получения микрошероховатости поверхности, часто заключается в мокрой или сухой абразивной обдувке сжатым воздухом давлением 0,1 — 0,6 МПа или обработке абразивными кругами и лентами на шлифовально-полировальных станках. Мелкие детали массового производства галтуют с абразивом во вращающихся барабанах или колоколах. Один из современных способов подготовки поверхности изделий – вибрационная обработка (виброгалтовка или виброполировка) – механический или химико-механический процесс сглаживания микронеровностей и съема мельчайших частиц с обрабатываемой поверхности частицами рабочей среды, осуществляющей в процессе работы колебательное движение [8, 9]. Наиболее эффективна виброхимическая обработка [10]. В последнее время в оптической и некоторых других отраслях промышленности находит широкое применение процесс сатинирования – обработки деталей стеклянной пульпой (взвесь стеклянного порошка в воде) в специальных автоматических установках, в результате которого получается матовая, бархатистая поверхность [11].
Обработку производят всухую или в жидкой среде, содержащей раствор щелочи, кальцинированной соды или мыла. Вид обработки зависит от типа обрабатываемой поверхности. Так, в случае диэлектриков в качестве абразива используют кварцевый песок, наждачный порошок, электрокорунд, пемзу и другие материалы. В условиях единичного или опытного производства для обработки применяют шлифовальную шкурку, пемзу, абразивную пасту, стальные щетки и т.п. [7]. В случае металлической поверхности выбирают раствор для обработки в зависимости от типа металла по справочным данным [1].
Способ очистки деталей от жировых загрязнений определяется их природой [12]. Жиры растительного или животного происхождения практически не растворяются в воде, но взаимодействует с растворами щелочей или солей щелочных металлов, образуя растворимые в воде мыла. Жиры минерального происхождения, к которым относятся минеральные масла, консистентные смазки, полировочные пасты и др. в воде также не растворяются. Поэтому для их удаления используют водные растворы поверхностно-активных веществ (ПАВ) или специальные органические растворители. Органические растворители могут быть токсичны, а некоторые из них пожароопасны [13, 14]. После удаления основного количества жировых загрязнений и удаления следов ПАВ или растворителя детали дочищают химическим или электрохимическим способом в щелочных растворах. Под воздействием горячего щелочного раствора, содержащего эмульгаторы и вещества, понижающие межфазное натяжение на границе водный раствор-жир и водный раствор – металл, происходит разрыв жировой пленки, уменьшение ее толщины, образование отдельных капель масла и отрыв их от поверхности металла. При этом одновременно удаляются и мелкие механические загрязнения. Введение в щелочные растворы поверхностно-активных веществ усиливает их эмульгирующее действие и тем самым активно влияет на удаление жировых загрязнений. Современные синтетические ПАВ разделяются на катионоактивные, анионоактивные, неиногенные [15]; к катионоактивным ПАВ относятся соли первичных, вторичных и третичных аминов, четвертичные аммониевые основания и некоторые другие соединения. Они не обладают достаточно хорошими моющими средствами, токсичны и применяются в промышленности ограниченно. К катионоактивным ПАВ относится ОС-20. После обработки деталей в щелочных растворах, содержащих ПАВ, их тщательно и щедро промывают большим количеством воды. Труднее всего смываются растворы кальцинированной соды и едкого натра, затем растворы силикатов и легче всего растворы фосфатов.
При выборе ПАВ необходимо учитывать возможность его обезвреживания в сточных водах. В отличие от биологически жестких ПАВ, выведение которых из стоков затруднено или невозможно (алкил-сульфонаты, ОП-7, ОП-10, сульфонол, НП-1, контакт Петрова) биологически мягкие ПАВ (например, синтанол ДС-10) хорошо поддаются обезвреживанию [12]. После предварительного обезжиривания перед гальваническими операциями детали обычно подвергаются электрохимическому обезжириванию. Эффективность очистки поверхности металла в этом случае определяется электрохимическими процессами при электролизе. Процессы обезжиривания могут быть интенсифицированы применением вибрации, перемешивания, струйной или ультразвуковой обработки [1, 11, 15, 16]. Струйная обработка особенно рекомендуется для очистки крупногабаритных деталей. Эффективность действия ультразвукового поля основана на явлении кавитации [12]. Однако обработка ультразвуком требует значительных мощностей, специального оборудования и дополнительных затрат, что не всегда экономически целесообразно. При этом достигается высокое качество очистки поверхности от химических и механических загрязнений [11].
Используемые при обезжиривании органические растворители можно разделить на две группы – горючие и негорючие. К первой группе относятся нефтяные фракции (нефрасы), бензин, керосин, Уайт-спирит, толуол. Ко второй хлорированные и фторированные углеводороды – трихлорэтилен, тетрахлорэтилен (перхлорэтилен), четыреххлористый углерод, хладоны (в частности фреон-113 – трифтор трихлорэтан). Если применение растворителей первой группы крайне нежелательно по причине их пожароопасности, то растворители второй группы характеризуются еще и значительно лучшим обезжиривающим действием. Обработка органическими растворителями реализована в настоящее время в современном обезжиривающем оборудовании [12].
Распространен метод одновременного обезжиривания и травления, что достигается одновременным введением в растворы для травления ПАВ, которые эмульгируют жировые отложения на поверхности металла [1], что экономически целесообразно, особенно при работе на автоматических линиях [11].
2.1.3. Предтравление.
Непосредственно перед травлением в некоторых случаях выполняют операцию предтравления, которая включает обработку поверхности диэлектрика органическими растворителями, их смесями или эмульсиями, растворами кислот, щелочей, солей. К предтравлению относят также термообработку, облучение, обработку ультразвуком и другие виды воздействия. Предтравление способствует улучшению травимости материала, что приводит к увеличению прочности сцепления его с покрытием, равномерности ее распределения по всей поверхности, уменьшению влияния режима переработки материала в детали. Одновременно снижаются продолжительность (иногда в несколько раз) и (или) температура травления, удлиняется период эксплуатации раствора. Для предтравления полимеров используют отдельные растворители и чаще всего двух- или трехкомпонентные их смеси, в которых хотя бы один растворяет полимер или вызывает его набухание, а другие не взаимодействуют с ним и являются растворителями. Для металлов нет необходимости проводить предтравление [1, 7].
2.1.4. Травление.
Является очень важным этапом при подготовки материала к нанесению металлического покрытия. Механизм травления зависит от типа подготавливаемой поверхности. Так, в случае диэлектриков при травлении изменяются структура и химические свойства поверхности. При этом ей придают требуемые шероховатость, гидрофильность и способность к реакции при выполнении последующих операций нанесения покрытий. В случае металлической поверхности, в зависимости от природы металла, в результате воздействия окружающей среды, а также под влиянием различных обработок в процессе изготовления — механической, термической и так далее, возникают оксидные пленки. Оксидные пленки с металлической поверхности уделяются как химическим, так и электрохимическим способами. Выбор способа и условий травления зависит от природы обрабатываемого металла, толщины и характера пленки, а также от типа обработки изделия до и после травления [1].
Удаляют оксидные пленки с поверхностей металлов в растворах кислот, кислых солей, щелочей и их смесей.
Химическое травление
. Химическое травление черных металлов ведут в основном в растворах серной, соляной и ортофосфорной кислот. Для предотвращения коррозии обрабатываемого изделия в процессе травления в травильный раствор вводят специальные добавки – ингибиторы [17-19].
При травлении в серной или соляной кислоте стальных изделий на их поверхности в ряде случаев образуется шлам, нерастворимый в этих кислотах. Для удаления шлака осуществляют травление при комнатной температуре в равнообъемной смеси серной и соляной кислот либо в растворе, содержащем серную кислоту (30—40 г/л), хромовый ангидрид (70—80 г/л) и хлористый натрий (2—4 г/л), или электрохимическое обезжиривание на аноде в горячем щелочном растворе для получения светлой поверхности на изделиях из углеродистых сталей посте травления их необходимо последовательно обработать в растворах следующих составов: хлорное железо 160—170, соляная кислота 140—150, моющее средство «Прогресс»» 3—5 г/л или фторид аммония 45—50 г/л, пероксид водорода (30 %-ный) 350—370 мл/л, мочевина 45—50 г/л [18].
Травление коррозионностойких сталей проводят главным образом в смесях серной соляной, азотной и плавиковой кислот [19]. В некоторых случаях к этим растворам добавляют соли этих кислот, и в некоторых – с целью интенсификации – травление проводят в ультразвуковом поле [20].
Для снятия травильного шлама с поверхности нержавеющих сталей используются нагретые до 20-30 °С растворы следующих составов, г/л серная кислота 15-30, хромовый ангидрид 70-120, хлорид натрия 3-5 (при τ
=5-10 мин), азотная кислота 350-450 плавиковая кислота 4-5 (при τ
=1-5 мин) [1, 11].
Удаления оксидных пленок с поверхности нержавеющей и быстрорежущей стали, а также титана, можно достигнуть, используя при температуре 370-3800
С расплав едкого натра, в которые введено 1,5-2» гидрида натрия [11].
Химическое травление цветных металлов ведут в разных кислотах или их смесях, а в некоторых случаях и в щелочах, например, при обработке алюминия и его сплавов [21].
Электрохимическое травление.
Электрохимический способ позволяет снизить расход химикатов, сократить продолжительность процесса, почти полностью исключает наводороживаине металла при травлении. Электрохимическое травление металлов ведут преимущественно на аноде при постоянном токе или с применением реверсирования тока
Для электрохимической обработки некоторых металлов предложен ряд растворов [1, 11, 22].
Универсальный электролит для электрохимической обработки тугоплавких металлов – ниобия, хрома, титана и их сплавов имеет состав, % (по массе): плавиковая кислота 3-4, фторид аммония 5-6, нитрат аммония 5-6 этиленгликоль 83-85, вода 8-10 [1, 23].
Таблица 1.
Электролиты и технологические режимы электрохимического травления сталей.
| Обрабатываемые стали |
Концентрация, г/л |
Iа
, А/дм3
|
| Н2
SО4
|
HCl |
HF |
FeSO4
·7H2
O |
NaCl |
| Углеродистые |
1 |
200-500 |
2-1 |
20-25 |
5-10 |
| Кремнистые |
2 |
300-350 |
0,2-0,3 |
5-11 |
| Легированные |
3 |
80-100 |
10-20 |
| 4 |
250-300 |
5-10 |
В табл. 1 приведены наиболее распространенные составы электролитов для электрохимического травления черных металлов [1, 18].
В ряде случаев электрохимическое травление стальных деталей ведут, реверсируя ток, в щелочном электролите следующего состава, г/л; едкий натр 100, триэтаноламин 20, соотношении продолжительности катодного и анодного периодов 4: 4 Выгрузка деталей производится в анодный период [1, 11, 18, 22].
Состав электролита для обработки титана, % (по массе) плавиковая кислота 4-5, фторид аммония 5-6, этиленгликоль 89, вода остальное.
Для ниобия и его сплавов предложены электролиты, % (по массе), серная кислота 10, плавиковая кислота 20, этиленгликоль 70; плавиковая кислота 2, фторид аммония 5-6, нитрат аммония 3-4, глицерин 78-80, вода 8-10 [24].
Последний электролит не оказывает агрессивного воздействия на обрабатываемое изделие и оборудование [25].
Электрохимическую обработку кобальта проводят в электролите состава % (по массе): хлорид кобальта 25, этиленгликоль 72, вода 3 [1].
Для травления диэлектриков наибольшее промышленное применение получили растворы серной кислоты с сильным окислителем, в качестве которого используют прежде всего хромовый ангидрид, реже – бихромат калия или натрия. При травлении сополимеров стирола в этих растворах происходят окисление и удаление полибутадиена (каучука) и внедрение сульфогруппы в поверхностный слой пластика. При этом каркас пластика претерпевает незначительные изменения, выражающиеся в образовании в поверхностном слое углублений шарообразной и овальной формы глубиной от сотых до нескольких микрометров [7].
При травлении полипропилена вытравливаются расположенные в поверхностном слое низкомолекулярные и аморфные участки полимера. Появляющиеся при этом микроуглубления более глубоки и удобны для зацепления с металлом, чем у пластика АБС [23]. Поверхность большинства других диэлектриков разрушается в процессе травления, вследствие чего создается необходимая шероховатость (углубления, раковины, каналы и т. п.).
Хромовая кислота вызывает и окислительную деструкцию полибутадиеновой цепи с образованием СО2
и Н2
О [7, 11].
Серная кислота в растворах травления действует преимущественно как обезвоживающий агент и растворитель окисленных фракций. С увеличением ее концентрации снижается содержание хромового ангидрида в растворе (за счет уменьшения растворимости) и возрастает разрушающее воздействие H2
SO4
на каркас диэлектрика [7, 11].
При содержании в растворе 50 -70 % серной кислоты она с большей скоростью, чем окислитель, разрушает не только каучук, но и каркас пластмассы (в частности, пластика АБС) [25]. В интервале 70 - 80 % наблюдается улучшение травимости, однако поверхность быстро перетравливается, т.е. становится рыхлой, снижается механическая прочность.
Скорость травления возрастает с повышением температуры [7].
На практике для травления сополимеров стирола чаще всего применяют растворы, содержащие 20 - 40 % серной кислоты и 20 -30 % хромового ангидрида [11]. При травлении полиолефинов, полиацеталей, поливинилхлорида и других пластмасс используют насыщенные растворы хромового ангидрида или бихроматов в концентрированных растворах серной кислоты [26].
Для более мягкого действия растворов травления в них иногда добавляют ортофосфорную кислоту, но ее присутствие затрудняет их аналитический контроль [23]. В ряде случаев в раствор вводят и другие добавки для улучшения смачиваемости, активации поверхности, регулирования скорости травления компонентов диэлектрика и др.
Травление поликарбоната и полиэфиров осуществляют также и в растворах, содержащих едкий натр, а силикатных материалов – в растворах, в состав которых входит фтористоводородная кислота и ее соли, преимущественно кислые.
Зависимость между составом раствора, температурой продолжительностью обработки и природой диэлектрика довольно сложная [27]. Поэтому оптимальные состав раствора и режим травления для конкретного диэлектрика в большинстве случаев устанавливают экспериментально с учетом марки и способа его получения, режимов изготовления детали, ее геометрической формы, шероховатости поверхности, продолжительности эксплуатации раствора содержания в нем продуктов реакции, других факторов [1, 23, 24, 27, 31]
Наиболее подходящим для травления пластика АБС-2020 является раствор, содержащий (г/л):
ангидрид хромовый СгО3..........
370—390
кислота серная H2
SO4..................
380—400
(при режиме обработки: температура – 63-680
С продолжительность – 8-15 мин).
Для улучшения смачиваемости пластика в раствор травления вводят 0,5-1,5 г/л препарата «Хромин». С целью отвода продуктов реакции, обеспечения равномерности концентрации С
r
6+
и температуры травление производят при умеренном перемешивании раствора сжатым воздухом [26].
При обработке труднотравимых диэлектриков иногда на их поверхность наносят промежуточное лаковое покрытие, которое подвергают травлению [7].
Корректируют хромовокислые растворы травления путем введения в них требуемого количества хромового ангидрида или бихромата, растворенного в минимальном количестве воды, и серной (или серной и ортофосфорной) кислоты [7, 28].
Способы устранения возможных неполадок, обнаруживаемых на операции травления в хромовокислых растворах, приведены в табл. 2.
Таблица 2
Основные неполадки в работе хромовокислых растворов травления
| Неполадки |
Причина |
Способ устранения |
| После травления поверхность пластика блестящая, не смачивается водой |
Недостаточная продолжительность травления |
Увеличить продолжительность травления |
| Низкая температуры раствора |
Нагреть раствор до требуемой температуры |
| Заниженное содержание компонентов |
Проверить и откорректировать состав раствора |
| Накопление в растворе более 40-50г/л
Сr
3+
или тяжелых металлов свыше 3г/л
|
Регенерировать или заменить раствор |
| Повышенная деформируемость деталей |
Завышена температура раствора |
Проверить температуру и охладить раствор |
Контроль качества травленой поверхности осуществляют визуально или под микроскопом. Оптимально протравленная поверхность полимера остается гладкой на ощупь, теряет блеск и приобретает незначительную равномерную матовость, хорошо смачивается водой и обеспечивает максимальное сцепление покрытия с основой. Под микроскопом она имеет вид губки . Среднеарифметическое отклонение микронеровностей от средней линии R
а
~1 мкм.
Для определения микрошероховатости могут быть использованы различные микроскопы (оптические, металлографические, растровые, электронные сканирующие), а также профилометры и профилографы [29].
2.1.5 Обезвреживание.
Для удаления значительного количества С
r
6+
, остающегося на поверхности диэлектрика после выполнения операций улавливания и (или) промывки, производят обезвреживание, заключающееся в обработке поверхности одним из растворов обезвреживания. При последующем активировании в коллоидном активаторе наиболее часто используют раствор кислоты соляной НС1
(плотность 1,19 г/см3
), 150-500 мл/л. При этом промежуточные промывки между данными операциями не производят (их выполняют перед обезвреживанием), что дает возможность стабилизировать состав раствора активирования.
Если промывные операции после травления не обеспечивают достаточное удаление соединений С
r
6+
, обезвреживание осуществляют в двух растворах, например, натрия пиросульфита Na
2
S
2
O
5
или кислоты соляной НС1
, а затем после промывки – в растворе соляной кислоты.
Хром, оставшийся на поверхности обрабатываемых деталей и приспособлений, способствует снижению стабильности работы последующих растворов, особенно сенсибилизации и химического меднения [30].
Приготовляют составы обезвреживания путем растворения рецептурного количества компонентов в рабочей ванне, заполненной наполовину обессоленной водой, и доведения объема до требуемого.
Корректировать растворы можно по данным химического анализа. Но часто эксплуатируют их до накопления значительного количества С
r
3+
(о чем свидетельствует приобретение бесцветным раствором зеленоватой окраски), после чего заменяют свежими [1, 22].
Активирование металлических поверхностей.
Непосредственно перед осаждением покрытий на детали проводится активирование поверхности с целью удаления тонких окисных пленок. Стальные детали выдерживают в течение 0,1-1,0 мин в 5-10%-ном растворе соляной или серной кислоты, а также в смеси, содержащей по 30-50 г/л каждой из кислот Высококремнистые стали можно активировать в 0,5-1,0%-ном растворе плавиковой кислоты. В случае осаждения на детали из стали 20 медного покрытия из пирофосфатного электролита активирование следует проводить в растворе следующего состава концентрированных кислот (объемная доля, %): азотная - 40, фосфорная - 40, серная – 20 [1].
Особенно большое внимание необходимо обратить на активирование хромоникелевых сталей типа 12Х18Н9Т, характеризующихся высокой пассивностью. Перед серебрением в роданистожелезисто-синеродистом электролите можно проводить химическое активирование в течение 20-30 мин в смеси, состоящей из 100 г/л азотной кислоты и 30 г/л бифторида калия, с последующим катодным активированием в растворе, содержащем 80 г/л хлористого никеля и 40 г/л соляной кислоты. Удовлетворительные результаты дает также анодное активирование в 10-15%-ной серной кислоте в течение 1-2 мин при плотности тока 10-15 А/дм 2
. Для подготовки к осаждению покрытий на нержавеющую сталь и никелевые сплавы, например пермаллой, их можно активировать катодной обработкой в 15-20%-ной соляной кислоте в течение 20-30 с при плотности тока 8-10 А/дм 2
.
Представляет интерес процесс катодного активирования с одновременным осаждением на детали тонкого слоя металла. Хорошие результаты были получены при такой обработке деталей из углеродистой стали перед пирофосфатным меднением. Электролит содержал 250 г/л сернокислого никеля и 50 г/л серной кислоты. Катодная плотность тока 8-10 А/дм2
, продолжительность обработки 20-30 с.
Детали из сплава 40ХНЮ перед их никелированием рекомендуется после обычного активирования в разбавленной соляной кислоте обрабатывать в течение 1—2 мин в смеси (мл): уксусная кислота - 650, азотная кислота (концентрированная) -300, соляная кислота – 5 и краситель метиленовый голубой - 1 г.
Для активирования поверхности деталей из меди и ее сплавов можно использовать 0,5-1,0%-ный раствор соляной кислоты, или смесь, состоящую из 30-50 г/л соляной и 30-50 г/л серной кислоты. Наиболее положительные результаты дает предварительная обработка в 3-6%-ном растворе цианистого калия, но ее можно использовать лишь в тех случаях, когда в дальнейшем на детали наносят покрытие из цианистого электролита. Активацию серебра или серебряных покрытий перед палладированием или родированием проводят в 0,5-1,0%-ном растворе серной кислоты. Повышение концентрации кислоты до 2-3% позволяет использовать такой раствор для активации деталей из алюминия, изготовленных по 1-, 2-, 3-му классам точности.
Хотя удаление тонких окисных пленок с поверхности деталей считается обязательной и необходимой операцией, способствующей прочному сцеплению покрытия с основным металлом, в последнее время исследования показали, что эта цель может быть достигнута иным путем. Иногда на металле формируются тонкие окисные пленки определенной структуры и пористости, присутствие которых не только не ухудшает, но и повышает прочность сцепления покрытия с основой, снижает пористость осадков. Примером эффективности такой обработки являются процессы осаждения металлических покрытий на предварительно оксидированный алюминий. Стальные детали перед хромированием обрабатывают на аноде в течение 0,5—1,0 мин при плотности тока 15—20 А/дм 2
, чугунные — в течение 20—30 с. Анодирование алюминия перед осаждением на него металлических покрытий ведут в 30%-ном растворе фосфорной кислоты при 1,0—1,5 А/дм2
в течение 5—8 мин.
Для анодной обработки стальных деталей перед осаждением на них покрытий предложено использовать растворы следующих составов (г/л): раствор № 1 — серная кислота — 700—800; раствор № 2 — серная кислота — 700—800 и двухромовокислый калий — 20—30. Раствор № 3 приготовляется из концентрированных серной и фосфорной кислот в соотношении 1:1 по объему начальная плотность тока в первых двух электролитах— 10—15 А/дм2
, в третьем— 15—30 А/дм 2
. По мере формирования окисной пленки ток снижается, а напряжение возрастает до 10—15 В. Когда на аноде начинается бурное выделение кислорода, процесс можно считать законченным. При эксплуатации электролитов нельзя допускать разбавления их водой и попадания ионов хлора, так как это приводит к разрушению пассивирующей пленки и травлению металла.
Детали из меди и ее сплавов перед осаждением на них покрытий из цианистых электролитов можно обрабатывать в течение 0,5—1,0 мин на аноде при плотности тока 3—5 А/дм 2
в электролите, содержащем 30—40 г/л цианистого калия и 20—30 г/л углекислого калия.
Активирование диэлектрических поверхностей.
Процесс активирования состоит в получении каталитически активного металла в результате взаимодействия активатора с восстановителем адсорбированным поверхностью в растворе сенсибилизации:
Sn2+
+ Pd2
+->Pd+Sn4+
.
Получаемый при этом металл равномерно распределяется по всей поверхности в виде коллоидных частиц или малорастворимых соединений. Полное превращение таких соединений в металл часто происходит уже в растворе химического покрытия.
Успешное проведение процесса нанесения покрытия обеспечивают частицы палладия диаметром около 0,005 мкм в количестве 10 —15 на 1 мкм2
.
Для активирования широко используют растворы, содержащие 0,01 - 5 г/л двухлористого палладия и 0,25 - 20 мл/л соляной кислоты. Они придают поверхностям высокую каталитическую активность, стабильны в работе, применимы для всех технологических процессов получения химических покрытий. Такие растворы не рекомендуется использовать лишь при обработке комбинированных поверхностей (из металла и диэлектрика), так как вследствие реакции контактного обмена раствор быстро истощается и не обеспечивает прочности сцепления покрытия с металлической основой.
Растворы активирования соединениями серебра находят ограниченное применение. Они малопригодны для активирования поверхности перед химическим никелированием, кобальтированием и другими процессами, не позволяют наносить покрытия без перемонтажа деталей, весьма чувствительны к загрязнению хлор-ионами из ванны сенсибилизации. В связи же с миграцией серебра по поверхности полимерных материалов их не используют при обработкедеталей в радиоэлектронике. Применяют соединения серебра в основном для активации поверхности пластмасс перед химическим меднением. При этом наличие на поверхности бурой окраски, вызванной осадком крупных частиц серебра (0,005 - 0,01 мкм), свидетельствует о качестве активирования [16].
Рекомендуемые составы растворов приведены в табл. 4. Раствор № 1 отличается малой концентрацией и небольшим расходом соли палладия, поэтому его использование более целесообразно, чем раствора №2. После активирования производят промывку в непроточной обессоленной воде для улавливания благородного металла. Затем детали промывают в проточной воде и загружают в ванну химического покрытия.
Таблица 4
Составы (г/л) растворов и режимы активирования
| Компоненты и параметры |
Номер раствора |
| 1 |
2 |
| Палладий двухлористый PdCl2
|
0.1-0.5 |
| Кислота соляная HCl (плотность 1.19г/см3
) |
1-10мл/л |
| Серебро азотнокислое AgNO3
|
2-5 |
| Аммиак водный NH3
H2
O (25%-ный), мл/л |
10-15 |
| Кислотность (оптимальная), рН |
1.5-2.5 |
| Температура, о
С |
18-25 |
18-25 |
| Продолжительность, мин |
1-5 |
1-3 |
При применении раствора № 2 после активирования диэлектрик обрабатывают в растворе, содержащем 50 мл/л 25 %-го раствора аммиака.
Корректируют растворы активирования по данным химического анализа концентрированным раствором активатора.
В растворы активирования не должны попадать ионы железа (Fe3+
), так как они окисляют металлические частицы палладия, разрушая центры катализа.
Химическое никелирование достаточно широко внедряется в гальванотехнику благодаря ценным свойствам покрытия: высокой равномерности, большой твердости, значительной коррозионной стойкости и износостойкости.
Химически осажденный никель обладает более высокими защитными свойствами из-за меньшей пористости, чем электрохимически осажденный никель, а также потому, что осадки, содержащие в своем химическом составе фосфор, более стойки к агрессивным средам, чем чистый никель.
Вследствие своих специфических свойств химическое никелирование находит применение во многих отраслях машиностроения и приборостроения для покрытия металлических изделий сложного профиля (с глубокими каналами и глухими отверстиями), для увеличения износоустойчивости трущихся поверхностей деталей машин; для повышения коррозионной стойкости в среде кипящей щелочи и перегретого пара; для замены хромового покрытия (с последующей термической обработкой химического никеля), чтобы использовать вместо коррозионно-стойкой стали более дешевую сталь, покрытую химическим никелем, для никелирования крупногабаритной аппаратуры, для покрытия непроводящих материалов, пластмасс, стекла, керамики и т.п.
Согласно современным представлениям, суммарный процесс химического никелирования включает в себя, по крайней мере, три реакции-
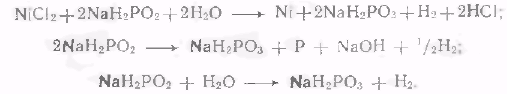
Механизм процесса химического никелирования очень сложен Согласно последним исследованиям [32], механизм реакций при химическом никелировании носит следующий характер.
Первой стадией процесса является реакция взаимодействия гипофосфита с водой. Эта реакция, протекающая на каталитической поверхности, заключается в замене водорода из связи Р – Н в молекуле гипофосфита на группу —ОН из воды. Реакция, описывающая это взаимодействие, выражается уравнением
 (1) (1)
Образующиеся при реакции электрон и адсорбированный атом водорода в условиях кислой и слабощелочной среды взаимодействуют с ионом водорода по реакции
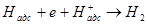
Суммарная реакция взаимодействия гипофосфита с водой соответствует уравнению
 (2) (2)
В условиях щелочной среды (рН> 9) образующиеся при окислении гипофосфита в фосфит электрон и атом водорода из связи Р — Н, взаимодействуя с водой, приводят к молизации по типу электрохимической десорбции:
 (3) (3)
Учитывая, что вторая константа диссоциации нона фосфита достаточно велика, можно полагать, что молизация водорода непосредственно связана с диссоциацией этого иона. В этом случае реакция электрохимической десорбции может быть представлена уравнением:
 (4) (4)
Из уравнения наглядно видно, что процесс окисления гипофосфита водой приводит к снижению рН раствора. Снижение рН раствора может оказаться и результатом непосредственной нейтрализации иона Н2
РО3
-
ионом ОН -
.
При наличии в растворе ионов никеля электроны восстанавливают их до металла:
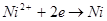
Суммарную реакцию восстановления ионов никеля гипофосфитом можнопредставить в виде следующих уравнений:
 (5) (5)
 (6) (6)
При протекании реакций (5) и (6) могут также идти реакции (2) — (4), которые приводят к снижению коэффициента использования гипофосфита.
Одновременно с восстановлением никеля протекает реакция восстановления гипофосфита до элементарного фосфора. Реакция, приводящая к образованию фосфора, связана с разрывом связей Р — Н, Р — О и Р — ОН в молекуле гипофосфита. Протекание указанной реакции может быть представлено следующим уравнением.
 (7) (7)
Суммарная реакция, включая и реакцию взаимодействия гипофосфита с водой, поставляющую электроны, выразится уравнением:
 (8) (8)
В соответствии с уравнением (7) экспериментально определяется установленная зависимость содержания фосфора в покрытиях от рН раствора, а именно увеличение количества фосфора в осадке с уменьшением величины рН.
Процесс образования Ni — Р-покрытий начинается самопроизвольно только на некоторых каталитически активных металлах. К их числу относятся никель, железо кобальт палладий и алюминий. Однако никелевое покрытие можно нанести и на другие металлы (например, на медь или латунь) если их после погружения в раствор привести в контакт с более электроотрицательным металлом, чем никель (например, с алюминием). В результате контактирования на поверхности покрываемого металла за счет работы возникающего при этом гальванического элемента образуется слой никеля, на котором далее продолжается процесс восстановления.
Для покрытия каталитически неактивных металлов (медь и ее сплавы) был предложен другой метод, который заключается в нанесении на покрываемую поверхность каталитически активного металла (например, палладия). Палладий наносится погружением деталей на несколько секунд в палладиевый раствор. Следует отметить, что на некоторых металлах вообще не удается получить никелевого покрытия. К таким металлам относится олово, свинец, кадмий, цинк, висмут и сурьма.
 Многочисленными исследованиями установлено, что кислые растворы имеют некоторые преимущества по сравнению с щелочными большую устойчивость к высокой температуре, более высокую скорость протекания процесса и лучшее качество покрытий. Однако и щелочные аммиачные растворы представляют интерес в некоторых случаях. Многочисленными исследованиями установлено, что кислые растворы имеют некоторые преимущества по сравнению с щелочными большую устойчивость к высокой температуре, более высокую скорость протекания процесса и лучшее качество покрытий. Однако и щелочные аммиачные растворы представляют интерес в некоторых случаях.
Рис. 2. Влияние температуры на скорость образования покрытия.
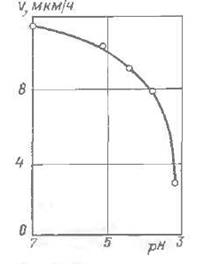
Рис. 3. Влияние кислотности раствора на скорость образования покрытия.
Кислые растворы.
Одним из основных факторов, определяющих процесс никелирования является температура Установлено, что при низких температурах процесс не будет проходить. Из рис. 2 видно, что восстановление никеля возрастает с повышением температуры и в растворах, нагретых до 98-99 °С, достигает максимальных значений.
Значительное влияние на процесс восстановления химического никеля оказывает кислотность раствора. В процессе никелирования происходит самопроизвольное подкисление раствора. Наилучшие результаты в отношении скорости восстановления никеля и качества покрытия получаются при рН 4.5—5.0 [33]. При понижении кислотности раствора до рН 6.0—6.5 скорость осаждения никеля увеличивается, однако поддержание рН на этом уровне затруднено, так как в ходе процесса образуются малорастворимые никелевые соединения (рис. 3).
 При увеличении концентрации гипофосфита от 5 до 10 г/л скорость образования покрытия несколько возрастает, но при концентрации гипофосфита 30 г/л скорость образования покрытия снижается (рис. 3). При увеличении концентрации гипофосфита от 5 до 10 г/л скорость образования покрытия несколько возрастает, но при концентрации гипофосфита 30 г/л скорость образования покрытия снижается (рис. 3).
Рис. 4. Влияние концентрации гипофосфита натрия на скорость образования покрытия.
При исследовании растворов для никелирования с низким содержанием гипофосфита установлено, что изменение концентрации никелевой соли мало отражается на скорости процесса (рис. 4) Соли органических кислот (гликолевой, уксусной и лимонной) оказывают большое влияние на процесс восстановления, так как поддерживают рН при оптимальном значении и влияют на скорость восстановления никеля.
Некоторые исследователи [33] предлагают применять в качестве буферных соединений соли органических двухосновных насыщенных кислот (янтарной, малоновой и глутаровой). Многие работы показывают, что скорость восстановления никеля, а также и качество покрытия зависят в значительной степени от концентрации и природы буферного соединения.
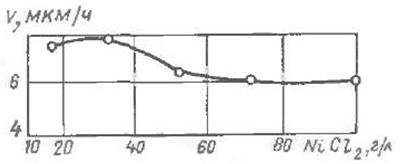
Рис. 5 Влияние концентрации хлористого никеля на скорость образования покрытия.
В силу каталитической природы процесса ничтожные примеси в растворе могут оказывать значительное влияние на его течение. Посторонние вещества попадают в раствор в виде примесей к основным реагентам, и при корректировании раствора концентрация этих примесей может быть столь значительной, что вредно отразится на процессе. Данные исследования [31, 32, 34] показывают, что ничтожные количества ионов роданида и хлористого свинца (0,1 г/л) полностью прекращают процесс как в кислых, так и в щелочных никелевых растворах. Вредное влияние на процесс оказывают соли кадмия, причем в щелочных никелевых растворах в большей степени, чем в кислых никелевых. Присутствие в кислом растворе хлористых солей цинка, магния, алюминия, железа и натрия (до 0,1 г/л) не оказывает заметного влияния на процесс. При повышении концентрации хлористого железа до 3 г/л скорость процесса сильно снижается.
Кроме того, на процесс никелирования могут влиять вещества, образующиеся в результате окислительно-восстановительных реакций (фосфит и кислота) [35]. Так, ионы фосфита образуют нерастворимое соединение — фосфит никеля. Выпадение осадка плохо отражается на скорости процесса и качестве покрытия и затрудняет корректирование раствора. Выпадению фосфита никеля способствуют высокая температура и малая кислотность раствора.
Для предотвращения выпадения осадков фосфита никеля необходимо вводить в раствор вещества, способные образовывать с никелем комплексные соединения и не оказывающие отрицательного влияния на реакцию восстановления [31-35].
Наиболее эффективными комплексообразователями являются глицин и лимоннокислый натрий. Введение в раствор глицина препятствует выпадению фосфита, однако невысокая скорость осаждения никеля в данных условиях вызывает необходимость сочетания этой добавки с другими веществами (например, с уксуснокислым натрием).
Накопление фосфитов в растворе замедляется при использовании не только глицина, но и других аминокислот, α-
аминопропионовой, аминобутиловой, аминоянтарной, аминодиуксусной.
Стабилизаторами растворов могут быть сульфид свинца, тиомочевина, тиосульфат натрия, хромат свинца, сульфид висмута. Действие стабилизаторов основано на том, что они изолируют фосфиты от взаимодействия с раствором. Стабилизаторы адсорбируются предпочтительно на образующихся в ходе реакции частицах коллоидного размера, препятствуя их превращению в центры кристаллизации, на которых бы осаждался никель, тем самым предотвращая разложение раствора Стабилизаторы повышают скорость осаждения покрытий и сокращают расход гипофосфита.
Щелочные растворы
. Основным недостатком щелочных ванн является их неустойчивость, связанная с улетучиванием аммиака при высокой температуре. Кроме того, отмечается пониженная скорость восстановления никеля по сравнению с кислыми растворами. Однако при наличии в составе щелочных растворов таких комплексообразователей, как лимоннокислый натрий и аммиак облегчается корректирование раствора, что позволяет осуществлять длительное ведение процесса.
Многими авторами [31-34, 35] установлено, что изменение концентрации никелевой соли в широких пределах не отражается заметно на скорости восстановления никеля, в то время как изменение концентрации гипофосфита оказывает значительное влияние на процесс никелирования. Однако не рекомендуется использовать растворы с высокой концентрацией гипофосфита (свыше 25-30 г/л) ввиду возможности протекания процесса в объеме раствора с образованием порошкообразного никеля. Высокая концентрация никелевых солей (свыше 50—60 г/л) приводит к ухудшению качества покрытий (появлению шероховатости). Снижение концентрации солей никеля (ниже 20 г/л) и повышение ее (свыше 70 г/л) снижают скорость осаждения никеля.
Так же как и в кислых растворах, большое влияние на ведение процесса оказывает температура раствора. Наибольшая скорость образования покрытия достигается при высокой температуре.
Максимум скорости никелирования получен при концентрации хлористого аммония 25 г/л. Изменение его концентрации менее 20 г/л или более 75 г/л снижает скорость никелирования, а покрытия получаются темными. Аналогично влияет изменение концентрации лимоннокислого натрия. При отсутствии лимоннокислого натрия осаждение покрытия прекращается.
В щелочных и кислых растворах при молярном отношении соли никеля к гипофосфиту, равном 0,5, скорость никелирования при прочих равных условиях существенно возрастает. Для поддержания процесса на постоянном уровне рекомендуется периодически добавлять к раствору расходуемые компоненты (в виде концентрированных растворов) — соль никеля и гипофосфит. Поддержание оптимальной концентрации компонентов щелочного раствора позволяет длительное время сохранять максимальную скорость никелирования на практически постоянном уровне.
2.2.2.Структура и физико-химические свойства
Ni
— Р-покрытий
Осадки никеля, получаемые из кислых растворов, имеют гладкую блестящую поверхность. Покрытия, осаждаемые из щелочных растворов, имеют менее блестящую поверхность. Добавление в растворы блескообразующнх веществ повышает блеск и отражательную способность покрытий. Так, при добавлении солей кобальта в щелочной раствор блеск покрытий по отношению к серебряному зеркалу составляет 40 %, а без добавки кобальта 5%.
Структура.
Установлено, что помимо фазы твердого раствора фосфора в никеле (гексагональная плотная упаковка) существует ряд химических соединений состава Ni3
PNi5
P2
и Ni2
P. Химически восстановленный никель имеет аморфную структуру. При нагревании аморфный осадок переходит в кристаллическое состояние. Так, в процессе нагрева в вакууме при температуре свыше 300 °С происходит превращение исходной структуры в двухфазную, состоящую из фазы Ni3
P и фазы твердого раствора (внедрения) фосфора в β — Ni с гранецентрированной кубической решеткой (ГЦК). С увеличением температуры нагрева количество фазы Ni3
P возрастает за счет распада твердого раствора. Процесс распада β — Ni-раствора и образования Ni3
P необратим [31-36].
В исходном состоянии наблюдается слоистость покрытия. Вопрос о природе слоистости объясняется изменением концентрации фосфора по толщине слоя осадка.
По мере повышения температуры и длительности нагрева частицы химического соединения Ni3
P коагулируют и становятся еще более различимыми. После нагрева до 700 "С и более слоистость в осадках исчезает, происходит дальнейшее укрупнение размеров частиц Ni3
P [35].
При длительной эксплуатации Ni — Р-покрытий в условиях высоких температур наблюдается образование различных зон по сечению осадка: верхняя, средняя и нижняя, прилегающая к основному металлу. Так, после выдержки в течение 500—3000 ч при температуре 600°С наблюдаются коагуляция частиц избыточной фазы и уменьшение их числа в верхней зоне, в то время как в средней зоне обнаруживаются мелкодисперсные частицы Ni3
P. В результате распада и одновременного выделения избытка фосфора из твердого раствора и из фазы Ni3
P может образоваться более богатая фосфором фаза Ni2
P5
, которая также обнаруживается в средней зоне.
Прочность сцепления покрытия с основным металлом.
Прочность сцепления никель-фосфор но го покрытия с основой непосредственно после осаждения сравнительно невелика. На адгезию покрытия влияет не только подготовка поверхности, во и сам раствор. Покрытия из щелочного раствора более прочно связаны с основой, чем из кислого. Однако даже в оптимальных условиях детали, покрытые химическим никелем, не должны испытывать силовых нагрузок при эксплуатации [36, 37].
Термообработка никелированных деталей способствует повышению адгезии покрытия с основой вследствие диффузии никеля и фосфора в основной металл с образованием переходного диффузионного слоя. Максимальная прочность сцепления достигается в результате нагрева покрытия при температуре 400—500 °С в течение 1 ч.
Природа материала основы оказывает определенное влияние на прочность сцепления его с покрытием. При одинаковых условиях термообработки адгезия на образцах из легированных сталей несколько ниже, чем на образцах из углеродистой стали. Удовлетворительная прочность никель-фосфорного покрытия с алюминиевыми и медными сплавами обеспечивается термообработкой при температуре 350 °С с минимальной выдержкой ~30 мин.
Пористость.
Основной характеристикой, определяющей защитные свойства катодных покрытий, является их пористость. В связи с тем, что Ni—Р-покрытия — катодные по отношению ко многим машиностроительным материалам (таким, как сталь, алюминиевые сплавы и др.), исследователи уделяют большое внимание пористости никелевого покрытия, осажденного химически. Установлено, что химические Ni — Р-покрытия менее пористые, чем покрытия той же толщины, но полученные электрохимическим способом. При определении пористости никелевых покрытий различной толщины было обнаружено [2], что химически восстановленные никелевые покрытия толщиной 8—10 мм по пористости соответствовали электролитическим осадкам толщиной 20 мкм.
Защитные свойства.
Защитные свойства Ni—Р-покрытия определяются не только собственной химической стойкостью осаждаемого металла, но и особенностями его строения, а также наличием трещин, пор и других дефектов, изменяющих сплошность покрытия.
В связи с тем, что Ni — Р-покрытие содержит некоторое количество фосфора, химические свойства Ni — Р-покрытия должны отличаться от характеристик чистого никеля. Как уже отмечалось ранее, фосфор в этих осадках находится в виде фосфида никеля, присутствующего в осадке наряду с чистым никелем или твердым раствором фосфора в никеле [38].
Присутствие нескольких фаз в химически осажденном никеле связано с возможностью их различного распределения в осадке а распределение состава осадка зависит от условий проведения процесса и последующей термической обработки. Защитные свойства покрытий, полученных химическим восстановлением из кислых растворов, выше чем осадков из щелочных растворов.
Важное практическое значение имеет способность Ni— Р-покрытий защищать от коррозии основной материал в условиях высоких температур (560—625 °С) и давлений 1250 МПа в воздушной и паровой средах. И в этих случаях защитная способность Ni—Р-покрытий определяется их толщиной и содержанием в них фосфора. Защитные свойства покрытий с 6—12 %-ным содержанием фосфора практически одинаковы, и привес таких образцов почти в 90 раз меньше, чем без покрытий. Недостаточно надежно в данных условиях эксплуатации защищают металл основы покрытия с 3,8—4.2 %-ным содержанием фосфора. На них уже после 500 ч эксплуатации образуется сетка мелких трещин, в которых вскоре обнаруживаются продукты коррозии основного металла (стали) и покрытие отслаивается от основы. Это, по-видимому, связано с повышенной пористостью покрытий содержащих небольшие количества фосфора. Такие покрытия, получаемые из щелочных ванн нецелесообразно использовать для защиты деталей, работающих в условиях газовой коррозии [31].
Микротвердость никель-фосфорных покрытий.
Одной из важнейших эксплуатационных характеристик является твердость никель-фосфорных покрытий. Твердость химически восстановленного никеля выше твердости электрохимически осажденного никеля. Сразу после осаждения микротвердость никель-фосфорных покрытий равна 4500— 5000 МПа, что примерно в 1,5—2 раза выше твердости электролитических никелевых покрытий [35].
Зависимость коэффициентов трения от величины нагрузки при трении стали по бронзе никель-фосфорному и хромовому покрытиям приведена на рис. 5. Как видно из приведенных кривых, возрастание коэффициента трения для никель-фосфорных покрытий наблюдается при повышении нагрузки свыше 6 0, а для хромовых покрытий после 6,5 МПа. Довольно низкие коэффициенты трения ннкель-фосфорных покрытий объясняются, в частности, их хорошей прирабатываемостью. Применение смазочного материала существенно снижает силу трения. Важное значение имеет определение максимальных нагрузок до заедания, выдерживаемых никель-фосфорными покрытиями.
 Рис. 6 Зависимость коэффициента трения μ
стали при трении по бронзе 1
, хромовому 2
и никель-фосфорному покрытию 3
от удельной нагрузки при смазке маслом АМГ 10. Рис. 6 Зависимость коэффициента трения μ
стали при трении по бронзе 1
, хромовому 2
и никель-фосфорному покрытию 3
от удельной нагрузки при смазке маслом АМГ 10.
Магнитные свойства.
Наличие фосфора в никелевом покрытии сильно сказывается на магнитных свойствах покрытия. Магнитные свойства осадков никеля, полученных из кислых и щелочных растворов, определяются технологией их получения, химическим составом и структурным состоянием. Например, магнитные свойства покрытия с 3 %-ным содержанием фосфора приближаются к магнитным свойствам электролитического никеля в то время как покрытие с 11 %-ным содержанием его немагнитно. Термообработанные покрытия при прочих равных условиях более магнитны, чем нетермообработанные.
Температура, при которой осуществляется термическая обработка, имеет большое влияние на магнитные свойства покрытия.
2.2.3 Технологические процессы осаждения
Ni
— Р-покрытий
При нанесении покрытий химическим способом предъявляют повышенные требования к подготовке поверхности покрываемых деталей. Поверхность деталей перед химическим нанесением покрытия подготавливают теми же способами, что и при нанесении гальванических покрытий. Детали обезжиривают в органических растворителях и щелочных растворах; травление осуществляют в кислотах в присутствии ингибиторов коррозии так же, как и активирование. Составы растворов для химического никелирования приведены в ГОСТ 9 047—75. Однако в производственных условиях применяют более широкий ассортимент составов [31, 38, 39].
Основные показатели эффективности растворов — скорость образования покрытий при той или иной плотности загрузки; масса покрытия, полученного из 1 л раствора (т. е. выход металла), стабильность, зависимость этих величин от различных факторов (кислотности, температуры и т. д.).
Кислые растворы (рН 4,0—6,5) применяют при нанесении покрытий на детали из черных и некоторых цветных металлов (медь, латунь и др. ), особенно когда их рабочие поверхности должны иметь высокие твердость, износостойкость и коррозионно-защитные свойства.
С течением времени скорость никелирования в некорректируемых кислых растворах постепенно уменьшается и через 6 ч работы процесс образования покрытий почти прекращается. При этом кислотность растворов возрастает, они мутнеют, на дно ванны выпадает нерастворимый осадок. Перегрев растворов и изменение оптимальной концентрации компонентов приводят к саморазряду и образованию никеля в объеме ванны. Практически установлено, что растворы с янтарнокислым натрием позволяют получать за то же время более толстый слой покрытия чем растворы с уксусно- или лимоннокислым натрием. Кроме того, чем больше плотность загрузки ванны, тем меньше скорость осаждения покрытия за равный промежуток времени.
Необходимо иметь в виду, что поддержание в ходе реакции оптимальной величины рН, например, гидроксилом натрия, мало повышает скорость осаждения химического никеля, что объясняется нарушением оптимальной концентрации его основных компонентов, а также накоплением в растворе побочных продуктов реакции.
Периодическое корректирование кислых растворов гипофосфитом способствует увеличению выхода никеля на 6—12 %. Одновременное корректирование кислых растворов солями никеля и гипофосфитом не дает существенного повышения выхода никеля по сравнению с корректированием одним гипофосфитом.
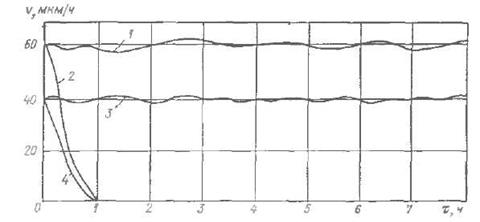
Рис. 7 Зависимость скорости осаждения покрытия от продолжительности никелирования в кислом растворе. 1
– с 15 мг/л сульфида свинца и корректированием; 2
– то же, без корректирования; 3
– с 15 мг/л аллилчепа и корректированием; 4
– то же, без корректирования.
На рис. 6 показана зависимость скорости осаждения покрытия от продолжительности никелирования в кислом некорректируемом и корректируемом растворах с сульфидом свинца в качестве стабилизатора. Для этих целей применяют раствор следующего состава (г/л), хлористый никель 21, гипофосфит натрия 24, уксуснокислый натрий 10, рН 5,2, температура 97—98 °С, плотность загрузки 1 дм2
/л. В обоих случаях начальная скорость никелирования в свежеприготовленных растворах составляет около 60 мкм/ч, однако некорректируемый раствор уже после 1 ч работы почти полностью выработался и осаждение никеля в нем прекратилось. В корректируемом растворе, когда концентрация компонентов и рН поддерживались на оптимальном уровне, такая скорость никелирования сохраняется длительное время. При использовании в том же растворе в качестве стабилизатора 15 м/л аллилчепа (вместо сульфида свинца) скорость никелирования снижается на 20—22 % по сравнению с первым случаем, однако и тогда при помощи корректирования можно использовать раствор длительное время. Применение в кислых растворах указанных стабилизаторов позволяет вести процесс при максимальной температуре и на наибольшей скорости. При этом возможно многоразовое корректирование растворов, что является чрезвычайно важным фактором в производственной практике так же, как возрастание выхода металла из кислых растворов до 50 % [31, 33, 34].
На рис. 7 показана зависимость скорости осаждения покрытия от продолжительности никелирования в растворе с малеиновым ангидридом и без него. Из рисунка видно, что в растворе следующего состава (г/л), сернокислый никель 21, гипофосфит натрия 24, уксуснокислый натрий 10, рН 5.0—5,2 и температура 82—84 °С. при плотности загрузки 1 дм2
/л, содержащем 1.5—2 г/л малеинового ангидрида, скорость покрытия на четвертом часу работы ванны почти в четыре раза выше, чем без этого стабилизатора.
 . .
Рис. 8. Зависимость скорости осаждения покрытия от продолжительности никелирования в водном растворе. 1
– с малеиновым ангидридом (1,5-2,0 г/л), 2
– без малеинового ангидрида.
2.2.4 Химическое никелирование металлов
Химическое никелирование стали, ковара, инвара и суперинвара.
Химическое никелирование указанных металлов и сплавов проводится в кислом гостированном растворе следующего состава (г/л) и режиме осаждения [38]:
Сернокислый или хлористый никель (кристаллогидрат) 20—25
Гипофосфит натрия 25—30
Ангидрид малеиновый 1,5—2,0
Сернокислый аммоний 45—50
Уксусная кислота, мл/т 20—25
рН 5,0—5,5
Плотность загрузки дм2
/л 1.0
Температура. °С 90—95
Скорость осаждения, мкм/ч 18—25
Химическое никелирование указанных металлов и сплавов проводится в щелочном растворе следующего состава (г/л) и режиме осаждения:
Сернокислый или хлористый никель (кристаллогидрат) 20—50
Гипофосфит натрия 10—25
Хлористый аммоний 35—55
Лимоннокислый натрий (трехзамещенный) 35—55
рН 7,5—9,0
Плотность загрузки, дм2
/л . 1—2
Температура, °С 78-88
Скорость осаждения, мкм/ч 8—12
После нанесения покрытия детали подвергают термической обработке при 200—220 °С в течение 1—2 ч для снятия внутренних напряжений. Для повышения твердости покрытия детали нагревают при температуре 400 °С в течение 1 ч.
Снятие недоброкачественного никелевого покрытия производят в растворе следующего состава [31, 38]:
Серная кислота плотность 1,84)части по объему 1
Азотная кислота (плотность 1.4) части по объему 2
Сернокислое железо (окисное), г/л . 5-10
Плотность загрузки, дм2
/л 1
Температура раствора — комнатная.
Для снятия недоброкачественных покрытий можно применять раствор, состоящий из 7 частей по объему азотной кислоты (плотность 1.4) и 3 частей по объему уксусной кислоты (98 %-ной).
Химическое никелирование меди и ее сплавов.
Для никелирования меди и ее сплавов рекомендуют щелочной раствор, применяемый для химического никелирования стали (табл. 5). Корректирование осуществляют концентрированными растворами соли никеля и гипофосфита, а также добавлением аммиака [36]
Таблица 5
Состав и режимы осаждения щелочных растворов с неорганическими добавками
| Номер раствора |
рН |
Температура, о
С |
Скорость осаждения, мкм/ч |
Концентрация компонентов раствора, г/л |
| Хлористый никель (кристаллогидрат) |
Сернокислый никель (кристаллогидрат) |
Гипофосфит натрия |
Хлористый аммоний |
Пирофосфат натрия (калия) |
Сернокислый аммоний |
Гидразинсульфат |
| 1 |
8-9 |
90 |
5 |
30 |
10 |
100 |
| 2 |
10-10,5 |
70-75 |
20-25 |
25 |
25 |
15 |
60-70 |
| 3 |
8,2-8,5 |
85 |
15-18 |
30 |
10 |
30 |
| 4 |
8-10 |
90 |
9-10 |
29 |
13 |
| 5 |
8-11 |
65-75 |
15 |
25 |
25 |
50 |
Снятие недоброкачественного никелевого покрытия осуществляют в растворе такого же состава, как и для стальных деталей.
Химическое никелирование алюминия.
Химическое никелирование алюминия применяют для защиты от коррозии, повышения твердости, износостойкости, электропроводности, обеспечения пайки. Можно рекомендовать щелочной раствор (табл. 5).
Для прочного сцепления химического никеля с алюминием необходимо сделать предварительную двойную цинкатную обработку алюминиевой поверхности
Первая обработка производится в течение 15—30 с при комнатной температуре в растворе содержащем 95—105 г/л окиси цинка и 450—550 г/л гидроксида натрия. После цинкатной обработки слой цинка снимается в растворе, содержащем 300—400 г/л азотной кислоты (плотность 1 4) в течение 15—20с при комнатной температуре, а затем производят повторную цинкатную обработку в том же растворе и по тому же режиму, что и первая.
Для алюминиевых сплавов марок Д1, Д16, АМц перед химическим никелированием на одном из заводов применяют следующую технологическую подготовку: травление в растворе, содержащем 100 г/л гидроксида натрия и 40 г/л хлористого натрия при 60 °С в течение 30 с, осветление в течение 5—10 с в 35 %-ном растворе азотной кислоты; матирование в течение 60 с в растворе, состоящем из 1 части по объему плавиковой кислоты и 2 частей по объему соляной кислоты, активирование в течение 60 с в 5 %-ном растворе соляной кислоты.
Химическое никелирование осуществляют в кислом растворе, содержащем 15 г/л уксуснокислого никеля, 10 г/л гипофосфита натрия, 6,2—6,5 мл/л 98%-ной уксусной кислоты, 0,02—0,03 г/л тиомочевины при температуре 90±2 °С. Плотность загрузки 2дм2
/л, скорость осаждения 10—12 мкм/ч, рН 4,1—4,3. Кроме того, химическое никелирование осуществляется и в щелочном растворе.
После никелирования производят термическую обработку в течение 1—2 ч при 200—220 о
С для снятия внутренних напряжений. Удаление некачественного никелевого покрытия производят электрохимическим способом в растворе, содержащем 1070—1200 г/л серной кислоты и 8—10 г/л глицерина, при комнатной температуре, анодной плотности тока 5—10 А/дм2
, напряжении 12 В, катоды — свинцовые.
Химическое никелирование магниевых сплавов.
Магний и его сплавы относятся к наиболее легким и прочным металлам, поэтому химическое никелирование этих металлов находит большое применение в промышленности. Однако вследствие высокой химической активности магния и его сплавов при подготовке поверхностей изделий к нанесению покрытия возникают определенные трудности [39].
Так как при химическом никелировании одновременно протекают два процесса (травление магния и осаждение никеля), обычные растворы химического никелирования непригодны к использованию.
Перед химическим никелированием изделия из магниевых сплавов травит в 20—30 % ном растворе гидроксида натрия. Состав химического никелирования для магниевых сплавов (г/л):
Никель сернокислый (кристаллогидрат) 20
Гипофосфит аммония 30
Пирофосфорнокислый натрий . 50
Температура раствора, °С 50—70
рН 9—10
После химического никелирования изделия подвергают термической обработке при температуре 150—200о
С в течение 1ч.
Химическое никелирование цинковых сплавов.
Перед химическим никелированием детали обезжиривают в растворе обычного состава, промывают в горячей и холодной воде и обрабатывают в горячем 50 % ном растворе гидроксида натрия в течение 20—30с. Состав раствора для химического никелирования следующий (г/л) [31-34, 38, 39]:
Хлористый (сернокислый) никель (кристаллогидрат) 25—30
Гипофосфит натрия (калия) 25—30
Пирофосфат натрия (калия) 30
Карбонат натрия (калия) 40—45
Температура раствора, °С 45-50
Скорость осаждения, мкм/ч . 10—15
Необходимого значения рН 9,5—10,0 достигают добавлением аммиака.
Основные неполадки при химическом никелировании.
При работе с растворами химического никелирования возникают различные неполадки: осаждение никеля на стенках и дне ванны, отслаивание никелевого покрытия и др., которые нужно устранять. Примеры неполадок и способы их устранения приведены в табл. 6.
Таблица 6
Основные неполадки при химическом никелировании
| Неполадки |
Возможные причины |
Способы устранения |
| Для кислых и щелочных растворов |
| Частичное осаждение никеля на поверхности ванны |
Касание деталями дна или стенок ванны в процессе никелирования |
устранение касания деталями дна или стенок ванны |
| Самопроизвольное осаждение никеля в виде черных точек на деталях и поверхности ванны |
Плохая очистка раствора. Наличие в воде механических загрязнений |
раствор отфильтровать, ванну промыть азотной кислотой, разбавленной 1:1, а затем водой с применением щетки |
| Отслаивание никелевого покрытия |
Плохая подготовка поверхности перед никелированием |
Улучшить подготовку поверхности |
| Наличие непокрытых мест на деталях |
Образование газовых мешков, неравномерное омывание деталей раствором |
Производить встряхивание деталей |
| Для кислых растворов |
| Грубый шероховатый осадок |
рН ниже 3, повышенная температура |
Откорректировать рН добавлением раствора щелочи, снизить температуру |
| Растрескивающийся хрупкий осадок |
рН выше 5,8 |
Подкислить раствор кислотой |
Детали из неметаллических материалов с металлическими покрытиями широко внедряются в автомобилестроение, радиотехническую промышленность и другие отрасли, поэтому вопрос о способах химического осаждения металлов в сочетании с гальваническим является очень современным [37, 40].
Металлизацию производят путем обработки неметаллических деталей в растворах, в которых металлические покрытия образуются в результате восстановления ионов металла, присутствующих в растворе, под действием восстановителей. Полученный тонкий слои восстановленного металла затем доращивают гальваническим способом до необходимой толщины. Xимико-электролитический способ металлизации обеспечивает получение большого количества покрытий по видам и толщинам, не требуя для его выполнения сложного оборудования, дает возможность получить равномерные по толщине покрытия и хорошее сцепление покрытий с основой.
Подготовка поверхности пластмасс.
Химическому осаждению металлов из пластмассы предшествуют операции обезжиривания, травления и активирования. Особенно важна операция активирования ибо в результате ее выполнения на поверхности пластмассы образуются микроскопические зародыши, обычно из палладия или серебра, диаметром в несколько тысячных микрометра которые служат катализаторами последующей реакции химического восстановления металлов.
Подготовку поверхности керамических деталей осуществляют щелочным обезжириванием и тщательной промывкой. Химическая обработка для создания микрошероховатостей не производится, так как поверхность керамических деталей всегда имеет шероховатость.
Химическое восстановление никеля является автокаталитической реакцией, так как металл, образовавшийся в результате химического восстановления из раствора, катализирует дальнейшую реакцию восстановления этого же металла. Но для начального периода восстановления металла необходимо, чтобы покрываемая поверхность имела каталитические свойства, которые создаются в результате выполнения операции, называемой активированием Активирование заключается в том, что на обрабатываемую поверхность химическим путем наносят чрезвычайно малые количества металлов, являющихся катализаторами реакции химического восстановления никеля. Такими катализаторами являются коллоидные частицы или малорастворимые соединения палладия, платины, золота, серебра. Самое широкое распространение получил палладий, обладающий высокой каталитической активностью.
Образование каталитического слоя в виде металла, находящегося в коллоидном состоянии, осуществляется в две стадии.
1) сенсибилизирование — нанесение пленки раствора восстанавливающего каталитический металл (палладий) из раствора его соли,
2) активирование — погружение в раствор соли металла-катализатора и восстановление его до металлического состояния в пленке раствора, прилегающей к поверхности диэлектрика.
Самым эффективным способом сенсибилизации является обработка поверхности в растворе солей двухвалентного олова. Наиболее распространенный раствор состава олово хлористое 20 — 25 г/л. кислота соляная (плотность 1.2) 40—60 мл/л.
Соляная кислота необходима для предотвращения гидролиза хлористого олова и получения стабильного прозрачного раствора, используемого при комнатной температуре. Продолжительность выдержки может колебаться в пределах от 0 5 до 15 мин. После сенсибилизирования необходимо детали промыть в холодной воде, при этом происходит гидролиз хлористого олова по реакции.
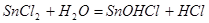
Раствор для сенсибилизации приготовляют и корректируют следующим образом. Расчетное количество хлористого олова растворяют в дистиллированной воде, в которую добавлена соляная кислота в соответствии с рецептурой. Раствор перемешивают, дают отстояться и затем сливают в рабочую ванну. В результате окисления раствора кислородом воздуха происходит частичное образование четырехвалентного олова (Sn4+
), которое весьма склонно к гидролизу в кислой среде, вследствие чего раствор мутнеет. Чтобы избежать этого явления, рекомендуется в раствор опустить несколько гранул металлического олова, в присутствии которого четырехвалентное олово восстанавливается до первоначального двухвалентного состояния:
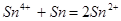
Для качественной оценки пригодности раствора сенсибилизации одну часть данного раствора смешивают примерно с равным объемом свежеприготовленного раствора для активирования. Раствор пригоден к работе, если полученная смесь окрашивается в красный или коричнево-красный цвет. Раствор для сенсибилизации заменяется свежеприготовленным, если он мутнеет или появляется отрицательная реакция с раствором активирования.
Процесс активирования заключается в том, что на поверхности диэлектрика, сенсибилизированной двухвалентным оловом, происходит реакция восстановления ионов каталитического металла (палладия) по реакции: 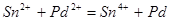
Металлический палладий в коллоидном виде равномерно распределяется тончайшим слоем по всей поверхности обрабатываемой детали.
В настоящее время начинает применяться способ так называемого прямого активирования в растворах, содержащих одновременно соли двухвалентного олова и палладия. Растворы для прямого активирования называют также совмещенными растворами. Применение совмещенного раствора для прямого активирования технологически более перспективно, так как исключает необходимость довольно сложного корректирования двух взаимосвязанных растворов сенсибилизации и активирования и сокращает количество ванн на линиях металлизации.
Механизм процесса активирования в совмещенном растворе достаточно сложен и может быть представлен следующими этапами:
1) заполнение катализатором микровпадин и адсорбция его на поверхности.
2) в результате взаимодействия с водой происходит гидролиз комплексной соли с образованием труднорастворимого Sn(OH)Cl, который захватывает частицы хлористото палладия. Следовательно, на поверхности пластмассы создаются желеобразные частицы из смеси Sn(OH)CI и PdCl2
.
3) обработка в растворе «ускорителя», содержащего 120 г/л бифторида аммония и имеющего кислую среду. В кислой среде Sn(OH)Cl растворяется, в результате чего образуются свободные ионы Sn2+
сразу же вступающие в реакцию с имеющимися на поверхности ионами Pd2+
по реакции 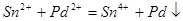 . .
Следовательно, в поверхностном слое будут существовать мелкие частицы металлического палладия, окруженные более крупными частицами гидроокисных соединений четырехвалентного олова.
4) промывка в воде, что помогает удалить частицы гидроокиси четырехвалентного олова, а на поверхности остаются в коллоидном виде адсорбированные частицы металлического палладия.
Очень важное значение в процессах прямого активирования имеют промывочные операции. Увеличение времени промывки может привести к удалению реагирующих компонентов и тогда не будет успешного активирования.
На пластмассы, которые нельзя непосредственно металлизировать, наносят адгезионные слои. В качестве адгезионных слоев без наполнителя используют термореактивные смолы (типа полиамидноэпоксидных, фенолформальдегидных, мочевиноформальдегидных. алкидных, полиамидов, полиэтанов и полиэфиров). Их используют при металлизации изделий из фенольной пластмассы, сополимеров, винилацетата, ацетатцеллюлозы, стекла и стеклотканей. После сушки адгезионного слоя наполнитель вытравливают в соответствующем растворителе, благодаря чему в пленке создаются углубления [41].
После предварительной подготовки детали из неметаллических материалов подвергают химическому никелированию. На ряде предприятий химическое никелирование вытесняет химическое меднение вследствие более высокой скорости осаждения, стабильности раствора и лучшей адгезии его на некоторых пластмассах (например, эпоксидные материалы). В результате активирования частицы металлического никеля становятся в дальнейшем катализаторами процесса никелирования.
Для металлизации диэлектриков можно применять кислые и щелочные растворы [40]. Наиболее популярными для химического никелирования неметаллических материалов являются следующие растворы (г/л):
1) Сульфат никеля (кристаллогидрат) 30
Гипофосфит натрия 10
Ацетат натрия 10
рН 4-6
Температура, °С 90
Скорость никелирования, мкм/ч 4—25
2) Хлорид никеля (кристаллогидрат) 30
Гипофосфит натрия 10
Цитрат натрия 100
Хлористый аммоний до требуемого значения рН 8—9
Температура, °С 90
Скорость никелирования, мкм/ч 6
Для никелирования при комнатных температурах можно использовать аммиачные растворы (моль/л):
Никель сернокислый (кристаллогидрат) 0,1
Гипофосфит натрия 0,2
Хлористый аммоний 9
Аммиак до рН 9
Для никелирования при невысоких температурах предлагаются цитратные растворы (моль/л):
Никель хлористый (кристаллогидрат) 0,5
Гипофосфит натрия 10
Цитрат аммония 0,4
Гидроксид натрия до рН 10.
2.3 Химическое кобальтирование
В связи с повышенными требованиями современной техники к материалам различных приборов и механизмов возникли новые требования в отношении свойств покрытий, в частности магнитных свойств. Эти требования в какой-то степени могут быть удовлетворены с помощью нанесения покрытий химическим способом из растворов, содержащих кобальт. Особое значение для звукозаписи и запоминающих устройств ЭВМ имеют тонкие магнитные пленки, которые получаются путем осаждения Со—Me на металлических и каталитически неактивных материалах [16, 42].
В отличие от процесса химического никелирования, происходящего как в кислой, так и в щелочной среде, благоприятной для восстановления кобальта является только щелочная среда. Помимо соли кобальта и гипофосфита в раствор вводится комплексообразующее вещество для предотвращения выпадения гидроокиси кобальта, а также буферное соединение для поддержания постоянного значения рН.
Восстановление кобальта с достаточной скоростью, как при восстановлении никеля, протекает при повышенных температурах (90— 95 °С). Включения фосфора в покрытия кобальтом оказывают важное влияние на структуру и свойства покрытия, на их магнитные характеристики. Свойства Со—Р-покрытия зависят от физико-химических параметров процесса его получения, таких, как значение рН. состав раствора, температура и др.
Согласно современным представлениям, суммарный процесс химического кобальтирования включает три реакции:
 (9) (9)
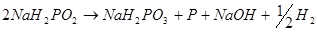 (10) (10)
Одновременно с восстановлением кобальта всегда происходят реакция восстановления гипофосфита до элементарного фосфора (подробно механизм этого процесса разобран в процессе химического никелирования).
Для установления оптимальных условий проведения процесса осаждения Со—Р-покрытий необходимо знать зависимость скорости процесса от температуры рН, концентрации компонентов и др. По данным исследователей [38, 42], возрастание скорости Qосаждения находится в экспоненциальной зависимости от возрастания температуры, подобной зависимости при протекании процесса химического никелирования (рис. 8).
 Рис. 8. Зависимость скорости осаждения Со–Р-покрытий от температуры раствора – рН 8,02. Рис. 8. Зависимость скорости осаждения Со–Р-покрытий от температуры раствора – рН 8,02.
Исследование реакции восстановления кобальта гипофосфитом показало, что и в щелочных растворах изменение рН влияет как на скорость процесса, так и на свойства образующихся покрытий. Таким образом, увеличение рН раствора от 8 до 10 приводило не только к повышению скорости восстановления кобальта от 0 5 до 7,0 мкм/ч, но и к улучшению внешнего вида покрытия.
При дальнейшем повышении рН> 10.5 скорость восстановления кобальта падает, а при рН 12 процесс прекращается. Повышение рН приводит к уменьшению фосфора в покрытии. На оптимальное значение рН раствора, соответствующее максимальной скорости покрытия, влияет концентрация и природа буферного соединения.
Состав раствора химического кобальтирования.
Для восстановления химического кобальта в щелочных растворах требуется более высокая концентрация гипофосфита, чем при химическом никелировании.
Исследования показывают, что зависимость процесса от концентрации гипофосфита проходит через максимум, а величина максимальной скорости и соответствующей ей концентрации гипофосфита находятся в зависимости от состава применяемого раствора и условий проведения процесса. Наибольшая скорость процесса наблюдалась в тартратных растворах, содержащих борную кислоту; в цитратных растворах скорость оказалась меньшей.
 Величина максимальной скорости и соответствующая ей концентрация гипофосфита находятся в зависимости от состава применяемого раствора и условий проведения процесса. При увеличении концентрации кобальта скорость процесса проходит через максимум, положение которого изменяется в зависимости от состава исходного раствора (рис. 9). Величина максимальной скорости и соответствующая ей концентрация гипофосфита находятся в зависимости от состава применяемого раствора и условий проведения процесса. При увеличении концентрации кобальта скорость процесса проходит через максимум, положение которого изменяется в зависимости от состава исходного раствора (рис. 9).
Рис. 9. Влияние рН раствора на скорость осаждения Со–Р-покрытий: 1 – цитратный раствор без добавки Н3
ВО3
; 2 – цитратный раствор с 0,5 моль/л Н3
ВО3
; 3 – тартратный раствор без добавки Н3
ВО3
; 4 – тартратный раствор с 0,5 моль/л Н3
ВО3
.
Для предотвращения выпадения гидроокиси кобальта при химическом осаждении Со—Р-покрытий были подобраны вещества, способные за счет образования комплекса снизить концентрацию свободных ионов кобальта до значений, при которых в данном растворе дальнейшее повышение содержания комплексообразующего соединения не оказывает существенного влияния на скорость.
Соли аммония выполняют не только функцию буферной добавки, но и роль комплексообразующего соединения [42]. Борная кислота в присутствии соли лимонной или винной кислот образует смешанные комплексы с кобальтом, в состав которых входят анионы органической и борной кислот. Соли аммония в кобальтовых растворах, в противоположность их действию в щелочных растворах для никелирования, приводят к снижению скорости покрытия. Оптимальная концентрация солей аммония находится в пределах 25—50 г/л. Использование солей аммония в качестве буферных добавок имеет некоторые недостатки — летучесть аммиака при высоких температурах, а также образование в растворах очень стабильных комплексов с ионами Со2+
. Было также установлено, что борная кислота ускоряет течение процесса в щелочных растворах, содержащих лимонную или винную кислоту, что объясняется ее высокой буферной способностью, обеспечивающей длительное поддержание рН на постоянном уровне. По-видимому, действие борной кислоты не ограничивается ее буферной способностью, а связано с ее влиянием на комплексообразование кобальта в цитратных или тартратных растворах.
Процесс химического кобальтирования более чувствителен к примесям, чем процесс химического никелирования.
Структура Со—Р-покрытий
. Со—Р-покрытия, получаемые при химическом кобальтировании с помощью восстановления гипофосфитом, заметно отличаются по своему фазовому строению от строения Со—Р-сплавов, полученных термическим способом (в виде объемной фазы) [43].
Рентгеноструктурным и электронографическим методами анализа установлено, что Со—Р-покрытия при содержании в них фосфора не более 6 (массовые доли, %) имеют кристаллическое строение и представляют собой твердый раствор замещения фосфора в гексагональном α
-кобальте.
В Со — Р-покрытиях обнаруживается преимущественная ориентация кристаллов текстура и степень совершенства которой зависят от условий их получения и содержания в них фосфора. При поперечном срезе покрытий наблюдают четкую столбчатую структуру, перпендикулярную поверхности основы, а также слоистость, характерную и для Ni—Р-покрытий.
Наиболее четко слоистость выявляется при проведении процесса в растворах с высокой концентрацией гипофосфита и высокой скоростью осаждения (12 мкм/ч). а при более низких концентрациях гипофосфита и более низкой скорости осаждения (~3 мкм/ч) слоистость выражена нечетко. Свойства Со—Р покрытий определяются их структурно-фаговым строением как в исходном состоянии, так и после термической обработки. Чтобы получить сплавы с заданными свойствами, необходимо знать структуру и состав фаз и взаимосвязь их со свойствами осадков, а также режим термической обработки покрытий. Установлено, что до 100 о
С никаких изменений в структуре осадков не происходит. Но в области температур 200—350 о
С происходит процесс распада твердого раствора с последующим выделением фазы интерметаллического соединения Со2
Р. А в области температур 350— 550 °С идет процесс модификационного перехода α
-твердого раствора в β
-твердый раствор, который представляет собой твердый раствор замещения фосфора в решетке гранецентрированного β
-кобальта, причем скорость этого перехода значительно выше скорости выделения фазы Со2
Р особенно в начальный момент перехода.
При 550—600 о
С процессы распада α
- и β
-твердых растворов и выделения фосфида Со2
Р завершаются, и структура Со—Р покрытий представляет собой трехфазную систему, состоящую из соединения Со2
Р и α
- и β
-твердых растворов с равновесной концентрацией в них фосфора.
В связи с развитием вычислительной, информационной техники и микроэлектроники возникают вопросы, связанные с получением тонких ферромагнитных пленок с определенными магнитными характеристиками. При химическом кобальтировании можно получать Со—Р пленки как магнитотвердые, так и магнитомягкие.
2.3.2 Условия образования, структура и свойства Со—В-покрытий
Условия образования Со—В-покрытий аналогичны условиям образования Ni—В-покрытий.
Растворы, содержащие боразотные соединения
. Для проведения процесса в более широком диапазоне температур и рН предложены растворы, содержащие в качестве восстановителя боразотные соединения. Наибольшее применение находят боразаны Н3
N ВН3
. Обычно рН растворов поддерживают ниже значении 6.5—7.0. Понижение до рН 2—3 приводит к резкому разложению самого восстановителя и уменьшает стабильность ванны, при этом образуется порошкообразный осадок в объеме. По мере выделения металла рН раствора постепенно повышается вследствие образования амина из аминоборана. Для предупреждения увеличения рН необходимо подкислять раствор любой неокисляющей кислотой, например соляной или уксусной.
Некоторые компоненты буферных систем могут образовывать в растворе комплексные соединения с ионами кобальта, что желательно при проведении процесса в щелочной среде. Рекомендуется в боро-гидридные растворы на 1 моль соли вводить от 1 до 3 молей натриевой или аммонийной соли гликолевой кислоты.
В зависимости от природы используемого восстановителя рекомендуемая температура раствора может изменяться от комнатной температуры до температуры кипения. Источником иона кобальта являются сернокислая или хлористая соль кобальта в концентрации 0.01 — 1.0 моль/л.
Для получения высококачественных Со—В-покрытий на стали из ванн, характеризующихся высокой стабильностью, рекомендуется использовать раствор следующего состава (г/л): сернокислого кобальта (кристаллогидрат 36.5, диметилборазана 7.5, уксусной кислоты до рН 6.0—7 0, гептаглюконата калия 17.4 (температура 49—57 °С). Способ корректирования раствора при непрерывном ведении процесса нанесения Со—В покрытия аналогичен корректированию раствора Ni — В покрытия.
Структура и свойства Со—В покрытий
. Исследования ИФХ АН СССР показывают, что полученные Со—В покрытия представляют собой сочетания кристаллической и аморфной фаз. Кристаллическая структура представляет собой твердый раствор внедрения бора и водорода в гексагональном α-Со. В процессе нагрева в Со—В-покрытиях протекают необратимые структурно-фазовые превращения с выделением фазы борида Со3
В а области температуры 215°С и фазы Со3
В в области температур 425—460 о
С. Свойства химически восстановленных Со—В-сплавов сильно отличаются как от гальванического кобальта, так и от сплавов Со—Р. Это относится к таким свойствам, как твердость, износостойкость и магнитные характеристики.
Твердость Со—В-покрытий до термообработки составляет 4000—7400 МПа, после отжига в области температур 300 и 500°С твердость увеличивается до 13 000 МПа. Химически восстановленные Со—В сплавы после термообработки рекомендуется использовать в качестве износостойких покрытий.
Включение бора в решетку кобальта вызывает резкое уменьшение величин максимальной и остаточной магнитной индукции кобальта. Наблюдается также изменение магнитных свойств Со—В-покрытия в результате нагревания, поскольку фазы Со3
В и Со2
В характеризуются низкими значениями ферромагнитных характеристик, после отжига наблюдается значительное возрастание коэрцитивной силы Со—В-покрытий от 640 до 1280 А/м.
2.4.1.
Ni
—Со—Р-покрытия
Для решения ряда технологических задач необходимо расширить диапазон эксплуатационных свойств Ni—Р и Со — Р-покрытий, легируя их другими металлами.
Наибольший интерес из тройных сплавов представляет система N1 — Со — Р которая получила широкое применение в электронной радиотехнической промышленности [43]. Получение осадков, включающих одновременно никель и кобальт, возможно в щелочных аммиачных растворах, содержащих растворимые соли как того, так и другого металла.
Приведем один из составов растворов, в котором можно осаждать Ni—С—Р-покрытие (г/л):
Хлористый никель (кристаллогидрат) 25
Хлористый кобальт (кристаллогидрат) 25
Гипофосфит натрия 24
Хлористый аммоний 30
Лимоннокислый натрий 45
Аммиак (25 %-ный), мл/л 50—60
рН 8,3—8,5
Осаждение производится при температуре 90—92°С. Скорость осаждения Ni — Со — Р-покрытия соизмерима со скоростью осаждения Ni—Р-покрытия. Скорость образования сплава возрастает экспоненциально с увеличением температуры; содержание кобальта при этом увеличивается. Заметное влияние на состав Ni-—Со—Р-покрытия оказывает изменение концентрации аммиака в растворе; с ростом концентрации аммиака происходит обогащение сплава кобальтом.
В литературе [16] отмечается, что применение сульфатов никеля и кобальта предпочтительнее, чем хлоридов, поскольку скорость образования покрытия в первом случае выше, а сами осадки получаются более блестящими.
На рис. 10 приведена зависимость скорости осаждения и состава сплава от содержания гипофосфита.
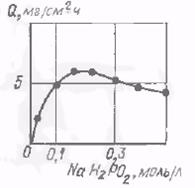
Рис. 10. Зависимость скорости осаждения Ni—Со—Р-покрытия от концентрации гипофосфита натрия в растворе.
Применение борной кислоты в отличие от хлористого аммония позволяет получать Ni—Со—Р-покрытия с достаточной скоростью (10—15 мкм/ч) и с высоким содержанием (массовая доля %) 60—80 кобальта. Скорость образования Ni—Со—Р-покрытия линейно возрастает с увеличением концентрации сернокислого аммония (до 40 г/л). Составы растворов, применявшиеся для этой цели, представлены в табл. 7.
Таблица 7.
Составы растворов для получения Ni—Со—Р-покрытий в виде тонких пленок
| Номер раствора |
Температура, оС |
| Сульфат кобальта (кристаллогидрат |
сульфат никеля (кристллогидрат) |
Хлорикобальта (кристаллогидрат) |
Хлорид никеля (кристаллогидрат) |
Гипофосфит натрия |
Лимоннокислый натрий |
Хлорид аммония |
Аммиак |
| 1 |
0,05 |
0,05 |
0,2 |
0,2 |
0,5 |
| 2 |
0,004 |
0,004 |
0,1-0,2 |
0,2 |
0,2 |
Скорость образования покрытий значительно увеличивается с увеличением концентраций гипофосфита, однако в этих условиях возможно восстановление сплава в объеме раствора. Саморазложение раствора предотвращается насыщением его кислородом или введением тиомочевины.
Непосредственно после осаждения Ni—Со—Р-покрытия имеют малую твердость и слабое сцепление с основным металлом. Но их твердость и адгезия повышаются после часового нагрева. При 350—400 °С — для стальных и медных деталей и при 200 — 220 °С — для алюминиевых В исходном состоянии твердость покрытий не зависит от химического состава осадка и составляет 5000—5500 МПа. С повышением температуры отжига твердость этих сплавов растет, достигая максимального значения 5500 МПа после отжига при 300—350 °С. При дальнейшем отжиге твердость покрытий уменьшается.
Раствор корректируется теми же методами, что и для Ni — Р-покрытий. Ni — Со — Р-покрытия можно осаждать на детали из железных, медных и алюминиевых сплавов, а также из неметаллов. Покрытия блестящие, светлые с серебристым оттенком, типичная для никелевых осадков желтизна отсутствует
Магнитные свойства
. Радиоэлектронная промышленность и некоторые отрасли приборостроения нуждаются в покрытии с самыми разнообразными магнитными свойствами. Эти требования в ряде случаев могут быть удовлетворены путем использования Ni—Со—Р-покрытий, которые в зависимости от условий их получения, состава и структуры способны проявлять свойства как магнитомягких, так и магнитотвердых материалов. Первые находят применение для элементов оперативной памяти электронно-счетных устройств, а вторые используются для записи звука. Для элементов оперативной памяти ЭВМ используют Ni—Со—Р-покрытия в тонких слоях.
Большое влияние на магнитные свойства Ni—Со—Р-пленок оказывают природа и характер подготовки поверхности, на которую наносятся покрытия
2.4.2.Покрытия N
i
—С
u
—Р,
Ni
—
Fe
—Р,
Ni
—
Re
—Р,
Ni
—Со—
Re
—Р,
Ni
—
W
—Р, Со—
W
—Р и
Ni
—Со—
W
—Р
Ni—Сu—Р-покрытие можно получить из раствора содержащего (г/л): хлористый никель 20, гипофосфит натрия 20, лимоннокислый натрий 50; хлористый аммоний 40; сернокислая медь 1,6; рН 8,8—9,0; t=80°С. Введение в раствор сернокислой меди увеличивает Нс
до 960 А/м (вместо 560 А/м в осадке, полученном из раствора без сернокислой меди) и снижает магнитную индукцию. При дальнейшем увеличении концентрации меди содержание фосфора в покрытиях превышало 12 % и они были немагнитны [43].
Ni
—
Fe
—Р-покрытия
. Эти покрытия являются магнитомягкими и применяются в виде двухслойных пленок. Первый слой толщиной до 0,1 мкм содержит до 70% никеля и 30 % железа и получается из раствора, содержащего (г/л): хлористый никель 30; хлористое железо 20; сегнетова соль 50; гипофосфит натрия 25.
Ni
—
Re
—Р- и
Ni
—Со—
Re
—Р-покрытия
. Эти покрытия можно получить из кислых растворов (рН=5) при температуре 90-92о
С. Один из рекомендуемых растворов содержит (г/л): хлористый никель 21, перренат калия 3,0, уксуснокислый натрий 10, гипофосфит натрия 24. Из этого раствора за 30 мин можно осадить покрытие толщиной 10 мкм. Покрытия получаются блестящие гладкие, равномерные, с серебристым отливом. Прочность сцепления с основой может быть увеличена с помощью термообработки при температуре 350°С Одновременно увеличивается микротвердость покрытий. Так, без термообработки микротвердость составляет 4760 МПа, а после часовой термообработки при 350°С микротвердость составляет 6440МПа, максимум микротвердости соответствует термообработке при 500 о
С и равняется 8660 МПа. Износостойкость этих покрытий несколько ниже, чем Ni—Р-покрытий. Введение рения в такое покрытие существенно повышает коррозионную стойкость этого покрытия. Добавление в растворы для получения Ni—Со—Р-покрытий перрената калия позволяет получать Ni—Со—Re—Р-покрытия. Коррозионная стойкость такого покрытия выше, чем у Ni—Со—Р-покрытий.
Значительный интерес представляет покрытие Со—W—Р. С увеличением концентрации вольфрамовокислого натрия скорость образования покрытия немного снижается. При этом содержание вольфрама в сплаве увеличивается от 6.4 до 8 3 (массовые доли %), в то время как фосфор уменьшается от 2.6 до 1,6 (массовые доли. %) (концентрация хлористого кобальта в этом случае составляла 36 г/л) Покрытия в этих условиях получались блестящими.
Исследования показывают, что при получении Со—W—Р-сплавов можно вести процесс в течение 5—6ч с относительно постоянной скоростью.
Покрытия
Ni
—
W
—Р, Со—
W
—Р и N
i
—С
o
—
W
—Р.
Структура и свойства. В результате рентгеноструктурных исследований было установлено, что покрытия Со—W—Р в исходном состоянии представляют собой твердый раствор замещения W и Р в решетке гексагонального α-Со. При нагреве до 100°С никаких изменений в структуре и свойствах покрытий не происходит. В области температур 250—450 °С протекает процесс распада α-твердого раствора при одновременном образовании фазы Со2
Р. В области температур 450—600 °С происходит переход гексагонального α-Со в кубический гранецентрированный β
-Со и распад β
-твердого раствора с выделением фазы Cо3
W. При нагреве покрытий выше 600 °С идут процессы коагуляции и рекристаллизации частиц образовавшихся фаз.
Микрофотографии шлифов поперечного среза покрытий дают четкую столбчатую структуру с характерной слоистостью. В соответствии со структурно-фазовыми превращениями находятся и изменения свойств покрытий. Это наглядно видно на кривых зависимости твердости от температуры отжига. Повышение твердости покрытий после отжига в области температур 200—400 °С и 500—600 °С связано с выделением фазы Со2
Р и Co3
W соответственно.
2.4.3 Покрытия Со—
Zn
—Р, Со—
Fe
—Р, Со—
Re
—Р, Со—С
u
—Р, Со—Мо—Р, Со—М
n
—Р
Со—
Zn
—Р-покрытие
. С точки зрения магнитных характеристик значительный интерес представляют пленки сплава Со—Zn—Р. Эти пленки наносились как на лавсановую основу, так и на образцы из латуни. Поверхность лавсановой пленки активировалась путем последовательной обработки в растворах хлористого олова и хлористого палладия. Латунь обрабатывалась только в растворе хлористого палладия. Нанесение покрытия осуществлялось в растворе следующего состава (г/л): хлористый кобальт 7.5, гипофосфит натрия 3 5, лимонная кислота 20. хлористый аммоний 12,5; хлористый цинк 0.1: рН 8.2, температура 80 °С.
Содержание цинка в покрытиях увеличивается линейно с повышением концентрации хлористого цинка в растворе, находясь в пределах 0—4 (массовые доли. %), при этом содержание фосфора остается постоянным (~4 массовые доли. %). Полученные покрытия были блестящими и обнаруживали хорошую адгезию с металлом основы .Микроструктура поперечного среза Со—Zn—Р покрытия обнаруживает слоистость. Твердость покрытий составляет 3500— 4000 МП а.
Наибольшее внимание уделялось изучению магнитных свойств Со—Zn—Р пленок.
Коэрцитивная сила химически восстановленных Со—Zn—Р-пленок, полученных на лавсане, зависит от их толщины; она увеличивается до максимума 77-103
— 88-103
А/м. При толщине 0,02 мкм и далее с ростом толщины пленки уменьшается; она мало изменяется с увеличением концентрации цинка в пленке. Прямоугольность петли гистерезиса уменьшается от 0,7 до 0,5 при снижении толщины пленки от 0,05 до 0,0150 мкм, при толщине пленки более 0,06мкмпрямоугольность петли гистерезиса остается приблизительно постоянной. При низких содержаниях цинка в Со—Zn—Р-пленках их коэрцитивная сила меньше при нанесении на латунь, чем на лавсан. Пленки, полученные при концентрации хлористого цинка 1 г/л, независимо от природы основы характеризуются одинаковой величиной коэрцитивной силы.
Со—
Fe
—Р-покрытие
. Для осаждения Со—Fе—Р-сплава можно использовать раствор следующего состава (г/л): сернокислое железо (закисное) 30, сернокислый кобальт 10: гипофосфит натрия 10, сегнетова соль 50, рН—10, температура 90 °С.
На рентгенограммах Со—Fe—Р-пленок, полученных из раствора с 25 % железа выявляется наличие двух фаз α-Со и α-Fe. Коэрцитивная сила Со—Fe—Р-пленок, независимо от содержания в них железа и кобальта, монотонно уменьшалась с толщиной покрытия.
Со—
Re
—Р-покрытие.
Для получения этих покрытий использовался раствор следующего состава (г/л): хлористый кобальт 30; гипофосфит натрия 20, лимоннокислый натрий 80. хлористый аммоний 50, аммиак (25 %-ный) 60 мл/л. В указанный раствор вводился перренат калия в количестве 0—0.8 г/л, рН 8—9, температура — 95 °С В качестве основы использовались медные пластины.
Со—С
u
—Р-покрытие
. Сплав Со—Сu—Р был получен путем введения в аммиачный цитратный раствор для химического кобальтирования соли двухвалентной меди. Максимальное содержание меди достигало 23 (массовые доли. %). Скорость осаждения составляла 5 мкм/ч. Легирование медью сплава Со—Р уменьшало величину коэрцитивной силы, другие магнитные характеристики изменялись незначительно.
Покрытие Со—Мо—Р.
Для осаждения Со—Мо—Р-пленок применялся раствор, содержащий (г/л): хлористый кобальт 25—30, молибденовокислый аммоний 0.005—0,01, лимоннокислый натрий 80—100: гипофосфит натрия 15—20- хлористый аммоний 40— 50. аммиак (25 %-ный) до рН 9—9.5. температура 90 °С. Этот сплав рекомендуется использовать как ферромагнитный материал.
Покрытие Со—М
n
—Р
. Со—Мn—Р-сплав может быть получен из раствора следующего состава (моль/л), хлористый кобальт 0,2, хлористый марганец 0,1; гипофосфит натрия 0,5, малеиновокислый аммоний 0.3, гликол 0,3; аммиак 0.3; рН 10,5; температура 80 °С.
Были получены блестящие Со—Мn—Р-покрытия, магнитные свойства которых сильно изменялись от присутствия марганца в осадке. Твердость по Виккерсу составляла 1500 МПа.
2.5 Химическое меднение
Наибольшее практическое значение приобрело химическое меднение в производстве печатных плат. Оно применяется для металлизации сквозных отверстий простых и многослойных двусторонних печатных схем. Серебро не используется для этой цели не только из-за высокой стоимости, но и потому, что оно при высокой влажности воздуха может мигрировать на поверхности пластмасс, особенно феноловых, вызывая нежелательный электронный эффект [45]. Поэтому за рубежом широко применяется производство всей печатной схемы с помощью химического меднения. В настоящее время некоторые металлические детали и изделия с успехом заменяются пластмассовыми, на которые наносят медь химическим способом в качестве токопроводящего подслоя наращивают ее электрохимически, а затем также электрохимически осаждают декоративное и коррозионно-стойкое никелевое, хромовое или другое покрытие. Металлизация пластмасс улучшает внешний вид изделии и предохраняет пластмассы от старения [39].
В радиоэлектронике подобная металлизация обеспечивает электростатическое и электромагнитное экранирование приборов и удовлетворяет основным требованиям, предъявляемым к ним (например, к приборам СВЧ). При замене металлических деталей металлизированными тает массовыми деталями уменьшаются масса и себестоимость приборов и изделий поэтому металлизация пластмасс широко применяется в радиоэлектронике автомобилестроении, в производстве телефонных аппаратов, деталей велосипедов и т.п. В некоторых случаях медь химическим способом наносят на многослойную поверхность, состоящую из чередующихся слоев металла и диэлектрика. Иногда меднят сложные поверхности металл—полупроводник—диэлектрик. Спрос на медные зеркала заставляет искать рациональные методы меднения гладкой поверхности стекла.
Из-за расширения потребности в профилированных металлических изделиях, нуждающихся в покрытии, внимание уделяется и химическому меднению железа, стали, алюминия и некоторых других металлов. Кроме того, медь эластичнее полученного химическим путем никеля и химическое меднение может осуществляться на холоду. Химическое меднение используется в гальванопластике, а также для защиты отдельных участков стальных деталей при цементации [46].
В настоящее время существуют несколько теорий, объясняющих механизм процесса Процесс химического меднения основан на восстановлении меди из ее комплексной соли формальдегидом в щелочной среде по уравнению [45]:
 (11) (11)
Предполагается, что процесс меднения определяется двумя реакциями:
а) дегидрогенизации формальдегида:
 (12) (12)
б) последующего восстановления Сu (II) водородом
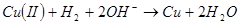 (13) (13)
Возможно, в реакции (13) участвует активный водород и даже атомный.
В последнее время высказывается мнение, что этот процесс носит каталитический и автокаталитический характер. Было установлено, что водород выделяется лишь в том случае, когда в растворе содержится кислород. После его удаления инертным газом выделение водорода прекращается. Отсюда можно сделать заключение что мы имеем дело с каталитическим окислением формальдегида кислородом:
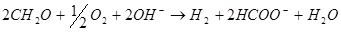
Эта реакция при комнатной температуре заметно протекает лишь под влиянием катализатора, в данном случае — меди. Схема катализа:
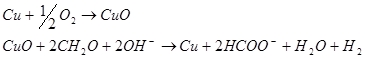
Из этого следует, что на холоду металлическая медь не вызывает дегидрогенизации формальдегида и, следовательно, механизм восстановления Сu (II), предполагающий первой стадией именно дегидрогенизацию, маловероятен.
Предложен, кроме вышеуказанного, гидридный механизм, по которому на поверхности катализатора из формальдегида отщепляется отрицательный ион водорода Н-
восстанавливающий Сu:
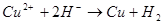
Для объяснения каталитического влияния металлической поверхности на процесс химического меднения предложена также электрохимическая теория, по которой на отдельных участках поверхности катализатора происходит катодное восстановление Сu(II) и анодное окисление СН3
О. Катализатор служит для передачи электронов, переход которых от формальдегида к ионам меди затруднен.
Растворы химического меднения могут быть концентрированные (быстрого действия) и неконцентрированные (медленного действия). Концентрация солей двухвалентной меди, входящих в состав раствора, обеспечивает нужную скорость меднения.
Основным восстановителем является формальдегид, восстанавливающий медь на холоду. Как показывают исследования, скорость восстановления меди увеличивается с увеличением концентрации формальдегида, причем увеличение более значительно при небольших концентрациях СН3
О. Кроме того, чем выше в растворе концентрация ионов меди, тем сильнее влияние концентрации формальдегида на скорость процесса меднения. В качестве восстановителей можно применять гипофосфит и гидразин, но они менее удобны, так как их восстановительные свойства проявляются лишь при повышенной температуре.
Важно учитывать рН раствора Растворы, в которых Си (II) восстанавливается гипофосфитом или гидросульфитом, являются обычно кислыми. Гидразин и формальдегид восстанавливают медь в щелочной среде. Восстанавливающая способность формальдегида увеличивается с повышением щелочности среды. Восстановление Сu (II) формальдегидом начинается лишь при рН> 11 и скорость восстановления увеличивается с повышением рН (рис. 11). Величина рН неконцентрированных растворов меднения обычно не ниже 12.0, а концентрированных — может быть 11.5.

Рис. 11. Зависимость скорости образования медного слоя от рН раствора: 1
– в присутствии соли никеля, 2
– без соли никеля.
Для растворения солей меди в щелочном растворе в нем должны присутствовать лиганды, которые связывают ионы меди в комплекс. С ионами меди образуют комплексы ионы гидроксила тартрата, оксалата карбоната, аммиак, глицерин, трилон Б и некоторые др. Комплексообразователи (лиганды) не только увеличивают растворимость солей меди в щелочной среде но и влияют на процесс восстановления ионов меди. Следовательно, вещества образующие прочные комплексы с ионами меди увеличивают устойчивость растворов химического меднения. Кроме того, комплексообразователи влияют на скорость каталитического восстановления меди и на физические свойства получаемого покрытия плотность, блеск, цвет и т.п. В качестве комплексообразователей и блескобразующих веществ могут быть использованы также аминоуксусные кислоты, этиленаминоуксусные кислоты. Самые распространенные комплексообразователи — тартраты (сегнетова соль) и глицерин.
Для облегчения образования покрытия и улучшения сцепления в раствор меднения рекомендуется вводить различные поверхностно-активные вещества (смачиватели), типа препарата «Прогресс», уменьшающие поверхностное натяжение и облегчающие выделение водорода в виде малых пузырьков.
На основании промышленного опыта применения растворов химического меднения при металлизации диэлектриков и в производстве печатных плат рекомендуются растворы, составы которых представлены в табл. 8.
Таблица 8
Растворы химического меднения
| Компоненты |
Концентрация компонентов раствора |
| 1 |
2 |
3 |
| Медь сернокислая (кристаллогидрат) |
.10-15 |
25-35 |
25-35 |
| Сегнетова соль |
50-60 |
150-170 |
| Гидроксид натрия |
.10-15 |
40-50 |
30-40 |
| Натрий углекислый |
.2-3 |
25-35 |
20-30 |
| Трилон Б |
80-90 |
| Фомалин (40%-ный), мл/л |
15-20 |
20-25 |
20-35 |
| Тиосульфат натрия |
0,005-0,001 |
0,002-0,003 |
| Никель хлористый (кристаллогидрат) |
.2-3 |
.2-3 |
| Роданин |
0,003-0,005 |
| Моющее средство "Прогресс" |
0,5-1,0 |
| Калий железосинеродистый |
0,1-0,15 |
Раствор 1 имеет скорость осаждения меди 0.8—1.0 мкм/ч при плотности загрузки 2—2.5 дм2
/л. Раствор обладает высокой стабильностью но менее производителен из-за пониженной концентрации солеи меди.
Раствор 2 имеет скорость осаждения 2—4 мкм/ч при плотности загрузки 2—2.5 дм2
/л. Раствор обладает большей производительностью, но меньшей стабильностью.
Раствор 3 отличается высокой стабильностью и допускает длительную эксплуатацию, что дает возможность получать в нем толстые слои меди.
Химическое меднение металлов пока не имеет широкого распространения так как механические свойства химически полученной меди хуже, чем электрохимической и поэтому химическое меднение металлов ограничено специальными случаями.
Практическое применение растворов химического меднения осложняется тем, что они являются неустойчивыми, продолжительность их использования иногда не превышает 1—2 ч. Неустойчивость растворов проявляется в том, что при некоторых условиях восстановление Сu(II) начинается не только на покрываемой поверхности, но и во всем объеме раствора. Так как реакция восстановления Сu (II) формальдегидом протекает автокаталитически, то соли меди и формальдегида быстро и непроизводительно расходуются и ванна выходит из строя.
В растворах химического меднения после длительного хранения происходит разложение формальдегида по реакции Канниццаро.
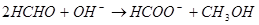
Поэтому растворы меднения обычно приготавливаются в виде отдельных растворов, которые смешиваются непосредственно перед меднением. В этих растворах формальдегид и щелочные вещества должны находиться раздельно. Соль меди может находиться с формальдегидом, так как в отсутствие щелочи восстановления меди не происходит.
Если в растворе присутствует металлическая медь, то при восстановлении меди на каталитической поверхности увеличивается склонность к восстановлению ее во всем объеме.
Можно перечислить следующие факторы, способствующие восстановлению меди во всем растворе:
1) повышение концентрации реагирующих веществ — двухвалентной меди, формальдегида и щелочи, повышение температуры, а также увеличение соотношения каталитической поверхности и объема, т.е. степени загрузки ванны.
2) недостаточное количество лиганда или лиганд, образующий слабый комплекс меди
3) присутствие в растворе катализатора восстановления меди частиц металлической меди, отрывающихся от покрытия, или частиц активатора, например, в случае, когда активированная поверхность не промывается;
4) любые твердые частицы в растворе могут служить центрами кристаллизации и, таким образом, облегчать образование зародышей металлической меди в объеме раствора.
Простейшей мерой стабилизации растворов является уменьшение их концентрации. Все известные неконцентрированные растворы меднения стабильнее концентрированных. Возможны, однако, и меры стабилизации, не приводящие к снижению скорости меднения. Таковыми являются:
1) добавка стабилизирующих веществ соединений, образующих прочные комплексы с медью (карбонат, триэтаноламин, трилон Б, тиосульфат, железосинеродистый калий, роданин), поверхностно активных веществ (высшие спирты, жирные кислоты и др.), которые, адсорбируясь на поверхности твердых частиц, могут блокировать их, затрудняя кристаллизацию меди. Однако добавки могут иногда неблагоприятно влиять на качество покрытия.
2) фильтрование раствора для удаления частиц катализатора или других веществ. При применении непрерывного фильтрования cконцентрированные растворы можно практически использовать неограниченное время, добавляя реактивы по мере их расходования.
3) умеренная степень загрузки (не превышать 2.5 дм2
/л).
4) перемешивание раствора любым способом. Перемешивание, кроме стабилизации, увеличивает скорость меднения, а также способствует получению более плотного осадка меди. Поэтому перемешивание можно рекомендовать как простой и эффективный способ улучшения химического меднения.
Химическое меднение можно осуществить путем разбрызгивания раствора с помощью специального пистолета-распылителя [45]. Процесс пульверизации позволяет наносить слой меди на изделия, погружение которых в ванну затруднительно из-за больших габаритов или по каким-либо другим причинам. При меднении путем пульверизации всегда применяют два различных раствора, которые с помощью двухствольного пистолета по двум его каналам подаются к определенному участку поверхности изделия, где и смешиваются.
Специфической особенностью этого метода является то, что здесь можно использовать и такие растворы, в которых восстановление меди не является автокаталитическим. Дело в том, что большая скорость, необходимая для восстановления, достигается лишь в условиях, когда реакция идет во всем растворе поэтому при использовании этого метода наряду с формальдегидом, можно применять и другие восстановители (например, гипофосфит). Необходимую скорость восстановления меди обычно достигают повышением температуры раствора, по этой причине большинство предложенных растворов работает при температуре 80—90 °С. Поскольку при столь высоких температурах происходит размягчение многих пластмасс то ряд авторов стремился разработать состав раствора меднения при комнатной температуре. В этом случае необходимая скорость восстановления обеспечивалась наличием в растворе ионов палладия, платины или золота которые, восстанавливаясь в щелочной среде формальдегидом образуют на поверхности изделия множество каталитически активных центров. Указанным методом можно металлизировать полиэтилен, поливинилхлорид, полистирол, керамические материалы и т.д. Формалин можно заменить гидразингидратом.
2.6Химическое осаждение драгоценных металлов
Химическое серебрение широко применяется в производстве зеркал. Кроме того, в ряде случаев производится серебрение различных пластмасс, восковых композиций и металлов [1, 16, 36-39, 47].
В основе процесса химического серебрения лежит реакция восстановления серебра из его соединений. Обычно в качестве основного компонента применяют соль серебра в виде нитрата, цианистого или аммиачного комплекса. Из восстановителей используют пирогаллол, формальдегид, сегнетову соль, гидразингидрат. В более старых рецептах в качестве восстановителя применялись инвертированный сахар, глюкоза. Образование зеркальной пленки возможно только при довольно медленном течении процесса по этой причине сильные восстановители малопригодны. По этой же причине рекомендуется вести процесс серебрения при пониженной температуре. Химическое серебрение можно производить методом погружения деталей в раствор, полива или распыления растворов сжатым воздухом из специального пистолета. Наиболее экономичен метод пульверизации, который позволяет уменьшить расход серебра примерно в 10 раз по сравнению с первыми двумя способами.
Процесс восстановления серебра довольно легко протекает не только на поверхности обрабатываемых форм, но и во всем объеме раствора. Поэтому растворы серебрения малостабильны, для их стабилизации предложено вводить различные добавки: желатину, пиридин, соединения хрома, а также соединения меди, ртути и свинца. Покрытия получаются очень тонкие, не превышающие 1 мкм. Для увеличения толщины слоя можно применять контакт из алюминия или магния.
Состав раствора для химического серебрения стекла следующий (первый раствор): нитрат серебра 5 г, гидроксид натрия 3,5 г; вода дистиллированная 1 л, (второй раствор) глюкоза 5 г; вода дистиллированная 1 л. Приготовляют раствор серебрения таким образом: растворяют нитрат серебра в 1 л дистиллированной воды, отдельно растворяют в воде гидроксид натрия (или эквивалентное количество гидроксида калия) и смешивают. Образовавшийся при сливании растворов гидрат окиси серебра растворяют в 22—24 мл 25 %-ного раствора аммиака, разбавляют до требуемого объема и затем фильтруют. Восстановитель приготовляют простым растворением глюкозы в одном литре дистиллированной воды.
Растворы серебра и восстановителя хранят отдельно и смешивают только непосредственно перед серебрением, при этом на два объема комплексной серебряно-аммиачной соли берется один объем раствора глюкозы. При длительном хранении серебряного раствора могут образовываться взрывчатые вещества (азид и нитрид серебра). Поэтому обращение с этими растворами требует исключительной осторожности и соблюдения правил техники безопасности. По этой причине остатки неиспользованного раствора для серебрения необходимо сливать в отстойник, в котором находится в избытке серная кислота с целью разрушения аммиачного комплекса серебра [48].
Перед серебрением поверхность стекла должна быть тщательно очищена и обезжирена. Детали, подлежащие серебрению, укладывают в кюветы, заливают азотной кислотой (плотность 1.4), выдерживают 4—10 мин, затем кислоту сливают и детали тщательно промывают водой, после этого протирают тампоном, смоченным 15—20 %-ным раствором щелочи и вновь промывают дистиллированной водой. Детали обрабатывают в течение нескольких минут в 0.05—0 1 %-ном растворе хлористого олова, промывают водой и хранят в дистиллированной воде перед серебрением.
Серебрение восковых композиций
. В некоторых случаях возникает необходимость нанести тонкий слой серебра на изделия из воска или восковых композиций. Для повышения смачиваемости поверхность воска предварительно промывается этиловым спиртом (1—2 мин) затем активируют в течение 5 мин раствором следующего состава: олово хлористое 5 г, соляная кислота (плотность 1.19) 40 мл, дистиллированная вода 1 л. Затем форму промывают дистиллированной водой и подвергают серебрению. Для этого используют два раствора:
Раствор 1: нитрат серебра 20 г, дистиллированная вода 1 л.
Раствор 2: пирогаллол 35 г. лимонная кислота 25 г, дистиллированная вода 1 л.
Пластмассовые детали можно серебрить методом пульверизации, предварительно активируя их поверхность раствором хлористого олова Составы растворов для серебрения методом пульверизации аналогичны предложенным ранее растворам для серебрения воска и восковых композиций. Процесс серебрения осуществляется на холоду, но покрытия более высокого качества получаются при температуре 8—12 °С. Толщина слоя серебра составляет 0,1—0,2 мкм. При необходимости получения более толстых слоев серебра операцию повторяют. После окончания процесса изделие промывают водой и сушат.
Для серебрения форм из полимерных материалов применяют концентрированные растворы, содержащие 60 г/л нитрата серебра и 70 мл/л 25 %-ной гидроокиси аммония. В качестве восстановителя используется раствор, содержащий 100 г/л глюкозы и 65 мл/л 40%-ного раствора формалина. По приведенным данным, максимальная величина сцепления пленки серебра с материалом изделия получается при использовании глюкозы, минимальная — с формалином, с сегнетовой солью величина сцепления имеет промежуточное значение
При получении серебряных покрытий небольшой толщины на мелких изделиях из меди, латуни, мельхиора и других медных сплавов применяют контактное серебрение, используя цинковый электрод Раствор имеет следующий состав (г/л): нитрат серебра 10, цианистый калий 30, температура ванны 60—70 °С, продолжительность погружения 2—3 мин
Контактное серебрение можно осуществить также путем протирки поверхности меди с помощью щетки. Для этого используют раствор следующего состава: нитрат серебра 20 г, калий цианистый 30 г; хлористый натрий 8 г, вода 1 л. Небольшое количество этого раствора смешивают с тонко измельченным мелом или венской известью. Полученной кашицей натирают поверхность изделия. Натирание производят до получения равномерного отложения серебра. Предлагается также раствор, содержащий (г/л): хлористого серебра 10, хлористого натрия 20 и кислого виннокислого калия 20.
При серебрении метких деталей в корзине или в барабане (из винипласта, полиэтилена, полипропилена) контакт осуществляется при помощи медных или латунных шин. расположенных внутри барабана или корзины. Алюминий в процессе работы растворяется, в результате чего образуются гидраты окиси алюминия. Во избежание загрязнения раствора образующимися гидратами алюминий помещают в мешок из хлопчатобумажной или капроновой ткани В процессе работы в растворе образуется небольшое количество свободного цианида, для связывания которого необходимо помещать в раствор свежеприготовленное хлористое серебро (в бязевом мешке) Раствор контактно-химического серебрения довольно стабилен.
При снижении в нем содержания серебра раствор корректируют концентрированным раствором комплексной соли серебра. Серебряное покрытие, полученное описанным способом, отличается высокой равномерностью, коррозионной стойкостью и хорошо паяется канифольным флюсом.
2.6.2 Химическое золочение
Покрытия золотом, несмотря на высокую стоимость металла, имеют широкое применение благодаря химической стойкости, электропроводности и декоративности. Золочение применяется в приборостроении и радиоэлектронике, а также в ювелирном и часовом деле [1, 16, 36-39, 47].
Такие пленки золота пропускают видимые лучи света и отражают инфракрасные лучи и радиоволны. Поэтому их используют для изготовления отражателей радиоволн, селективных световых фильтров, наносят на поверхность различного оборудования для терморегуляции, особенно в космической технике.
В литературе приводится значительное количество рецептов химического золочения. Химическое золочение осуществляется в растворе дицианоаурата калия KAu(CN)2
, к которому в качестве восстановителя добавляют гипофосфит или борогидрид натрия. Рекомендуется следующий состав раствора для осаждения золота на медь и ее сплавы (г/л): золото (в виде дицианоаурата калия) 2—3; натрий лимоннокислый (трехзамещенный) 45—50; аммоний хлористый 70—75, гипофосфит натрия 8—10; рН 7.5; температура раствора 80—85 °С, плотность загрузки 1 —2 дм2
/л; скорость осаждения 1 мкм/ч. Покрытие получается блестящим, но лучшие результаты получаются при использовании в качестве подслоя химически осажденного никеля [48].
Для получения оптических фильтров находят применение растворы золочения следующих составов (г/л): состав 1 — золото-хлористоводородная кислота 1; углекислый натрий 30. глюкоза 10, температура 10 °С. состав 2 — хлорное золото 3; натрий углекислый 30. формалин (мл/л) 10, температура 8 о
С Покрытие толщиной в 0.15—0.02 мкм образуется в течение 1—5 мин.
В цианисто-щелочном растворе в присутствии борогндрида натрия можно получить более толстые покрытия и с большей скоростью осаждения, чем в растворе с гипофосфитом натрия. Рекомендуется следующий состав раствора для химического золочения изделий из меди, никеля и ковара (г/л): дицианоаурат калия 6, гидроксид калия 7, цианистый калий 6,5; борогидрид натрия 0,4, температура 95—98 °С, скорость осаждения золота 2—3 мкм/ч; толщина покрытия может достигать 10 мкм.
Для приготовления раствора к дицианоаурату калия необходимо прибавить цианистый калий (как стабилизатор), а затем борогидрид натрия, предварительно растворенный в щелочном растворе, все тщательно перемешать и нагреть до требуемой температуры [49].
Для химического золочения может быть использован раствор, не содержащий цианистых соединений, что весьма существенно для золочения некоторых непроводящих материалов. В этом случае тщательно очищенное изделие (процесс обработки аналогичен процессу перед химическим серебрением) обрабатывают раствором хлористого олова. После тщательной промывки дистиллированной водой изделие погружают в ванну золочения. Процесс проводится при температуре 25—30 °С Рекомендуется следующий рецепт раствор 1 — хлористое золото 37 г, вода дистиллированная 1 л; раствор 2 — углекислый натрий 100 г, вода дистиллированная 1 л; раствор 3 — формалин (40 %-ный) 50 мл; вода дистиллированная 1 л. Для составления рабочего раствора все три приведенных раствора берутся в равных объемах.
Золочение изделий, изготовленных из меди и латуни, а также стальных омедненных или латунированных деталей, можно осуществить с применением пористой диафрагмы и цинкового контакта [49].
Золочение медных и латунных изделий в результате контактного золота может быть осуществлено в растворе следующего состава (г/л): золотохлористоводородная кислота (кристаллогидрат) 0,6; цианистый калий 10.0; фосфат натрия двухзамещенный (кристаллогидрат) 6,0; гидроксид натрия 1,0, сульфат натрия 3,0; температура ванны 90 °С; концентрация золота в этом растворе поддерживается на заданном уровне периодическим добавлением в раствор золотохлористоводородной кислоты.
2.6.3 Химическое палладирование и платинирование
Палладиевое покрытие применяется для придания изделиям высокой коррозионной стойкости, электропроводности, термостойкости, износостойкости, а также в качестве замены золотых покрытий в радиоэлектронике и других отраслях промышленности. Так как электролитический способ палладирования не обеспечивает получения равномерных покрытий для изделий сложного профиля, в таких случаях используется химическое палладирование [1, 16, 36-39, 47-49].
Осаждение палладия химическим способом возможно на железе, никеле, алюминии. Процесс имеет автокаталитический характер. Первые же порции палладия, осевшие на поверхности указанных металлов, действуют как катализаторы, и процесс в дальнейшем развивается без осложнений. Для палладирования таких некаталитических металлов, как медь и ее сплавы, на поверхности изделий осаждают слой серебра или никеля (химическим или электрохимическим способом). Перед нанесением покрытия поверхность деталей должна быть подготовлена обычными способами.
При химическом палладировании в качестве восстановителя применяют гидразингидрат. Процесс основан на следующей реакции:
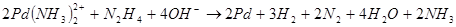
Растворы для химического палладирования содержат растворимую соль палладия (обычно хлористый палладий) комплексообразователь — аммиак, восстановитель — гидразингидрат. Состав раствора для химического палладирования следующий (г/л): палладий хлористый 4, аммиак (25 %-ный) 300—350 мл/л; трилон Б2, гидразингидрат 2, температура 50—55 °С, скорость покрытия 2—3 мкм/ч; отношение площади покрываемой поверхности к объему рабочего раствора 1:3.
Для приготовления раствора хлористый палладий растворяют при нагревании в 25 %-ном растворе аммиака, затем добавляют трилон Б, после чего раствор фильтруется. Гидразингидрат в виде 5 %-ного раствора добавляют непосредственно перед началом процесса. Через каждые 30 мин добавляют половину первоначального количества гидразингидрата. Для ускорения процесса палладирования применяется встряхивание покрываемых изделий или покрытие в барабанах.
Предложен следующий раствор химического палладирования, обладающий устойчивостью и обеспечивающий получение высококачественных осадков металла. Он состоит из хлористого палладия, аммиака, пирофосфата и гипофосфита натрия Восстановитель — гипофосфит натрия — вводится в предложенный раствор перед началом работы. Было установлено, что скорость химического палладирования возрастает с увеличением температуры, а стабильность уменьшается Оптимальная температура, при которой раствор достаточно устойчив а скорость процесса технологически приемлема, является 40—45 °С.
С увеличением концентрации ионов палладия и гипофосфита стабильность раствора уменьшается, а с увеличением рН среды несколько увеличивается. Увеличение концентрации пирофосфата натрия приводит к уменьшению скорости палладирования, но увеличивает стабильность раствора. Для ускорения процесса химического палладирования рекомендуется вводить в раствор фторид аммония.
Раствор химического палладирования очень чувствителен к различным примесям, содержащимся в растворе. Ионы цинка меди, железа, никеля вызывают восстановление палладия во всем объеме раствора Уже при концентрации ионов цинка 0,0004г·ион/л стабильность раствора уменьшалась в семь раз, а в присутствии ионов железа в такой же концентрации стабильность снижалась почти в три раза. Аналогичное влияние оказывает присутствие в растворе некоторых веществ органического происхождения. Одновременно с ухудшением стабильности раствора ухудшалось и качество получаемых осадков. При восстановлении палладия параллельно протекает реакция восстановления фосфора, в результате чего последний включается в осадок палладия. Установлено, что количество фосфора в палладиевом покрытии может колебаться в пределах от 1 до 2,5 (массовые доли, %) в зависимости от условий и режима осаждения. Анализ показал также, что в процессе химического палладирования водород практически не включается в осадок палладия.
Предлагается следующий состав химического палладирования: (моль/л): палладий хлористый 0,05; пирофосфат натрия 0,11; фторид аммония 0,3; аммиак 8, гипофосфит натрия 0,05; рН 10; температура 45—55 °С; скорость осаждения 3—4 мкм/ч. Из указанного раствора были получены светлые, гладкие палладиевые покрытия толщиной до 10 мкм на меди и медных сплавах, на никеле, кобальте и их сплавах, серебре и платине.
Предложен [8] оптимальный состав раствора для химического палладирования (г/л): палладий хлористый 2; гипофосфит натрия 10; хлористый аммоний 27; аммиак (25 %-ный) 160 мл/л, соляная кислота (плотность 1,19) 4 мл/л; рН 9,8. Скорость осаждения покрытия при 30 °С равна примерно 1,0 мкм/ч, а скорость при 80 °С ~10 мкм/ч.
Платиновые покрытия обычно наносят методом погружения изделий в ванну. Возможно нанесение платины на такие непроводящие материалы, как керамика, фарфор, кварц, стекло, пластмасса.
Для приготовления рабочего раствора необходимо 2 г платины растворить в смеси концентрированных кислот соляной и азотной (соответственно 35 и 5 мл) при нагревании. Раствор упаривается до 20 мл. Для нанесения платины к 5 мл раствора прибавляется 0,5 г гидроксиламингидрохлорида. Вместо последнего можно применять гидроксиламинсульфат или формалин. После нанесения платины поверхность изделия сушат и обжигают. Толстые покрытия получают многократным повторением процесса.
Для проведения процесса химического восстановления металлов весьма существенным является подбор материала ванны. Материал должен отвечать следующим требованиям, быть химически стойким к растворам с кислотностью в пределах рН 3—11 и выдерживать температуру до 100 °С без изменения физико-химических и механических свойств.
Поэтому наиболее приемлемыми материалами являются фарфор, эмали, стекло, полиэтилен.
В качестве источника тока применяют аккумулятор или батарею аккумуляторов али же используют питание от сети переменного тока через выпрямитель. Анодная плотность тока — 0,004 А/дм2
, катодная плотность тока не должна превышать 25—30 А/дм.
Поверхность катода (пластины и коррозионностойкой стали) рассчитывают исходя из заданной катодной плотности тока или силы тока, подаваемого на ванну из коррозионно-стойкой стали марки 1Х18Н9Т. Наложением на металлическую конструкцию слабого анодного тока можно длительное время поддерживать металл в пассивном состоянии, тормозя воздействие на него агрессивной среды.
Установка для одноразового покрытия деталей в непроточном растворе представляет собой сварную железную или фарфоровую ванну, помещенную в емкость большего размера термостат. Пространство между стенками обеих ванн заполняют водой или маслом, которые нагревают электронагревательными приборами или острым паром. В ванне устанавливают контактный термометр с терморегулятором для поддержания необходимой температуры рабочего раствора. При использовании в качестве ванн фарфоровых котлов, футерованных кобальтовой эмалью, необходимо соблюдать особую осторожность, чтобы при срыве детали с подвески фарфоровая ванна не была повреждена.
 Рассмотрим несколько аппаратурных схем на примере химического никелирования. На рис 12 показана принципиальная схема установки для химического никелирования деталей в корректируемом непроточном щелочном растворе, подогрев которого осуществляют с помощью циркулирующей по специальной системе воды, подогреваемой в особом баке со змеевиком. Установка состоит из двух 100-литровых ванн / и //, представляющих собой железные баки, футерованные кобальтовой эмалью Э-1. Одна ванна предназначена для химического никелирования, другая для фильтрования и корректирования отработанного раствора. Баки обогреваются циркулирующей по замкнутому контуру водой, нагретой паровым змеевиком до 98 °С. Подогреватель 7 расположен ниже уровня пола для обеспечения непрерывности циркуляции за счет разности плотностей горячей и охлажденной воды, чтобы не использовать насос. Трубопровод горячей воды 9 и подогреватель имеют теплоизоляцию. Фильтруют и корректируют раствор один раз в сутки в начале рабочего дня. Корректировочные растворы содержат (г/л): первый – хлористого никеля 160; хлористого аммония 50; лимоннокислого натрия 45, второй –гипофосфита натрия 400-500. Количество корректировочных растворов устанавливается анализом или расчетным путем, рН 8-9 поддерживают добавлением 25 %-ного раствора аммиака. Средняя плотности загрузки ванны деталями - 40 дм2
. Детали завешивают на стальной проволоке или в корзине из стеклоткани. Рассмотрим несколько аппаратурных схем на примере химического никелирования. На рис 12 показана принципиальная схема установки для химического никелирования деталей в корректируемом непроточном щелочном растворе, подогрев которого осуществляют с помощью циркулирующей по специальной системе воды, подогреваемой в особом баке со змеевиком. Установка состоит из двух 100-литровых ванн / и //, представляющих собой железные баки, футерованные кобальтовой эмалью Э-1. Одна ванна предназначена для химического никелирования, другая для фильтрования и корректирования отработанного раствора. Баки обогреваются циркулирующей по замкнутому контуру водой, нагретой паровым змеевиком до 98 °С. Подогреватель 7 расположен ниже уровня пола для обеспечения непрерывности циркуляции за счет разности плотностей горячей и охлажденной воды, чтобы не использовать насос. Трубопровод горячей воды 9 и подогреватель имеют теплоизоляцию. Фильтруют и корректируют раствор один раз в сутки в начале рабочего дня. Корректировочные растворы содержат (г/л): первый – хлористого никеля 160; хлористого аммония 50; лимоннокислого натрия 45, второй –гипофосфита натрия 400-500. Количество корректировочных растворов устанавливается анализом или расчетным путем, рН 8-9 поддерживают добавлением 25 %-ного раствора аммиака. Средняя плотности загрузки ванны деталями - 40 дм2
. Детали завешивают на стальной проволоке или в корзине из стеклоткани.
Рис. 12. Принципиальная схема установки для химического никелирования в корректируемом непроточном щелочном растворе: 1 – ванна для никелирования, 2 – обогревающая рубашка, 3 – термоизоляция, 4 – линия цеховой канализации, 5 – трубопровод для охлаждения воды, 6 – бочок для слива воды, 7 – бак для подограва воды, 8 – термометр, 9 – трубопровод с термоизоляцией для горячей воды, 10 – расширительный бачок, 11 – ванна для корректирования, 12 – фильтр.
Принципиальная схема установки для химического никелирования в щелочном корректируемом проточном растворе показана на рис. 13. Горячий раствор из ванны никелирования / непрерывно перекачивается поршневым насосом 5, проходит через змеевиковый холодильник 4 и фильтр 7 после чего по трубопроводу 8 возвращается в ванну. В ванну необходимыми порциями из корректировочных баков 9 и 10 подается самотеком растворы хлористого никеля гипофосфита натрия и аммиака. Растворы поступают в смесительный бак 11, а из него в ванну никелирования. Трубопровод 8 соединен с емкостью, наполненной раствором для никелирования. Когда отработанный и отфильтрованный раствор изменяет окраску (становится зеленым, что не соответствует требуемой кислотности), в ванну добавляется раствор аммиака.

Рис. 13. Принципиальная схема установки для химического никелирования деталей в корректируемом проточном щелочном растворе:
1 – ванна для никелирования, 2 – термометр, 3 – контактный термометр, 3 – контактный термометр, 4 – змеевик, 5 – насос, 6 – электродвигатель, 7 – фильтр, 8- трубопровод, 9 – корректировочный бак с концентрированным раствором хлористого никеля и гипофосфита натрия, 10 – корректировочный бак с 25%-ным раствором аммиака, 11 – смесительный бак, 12 – водяная или масляная рубашка, 13 – змеевик, 14 – ванна-термостат, 15 – электронагревательный элемент.
Принципиальная схема автоматизированной установки для химического никелирования деталей в проточном регенерируемом кислом растворе показана на рис. 14. Раствор, нагретый до 88 °С, поступает из ванны 1 в теплообменник 2, где охлаждается водой до 55 °С и затем перекачивается насосом 3 в смесительный бак 8 через фильтр 7. С помощью датчика 4 автоматического электронного рН-метра 5 и исполнительного механизма открывается кран корректировочного бачка 6 с раствором гидроксида натрия для доведения до заданного значения рН раствора. В бак 8 из бачков 9, 10 и 11 при помощи автомата программного корректирования 12 поступают определенные порции концентрированных растворов солей никеля, гипофосфита и буферной добавки. Температура раствора поддерживается автоматическим терморегулятором 13 с электронагревателями, которые подогревают масляную рубашку реактора. Датчиком является контактный ртутный термометр 14. Включение электронагревателей осуществляется магнитным пускателем через промежуточное реле. Отфильтрованный и откорректированный раствор проходит через теплообменник 15, где подогревается до 88-90 °С, после чего поступает в ванну — фарфоровый котел с тубусами. Теплообменник 2 состоит из двух концентрически расположенных сосудов. Наружный сосуд соединен с ванной и насосом, по внутреннему сосуду протекает водопроводная вода.

Рис. 14. Принципиальная схема автоматизированной установки для химического никелирования деталей в проточном регенерируемом кислом растворе. 1 — ванна никелирования; 2 — теплообменник для охлаждения отработанного раствора; 3—насос. 4 — датчик ДКИ-1, 5 — электронный рН-метр. 6 — корректировочный бачок с раствором гидроксида натрия. 7 — фильтр 8 — смесительный бак. 9, 10, 11 — бачки с концентрированными растворами хлористого никеля, гипофосфита натрия и яблочной кислоты. 12 — автомат программного корректирования. 13 — автоматический терморегулятор 14 — контактный термометр: 15 — теплообменник для нагрева регенерированного раствора.
Коловратный насос 3 из коррозионностойкой стали или пластмассы имеет производительность 2—6 л/мин. Фильтрующий элемент бязь, корректировочные бачки представляют собой фарфоровые котлы с тубусами. Трубопроводы изготовлены из фторопласта или кислотостойкой резины. Автоматический электронный рН-метр позволяет замерять рН от 1 до 8. Автомат программного корректирования состава раствора основан на использовании электронного универсального реле времени. Дозировка количества добавляемых компонентов задается изменением соответствующих сопротивлений, которые подключаются в цепь при срабатывании реле. Через заданные промежутки времени шаговый искатель включает исполнительное реле, а его контакты (магниты исполнительных механизмов) открывают краны корректировочных бачков.
Техническая характеристика установки емкость реактора — 35 л; общий объем заливаемого раствора в установку — 55 л; емкость смесительного бака – 35 л; емкость бачков с растворами компонентов — 5—7 л, скорость прокачки растворов 2-6 л/мин; габаритные размеры установки — 180 X 700 X 1250 мм, площадь одновременно покрываемых изделий – 50 дм2
.
Для химического никелирования изделий различной номенклатуры разработана установка, приведенная на рис. 15. Установка состоит из бака 4 для приготовления и корректирования раствора химического никелирования, насоса 3 для перекачивания приготовленного и отфильтрованного через фильтр 2 раствора в напорный бак 1, нагревателей 7 для подогрева раствора, ванны б емкостью 100 л для химического никелирования и бачков с корректировочными растворами 5. Отработанный раствор непрерывно стекает в бак 4 для приготовления и корректирования раствора. Установка включает также пароводоподогреватель 8 и емкость для конденсата 9.

Рис. 12. Принципиальная схема автоматизированной установки химического никелирования деталей различной номенклатуры. 1 – напорный бак, 2 – фильтр, 3 – насос, 4 – бак, 5 –корректировочные баки, 6 – ванна-реактор, 7 – нагреватель, 8 – пароводоподогреватель, 7 – емкость для конденсата.
Установка имеет пульт управления и работает по автоматическому циклу. Что касается материалов, из которых сделаны отдельные узлы установки, то нагреватель 7 состоит из трубчатой греющей камеры и эмалированных съемных греющих труб. Отдельные части нагревателя, соприкасающиеся с раствором имеют лакокрасочное покрытие, состоящее из двух слоев клея БФ-2, пигментированного окисью хрома, и двух слоев эпоксидно-фенольного лака Точно так же защищены насос, приборы КИП и другие части. Аппаратура, которая соприкасается с ненагретым раствором, выполнена из винипласта, стали, футерованной полиэтиленом, коррозионно-стойкой стали без покрытий. Трубопроводы для нагретого раствора — полиэтиленовые, вентили футерованы полиэтиленом. Вода для обогрева труб нагревателя может дополнительно подогреваться паром, подаваемым в межтрубное пространство греющей камеры.

Рис. 16. Принципиальная схема для получения Ni-B – покрытий в стандартных растворах: 1 – ванна никелирования, 2 – катоды, 3 – электроды сравнения, 4 – регулирующее устройство, 5 – насос, 6 – теплообменник, 7 – реагентные бачки, 8 – фильтры.
Техническая характеристика общий объем раствора — 600 л, скорость циркуляции раствора — 400 г/л, температура раствора 90—92 °С, емкость ванны — 100 л, поверхность никелируемых изделий — 200 дм2
, скорость никелирования — 15-20 мкм/ч производительность по массе осаждаемого покрытия—0.4 кг/ч, габаритные размеры — 4.5Х 1 5X5 5 м.
Промышленная установка, предназначенная для получения покрытия Ni — В в стандартных растворах, приведена на рис. 16. Ванна 1 объемом 700 л изготовленная из коррозионно-стойкой стали, включена в цепь постоянного тока в качестве анода, чтобы предотвратить восстановление ионов металла на ее стенках. Пластины 2, служащие катодами, находятся у торцовых сторон ванны.
Специальная схема включает электроды сравнения 3, изготовленные в виде тонких никелевых стержней, и регулирующее устройство 4, поддерживая на ванне постоянное значение (~0,6 В) «защитного потенциала». Катоды и электроды должны иметь по возможности малую поверхность для предупреждения выпадения осадка. Система циркуляции и регенерации раствора включает в себя центробежный насос 5, теплообменник б для поддержания необходимой температуры, бачки 7 для пополнения раствора реагентами и фильтры 8, через которые откорректированный раствор вводится вновь в ванну. По аналогичной схеме работают установки барабанного типа.
Рассмотрены основные методы нанесения металлических покрытий химическим методом, механизмы процессов. Предложены различные способы подготовки металлических и неметаллических покрытий к нанесению металлических покрытий химическим, либо электрохимическим способами. Проведен анализ и перечислены области применения различных типов металлических покрытий.
Для наиболее распространенных в промышленности процессов химического нанесения металлических покрытий – никелирования и кобальтирования – подробно рассмотрены область применения данного типа покрытий, структура и механические свойства покрытий, некоторые технологические аспекты. Предложены кислые и щелочные растворы никелирования. Рекомендованы составы щелочных и кислых растворов для нанесения покрытий на металлические и составы растворов для снятия покрытий, также перечислены составы растворов никелирования для основных типов металлических поверхностей (меди, алюминия, магия, цинка). Перечислены основные недостатки процессов никелирования и способы их устранения. Для процесса кобальтирования на основании литературных данных предложен щелочной раствор. Для рассматриваемых процессов приведены оптимальные составы растворов нанесения покрытий, температуры процесса, значения рН среды и времени ведения процесса.
Рассмотрены некоторые комбинированные металлические покрытия, определены их основные свойства и даны рекомендации относительно их нанесения и эксплуатации.
Для процессов химического меднения, серебрения, золочения, палладирования и патинирования рекомендованы основные растворы для нанесения покрытий, перечислены недостатки и достоинства процессов, рассмотрены структурно-механические свойства покрытий.
Для типового процесса нанесения Ni-B–покрытий предложены принципиальные схемы промышленных установок в различных типах реакторов. Предложены типы реакторов относительно выбранных размеров деталей. Кроме того, предложена схема автоматизации промышленной установки никелирования.
1. Беленький М.А. Электроосаждение металлических покрытий. М.: Металлургия, 1985г, 289с.
2. Н. В. Катц, Е. В. Антошин, Д. Г. Вадивасов. Металлизация распылением. М.: Машиностроение, 1966, 200с.
3. Палатник Л.С. и др. Механизм образования и субструктура конденсированных пленок. М.: Наука, 1972, с.20.
4. Патент США N 3822146, кл. B 05 B 13/06, 1974.
5. Патент РФ ИЗ № 2257423 от 27.07.2005 г. ООО «Обнинский центр порошкового напыления».
6. Материалы 4-й всероссийской практической конференции "Технологии ремонта, восстановления, упрочнения и обновления машин, механизмов, оборудования и металлоконструкций", С-Пб, 16-18 апреля 2002, с.136-140.
7. Мелащенко Н.Ф. Гальванические покрытия диэлектриков. Минск: Беларусь, 1987, 176с.
8. Синдеев Ю.Г. Гальванические покрытия. М.: Феникс, 2000, 251с.
9. Политов И. В., Кузнецов Н. А., Вибрационная обработка деталей машин и приборов, Л.: Машиностроение. 1965, 495с.
10. Бабичев А.П., Вибрационная обработка деталей в абразивной среде. М.: Металлургия. 1968, 564 с.
11. Грилихес С.Я. Обезжиривание, травление и полирование металлов. Л.: Машиностроение. 1983, 101с.
12. Зюзькевич С.А. Очистка деталей от жировых загрязнений перед нанесением гальванических покрытий // Мир гальваники. №1, 2007, с. 34.
13. Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Ч 1. М.: Химия, 1990, 713 с.
14. ЦОТАВИА, ЗАО. Межотраслевые правила по охране труда при нанесении металлопокрытий ПОТ РМ-018-2001. М.: Деан, 2002, 95 с.
15. Воюцкий С. С, Курс коллоидной химии, 2 изд., М.: Наука, 1975, 451с.
16. Вансовская К.М. Металлические покрытия, нанесенные химическим способом. Л.: Машиностроение, 1985, 103с.
17. В.В. Скорчеллетти. Теоретические основы коррозии металлов. Л.: Химия, 1973, 264 с.
18. А.М. Левинзон. Электролитическое осаждение металлов подгруппы железа. Л.: Машиностроение. 1983, 96 с.
19. В.С. Багоцкий. Основы электрохимии. М.: Химия, 1988, 400 с.
20. Прикладная электрохимия. Изд. 2-е, пер. и доп. под редакцией. Н. Т. Кудрявцева. М.: Химия, 1975, 552 с.
21. Л.И. Никандрова. Химические способы получения металлических покрытий. Л.: Машиностроение. 1971, 104 с.
22. А.А. Герасименко, В.И. Микитюк. Определение параметров электрохимических процессов осаждения покрытий. 1980, 111 с.
23. Ю.Д. Гамбург. Гальванические покрытия. Справочник по применению. М.: Техносфера. 2006, 216 c.
24. С.А. Вишенков. Химические и электрохимические способы осаждения металлопокрытий. М.: Машиностроение, 1975, 312 с.
25. Г.А. Саадаков. Гальванопластика. М.: Машиностроение, 1987, 288с.
26. А.М. Ямпольский, В.А. Ильин. Краткий справочник гальванотехника. Л.: Машиностроение. 1972, 269 с.
27. Р.Р. Салем. Физическая химия: начала теоретической электрохимии. М.: Техносфера, 2005, 320 стр.
28. Н.В. Авдеев. Металлирование. М.: Машиностроение. 1978, 184с.
29. А.П. Гуляев. Металловедение: Учебник для вузов. 6-е изд. М.: Металлургия, 1986, 544 с.
30. Б.Б. Дамаскин, О.А. Петрий. Электрохимия. М.: Высшая школа, 1987, 295 с.
31. Вишенков С. А. Химические и электротермохимические способы осаждения металлопокрытий. М Машиностроение 1975 312 с.
32. А.М. Ямпольский. Меднение и никелирование. Л.: Машиностроение. 1971, 136с.
33. Горбунова К. М. и Никифорова А. А Физико-химические основыпроцесса химического никелирования. М.: Изд-во АН СССР, 1960 208 с.
34. Choong-Nyeon Park, Min-Ho Chang. Effects of nickel coating on the properties of metal hydride electrodes // J. of Alloys and compounds. 1995. №231, рр. 846-851.
35. A. Turonova, M. Galova, L. Lux, M. Gal. Elektrochemical processes during Fe powder particles by Ni and Ni/Cu coating in the fluidized bed // J. Solid State Elektrochem. 2001, №5, рp. 502-506.
36. Ильин В. А. Металлизация диэлектриков. Л.: Машиностроение, 1977. 80 с.
37. Кудрявцев Н Т. Электрические покрытия металлами. М Химия, 1979. 351 с.
38. Никандрова Л. И. Химические способы получения металлических покрытий. Л.: Машиностроение, 1971. 104 с.
39. Шалкаускас М., Вяшкалис А. Химическая металлизация пластмасс. Л.: Химия. 1972. 168 с.
40. В.А. Ильин. Цинкование, кадмирование, оловянирование и свинцевание. Выпуск 2. Л.: Машиностроение, 1983, 87 с.
41. Физико-химические основы процесса химического кобальтирования // Под ред К М Горбуновой. М.: Наука. 1974. 220с.
42. Р.С. Сайфуллин. Комбинированные электрохимические покрытия и материалы. М.: Химия. 1972, 167 с.
43. Хокинг М., Васатасри В., Сидки П. Металлические и керамические покрытия: получение, свойства, применение. М.: Мир, 2000. 518 с.
44. К.М. Вансовская, Г.А. Волянюк. Промышленная гальванопластика. Л.: Машиностроение, 1986, 104с.
45. Розовский Г И, Вяшкалис А. И. Химическое меднение. Вильнюс, РИНТИП, 1966. 60 с.
46. Ю.А. Комиссаров, Л.С. Гордеев, Нгуен Суан Нгуен. Анализ и синтез систем водообеспечения химических производств. М: Химия, 2002, 496 с.
47. А. М. Ямпольский. Электролитическое осаждение благородных и редких металлов. Л.: Машиностроение. 1977, 96 с.
48. Yu Xingwen, Cao Chunan etc. Study of double layer rare earth metal conversion coating on aluminum alloy LY12 // Corrosion Science. 2001, №43, рp. 1283-1294.
49. Г.К. Буркат. Серебрение, золочение, палладирование и родирование. Л.: Машиностроение, 1984, 84с.
|