| Реферат на тему:
Конструкция модели секвенатора ДНК
2009
1. Автоматический секвенатор
Конструкция модели секвенатора ДНК. Эти конструкции непрерывно совершенствуются. Однако принципиальные черты устройства автоматических секвенаторов, по-видимому, в ближайшие годы сохранятся для всех моделей. Поэтому здесь я остановлюсь более или менее подробно на описании основных элементов конструкции прибора ABI Prism 377, выпущенного в 1995 году.
В основном блоке электрофореза, как и в любом приборе с вертикально стоящими пластинами, имеются верхний и нижний резервуары для буфера, электроды и источник напряжения. Ввиду последующего оптического сканирования обеспечивается строго фиксированная установка сменных пластин с ПААГ. Возможно использование гелей различной концентрации (обычно в пределах 4,5-6%). Толщина геля — менее 1 мм. Ширина рабочей его части — 16 см. Длину пластины можно выбрать в 24, 34 и 48 см. В верхней части геля имеется 36 карманов для препаратов. Таким образом электрофорез можно вести одновременно в 36 треках. Предусмотрен отвод выделяющегося при этом тепла.
Особенностью готовой пластины с гелем является наличие «окна» в нижней части пластины. Окно высотой в 2 см вырезано по всей ширине рабочей части пластины и отстоит на 2,5 см от ее нижнего края. Наличие окна связано с принципиально иным, чем было описано ранее, способом регистрации полос после прекращения
электрофореза, обусловленного тем, что наиболее быстро мигрирующая полоса достигала нижнего края пластины. В этом случае медленно мигрирующие полосы, соответствующие более крупным отрезкам ДНК, теснились в верхней части геля и были трудноразделимы при анализе рентгеновской пленки.
В автоматическом секвенаторе полосы в геле проходят мимо окна, регистрируются в процессе этого прохождения и далее покидают гель, уходя в резервуар с нижним буфером. При достаточной продолжительности, электрофореза (16—20 часов) мимо окна проходят все полосы, в том числе те, в которых мигрируют самые длинные отрезки ДНК, несущие флюоресцентную метку. Регистрация производится оптическим способом — по флюоресценции. Для этой цели используется следующий набор инструментов:
Реклама

1. Луч аргонового лазера фокусируется в точку на середине высоты окна. Сам лазер установлен на каретке возвратно-поступательно перемещающейся на всю ширину окна, прочерчивая таким образом тонкую линию, пересекающую все треки
разделения ДНК. За то время, когда в каком-либо из треков мимо окна проходит одна из полос, содержащая меченые отрезки ДНК определенной длины, эта полоса сканируется лучом лазера много раз по всей ее толщине в направлении миграции.
2. Возникающее при этом излучение флюоресценции определенного цвета (и постепенно изменяющейся интенсивности) проецируется оптической системой на входную щель спектрофотометра и падает на отражающую дифракционную решетку. В зависимости от длины волны флюоресценции дифракционная решетка отражает цветной луч в определенное положение на выходе спектрофотометра. Информация об этом положении поступает в компьютер, обеспечивая идентификацию дидезоксирибонуклеотида, которым заканчиваются данные отрезки ДНК.
3. Выходя из спектрофотометра, луч попадает в камеру для измерения его интенсивности, где используется явление фотоэлектронной эмиссии. Соответствующий электрический сигнал также поступает в компьютер.
4. В компьютере регистрируются и все перемещения лазера поперек пластины геля, что позволяет разнести вышеназванную информацию по его трекам.
5. Для каждого трека отдельно, по мере прохождения в нем полос любого цвета флюоресценции, компьютер ведет их счет, определяя тем самым последовательность нуклеотидов во всех секвенируемых одновременно фрагментах ДНК.
6. Все картины прохождения флюоресцирующих полос мимо окна пластины в каждом треке в реальном времени проецируются на дисплей прибора.
7. По окончании процесса электрофореза полученные данные обрабатываются компьютером и печатаются в виде четырехцветных графиков для каждого трека, где видна вся картина следования пиков, их нумерация и однобуквенные обозначения соответствующих нуклеотидов. Благодаря измерению интенсивности каждого цвета флюоресценции вершины пиков хорошо различимы.
Здесь необходимо сделать небольшое отступление. Хотя и было сказано, что рассматривать различные модели секвенаторов не имеет смысла, об одной из них, принадлежащей к последнему поколению, стоит вкратце написать и вот почему. Принципиальное его устройство такое же, но в интересах дальнейшего повышения продуктивности применена новинка, общие перспективы которой следует обсудить. Электрофорез в этом приборе ведут не на пластине геля, а в капиллярах! Вот, как это делается.
Реклама

В прибор (Beckman СЕФ-2000) устанавливают плашку на 96 лунок (12 рядов по 8 лунок), куда заранее вносят продукты реакций, проведенных по тому же методу Сэнджера с четырьмя люминесцентно мечеными дидезоксирибонуклеотидами. Тандемом к ней ставят вторую точно такую же плашку, лунки которой заполнены буфером. Сам ПААГ готовят так, что он не может запо-лимеризоваться до твердого состояния, а представляет собой вязкую жидкость. Прибор заряжают картриджем, заполненным таким гелем. Восемь тонких и гибких пластмассовых капилляров, длиной около метра, с одного конца закреплены в пластине так, что расстояние между ними равно расстоянию между лунками одного ряда плашки. Концы капилляров выступают из пластины и одеты металлическими трубочками, электрически соединенными с катодом источника высокого напряжения. Благодаря этому в каждую лунку, куда опускаются кончики капилляров, подается отрицательное напряжение электрофореза. Вторые концы капилляров собраны в некий зажим, где они располагаются в одной плоскости вплотную друг к другу. Выходя из дальнего конца этого зажима все восемь капилляров открываются в одну емкость с буфером, куда подается положительное напряжение электрофореза. Но перед этим в окне зажима, против которого приходятся прозрачные участки капилляров, все они сканируются лучом лазера и «отвечают» на это флюоресценцией проходящего мимо фрагмента ДНК. Далее все происходит так же, как описано для секвенатора с пластиной геля.
Но вернемся к началу операции. Первоначально пустые капилляры при помощи насоса целиком заполняются гелем из картриджа. Затем концы их автоматически переносятся и опускаются в восемь лунок первого ряда плашки препаратов. Включается умеренное напряжение и все отрицательно заряженные фрагменты ДНК в течение нескольких секунд входят в гель — из каждой лунки в «свой» капилляр. После этого концы капилляров автоматически переносят в лунки первого ряда плашки с буфером. Напряжение повышается до рабочей величины электрофореза, который продолжается 2 часа. По его окончании гель, с помощью того же насоса выталкивается из капилляров, а сами они промываются водой. Затем капилляры заполняются новыми порциями геля и все операции повторяются для второго ряда лунок с препаратом. И так до последнего, 12-го ряда. За 24 часа прибор может провести электрофорез 96-ти препаратов. Если в одном капилляре удается расшифровать последовательность в 500 нуклеотидов, то всего за одни сутки прибор может определить последовательность для 49 тысяч нуклеотидов. Кроме того оператор освобождается от трудоемкого приготовления пластин с гелем и деликатной операции внесения исходных препаратов в его «карманы».
Технический прогресс впечатляет. Но поясню, ради чего было сделано это отступление. Каковы перспективы электрофореза в капиллярах? Не вытеснит ли он классический метод электрофореза в пластинах? Думаю, что не вытеснит и вот почему. В капиллярном методе у экспериментатора нет возможности получить в свое распоряжение сам чистый гель без оболочки, а значит и решить целый ряд задач, описанных в гл. 6. К примеру, как использовать электрофорез в капиллярах для сравнения картин распределения по размерам белков или НК разного происхождения? Пометить их всех люминесцентной меткой и протягивать сплошь прозрачные капилляры мимо лазера, фиксируя времена прохождения каждого из белков или НК? Сложно! А если возникнет необходимость подробнее познакомиться с одним из белков? Найти его снова по времени регистрации и вырезать кусочек капилляра? Или, не меняя описанной конструкции фиксировать времена выхода всех белков из капилляров и сохранять их для последующего анализа? Тогда для каждого капилляра надо поставить свой коллектор фракций, как при хроматографии! А если белки или НК помечены радиоактивной меткой? Укладывать капилляры с гелем на рентгеновскую пленку? Для регистрации в таких условиях потребуется очень большая радиоактивность. Еще хуже с использованием иммунохимических методов для отыскания нужного антигена после электрофореза смеси белков. К белкам в капилляре не подобраться. Значит тестировать антисывороткой поодиночке каждый белок в варианте с коллекторами фракции? И так далее.
Все это очень трудно. Быть может технически разрешимо за счет усложнения и удорожания специальной аппаратуры. Но зачем? Ведь, кроме секвенирования ДНК, при проведении любой другой исследовательской работы электрофорез используется не более, чем несколько раз... Но вернемся к прерванному рассмотрению вопроса об использовании автоматических секвенаторов.
Уже упоминалось, что в одном треке пластины или в капилляре автоматического секвенатора удается надежно определить последовательность нуклеотидов во фрагменте ДНК длиной в 500-600 пар нуклеотидов. Каким же образом расшифровывают весь геном, хотя бы бактерии, где счет идет на миллионы пар? Очевидно здесь пока нет иного пути, чем разбиение всей ДНК генома на куски: сначала более крупные, потом мельче — вплоть до набора фрагментов, доступных для автоматического секвенирования. Средством разбиения могут служить различные рестриктазы или облучение ультразвуком. Сортировку кусков и фрагментов ДНК по размерам можно вести последовательно электрофорезом в мягких гелях агарозы с последующим извлечением их из этих гелей. Отбираются только достаточно крупные фрагменты.
Для обеспечения строгой одинаковости этих крупных кусков ДНК их приходится проводить через операцию умножения клонированием в E.coli. Обычные плазмиды могут вносить в бактерию фрагменты, не длиннее нескольких тысяч пар нуклеотидов. Ограничением служит процесс проникновения перегруженных плазмид в бактериальную клетку. Чтобы обойти эту трудность иногда в качестве переносчиков («векторов») используют так называемые «космиды». Они представляют собой такие гипермо-дифицированные плазмиды, включенные в головку бактериофага «^». (Используется явление самосборки фага.) Бактериофаг впрыскивает всю содержащуюся в нем ДНК через отверстие, которое он «прокалывает» в оболочке бактерии. Эта ДНК в бактериальной клетке циркулизируется и размножается как плазмида. Таким образом удается размножить в E.coli куски чужеродной ДНК длиной в 35-45 тысяч пар нуклеотидов.
Некоторые из секвенированных в конце концов фрагментов ДНК неизбежно обнаружат определенное «перекрытие» — совпадение участков последовательностей. Это обстоятельство в силу уникальности таких последовательностей (при достаточной их длине) используют для установления очередности фрагментов и получения из их совокупности единой последовательности нуклеотидов всего генома.
Впрочем, может оказаться и так, что из-за потери малых отрезков исходной ДНК генома при его дроблении между некоторыми расшифрованными фрагментами обнаруживаются пропуски (перекрытие отсутствует). Если два соседствующие с таким пропуском фрагмента уже секвенированы, то конец одного и начало второго из них позволяют синтезировать два праймера (начальный и концевой) и воспользоваться симметричной ПЦР-реакцией для получения на базе всей исходной ДНК или крупного ее куска пропущенной последовательности для ее секвенирования.
Если же нет достаточных оснований, чтобы после пропуска поставить один из расшифрованных фрагментов, то придется использовать асимметричную (с одним праймером) ПЦР-реакцию, начинающуюся от предшествовавшего пропуску фрагмента. Быть может даже в несколько этапов, когда праймер для каждого последующего секвенирования придется устанавливать по концу последовательности, расшифрованной на предыдущем этапе. И так до тех пор, пока не появится достаточно длинная последовательность нуклеотидов, уже обнаружившая себя в одном из секвенированных фрагментов. Разумеется, перебор и сопоставление всех последовательностей выполняет компьютер.
Необходимость секвенирования тысяч фрагментов ДНК ставит перед исследователем весьма трудоемкую задачу. Однако благодаря возможности автоматически секвенировать за один день 96 фрагментов и параллельного использования нескольких автоматов эта задача оказывается не такой уж страшной.
Другое дело — расшифровка генома человека с его тремя миллиардами пар нуклеотидов. Там, разумеется, есть свои приемы. Но, тем не менее, задача эта столь громоздка, что над ее разрешением координированно работают уже несколько лет многие лаборатории мира. (Общая программа «Геном человека».) О важности такой расшифровки для медицинских целей написано немало в общедоступной литературе. В первую очередь она ведется для тех участков генома, где расположены активные гены, в особенности гены, имеющие отношение к болезням человека. Эти гены во многих случаях могут быть найдены в геноме через синтез кДНК по иРНК, соответствующей белку — продукту деятельности интересующего гена, с дальнейшей гибридизацией с определенным куском генома. Для отыскания примерной локализации гена нет нужды получать соответствующие полноразмерные иРНК и кДНК. Достаточно знать последовательность в сотню нуклеотидов. Ее уникальность во всем геноме не вызывает сомнения — вероятность повтора составляет 1/4100
.
К концу 1998 года были расшифрованы последовательности 50-60 тысяч генов, что составляет более половины всего предполагаемого числа генов человека. Это звучит оптимистически. Но стоит вспомнить, что все активные гены человека в совокупности составляют лишь около 3% его генома. Нужно ли расшифровывать остальные 97% ? Наверное нужно, хотя бы для того, чтобы подойти к пониманию роли этого огромного количества как будто «молчащей» наследственной информации. Неужели — это пустой балласт? Или эта «внегенная» информация играет какую-то роль в обеспечении жизнедеятельности человека во всех ее аспектах? На этом пути, быть может, ученых ждут еще великие открытия!
2. Ультрацентрифугирование
10-20 лет тому назад скоростные ультрацентрифуги составляли едва ли не главную часть приборного оснащения любой биохимической лаборатории. Сейчас, когда молекулярная биология перешла на работу с микроколичествами исходных материалов, эти дорогие и капризные машины заняли куда более скромное место в арсенале исследователей. Тем не менее, в некоторых случаях, когда предполагается начать обширную программу изучения какого-нибудь однородного биологического материала, имеет смысл воспользоваться возможностями ультрацентрифугирования. Поэтому в этой главе мы весьма кратко познакомимся с этими возможностями.
2.1 Ультрацентрифуга
Этим термином принято называть центрифуги, позволяющие достигать скорости вращения своих роторов вплоть до 80 тысяч оборотов в минуту. На радиусе ротора в 6 см это создает в радиальном направлении ускорение в 700 тысяч раз превышающее ускорение земного притяжения («700 000 g»). Препарат ДНК с массой в 0,5 микрограмма, который фигурировал в предыдущей главе, при такой скорости вращения испытывал бы силу, влекущую его к периферии ротора, эквивалентную весу в 350 миллиграмм. А это — уже весьма ощутимая величина.
Вращение с такой скоростью невозможно осуществить в нормальной атмосфере из-за катастрофического разогрева ротора. Поэтому главным элементом конструкции ультрацентрифуги является вакуумная камера, в которой вращается ротор. Используя последовательное подключение к камере диффузионного масляного и обычного форвакуумного насосов, в ней удается достигнуть разрежения в 10-3
мм ртутного столба. Отсюда возникают технические трудности с обеспечением герметичности камеры — как по окружности ее довольно большой крышки, так и по оси мотора, вращающего ротор, поскольку этот мотор, естественно, располагается вне камеры. Столь же надежно должны быть герметизированы съемными колпачками и пробирки, устанавливаемые в ротор. В противном случае находящаяся в них жидкость закипит и улетучится.
Несмотря на столь высокий вакуум, роторы при такой огромной скорости вращения все же нагреваются, и потому их приходится охлаждать (через инфракрасное излучение) путем контролируемого интенсивного охлаждения стенок камеры. Что тоже составляет проблему, поскольку камера изготавливается из брони, толщиной в 2—3 см. Ее назначение — защитить оператора в случае разрыва ротора центробежными силами. Такое случается, если в материале ротора есть скрытый дефект. Или при слишком длительном использовании ротора, у которого есть предельный срок службы, определяемый «усталостью» материала. Высокоскоростные роторы изготавливаются из титана, низкоскоростные — из дюралюминия.
Ультрацентрифуги комплектуются, по выбору покупателя, набором разнообразных роторов: на большие скорости вращения и малые объемы пробирок, или наоборот, — на большие объемы и относительно малые скорости. Объемы пробирок варьируют в широких пределах: от 6,5
до 94-х миллилитров.
Используются (в основном) роторы двух типов: угловые и со свободно подвешенными (откидывающимися) пробирками. Второй тип роторов часто называют «бакет-роторами». Эти роторы несут три или шесть пробирок, которые устанавливают в свободно подвешенные металлические гильзы — «бакеты» (от английского bucket — ведро). Пробирки герметизируются крышками, навинчивающимися через прокладки на бакеты. Последние сначала висят вертикально, опираясь на гибкую ось. Но уже на малых скоростях вращения бакеты откидываются до горизонтального положения, ось прогибается, а они своими полу сферическими наружными краями опираются на соответствующие гнезда в самом роторе — так, что центробежная сила передается не на подвеску, а на само массивное тело ротора.
В угловых роторах (рис.1) гнезда для пробирок выполнены в самом теле ротора. Размеры гнезд и угол их наклона варьируют в широких пределах. Число гнезд всегда четное.
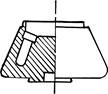
Рис. 1
Перед установкой в ротор заполненные пробирки вместе с еще не установленными на них колпачками попарно уравновешиваются (добавлением жидкости) весьма тщательно. В противном случае неизбежны опасные биения ротора при вращении. То же самое относится к бакет-роторами с шестью пробирками. В случае трех пробирок все они, вместе с бакетами и их крышками должны иметь совершенно одинаковый вес. Для каждого типа роторов указывается максимально допустимая скорость вращения.
К этой технической части описания ультрацентрифуги остается добавить, что все рабочие параметры процесса центрифугирования: скорость и продолжительность вращения, температура ротора и даже степень плавности его остановки задаются предварительно и далее обеспечиваются автоматически контрольными устройствами самого прибора.
В бакет-роторах частицы, оседающие под действием центробежной силы, движутся вдоль оси пробирки и оседают на ее сферическое дно. В угловых роторах частицы движутся сначала горизонтально в направлении наиболее удаленной от оси вращения стенки пробирки, затем по ней соскальзывают вниз и собираются в самой дальней части пробирки — в месте перехода от ее цилиндрической стенки к сферическому дну.
Литература
1. Микаэлян Н.П., Князев Ю.А. Основные стороны патогенеза гипергликемического синдрома при экстремальных состояниях. // Бюллетень эксперимент. биологии и медицины. - 1994. -N 1. -С. 22-26.
2. Михайленко А.А., Покровский В.И. Отек-набухание головного мозга при коматозных состояниях у инфекционных больных. - М.- Медицина. -1997.
3. Мороз В.В., Молчанова Л.В., Щербакова Л.Н. и др. Показатели липидного обмена у больных в критических состояниях //Анест. и реанимат. -2001.- №6.-С..4-7.
4. Мусил Я. Основы биохимии патологических процессов. - М., -1985. -С.356-361
|