Реферат на тему:
Регулирование белкового синтеза
2009
Трансляция иРНК
Термин «трансляция» обозначает передачу наследственной информации от иРНК к белку. Проще говоря, «перевод» последовательности трехчленных кодонов иРНК в последовательность аминокислот синтезируемого белка.
В учебнике Беркинблит, Глаголева и Фуралева этот процесс описан достаточно подробно. Напомню главные его черты. Во всех относительно малых (около 80 нуклеотидов) транспортных РНК (тРНК) имеется однонитевой участок («петля»), где располагается «антикодон» — тройка нуклеотидов, комплементарных кодону. Антикодон водородными связями соединяется с кодоном, и в этом состоит «узнавание» кодона, определяющее аминокислоту, которая должна быть присоединена к растущей цепи белка. Различных тРНК в клетке имеется, как минимум, 20 — по числу аминокислот.
На 3'-конце всех тРНК стоит тройка нуклеотидов ЦЦА. К ней специальный фермент, «аминоацил-тРНК-синтетаза», ковале-нтной связью присоединяет аминокислоту, соответствующую антикодону этой тРНК. Образуется молекула «аминоа-цил-тРНК». Условимся для краткости обозначать ее аа-тРНК. Процессы «узнавания» кодона и синтеза белка происходят в рибосоме. Ее образуют две субъединицы — малая и большая. Суммарный их диаметр порядка 25 миллимикрон. В каждой из субъединиц имеется набор специфических белков и молекулы крупных рибосомальных РНК: одна — в малой субъединице и две (а у эукариотов три) — в большой. Молекулярные веса этих pPHK лежат в диапазоне 0,5-1,5 миллиона дальтон (от 1541 до 4718 нуклеотидов). Малые pPHK рибосом (есть и такие) имеют длину всего 120-160 нуклеотидов.
Белки рибосом, общим числом около 55-ти (в среднем) у прокариотов и 83-х у эукариотов обеспечивают последовательность этапов биосинтеза конечного белка: посадку рибосомы на иРНК, ее продвижение вдоль матрицы, переброску растущей цепи белка с одной молекулы тРНК на другую, окончание трансляции и снятие рибосомы с матрицы иРНК. В этих процессах участвуют и некоторые белки цитоплазмы, временно связывающиеся с рибосомой — так называемые «факторы» инициации, элонгации и терминации белкового синтеза.
Рибосомы эукариотов значительно крупнее, чем у бактерий. Возможна посадка на иРНК и нескольких рибосом, следующих друг за другом. Такая комбинация именуется «полисомой».
Реклама

В клетке E.coli насчитывается около 20 тысяч рибосом. Место присоединения рибосом к иРНК для E.coli известно. Это — последовательность АГГАГГУ-З, расположенная на 10 нуклеотидов ранее АУГ — начального кодона для синтеза белка. Считают, что 3'-конец рРНК малой субъединицы рибосомы E.coli комплементарен к этой последовательности.
Относительно рибосом высших организмов полагают, что они садятся произвольно со стороны 5'-конца иРНК, а затем «скользят» по ней до тех пор, пока не встретят инициаторный кодонАУГ в специальном окружении: АЦЦАУГГ.
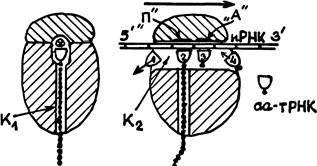
Нам известно, что субъединицы рибосом (малая и большая) синтезируются порознь. Посадку рибосомы на определенное для нее место на иРНК осуществляет малая субъединица. Большая субъединица к ней затем присоединяется. Снятие рибосомы с матрицы иРНК, очевидно, осуществляется путем разъединения субъединиц. Перед этим в рибосому вместо очередной аа-тРНК входит некий специальный белок (RF-releasefactor). Он вытесняет из рибосомы остающуюся в ней часть полипептидной цепочки белка. У эукариотов часть рибосом по своей большой субъединице связывается с внутриклеточными мембранами. Синтезируемые ими белки попадают в аппарат Гольджи и секретируются клеткой наружу. Рибосомы в цитоплазме обеспечивают собственные потребности клетки. После завершения синтеза полипептидной цепи белка начинается посттрансляционная трансформация белка, в частности, его сворачивание в глобулу. (Впрочем, не исключено, что для крупных белков это сворачивание начинается еще в процессе трансляции.) Сворачиванию белков в клетке способствуют еще и специальные белки — «помощники». В английской терминологии они именуются «molecularchaperones» (компаньоны). Короткие белки (меньше 300 аминокислот) легко сворачиваются в одну компактную структуру — «домен». Крупные белки эукариотов иногда сворачиваются в два или три домена, связанных короткими отрезками полипептидной цепочки. Трансформация белка перед его сворачиванием может включать в себя и химическую модификацию некоторых аминокислот: присоединение Сахаров или липидов — особенно для белков мембран. Возможны и некоторые укорачивания полипептидной цепи экзопептидазами (в интересах лучшего сворачивания) и т. д. Вернемся теперь к более подробному анализу центрального процесса — синтеза полипетидной цепи белка в рибосоме по матрице иРНК. Основные представления об этом процессе были изложены выше. Но в этих представлениях есть немало скрытых «темных мест». Я предупреждаю: все последующее является гипотезой автора, которую я предлагаю для критического рассмотрения своим ученикам. На рис. изображена рибосома в двух разрезах. Я предполагаю, что в большой субъединице есть два канала К1 и К2.
Реклама

MET
Рис.
Левая схема — разрез рибосомы плоскостью, перпендикулярной к иРНК, проходящей через вертикальный канал Кр иРНК здесь изображена маленьким кружком с перекрестием. На правом разрезе она видна, как узкая полоска, где кодоны отмечены черточками. Это — разрез плоскостью, проходящей через иРНК и оба канала. Из сопоставления разрезов видно, что горизонтальный канал имеет вытянутое вниз сечение. Вертикальный канал — круглый. Пронумерованные половинки эллипсов изображают молекулы тРНК. Их прямолинейные участки — антикодоны. Черная точка у вершины полуэллипса — аминокислота. Цепочка черных точек, выходящая из Ki — новосинтезированный фрагмент белка. Нижняя точка на этой цепочке — метионин, с которого начинался синтез белка.
Рибосома продвигается вдоль иРНК слева направо скачками — сразу на целый кодон. (Направление движения 5'-3'). Изображен момент, когда такой скачок только что закончился. Освободившаяся тРНК № 1 покидает рибосому. На тРНК № 2, находящейся в «сайте» П, сидит уже синтезированный фрагмент белка. На тРНК № 3 (в сайте А) — следующая аминоацил-тРНК. аа-тРНК № 4 только входит в канал Kg, она еще не сблизилась со «своим» кодоном.
Во время следующего скачка рибосомы вправо последняя аа-тРНК подойдет к этому кодону, «узнает» его и окажется в сайте А, в том положении, которое на рисунке занимает аа-тРНК № 3. В это же время весь фрагмент белка оторвется от тРНК № 2 и присоединится пептидной связью к аминокислоте, принесенной тРНК № 3, а сама эта тРНК уже окажется в сайте П — над вертикальным каналом К1 — в положении, которое на рисунке занимает тРНК № 2. Цепь белка удлинится тем самым на одно звено. «Отработавшая» тРНК № 2 оторвется от своего кодона и начнет выходить из рибосомы.
Теперь обратимся к проблеме генетического кода.
Напомню, что из 64-х триплетных кодонов в иРНК три кодона (УАА, УАГ и УГА) диктуют окончание синтеза белка и снятие рибосомы с иРНК. Остальные кодоны «значащие», то есть диктующие присоединение к синтезируемой цепи белка определенных аминокислот. Надо разобраться в этой «определенности». Мы знаем, что генетический код — вырожденный. 61 кодон иРНК распоряжается включением в белок всего 20-ти аминокислот. Было даже замечено, что на каждую аминокислоту приходится по 3 кодона. На самом деле распределение отнюдь не такое равномерное.
Аминокислоту лейцин
определяет целых 6 кодонов (для простоты изложения не буду их перечислять). Такой же избыток кодонов обнаруживается для серина
и аргинина.
Пять аминокислот (Гли, Вал, Про, Ала и Тре) кодируются с четырехкратным избыт-ком. Изолейцину
соответствуют 3 кодона. Для метионина
существует только один кодон (АУГ). Такое же строгое соответствие имеет место для триптофана,
У остальных девяти аминокислот имеется по 2 кодона.
У четырехкратно, трехкратно и двукратно вырожденных кодонов наблюдается различие только в последнем (считая по направлению движения рибосомы), третьем нуклеотиде кодона. Нередко предполагают, что этот нуклеотид не играет существенной роли и ... 41 кодон «соглашается» с таким пренебрежением. Для «шестикратного вырождения» четырех нуклеоти-дов, которые могут занимать третье положение в кодоне, уже недостаточно. Для Арг и Лей приходится дополнительно признать несущественность и первого нуклеотида их кодонов. Еще хуже обстоит дело с серином. Два из его шести кодонов отличаются от остальных четырех уже в первом и втором йуклеотидах. Что-то слишком много несущественного! Природа этого не терпит.
В утверждении о несущественности столь многих нуклеотидов в кодонах молчаливо предполагается, что транспортных тРНК имеется только 20 — по числу аминокислот (и у каждой — только один из «разрешенных» антикодонов). Так ли это? Быть может вырождение имеет место и для тРНК («изоакцепторные тРНК»)? То есть, для доставки аргинина, лейцина и серина в рибосому существует по шесть различных тРНК с разными
возможными для этих аминокислот антикодонами. Далее аналогично — по четыре, три и две различных тРНК. И только для метионина и трип-тофана — по одной. В этом случае должны существовать 61 различных тРНК. Экспериментальные данные говорят в пользу такого предположения.
«Изоакцепторных», то есть различных, но присоединяющих к себе одну и ту же аминокислоту транспортных РНК имеется не менее 59-ти. (по некоторым подсчетам их еще больше, но это требует проверки, так как суммарные цифры получали из совокупности работ разных авторов). Изоакцепторные тРНК для одной аминокислоты обнаруживают методом колоночной хроматографии, с которым мы будем знакомиться позже.
Но если транспортных РНК столько же, сколько кодонов, то каждый кодон «узнается» ими целиком и никаких нуклеотидов, не играющих существенной роли в кодонах, нет.
При изучении транспортных РНК возникает еще один вопрос, на который пока никто не ответил. В отличие от всех остальных РНК, транспортные РНК обязательно имеют в своей первичной структуре «модифицированные» нуклеотиды. Иногда это только присоединение к нуклеиновому основанию метильной группы (СНд). А иногда — довольно больших атомардых конструкций, размером чуть ли не в само основание. У разных тРНК модификации разные и модифицированные нуклеотиды расположены в различных местах. Чем организм сложнее, тем модифицированных нуклеотидов в его тРНК больше. Зачем они?
Я предлагаю обсудить довольно смелую гипотезу. Молекула тРНК компактна. В ней много спаренных нуклеотидов («шпилек»), образованных связыванием удаленных друг от друга по одиночной нити тРНК, но комплементарных, участков. Можно утверждать, что каждая молекула тРНК имеет вполне определенную и достаточно жесткую пространственную форму. Модификация некоторых нуклеотидов в молекуле, естественно, влияет на эту форму. У высших организмов таких модификаций достаточно много, чтобы иметь право предположить различие пространственных форм всех изоакцепторных тРНК.
Теперь вернемся к рис. 29. Мы видим, что аа-тРНК № 4 только начинает входить в канал Kg. Связаться со своим код оном, «узнать» его она может только внутри канала. Ошибки при проникновении в Kg разных аа-тРНК, очевидно, нежелательны —ведь неподходящей аа-тРНК пришлось бы возвращаться из рибо-сомы обратно в цитоплазму. (Да и непонятно каким образом — ведь для рибосомы движения в обратную сторону быть не может.) А что, если объемная форма тРНК служит «пропуском» в канал? В этом случае конфигурация входа в канал должна «дышать» — перестраиваться под влиянием каждого «ожидающего» кодона, как бы подающего на вход команду для пропуска подходящей тРНК. Слишком сложно? Но не даром же в рибосомах эукариотов почти вдвое больше разных белков, чем у прокариотов. (Принцип работы рибосом, наверное, в обоих случаях одинаков, но проблемы регулирования биосинтеза белка, как мы увидим, у эукариотов значительно сложнее.)
Все эти рассуждения приведена здесь для иллюстрации того, как рождается (и проверяется) научная гипотеза. Для будущих исследователей в области молекулярной биологии раннее знакомство с логикой построения такой гипотезы, я полагаю весьма полезным.
В связи с изложенным материалом имеет смысл по-новому взглянуть на механизм регулирования белкового синтеза, особенно у высших организмов. На классическом примере лак-оперона E.coli Жакоб и Моно предложили знакомую вам концепцию, в которой участвуют «оператор», управляющий разрешением транскрипции структурных генов. Перед оператором стоит «ген-регулятор». Он способен вести синтез белка-репрессора, который связывается с оператором. В свою очередь приходящая извне в клетку молекула-«активатор» может связать репрессор. Регулирование синтеза белков происходит на уровне транскрипции
ДНК-синтеза иРНК. Это хорошо для бактерий, где вся ДНК более или менее доступна для считывания наследственной информации в течение всего времени жизни клетки. При возникновении необходимости наработки нового фермента, например, при изменении питательной среды, РНК-полимераза легко может снять много копий иРНК с нужного участка генома бактерии.
ДНК высших организмов сверхскручена очень тесно, очень плотно упакована. Уместно сказать несколько слов о способе этой упаковки. Геном человека, например, насчитывает около 3-х миллиардов пар оснований (считая по гаплоидному набору хромосом). Во введении было упомянуто, что расстояние между соседними парами в спирали ДНК — примерно 0,34 миллимикрона. Откуда следует, что полная длина «молекулы» ДНК у человека составляет 1 метр! Как такую длину уместить в ядре клетки? Однако даже бытовой опыт подсказывает, что очень длинную, но очень тонкую нить можно свернуть в крошечный клубок. (Еще древние греки умели изготавливаться столь тонкие нити, что сотканное из них платье можно было протянуть через кольцо для пальца.) Но хаотический клубок непригоден. Его трудно распутать. А сворачивание ДНК должно быть хорошо организовано, хотя бы для того, чтобы быстро осуществить редупликацию всей молекулы.
Для этой цели служат специальные белки — «гистоны», тесно связанные с ДНК. Связь эта не ковалентная, а электростатическая. Все гистоны (их насчитывается 5 типов) — суть богатые лизином и аргинином «щелочные» белки. В нейтральной среде они несут достаточно большой положительный заряд, за счет которого притягиваются к отрицательно заряженным остаткам фосфорной кислоты в ДНК. Гистоны для упорядочения свертывания молекул ДНК играют роль, сходную с ролью катушки для ниток. На электронных микрофотографиях удается разглядеть частично развернутый дезоксирибонуклеопротеин (ДНП), как именуют комбинацию ДНК с гистонами, в виде нити, диаметром около 2 тц, на которой тесно расположены своего рода бусинки — «нуклеосомы». Полагают, что основу каждой нуклеосомы составляет октамер из восьми молекул гистонов (4-х типов), образующий подобие сердечника, на который навита двухнитевая спираль ДНК, образуя два витка общей длиной в примерно 150 пар оснований. Линейный отрезок длиной около 50 пар оснований соединяет соседние нуклеосомы.
Более того. В нативном состоянии и эта «нить с бусинками» сворачивается в плотную катушку (вроде соленоида), диаметром около 30 тц. Цепочка таких катушек образует хромосому. Синтез новых иРНК на матрице такой ДНК, скорее всего, возможен только во время клеточного деления, когда мембрана ядра исчезает, плотная упаковка разворачивается и хромосомный материал занимает почти весь объем клетки.
Если это так, то запас иРНК «на все случаи жизни» в клетках эукариотов должен оставаться неизменным. В пользу такого предположения говорит тот ранее упомянутый факт, что у высших организмов иРНК появляется в цитоплазме связанной с неким (может быть защитным) белком в виде «информосомы». Но как же регулируется синтез различных белков iio мере их надобности? Ведь питание клетки через кровь тоже зависит от потребляемой пищи.
Вот тут-то обнаруживается потенциальная ценность вырожденности генетического кода и модификации нуклеотидов изоак-цепторных тРНК.
Предположим, что у некоторых иРНК, кодирующих синтез различных белков, аминокислоте серии
в каком-то одном случае соответствует один определенный код он, а в других случаях — хоть все остальные пять разрешенных кодонов. Предположим далее, что в данный момент в клетке в активном состоянии, т. е. в состоянии готовности участвовать в белковом синтезе, отсутствует или очень слабо представлена изоакцепторная тРНК серина, узнающая именно этот отмеченный нами кодон. Тогда все иРНК, в которых он используется, не будут транслироваться и соответствующие белки синтезироваться. Остальные иРНК, которые не использовали для включения серина наш «злополучный» кодон будут транслироваться нормально.
А что значит «готовность участвовать в белковом синтезе»? Это означает полную модификацию всех оснований, которые должны быть модифицированы именно в этой тРНК. Ведь от полноты модификации зависит объемная форма молекулы тРНК и возможность «пропуска» ее в рибосому.
И такая возможность запрета или разрешения трансляции, а значит и синтеза соответствующих белков имеет место для 59-ти значущих кодонов из 61-го. Очевидно, что возможности регулирования белкового синтеза открываются колоссальные. Регулирование синтеза белков переносится на уровень трансляции —
считывания информации с иРНК. Наконец, кто осуществляет модификацию новообразованных молекул тРНК? Специальные ферменты. Их же активность, в свою очередь, может стимулироваться или подавляться факторами, поступающими в клетку извне.
Это — еще одна гипотеза, еще один материал для дискуссии!
Есть одно косвенное свидетельство в пользу предлагаемой гипотезы, которое можно усмотреть в опубликованных недавно сведениях о том, что разрешенная вырожденность генетического кода для некоторых аминокислот используется отнюдь не равномерно.
В книге Т. A. Bronk «Genomes» (1999 г.) приведена, в частности следующая таблица частоты использования кодонов для трех аминокислот, полученная обобщением обширного материала по сопоставлению расшифрованных генов с аминокислотными последовательностями кодируемых ими белков:
| Аминокислота |
Кодоны |
Частота использования |
| ГЦА |
22% |
| Аланин |
ГЦЦ ГЦГ |
41%
[и%]
|
| гцт |
26% |
| АЦА |
27% |
| Треонин |
АЦЦ |
38% |
| АЦГ |
Li2%J |
| АЦТ |
23% |
| ГТТ |
|11%1 |
| Валин |
ГТА |
25% |
| ГТЦ |
48% |
| ГТГ |
16% |
Как следует из этой таблицы, некоторые кодоны в каждом случае используются редко — быть может для редко синтезируемых белков. Другие же кодоны, как «рабочие лошадки» используются чуть ли не вдвое чаще, чем сред невероятностные 25%.
Литература
1
Барановский П.В., Мельник И.А. Взаимосвязь нарушений общего холестерина и холестерина липопротеидов в сыворотке крови больных инфарктом миокарда. //Кровообращение. -1987. -Т.ХХ. -N 2.-С.17-19
2
Баркаган З.С. Геморрагические заболевания и синдромы. М., Медицина.-1988.-528с.
3
Башкаревич Н.А. Физиология и фармакология терморегуляции. Минск. -1985. -Вып. 2. -С.128-134.
|