Постсинаптическая трансформация сигнала
Введение
Активность нервных окончаний регулируется двумя экзогенными факторами – изменением мембранного потенциала и прямым взаимодействием медиаторов нервных импульсов с рецепторами. В результате этих событий меняется цитоплазматический уровень по меньшей мере вторичных посредников – Са+
, цАМФ, цГМФ, инозитолтрифосфата и диацилглицерина, что приводит к активации соответствующих пулов протеинкиназ: цАМФ-зависимых протеинкиназ; цГМФ-зависимых протеинкиназ; Са-кальмодулин и Са-фосфолипид-зависимых протеинкиназ. Активация протеинкиназ обусловливает фосфорилирование регуляторных белков-мишеней в клетках нервной системы и тем самым модулирует функциональную активность этих клеток.
Определяющий вклад в проблему внутриклеточной регуляции был сделан в 50–60-е годы Э. Сазерлендом, сформулировавшим представление о роли циклических нуклеотидов как вторичных посредников, накапливающихся в клетке в ответ на нейромедиаторный или гормональный стимул и осуществляющих связь между рецепторами и исполнительными системами. В результате дальнейшего развития этих исследований оказалось, что циклический аденозинмонофосфат регулирует обмен белков, углеводов, липидов и нуклеиновых кислот, влияет на проницаемость мембран, электрическую, сократительную и секреторную функции клеток, дифференцировку и пролиферацию. Установлена роль фосфорилирования белков как основного пути действия этого нуклеотила на клетки животных. Найдена связь между содержанием циклических нуклеотидов и характером протекания некоторых патологических процессов в тканях. Описано участие цАМФ и цГМФ в проявлении действия многих лекарственных препаратов на организм. Спустя лишь 10–15 лет после открытия, сделанного Э. Сазерлендом, представления о роли и механизме действия циклических нуклеотидов оказались неотделимыми от современной биохимии, физиологии и медицины. Задача настоящей работы состоит в сравнительно детальном рассмотрении постсинаптических механизмов.
1. цАМФ-Зависимое фосфорилирование
1.1 Аденилатциклаза, ее активация
Синтез в клетке цАМФ из АТФ осуществляет аденилатциклаза. Фермент обнаружен практически во всех тканях млекопитающих. Максимальная активность аденилатциклазы выявлена в мозге, далее в порядке убывания активности фермента ткани можно распределить следующим образом: селезенка, скелетные мышцы, сердце, легкие, почка, печень, жировая ткань. Аденилатциклаза локализована почти исключительно в плазматических мембранах, хотя есть сообщения о присутствии фермента в митохондриальной и микросомальной фракциях.
Реклама

Аденилатциклаза представляет собой мультимолекулярный комплекс, состоящий из рецепторного и каталитического компонентов. Ответ клетки на действие гормона или биологически активного вещества зависит от концентрации рецепторов на поверхности мембраны и степени сопряжения рецепторов с аденилатциклазой. В последнем случае в роли сопрягающего компонента выступают G-белки, обладающие как ГТФ-связывающей, так и ГТФ-гидролизующей активностью.
Рецептия с участием G-белков отличается от других известных систем трансформации внеклеточного сигнала. Все эти системы включают рецептор – дискриминатор сигнала, с высокой специфичностью и чувствительностью "снимающий" внеклеточный сигнал с наружной мембраны. Рецептор может находиться внутри клетки – в том случае, если эффекторы являются липофильными молекулами, легко проникающими через мембрану. Рецепторы для водорастворимых эффекторов встроены в наружную мембрану: эти рецепторы могут быть ферментами; другой тип мембрановстроенных рецепторов сопряжен с ионными каналами. Наконец, рецепторы, которым не присущи свойства ни канала, ни фермента, сопряжены с ферментами-исполнителями с помощью G-белков.
Регуляцию аденилатциклазной системы с участием G-белков можно представить следующим образом. В системе есть два белка, состоящих из субъединиц а, р и у и названных Gs
и Gj. р – у-субъединицы в отличие от а-субъединиц практически идентичны во всех изученных G-белках. а-субъединица содержит участок связывания с гуаниловыми нуклеотидами и обладает ГТФазной активностью. Каждый из G-белков связан со своим рецептором. При образовании комплекса агонистрецептор происходит активация G-белка путем замены в нуклеотидсвязывающем центре ГДФ на ГТФ. При этом изменяется конформация а-субъединицы, что обусловливает ее диссоциацию от комплекса ру. Для диссоциации необходим Mg+
. Активированная а-субъединица G| ингибирует активность аденилатциклазы, в то время как активированная Gs
– стимулирует ее.
Очевидно, почти идентичные по структуре комплексы Ру могут ингибировать аденилатциклазу непрямым способом, а именно, путем связывания с ct-субъединицей Gs
, таким образом "выключая" ее способность стимулировать фермент. Действительно, во многих исследованных тканях, в том числе в нервной, концентрация Gj значительно выше, чем Gs
. Следовательно, возможно высвобождение достаточного количества комплекса Ру из Gi
для соединения со всеми а-субъединицами Gs
. Сопрягающий эффект G-белков прекращается медленным гидролизом связанного ГТФ до ГДФ. G-белки могут быть снова активированы при связывании рецептора с "сигнальной" молекулой.
Реклама

Установлено, что рецепторы многих гормонов собраны в группы, кластеры и малоподвижны в мембране. Поэтому при активации кластера, состоящего из рецепторов одного типа, происходит стимулирование аденилатциклазы и увеличение уровня цАМФ в ограниченном районе клетки. Это ведет к повышению протеинкиназной активности и фосфорилированию субстратов только в данной зоне клетки, в данном компартменте. Компартментализация цАМФ и А-киназы установлена во многих типах клеток: например, стимуляция сердца как с помощью катехоламинов, так и простагландина Ej приводит к увеличению уровня цАМФ и активации протеинкиназы А. Однако катехоламины и простагландин Ej оказывают различное влияние на фосфорилирование фосфорилазы гликогена. Видимо, рецепторы катехоламинов и простагландина и соответствующие постсинаптические системы расположены в разных компартментах клетки.
1.2 Протеинкиназа
Через 10 лет после открытия Сазерлендом цАМФ была обнаружена цАМФ-зависимая протеинкиназа, значительно повышающая скорость фосфорилирования субстратов в присутствии цАМФ. Реакция протеинфосфорилирования выглядит следующим образом:
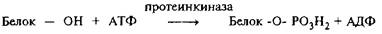
Гидроксильная группа белка, акцептирующая терминальный фосфат АТФ, почти всегда принадлежит серину, реже – треонинуи тирозину. Фосфосериновые остатки в белках существенно ионизированы при физиологических значениях рН, поэтомуфосфорилирование или дефосфорилирование серина резко меняет заряд белковых молекул. После открытия протеинкиназыА стало ясно, что реакции фосфорилирования – дефосфорилирования опосредуют действие многих гормонов и нейромедиаторов, которые через р-адренергическую рецептию активируют аденилатциклазу и приводят к повышению внутриклеточного уровня цАМФ.
Протеинкиназа А обнаружена во всех нормальных клетках млекопитающих, а также в некоторых типах клеток немлекопитающих. Высоким уровнем протеинкиназы А отличается мозг, где фермент распределен равномерно по всем отделам. Для проявления активности фермента необходимы ионы магния. Так, из легких кролика выделен стимулирующий модулятор протеинкиназы, связывающий магний и названный "магмодулином". Протеинкиназа А – тетрамер, построенный из двух различных субъединиц: регуляторной, связывающей цАМФ, и каталитической, осуществляющей фосфотрансферазную реакцию; будучи соединены вместе, они образуют неактивный комплекс. При активации происходит связывание цАМФ Р-субъединицей холофермента, после чего возможна диссоциация Р от К-субъединицы. Свободная К-рубъединица способна катализировать фосфорилирование различных клеточных белков:
Таким образом, в активном состоянии протеинкиназа А представляет димер Р-субъединиц, связанный с 4 молями цАМФ, и 2 свободные К-субъединицы.
Скорость обратной реакции обусловлена не только спонтанной диссоциацией комплексов Р – цАМФ, но и концентрацией К-субъединиц, так как последние высвобождают связанный цАМФ путем рекомбинации с комплексом Р – цАМФ. Этот своеобразный "ретрокооперативный" эффект К-субъединицы, названный так Свилленсом и Дюмоном, ведет к временному увеличению концентрации цАМФ, требуемой для активации протеинкиназы. В период стимуляции системы уровень К-субъединиц резко падает.
Существование эквивалентных количеств каталитических и регуляторных субъединиц цАМФ-зависимой протеинкиназы во многих тканях привело к представлению о том, что единственная функция регуляторной субъединицы – контроль протеинкиназной активности. Однако регуляторная субъединица может существовать отдельно от каталитической в некоторых типах клеток, например в клетках нейробластомы. Это указывает на возможность проявления биологического действия регуляторной субъединицы независимо от каталитической. Далее будет рассмотрена такая возможность на примере изменения проницаемости мембран нейронов для Na+
и К в присутствии Р-субъединицы. Надо также иметь в виду, что цАМФ-связывающие белки, не ассоциированные с протеинкиназой, могут регулировать активность последней путем модулирования уровня свободного циклического нуклеотида, способного присоединяться к протеинкиназе.
Отметим далее, что свободные Р-субъединицы ингибируют фосфодиэстеразу цАМФ, что может приводить к увеличению уровня этого нуклеотида в клетке. Установлено также, что свободные Р-субъединицы протеинкиназы типа А в отличие от холофермента киназы и ее К-субъединицы ингибируют фосфопротеинфосфатазы нескольких типов. Ингибирование обусловлено снижением скорости катализа без изменения сродства к энзиму. Очевидна физиологическая значимость такого ингибирования, так как в этом случае диссоциация А-киназы может способствовать не только стимулированию фосфорилирующей активности, но и ингибированию дефосфорилирования субстратов.
Протеинкиназа А существует в форме двух изоферментов, относительное количество которых варьирует в разных тканях.
Изоферменты были названы киназамиI и II. Они имеют различные скорости диссоциации в присутствии гистона и растворов NaCl и реассоциации после удаления цАМФ. Так, киназа I типа быстро диссоциирует в присутствии гистона или 0,5 М NaCl и медленно реассоциирует после удаления цАМФ; напротив, киназа II типа медленно диссоциирует в присутствии указанных агентов и быстро реассоциирует после удаления цАМФ.
Каталитические субъединицы киназ I и II типа имеют молекулярную массу 40 кД и минимальные различия в аминокислотном составе. Напротив, регуляторные субъединицы киназ I и II типа значительно отличаются по первичной структуре. Вероятно, субъединица Р I типа – 49 кД – является протеолитическим фрагментом Р II типа с молекулярной массой 55 кД. Один из сериновых остатков Р-субъединицы II типа фосфорилируется каталитической субъединицей цАМФ-зависимой протеинкиназы. Очищенная же Р-субъединица I типа не фосфорилируется каталитической субъединицей цАМФ-зависимой протеинкиназы. Другим отличием киназы I типа от II типа является то, что только первый фермент связывает Mg-АТФ с высоким сродством.
цАМФ-зависимые протеинкиназы локализованы в основном в цитозольной фракции клеток. Однако в мозге, например, значительная часть киназы II типа является мембранно-связанной. Очевидно, субклеточная локализация и соотношение киназ I и II типа могут обусловливать специфику действия цАМФ в клетке. Отношение киназы I типа к киназе II типа варьирует в различных органах и в различных фазах клеточного цикла.
При исследовании локализации фосфорилирующих систем в ЦНС установлено, что цАМФ-зависимая система избирательно сконцентрирована в нейронах, особенно в дендритах, а не в глии. Мозг крысы содержит как I, так и и II форму протеинкиназы А при соотношении этих форм 1:4 соответственно. Высокое содержание А-киназы II типа по сравнению с ферментом I типа вообще характерно для нервной ткани. Недавно установлена гетерогенность Р-субъединиц А-киназы II типа. При этом в мозге выявлена собственная, специфичная Р Н-субъединица, отличная по иммунохимическим свойствам от Р-субъединиц II типа в других тканях. Р II мозга отличается от Р II – мышц по характеру взаимодействия с К-субъединицей, а также по электрофоретической подвижности аутофосфорилированных форм. Показано, что фракция Р-субъединиц II типа мозга взаимодействует с Са+
и кальмодулином. Необычные свойства Р Н-субъединицы мозга могут являться следствием адаптации нервных клеток к специфической функции передачи и хранения информации.
Ассоциации А-киназы II типа мозга с мембранной фракцией клеток обусловлены только Р-субъединицей. цАМФ при диссоциации холофермента высвобождает из мембранно-связанного состояния только К-субъединицу; таким образом, компартментализация К-субъединицы изменяется при активации А-киназы. Молекула этой субъединицы гидрофильна, поэтому диссоциация мембранно-связанной А-киназы II типа приводит к транслокации каталитической субъединицы в цитоплазму и далее в ядро. Предполагается, что такая транслокация может обусловливать цАМФ-зависимое изменение экспрессии генов в нейронах, наибольшая концентрация Р-субъединиц А-киназы II типа обнаружена в пре- и постсинаптической мембранах, что свидетельствует о важной роли этой киназы в синаптической передаче.
Различия между регуляторными субъединицами А-киназы II типа нервной и других тканей проявляются также и во взаимодействии этих субъединиц с субстратами киназы. Так, для Р-субъединицы II типа из мозга характерно тесное взаимодействие с МАР-2 – нейроспецифическим белком, локализованным в отростках нейронов, кальцинейрином и другими белками. Такое взаимодействие Р II с субстратами А-киназы может приводить, с одной стороны, к локализации А-киназы II типа около специфических субстратов и, соответственно, в определенных внутриклеточных компартментах, что, очевидно, имеет важное физиологическое значение. С другой стороны, кроме связывания К-субъединицы Р-субъединица II типа нервной ткани может участвовать в регуляции функционирования других белков.
Регуляция активности протеинкиназы А осуществляется несколькими путями. Так, во многих тканях, в том числе и нервной, обнаружен низкомолекулярный термостабильный ингибитор киназы. Ингибитор связывается со свободной К-субъединицей и угнетает ее ферментативную активность. Вероятно, физиологическая роль ингибитора состоит в блокаде фосфорилирующей активности при "базаяном", т.е. нестимулируемом уровне цАМФ. В мозге наблюдается изменение концентрации ингибитора в ответ на некоторые гормональные сигналы, что может иметь определенное значение в долговременной регуляции активности А-киназы. Регуляция активности киназы II типа осуществляется также аутофосфорилированием ее Р-субъединицы; это ведет к повышению активности фермента, что обусловлено уменьшенной скоростью реассоциации фосфорилированной Р со свободной К-субъединицей. Киназа I типа также может быть фосфорилирована, но фосфорилирование ее Р-субъединицы осуществляется цГМФ-зависимой протеинкиназой. Установлено ау-тофосфорилирование К-субъединицы, однако функциональное значение этого процесса неизвестно.
Возможно, что фосфорилирование с помощью свободной К-субъединицы А-киназы и соответствующая активация фосфопротеинфосфатазного ингибитора I, приводящая к снижению активности фосфопротеинфосфатазы I, уменьшает дефосфорилирование комплекса Р-цАЛ1Ф и, следовательно, способствует диссоциации киназы II типа по принципу положительной обратной связи. Такое событие наряду с компартментализацией цАМФ в клетке может способствовать эффективной активации цАМФ-зависимой киназы при незначительном увеличении внутриклеточного уровня цАМФ.
цАМФ-зависимое фосфорилирование белков нервных окончаний оказывает существенное влияние на синаптическую передачу. Так, установлено, что мутации у дрозофил, изменяющие метаболизм цАМФ, приводят к плейотропным нарушениям механизма обучения. У моллюска аплизии серотонинергическая синаптическая передача усиливается инъекцией цАМФ в нейрон или инкубацией ганглия с блокаторами фосфодиэстеразы. Так как известно, что входящий ток кальция является непременным посредником в осуществлении синаптического действия, полагают, что серотонин усиливает такой ток посредством повышения внутриклеточного уровня цАМФ и активности А-киназы. Прямые доказательства осуществления этого механизма получены в экспериментах, где отмечено увеличение Са-проводимости нейронов улитки при инъекции в них К-субъединицы А-киназы. Блокаторы протеинкиназы А оказывают противоположный эффект – быстрое снижение Са-проводимости.
Повышение уровня ионизированного Са+
внутри клетки при открывании Са-каналов может способствовать снижению в ней содержания цАМФ за счет активации Са – КМ-зависимой фосфодиэстеразы и по принципу отрицательной обратной связи приводить к переходу Са-каналов в неактивное состояние. Введение в нейрон теофиллина замедляет процесс ослабления Са-проводимости. Таким же влиянием на кальциевую проводимость обладают ингибиторы кальмодулина, например трифтазин.
Таким образом, функционирование Са-каналов прямо регулируется протеинкиназой А, осуществляющей фосфорилирование их белковых компонентов, а также опосредованно контролируется гормонами, медиаторами и другими факторами, вызывающими или активацию аденилатциклазы, или ее ингибирование. При нарушении фосфорилирования каналы быстро теряют способность активироваться под действием изменения трансмембранного электрического поля. В течение некоторого времени это состояние является обратимым и фосфорилирование снова переводит каналы в рабочее состояние либо изменяя кинетику их активации, либо включая ранее неактивные каналы. При длительном нарушении цАМФ-зависимого фосфорилирования каналы подвергаются необратимым изменениям.
Дополнительный путь для токов Са+
внутрь клетки могут образовывать хемоуправляемые каналы, непосредственно активируемые медиаторными веществами в ответ на их взаимодействие с рецепторами. В отличие от электроуправляемых Са-каналов время жизни этих каналов существенно больше, однако относительное количество ионов, переносимых через хемоуправляемые каналы, вероятно, невелико по сравнению с электроуправляемым путем. По ряду данных хемоуправляемые каналы полностью инактивируются при увеличении внутриклеточного содержания цАМФ.
Заслуживает также рассмотрения участие цАМФ в К- и Na-проводимости мембраны.
Известно, что болевое раздражение усиливает рефлекс втягивания жабры у моллюска эплизии за счет модуляции секреции передатчиков сенсорными нейронами. Повышение чувствительности происходит за счет снижения К-проводимости и соответствующего увеличения продолжительности потенциала действия, в результате чего усиливаются Са-рефлекс и экзоцитоз. Болевое раздражение вызывает выделение серотонина "облегчающим" нейроном в окончаниях сенсорных нейронов. Серотонин, в свою очередь, увеличивает синтез цАМФ, активность протеинкиназы А и степень фосфорилирования белка, тесно связанного с К-каналом. В результате происходит закрытие канала. Блокада К-каналов приводит к тому, что приходящий в нервное окончание потенциал действия спадает медленно: "продленные" потенциалы действия удерживают потенциал-зависимые Са-каналы в открытом состоянии, вследствие чего приток ионов Са возрастает. Это, в свою очередь, ведет к опорожнению большего числа синаптических пузырьков. К блокаде К-каналов приводит также добавление АТФ и К-субъединицы протеинкиназы А в мембранные препараты нейронов; добавление протеинфосфатазы обусловливает открывание К-каналов.
Электрозависимые Na-каналы ответственны за формирование потенциала действия в возбудимых мембранах. Установлено, что в синаптосомах мозга а-субъединица №^каналов, играюшая центральную роль в функционировании этих каналов, фосфорилируется как эндогенной, так и экзогенной протеинкиназой А. Фосфорилирование приводит к ингибированию активированного нейротоксинами входящего Na-тока. Таким образом, активность Са-каналов, К-каналов и Na-каналов нейронов модулируется под действием протеинкиназы А и / или через изменение скорости их дефосфорилирования протеинфосфатазами.
Отметим, что протеинкиназа А в нервной ткани регулирует также чувствительность р-адренорецепторов к агонистам. Так, десенситизация этих рецепторов коррелирует с их цАМФ-зависимым фосфорилированием. Установлена также регуляция А-киназой биосинтеза самих р-агонистов. Эта регуляция осуществляется с помощью цАМФ-зависимого фосфорилирования тирозингидроксилазы – узлового фермента биосинтеза катехоламинов. Такое фосфорилирование может быть составной частью механизма ускорения биосинтеза катехоламинов в ответ на нервный импульс или секрецию нейромедиаторов в нервной ткани в условиях invivo,
Остановимся на роли цАМФ и еще одного вторичного посредника – 2', 5'-олигоаденилатав регуляции пролиферации и дифференцировки нервных клеток. 2–5А – это олигонуклеотид, состоящий из нескольких остатков АМФ, связанных 5'-фосфодиэфирной связью. В клетке существуют 2 фермента, обеспечивающие определенный уровень 2–5А. Олигосинтетаза– фермент биосинтеза 2–5А, активен лишь в присутствии двуспиральной РНК; молекулярная масса – 100–105 кД. 2'-Фосфодиэстераза гкдролизует 2–5А до АМФ и АТФ, молекулярная масса этого фермента около 40 кД.
Чтобы оценить биохимическое и физиологическое значение процессов образования 2–5А, необходимо остановиться на механизмах подавляющего влияния цАМФ на пролиферативный статус нервных клеток. Так, действие ряда факторов, в частности фактора роста нервов, а также повышение уровня цАМФ, вызванное теофиллиномили дибутирил-цАМФ, приводит к остановке деления и дифференцировке этих клеток. Действие теофиллина в отличие от фактора роста нервов или дибутирильного аналога цАМФ носит кратковременный характер. Повышение концентрации цАМФ в результате ингибирования фосфодиэстеразы под действием теофиллина, как и в случае фактора роста нервов и дибутирил-цАМФ, приводит к блокаде активного деления и дифференцировке нервных клеток. Однако в дальнейшем падение активности фосфодиэстеразы, обусловленное теофиллином, и соответствующее увеличение уровня цАМФ компенсируется индукцией биосинтеза этого фермента. Именно этим и объясняется кратковременное действие теофиллина.
Повышение уровня цАМФ в нервных клетках, вызванное действием факторов, непосредственно влияющих на аденилатциклазную систему, сопровождается более чем 10-кратным увеличением концентрации 2–5А. Установлено, что рост уровня олиго синтетазы и концентрации 2–5А наблюдается при дифференцировке клеток и замедлении клеточного деления.
Исследование биологических свойств 2–5А показало, что этот олигоиуклеид способен обратимо активировать специфическую латентную нуклеазу, ускорять гидролиз РНК и, таким образом, ингибировать синтез белка invivoи тормозить процесс размножения клеток. Следовательно, повышение уровня 2–5А и изменение концентрации цАМФ является частью универсального механизма регуляции клеточного деления. К настоящему времени установлены два взаимодополняющих процесса, с помощью которых осуществляются эти регуляторные реакции. С одной стороны, стимуляция А-киназы при повышении уровня цАМФ приводит к фосфорилированию белка сМг
– 18 кД. Этот белок в виде фосфоформы является ингибитором активности 2' – фосфодиэстеразы – фермента гидролиза 2–5А. С другой стороны, повышение концентрации цАМФ внутри клетки вызывает индукцию олиго синтетазы. осуществляющей синтез 2–5А.
Совокупность этих событий приводит к устойчивому повышению уровня 2–5А и связанному с этим переходу нервных клеток в состояние покоя. По-видимому, именно таким образом осуществляется ярко выраженный антинролиферативный эффект цАМФ, вызванный действием этого вторичного посредника на систему метаболизма 2–5А. При этом взаимное влияние уровней цАМФ и 2–5А основано на механизме отрицательной обратной связи. Так, установлено, что подъем уровня 2–5А, обусловленный увеличением внутриклеточной концентрации цАМФ по указанным механизмам, в свою очередь, способствует активации фосфодиэстеразы цАМФ. В результате происходит снижение уровня цАМФ и прекращение роста концентрации 2–5А, который является в этом случае вторичным посредником в проявлении антипролифера-тивного действия цАМФ.
1.3 Фосфодиэстераза
В прекращении сигнала цАМФ участвуют фосфодиэстераза, гидролизующая этот нуклеотид до АМФ. В противоположность аденилатциклазе фосфодиэстераза – преимущественно растворимый фермент. В то же время активность фермента обнаружена во фракциях саркоплазматического ретикулума, митохондрий и ядер.
Циклонуклеотидактивируемая фосфодиэстераза гидролизует как цАМФ, так и цГМФ, при этом под действием цГМФ ускоряется гидролиз цАМФ и наоборот, что свидетельствует о положительной кооперативности двух активных центров. Несомненна роль фермента в проведении нервного импульса: так, в постсинаптической мембране нервной ткани обнаружен необычайно высокий уровень фосфодиэстеразы цГМФ.
Для фосфодиэстеразы характерно наличие множественных форм. Эти формы различаются как по молекулярной массе, так и по сродству к одному и тому же и к различным циклическим нуклеотидам. В целом, сродство к циклическим нуклеотидам у фосфодиэстераз в 100–1000 раз ниже, чем у протеинкиназ А и G, поэтому при ускорении синтеза нуклеотидов сначала происходит насыщение циклическими нуклеотидами регуляторных центров киназ и лишь затем – гидролиз цАМФ и цГМФ фосфодиэстеразами.
В мозге содержатся Са-кальмодулинрегулируемые формы как цАМФ-синтезирующего, так и цАМФ-гидролизующего ферментов. Са-кальмодулинзависимая фосфодиэстераза представляет собой гомодимер, состоящий из субъединиц с различной молекулярной массой у разных изоформ фермента. Ограниченный протеолиз субъединицы 60 кД приводит к появлению фрагмента с Мг
= 36 кД и необратимой активации фосфодиэстеразы. Фрагмент 36 кД более не активируется кальмодулином. Следовательно, субъединицы фосфодиэстеразы включают 2 фрагмента: каталитический и регуляторный.
Анализ регуляторных свойств фосфодиэстеразы в нервной ткани свидетельствует о тесном сопряжении между цАМФ- и Са-зависимыми системами внутриклеточной сигнализации; это сопряжение может модулироваться с помощью изоферментов фосфодиэстеразы. Так, в мозге быка найдены 2 изоформы Са-КМ-зависимой фосфодиэстеразы, состоящей из субъединиц с Мг
= 60 и 63 кД. Изофермент с субъединицами 60 кД может быть фосфорилирован цАМФ-зависимой протеинкиназой, что приводит к уменьшению сродства фосфодиэстеразы к кальмодулину. Дефосфорилирование этого изофермента осуществляет Са-КМ-стимулируемая протеинфосфатаза; при этом восстанавливается чувствительность фосфодиэстеразы к кальмодулину.
В отличие от изофермента с субъединицами 60 кД фосфорилирование изоформы фосфодиэстеразы с субъединицами 63 кД осуществляется Са-КМ-зависимыми протеинкиназами. Это фосфорилирование также приводит к потере чувствительности фосфодиэстеразы к кальмодулину и "обращается" Са-КМ-стимулируемой протеинфосфатазой с восстановлением чувствительности фосфодиэстеразы к КМ. Очевидно, такой механизм регуляции фосфодиэстеразы реализуется в мозге invivo, несмотря на очень высокую, "насыщающую" концентрацию в нем КМ. Фосфорирование снижает сродство фермента к КМ и обусловливает зависимость его активности от физиологических концентраций Са+
.
В нервной ткани, таким образом, существует тесная взаимосвязь между двумя системами вторичных посредников, Са+
и цАМФ, осуществляемая посредством цАМФ- и Са-зависимого фосфорилирования-дефосфорилирования различных изоферментов фосфодиэстеразы цАМФ. Эта взаимосвязь может модулироваться также различным сродством к Са+
аденилатциклазы, фосфодиэстеразы, протеинкиназы и фосфатазы. Так, аденилатциклаза мозга активируется гораздо более низкими концентрациями Са чем фосфодиэстераза.
Кроме циклических нуклеотидов, Са+
и ограниченного протеолиза фосфодиэстеразу активируют также полианионы, фосфолипиды, жирные кислоты. Ингибиторами или активаторами фермента являются многочисленные фармакологические вещества. Фосфодиэстераза является более "удобной" мишенью для действия лекарственных препаратов, чем аденилатциклаза, так как менее специфична в отношении эффекторных влияний. Мощными ингибиторами фосфодиэстеразы являются производные ксантинов – ингибирование осуществляется блокадой аллостерического центра связывание нуклеотидов.
2. цГМФ-зависимое протеинфосфорилирование
Вскоре после открытия цАМФ-зависимых протенкиназ был обнаружен еще один класс циклонуклеотидзависимых фосфорилирующих ферментов, стимулируемых с помощью цГМФ, – протеинкиназыG. В тканях млекопитающих содержание протеинкиназ G весьма невелико. Наиболее высок уровень активности и содержания протеинкиназ G в мозжечке, сердечной мышце и легких, эти же ткани содержат и наибольшее количество цГМФ, не превышающее, впрочем, 10% от содержания в них цАМФ. Основное количество протеинкиназы G обнаружено в цитозоле, некоторая часть фермента связана с цитоплазматическими мембранами и ядерной фракцией.
Фермент состоит из двух примерно идентичных субъединиц, каждая из которых имеет каталитическую активность и способна связывать циклический нуклеотид. Ограниченным протеолизом можно перевести димер в мономеры и затем разделить каждую субъединицу на цГМФ-связывающий и каталитический фрагменты. Эти исследования наряду с выявленной гомологией между протеинкиназой G и протеинкиназой А II типа по субстратной специфичности, аминокислотной последовательности, способности к аутофосфорилированию, иммунологическим свойствам привели к представлению о том, что цАМФ и цГМФ-зависимые протеинкиназы эволюционировали от общего гена, кодирующего одну полипептидную цепь. В процессе развития цАМФ-зависимый фермент стал синтезироваться в виде разобщенных компонентов, тогда как цГМФ-зависимая протеинкиназа синтезируется как одна цепь.
В отличие от каталитической субъединицы протеинкиназы А, способной высвобождаться во время активации фермента, внутриклеточное перемещение "недиссоциированной" протеинкиназы G может быть затруднен. На основании аминокислотного анализа протеинкиназы G было установлено, что одна субъединица фермента содержит два центра связывания нуклеотида.
Регуляторная N-концевая половина молекулы протеинкиназы G сходна с семейством цАМФ-связывающих белков, в то время как каталитическая Сконцевая половина родственна группе киназ с различной специфичностью. Протеинкиназа G способна к аутофосфорилированию из расчета 2 моля фосфата на 1 моль холофермента. Аутофосфорилирование не изменяет сродства к цГМФ и незначительно повышает Vmakc
фосфотрансферазной реакции, но заметно увеличивает сродство протеинкиназы G к цАМФ. Таким образом, аутофосфорилирование может обусловливать регуляцию протеинкиназы G не только с помощью цГМФ, но и цАМФ.
Протеинкиназа G фосфорилирует, вероятно, те же аминокислотные остатки в молекуле субстрата, что и протеинкиназа А, но с гораздо меньшей скоростью. Различная скорость фосфорилирования протеинкиназ А и G может являться основой их субстратной специфичности.
Как упоминалось, наибольшее содержание протеинкиназы G в нервной ткани отмечено в мозжечке. В свою очередь, в этом отделе мозга фермент локализован в клетках Пуркинье. Найдена корреляция между увеличением содержания G-киназ в цитоплазме клеток Пуркинье, началом роста дендритов и установлением синаптических контактов в клетках Пуркинье и подобных им субкортикальных клетках, что может свидетельствовать в пользу безусловной значимости цГМФ-зависимого фосфорилирования для нейрональной дифференцировки этих клеток. В клетках Пуркинье находится и единственный в мозге млекопитающих специфичный субстрат для протеинкиназы G, названный G-субстратом; G-субстрат – кислоторастворимый и термостабильный белок с Мг
= 23 кД. Обнаружено, что фосфорилированный с помощью цГМФ-зависимой протеинкиназы G-субстрат ингибирует протеинфосфатазу, выделенную из мозжечка, являясь специфичным для клеток Пуркинье протеинфосфатазным ингибитором. При этом ингибируемая фосфатаза из этих клеток, вероятно, катализирует дефосфорилирование белков, не являющихся субстратами протеинкиназы А.
Увеличение уровня цГМФ обусловлено взаимодействием с плазмалеммой различных гормонов и нейромедиаторов. Так активируется связанная с мускариновыми рецепторами гуанилатциклаза Активация гуанилатциклазы обычно обусловлена мобилизацией Са+
из эндоплазматического ретикулума.
В клетках мозга обнаружен термостабильный белок, стимулирующий активность протеинкиназы G, но не изменяющий активность протеинкиназы А. Обратный процесс – инактивация протеинкиназы G состоит в гидролизе цГМФ фосфодиэстеразой, специфичной для этого нуклеотида. Кроме того, в тканях млекопитающих, в том числе и нервной, найден ингибитор G-киназы с Мг
= 15 кД.
Отметим, что системы циклических нуклеотидов осуществляют внутриклеточную регуляцию в тесном взаимодействии друг с другом. Так, например, если концентрация цАМФ в клетке длительное время повышена, может происходить фосфорилирование белков, встроенных в каналы плазматической мембраны, что приводит к повышению в цитоплазме концентрации Са+
. В результате этого активируются фосфодиэстераза и гуанилатциклаза; соответственно ускоряется гидролиз цАМФ и образуется цГМФ.
Итак, цГМФ играет важную роль в нервной системе, особенно в клетках Пуркинье мозжечка. Об этом свидетельствует избирательная локализация в этих клетках всех компонентов системы цГМФ, включая гуанилатциклазу, протеинкиназу G и G-субстрат. Различные нейромедиаторы, в том числе ацетилхолин, вызывают увеличение уровня цГМФ в клетках Пуркинье и активацию G-киназы, что, по всей видимости, модулирует такие свойства этих клеток, как скорость проведения возбуждения и способность к стимуляции.
Установлено также, что цГМФ модулирует активность ионных каналов мембран нервных клеток. Так, введение в нейроны улитки цГМФ или G-киназы увеличивает проводимость Са-каналов.
3. Са-кальмодулинзависимое протеинфосфорилирование
Как упоминалось, в процессе эволюции выработались эффективные механизмы удаления Са+
во внеклеточное пространство или специализированные внутриклеточные структуры. Низкая внутриклеточная концентрация Са+
позволила клеткам использовать "впрыскивание" Са+
в цитоплазму как сигнал на внешние воздействия. При этом кальций может быть даже более универсальным внутриклеточным регулятором, чем цЛМФ. Так, период действия Са+
очень короток и измеряется миллисекундами, а не секундами, как в случае цАМФ. Как стало понятно в последнее время, обе системы вторичных посредников функционируют в тесном взаимодействии.
Для внутриклеточной "реализации" кальциевого сигнала в процессе эволюции созданы специальные внутриклеточные белковые рецепторы Са+
, способные опосредовать действие этого иона на молекулярные мишени. Основным рецептором Са+
во всех клетках является кальмодулин. Кальмодулин – глобулярный белок сМг
– 16,5 кД. Структурно он очень консервативен: так, обнаружено только шесть или немногим более аминокислотных замен в кальмодулине, выделенном из живых объектов, эволюционно разделенных миллионами лет. Кальмодулин содержит 4 Са-связывающих участка: в состав каждого из этих участков входят кислые остатки аминокислот, необходимые для связывания Са+
и обусловливающие низкое значение изоэлектрической точки KM. Фосфорилированных форм КМ не обнаружено.
Кальмодулин локализован главным образом в цитоплазме, а также ассоциирован с различными клеточными структурами, микротрубочками и мембранами, включая постсинаптические мембраны. Внутриклеточное распределение КМ регулируется циклическими нуклеотидами. Так, цАМФ-зависимый транспорт Са+
через клеточные мембраны может изменять сродство КМ к мембранной и цитоплазматической фракциям клетки.
При стимулировании происходит связывание Са+
с КМ. В результате кальмодулин претерпевает конформационные изменения: экспонирование гидрофобного участка при этом – важное условие для последующего взаимодействия КМ с акцепторными белками. Среди ферментов-исполнителей, активность которых модулируется в присутствии КМ, непосредственное отношение к регуляторным реакциям внутриклеточного протеинфосфорилирования имеют Са-КМ-зависимые протеинкиназы, аденилатциклаза, фосфодиэстераза циклических нуклеотидов и КМ-зависимая протеинфосфатаза.
На первый взгляд, способность КМ во многих тканях активировать системы как синтеза, так и деградации цАМФ выглядит парадоксом. Однако локализация ферментов аденилатциклазы в мембране, а фосфодиэстеразы в интозоле обусловливает преимущественную Са-активацию аденилатциклазы. Кроме того, для полной активации аденилатциклазы достаточно комплекса КМ-Са+
, а для фосфодиэстеразы необходимо заполнение третьего, а возможно, и четвертого Са-связывающего участка КМ. Это означает, что аденилатциклаза активируется при более низких концентрациях Са+
.
Результатом действия Са+
и кальмодулина часто является фосфорилирование, катализируемое Са-КМ-зависимыми протеинкиназами. К настоящему времени обнаружено 3 тина КМ-зависимых протеинкиназ В, которые в порядке убывания молекулярной массы обозначаются как протеинкиназы ВI, II и III. Основные различия этих типов протеинкиназы В относятся к их субстратной специфичности. Так, протеинкиназа В I типа фос-форилирует лишь несколько белков в нервной ткани, в то же время для киназы II типа только в головном мозге найдено более 10 субстратов. Сродство этих протеинкиназ к КМ практически одинаково, что свидетельствует об одинаковой структуре КМ-узнающего участка фермента.
В нервной ткани, где концентрация Са-КМ-зависимых протеинкиназ особенно высока, обнаружены специфические изоферменты В-киназ I и II типа. Так, в мозге быка найдено, по меньшей мере, 3 изофермента В-киназы I типа. Высокомолекулярные олигомерные В Н-киназы из лобных долей мозга и мозжечка отличаются по субъединичному составу. Если первый фермент состоит из субъединиц а и р с Мг
= 50/55 и 60/65 кД в молярном соотношении 3:1, то В-киназа из мозжечка имеет другое соотношение этих субъединиц – 1:4. Гетерогенность и высокая концентрация В-киназ в нервной ткани может обусловливать физиологическую значимость Са-КМ-зависимого фосфорилирования в клетках нервной системы.
Как установлено, протеинкиназа В II типа составляет примерно 0,4% от общего белка головного мозга млекопитающих, что свидетельствует о важной регуляторной роли фермента в этом отделе ЦНС. В-киназа II типа преимущественно связана с мембранной фракцией в отличие от "цитоплазматической" киназы В I типа. Мембраносвязанный фермент II типа сконцентрирован в области постсинаптического уплотнения в тех отделах нервной системы, которые связаны с обучением. Киназа В II типа обладает свойствами двухфазного переключателя со стабильностью, необходимой для кодирования долговременной памяти.
КМ-зависимые протеинкиназы могут быть разделены на 2 группы по структурным особенностям. Так, в одной группе КМ является интегральной частью фермента, а в другой – способен обратимо диссоциировать от протеинкиназы. Примером первого случая может служить киназафосфорилазы, [Три активации фермента Са+
связывается с субъединицей фермента, являющейся кальмодулином. Около 20 лет назад было обнаружено стимулирующее действие на киназу фосфорилазы протеинкиназы А. К настоящему времени установлено, что 10–20 кратное увеличение активности фермента может быть вызвано цГМФ-зависимой и КМ-зависимой протеинкиназами. Участие экзогенного КМ в регуляции активности киназы фосфорилазы происходит только при отсутствии стимулов, приводящих к увеличению внутриклеточного содержания цАМФ. Гликоген и ферменты его метаболизма присутствуют в глии и нейронах: электростимулируемое расщепление гликогена в нервной ткани регулируется посредством активации киназы фосфорилазы.
Киназа легких цепей миозина является представителем второй группы КМ-зависимых протеинкиназ. Регуляция с помощью КМ-киназы легких цепей миозина осуществляется по принципу "все или ничего". Так, в отсутствие КМ фермент практически не активен, а при действии комплекса Са-КМ его активность возрастает в 200–300 раз. Установлено, что АТФазная активность актомиозина мозга увеличивается в 2–3 раза при фосформировании миозина киназой легких цепей.
Как упоминалось, активность КМ-зависимых протеинкиназ модулируется аутофосфорилированием. Аутофосфорилирование 2 субъединиц киназы фосфорилазы приводит к значительному увеличению ее активности. Аутофосфорилирование регулирует также компартментализацию В-киназ в нервных клетках, как это показано на нейронах аплизии. В присутствии комплекса Са-кальмодулин или цАМФ происходит транслокация активности В-киназы в цитозоль из мембраноцитоскелетной фракции. В-киназа тесно ассоциирована с определенными белками цитоскелета и мембран: фосфорилирование этих белков, как показано на препаратах мозга крыс, приводит к ослаблению сродства В-киназ к мембранам и цитоскелету.
Очевидно, что изменения в содержании цитоплазматического Са+
имеют множественные последствия для синаптической функции, особенно для экзоцитоза. Мишенью ряда регулирующих экзоцитоз лекарственных препаратов и антител может быть кальмодулин. Установлено, что запускаемая деполяризацией секреция вазопрессина и окситоцина из нервных терминалей гипофиза является Са-зависимой и не требует участия цАМФ или протеинкиназы С, причем комплекс Са – кальмодулин связывается с белками мембран секреторных гранул, представляющими собой, вероятно, субъединицы специфичной протеинкиназы. Следствием этого процесса является усиление экзоцитоза посредством слияния мембран секреторных гранул с цитоплазматической мембраной.
В секреции нейромедиаторов принимают участие протеинкиназы В I и II типа, а также протеинкиназы А и С. Взаимодействие этих протеинкиназ отчетливо проявляется при фосфорилировании синапсинов– специфических белков синаптических структур. Один из этих белков – синапсин I, составляющий 6% от общего белка высокоочищенных синаптических везикул и являющийся своеобразным "мостиком" между везикулами и цитоскелетом, фосфорилируется протеинкиназой В I типа и протеинкиназой А по одному остатку серина. Два других остатка серина в молекуле синапсина I фосфорилирует протеинкиназа В II типа и, вероятно, протеинкиназа С. В нейронах найден так называемый протеин-Ш – белок, также связанный с синаптическими мембранами и по ряду свойств напоминающий синапсин I. Протеин-Ш по единственному остатку серина фосфорилируют как протеинкиназа А, так и протеинкиназа В I типа. Очевидно, цАМФ- и Са-зависимое фосфорилирование синапсина I и протеина-III обеспечивает регуляцию секреции нейромедиаторов. Так, инъекция в синапс В-киназы II типа увеличивает секрецию, в то время как инъекция дефосфорилированного синапсина I угнетает высвобождение нейромедиаторов. Для эффективной секреции необходимо одновременное фюсфорилирование синапсина I А-, В- и С-киназами. Секреция нейромедиаторов регулируется, по-видимому, разрывом связи фосфорилированного синапсина I с актином и тубулином. В результате везикулы высвобождаются из комплекса с белками цитоскелета и становится возможной Са-индукция экзоцитоза. Предполагается также, что сконцентрированные в синаптических окончаниях молекулы В-киназы II типа сами по себе являются стерическим препятствием для высвобождения медиаторов из секреторных везикул. Аутофосфорилирование киназы способствует ее диссоциации на субъединицы и, таким образом, стимулирует секрецию.
Важную роль в функционировании нейронов играет совместное фосфорилирование протеинкиназами А II типа и В II типа высокомолекулярного белкаМАР-2, сконцентрированного в дендритах нейронов. Как упоминалось, именно здесь локализована Р-субъединица А-киназы II типа, которая обладает высоким сродством к МАР-2 и является своеобразным "якорем" цАМФ-зависимой фосфорилирующей активности в дендритах. МАР-2 участвует в сборке микротрубочек: фосфорилирование этого белка киназами В и АII типа контролирует процесс сборки и, таким образом, может модулировать функциональную активность нейронов. МАР-2 фосфорилирует также протеинкиназа С; роль этого процесса в функционировании нейронов выясняется.
Предполагается, что комплекс МАР-2 – Р-субъединица А-киназы II типа может изменять проницаемость мембран нейронов для Na+
и К+
без фосфорилирования К-субъединицей киназы. Возможно, сигналом для такого изменения мембранной проницаемости является взаимодействие цАМФ с Р-субъединицей протеинкиназы II типа, ассоциированной с МАР-2. Сигнал распространяется по цитоскелету к мембране нейронов с очень высокой частотой; для поддержания такой частоты достаточное время требуется энергия АТФ.
Синергизм в действии протеинкиназ В и А в нервной ткани проявляется также при потенцировании цАМФ-индуцируемых входящих токов внутриклеточными ионами Са. Повышение внутриклеточной концентрации цАМФ в нейронах виноградной улитки приводит к деполяризации мембраны, а в условиях фиксации потенциала – к возникновению ионного тока по каналам пассивной проницаемости. Увеличение внутриклеточной концентрации Са+
приводит к значительному увеличению амплитуды и длительности цАМФ-тока.
Можно полагать, что синергическое действие Са+
и иАМФ на соответствующие ионные каналы связано с наличием у последних двух различных участков фосфорилирования; для В- и А-киназ. Возникающие под влиянием КМ-зависимого фосфорилирования изменения в структуре канала обеспечивают повышение доступности соответствующего участка фосфорилирования для протеинкиназы А. Напротив, при изучении влияния внутриклеточного Са+
на Са-зависимые калиевые каналы взаимодействие двух систем вторичных посредников отличается тем, что цАМФ выступает в роли агента, повышающего чувствительность канала к внутриклеточному Са+
и КМ. Можно полагать, что регуляция числа каналов и их активности с помощью протеинфосфорилирования связана с изменениями в процессах поведения и обучения.
В последнее время появились данные о регуляции протеинкиназной и протеинфосфатазной активности с помощью Са-связывающего белка S-100. S-100 активирует фосфопротеинфосфатазы мозга, а также модулирует активность ядерных и цитоплазматических протеинкиназ этой ткани, в частности К-субъединицы протеинкиназы A. S-100 ингибирует фосфорилирование ряда субстратов в клетках мозга; кальмодулин активирует фосфорилирование этих же белков. Возможно, S-100 и кальмодулин действуют в мозге как антагонисты. Во всяком случае, в нервной ткани реализуется еще один путь Са-зависимого фосфорилирования-дефосфорилирования, независимый от КМ-стимулируемого процесса. S-100-стимулируемое фосфорилирование-дефосфорилирование может принимать участие в регуляции ряда функций нервных клеток.
Необходимо отметить участие В-киназы II типа наряду с протеинкиназой А в фосфорилировании и соответствующей активации т! фозингидроксилазы, что приводит к ускорению синтеза катехоламинов в ответ на нервный импульс и нейромедиаторный сигнал. Установлено, что тршггофангидроксилаза – фермент, катализирующий первую реакцию биосинтеза серотонина, также фосфорилируется протеинкиназой В II типа. Фосфорилирование триптофангидроксилазы приводит к двукратному увеличению ее активности. Таким образом, Са-КМ-зависимое фосфорилирование ферментов, принимающих участие в синтезе нейромедиаторов и гормонов, является одним из ключевых аспектов участия В-киназ в нейрогуморальной регуляции.
Отметим, что на основании результатов многочисленных исследований установлена тесная взаимосвязь между процессами, регулируемыми Са+
, цАМФ и 2–5А. Это дает основание для их рассмотрения в рамках единой регуляторной системы. Взаимодействие Са+
, цАМФ и 2–5А обусловлено двумя типами регуляторных связей. Во-первых, ряд жизненно важных для клеток реакций контролируется этими вторичными посредниками одновременно. Так, например, активность киназы фосфорилазы гликогена зависит от цАМФ и Са+
, скорость синтеза белка полирибосомами контролируется с помощью фосфорилирования А-киназой и уровнем 2–5А и т.д. Во-вторых, увеличение внутриклеточного уровня одного из посредников приводит к изменению содержания других. Так, возрастание уровня пАМФ обусловливает индукцию олигосинтетазы и ингибирование 2'-фосфодиэстеразы, что приводит к увеличению концентрации 2–5А. В свою очередь, Са* и 2–5А активируют фосфодиэстеразу цАМФ и тем самым вызывают падение уровня цАМФ. Кроме того, увеличение внутриклеточного уровня цАМФ приводит к выбросу Са+
из митохондрий в цитоплазму и высвобождению кальмодулина из примембранных компартментов.
4. Са+
-фосфолипид-зависимое протеинфосфорилирование
4.1 Образование диацилглицерина и инозитолфосфатов
Эта группа вторичных посредников образуется при активации фосфолипазыС, локализованной в наружной клеточной мембране. Для ее активации необходимо связывание ряда гормонов и нейромедиаторов, известных своей способностью увеличивать концентрацию Са+
в цитозоле, с соответствующими рецепторами. К числу агонистов, стимулирующих фосфолипазу С, относят ацетилхолин, норадреналин, гистамин, серотонин, а также ряд гормонов белковой природы и ростовых факторов. Сопряжение фосфолипазы С с рецепторами достаточно специфично; например, из 4 известных основных типов адренорецепторов характерно только для c-типа, а из 2 типов холинорецепторов – только для мускарин-чувствительного, но не для никотинчувствительного. Так же, как и в случае аденилатциклазы, для сопряжения рецептии и активации фосфолипазы С необходимы G-белки, иногда называемые Gp
. Установлено, что белок типа Gj также может непосредственно принимать участие в регуляции фосфолипазы С, а Gs
– опосредовано, путем цАМФ-зависимого ингибирования фосфолипазы С.
Субстратом фосфолипазы С является фосфатидилинозитол-дифосфат– относительно редкий фосфолипид мембран.
Фермент расщепляет фосфатидилинозитолдифосфат на липидный компонент диацилглицерин, который остается в мембране, и водорастворимый инозитолтрифосфат. Если в системе цАМФ трансмембранный перенос информации происходит с образованием одного вторичного посредника, то в фосфоино-зитидной системе идет раздвоение пути передачи сигнала, так как в результате образуются два различных вторичных посредника: диацилглицерини инозитолтрифосфат. Они действуют в клетке согласованно и активируют соответствующие пулы протеинкиназ.
Инозитолтрифосфат стимулирует высвобождение кальция из эндоплазматического ретикулума, при этом активируется семейство Са-КМ-зависимых протеинкиназ. Его концентрация, необходимая для достижения максимальной скорости высвобождения Са+
из депо ретикулума в нервной ткани, существенно ниже по сравнению с другими тканями. Таким образом, чувствительность эндоплазматического ретикулума к инозитолтрифосфату в клетках нервной системы может быть наиболее высокой.
Инозитолтрифосфат, очевидно, не единственный из инозитолтрифосфатов, выступающих в роли вторичного посредника. Образуемый в результате фосфорилирования инозитолтрифосфата инозитолтетрафосфаттакже участвует в регуляции внутриклеточной концентрации Са+
. Эта регуляция осуществляется, вероятно, влиянием инозитолтетрафосфата на поступление внеклеточного Са+
в цитоплазму. Поступление Са" в клетку в этом случае происходит не через рецепторзависимые Са-каналы, а каким-то иным, пока неизвестным способом.
Диацилглицерин служит источником арахидоновой кислоты, активирующей гуанилатциклазу. Этот путь регуляции имеет особое значение для реализации эффектов холинергической импульсации и функции мускаринчувствительных холинорецепторов и Н1
– рецепторов гистамина, для которых роль цГМФ как вторичного посредника общепризнанна. Следовательно, в системах вторичных посредников – цГМФ и фосфоинозитидной – существует функциональная взаимосвязь через стадию образования арахидоната, обеспечивающая интегральный характер транссинаптической регуляции биохимических процессов в клетке.
Из арахидоновой кислоты образуются простаглавдины, тромбоксани, кроме того, под действием соответствующей киназы диацилглицерин превращается в фосфатидную кислоту. Предполагается, что фосфатидная кислота обладает Са-ионофорными свойствами. Так, фосфатидная кислота накапливается в мембранах клеток при действии Са-агонистов. По такому механизму, очевидно, происходит инактивация электровозбудимых Са-каналов нейронов при действии дофамина. Взаимодействуя с собственным мембранным рецептором, дофамин в нейронах большого прудовика через G-белок активирует фосфолипазу С. Образовавшаяся из диацилглицерина фосфатидная кислота индуцирует поступление в клетку внешнего кальция и накопление его в примембранном слое цитоплазмы. Результатом локального повышения концентрации Са+
является инактивация электровозбудимьгх Са-каналов. Таким образом, система метаболизма фосфатидилинозитидов может регулировать внутриклеточную концентрацию Са+
как посредством увеличения потока Са+
через плазматическую мембрану, так и за счет выхода Са+
из внутриклеточных депо.
Наконец, диацилглицерин активирует также протеинкина-зу, связанную с плазмалеммой, – фосфолипидзависимый, Са-активируемый фермент – протеинкиназуС.
4.2 Протеинкиназа С
Уже отмечалось, что протеинкиназы, как и сопряженные с ними G-белки, имеют различную преимущественную локализацию в клетках нервной ткани. Так, аденилатциклаза и протеинкиназа С присутствуют в высоких концентрациях в мозжечке, но С-киназа локализована в клетках Пуркинье, в то время как аденилатциклаза – в гранулярных клетках. Таким образом, разные типы клеток мозга адаптированы к сигналам, активирующим синтез различных вторичные посредников: цАМФ, цГМФ, инозитолтрифосфата и дианилглицерина. В мозжечке рецепторов фосфоинозитидной системы примерно в 500 раз больше, чем в периферической нервной ткани.
Во многих отделах мозга, включая мозжечок, рецепторы фосфолипазы С и С-киназа имеют одинаковую локализацию и функционируют синергично. Однако в некоторых отделах, таких, как грудной отдел спинного мозга, рецепторы и киназа разобщены; две ветви этого внутриклеточного сигнального пути не составляют там эквивалентную пару. Поэтому в ряде случаев диацилглицерин формируется и активирует С-киназу без образования инозитолтрифосфата. В этих случаях, очевидно, диацилглицерин образуется уже не из фосфатидилинозитолдифосфата, а из монофосфорилированного мембранного липида – фосфатидилинозитолаТаким образом, в нервной ткани имеется еще один вариант активации протеинкиназы С.
Протеинкиназа С обнаружена в разных тканях млекопитающих и лишена строгой тканевой и видовой специфичности. Однако в мозге ее концентрация является наибольшей. Субклеточное распределение протеинкиназы С неодинаково в разных тканях и органах: фермент преимущественно локализован в ци-тозоле клеток сердца и в мембранной фракции клеток мозга. Протеинкиназа С мозга – мономер с Мг
= 80–87 кД, состоящий из двух доменов: регуляторного, имеющего участки связывания для диацилглицерина и фосфолипидов, и каталитического. Домены разделяют участок полипептидной цепи, чувствительный к протеолитической атаке.
Наибольший активирующий эффект на протеинкиназу С оказывают диацилглицерины и в меньшей мере фосфатидилянозитол, фосфатидилсерини фосфатидная кислота.Диацилглицерины увеличивают сродство протеинкиназы С к фосфолипидам. При этом протеинкиназа С становится чувствительной к физиологическим концентрациям Са+
в клетке. Диацилглицерин быстро образуется в ответ на сигнал-рецепторное взаимодействие и быстро разрушается, что в конечном итоге и определяет его свойства как вторичного посредника.
Известно, что сродство С-киназы к плазматическим мембранам увеличивается во время активации. Для транслокации киназы необходим Са+
. Связывание С-киназы с мембранами обусловлено координационным взаимодействием 4 карбоксильных групп молекул фосфатидилсерина с комплексом Са+
-фермент.
Таким образом, индуцированное инозитолтрифосфатом увеличение внутриклеточной концентрации Са+
может активировать С-киназу при встраивании ее в мембраны. Активированная и локализованная на наружной мембране С-киназа обусловливает фосфорилирование белковых компонентов ионных каналов, изменяя тем самым их проницаемость.
Как недавно установлено, Са+
и фосфолипиды не всегда необходимы для активации протеинкиназы С. Так, ненасыщенные жирные кислоты могут активировать фермент независимо от Са+
и фосфолипидов. В составе изоферментов протеинкиназы С обнаружена также Са-независимая, но фосфолипидзависимая форма фермента.
Протеинкиназа С подвергается аугофосфорилированию в присутствии Са+
и фосфолипидов. Физиологическое значение этого процесса состоит, вероятно, в повышении активности киназы. Установлена также активация протеинкиназы С ограниченным протеолизом под действием мембраносвязанной Са-активируемой эндогенной протеазы. Полученные фрагменты теряют сродство к мембранам независимо от присутствия Са+
и диацилглицерина. Такие рас* творимые фрагменты С-киназы, активность которых не зависит от Са* и фосфолипидов, появляются при взаимодействии форболовых эфиров с некоторыми клетками. Ингибиторы Са-зависимых протеиназ блокируют это действие форболовых эфиров. Очевидно, при стимуляции рецепторов фосфолипазы С увеличение внутриклеточной концентрации ионизированного Са+
под действием инозитолтрифосфата приводит наряду с транслокацией С-киназы на мембраны также к активации мембраносвязанных, Са-стимулируемых протеиназ и появлению независимой от Са+
и фосфолипидов активности С-киназы.
Таким образом, фосфорилирующая способность С-киназы может быть сохранена достаточно долго после прекращения действия вторичных посредников, что наводит на мысль об участии этого процесса в долговременном хранении информации в нейронах мозга – органа с наибольшей активностью протеинкиназы С.
Сильными ингибиторами протеинкиназы С являются такие фармакологические агенты, как психотропные препараты фенотиазинового ряда и местные анестетики. Очевидно, фармакологическое действие этих препаратов, которое раньше связывали с ингибированием кальмодулина, обусловлено их липофильной природой и способностью конкурентно связываться с фосфолипидами, тем самым препятствуя активации протеинкиназы С. Полиамины также способны ингибировать протеинкина-зу С, что связано с избыточным положительным зарядом этих соединений. В мозге недавно обнаружен термостабильный ингибитор С-киназы: димербелковых субъединицс Мг
= 19 кД. Кальмодулин и другие Са-связываюшие белки также ингибируют активность фермента, вероятно, за счет влияния на механизм активации С-киназы.
В клетках мозга найдено несколько субстратов для протеинкиназы С. Отметим среди них основной белок миелина, 87 кД-белок и В-50-белок. Степень фосфорилирования основного белка миелина протеинкиназой С, присутствующей в миелине, увеличивается invivoпри К+
-деполяризации мембраны. Протеинкиназы В не оказывают такого действия.
Установлено, что активация С-киназы форболовыми эфирами приводит к увеличению секреции нейромедиаторов, вызванной пресинаптическими потенциалами действия. Полагают, что способность С-киназы увеличивать секрецию связана именно с фосфорилированием упомянутого выше 87 кД-белка. Этот белок локализован преимущественно в синаптосомах – как в мембранной, так и цитозольной фракциях. Вероятно, его фосфорилирование С-киназой в окончаниях нейронов обусловливает регуляцию Са-зависимой секреции нейромедиаторов.
В-50-белок ассоциирован с пресинаптическими мембранами нейронов мозга. Как недавно установлено, этот белок проявляет активность фосфатидилинознтол-4-фосфат киназы– фермента, участвующего в синтезе фосфатидилинози-толдифосфата. Таким образом, передача сигнала через систему фосфатидилинозитола в мозге может регулироваться с помощью фосфорилирования В-50-белка протеинкиназой С.
Протеинкиназа С, по-видимому, регулирует как хемозависимые так и электрозависимые Са-каналы в нервных клетках. Так, искусственные аналоги диацилглицерина – форболовые эфиры – в задних корешках спинного мозга, блокируют хемозависимые Са-каналы в концентрациях, при которых эти соединения активируют протеинкиназу С. Установлено также, что внутриклеточная инъекция протеинкиназы С увеличивает амплитуду электрозависимого Са-тока и уменьшает Са-активируемый калиевый ток в нейронах моллюска аплизии. При этом, по имеющимся данным, С-киназа преимущественно фосфорилирует регуляторные компоненты мембран, сопряженные с каналами, а не пептиды, формирующие собственно трансмембранные каналы. Таким образом, приведенные данные о влиянии на секрецию нейромедиаторов и трансмембранные потоки ионов свидетельствуют о непосредственном участии С-киназы в важнейших процессах нервной ткани.
Оценивая место протеинкиназы в системах регуляции, отметим, что существуют два варианта взаимодействия между системами вторичных посредников, определяемые как состоянием рецепторов, так и распределением в разных тканях, природой и условиями для фосфорилирования отдельных белков-мишеней: синергизм и антагонизм. Протеинкиназа С, по всей видимости, является тем звеном, которое путем тонкой подстройки сопрягающего аппарата связывает аденилатциклазную и фосфолипазную системы передачи и усиления сигнала.
Так, обнаружено фосфорилирование протеинкиназой С а-субъединицы G{
, ведущее к снятию ингибиторного действия этого сопрягающего белка на аденилатциклазу. Кроме того, уже упоминалось, что G{
может быть одним из прямых активаторов фосфолипазы С. Непрямая активация фосфолипазы С может быть обусловлена увеличением активности фосфолипазы А2
при действии Gi
. Показано ингибирование фосфолипазы С посредством активации Gs
. Так, установлено уменьшение образования диацилглицерина и инозитолтрифосфата при повышении уровня цАМФ с помощью гормонов, дибутирил-цАМФ, форсколина. Вероятно, угнетение активности протеинкиназы С при активации протеинкиназы А обусловлено десенситизацией соответствующих рецепторов, потерей их чувствительности к агонистам. В пользу такого заключения свидетельствуют данные о потере специфического связывания с агонистами мускариновых холинорецепторов синаптических мембран при фосфорилировании этих рецепторов К-субъединицей протеинкиназы А. В свою очередь, стимуляция М-холинорецепторов сердца вызывает уменьшение активности аденилатциклазы и снижение уровня цАМФ.
Вместе с тем известны и примеры синергизма во взаимодействии протеинкиназ. Синергизм в действия протеинкиназ А, В и С отчетливо проявляется при фосфорилировании фосфоламбаиа– белка саркоплазматического ретикулума миокарда. Показано увеличение индуцированного инозитолтрифосфатом высвобождения Са+
под действием К-субъединицы протеинкиназы А, ингибитор К-субъединииы блокирует этот эффект Установлено также, что протеинкиназа С в некоторых типах клеток потенциирует р-адренергическую стимуляцию образования цАМФ. Преинкубация эндотелиальных клеток в присутствии 10 мкм и "внутреннему" механизмам. В первом случае различные метаболиты связываются с субстратом, изменяя скорость дефосфорилирования; во втором случае лиганды связываются с фосфатазой и, таким образом, прямо изменяют фосфатазную активность.
Изучение фосфатаз привело к открытию множества форм фермента, которые дефосфорилируют широкий спектр фосфо-белков. Д. Коэн и соавторы классифицировали протеинфосфатазы на два типа. Фосфатазы1-готипаингибируются белковыми инибиторами, относительно нечувствительны к ингибированию АТФ и предпочтительно дефосфорилируют р-субъединицу киназы фосфорилазы. Фосфатазы 2-го типане ингибируются термостабильными белковыми ингибиторами, чувствительны к ингибированию АТФ и преимущественно дефосфорилируют а-субъединицу киназы фосфорилазы. В свою очередь, все фосфопротеинфосфатазы 2-го типа делятся на подтипы 2А, 2В и 2С. Отличительной особенностью фосфатаз 2С является регулируемость M.g, а фосфатаз 2 В-зависимость от Са+
и кальмодулина.
Протеинфосфатазы 2 В и 2А присутствуют в мозге в наибольших концентрациях по сравнению с другими тканями. В нервной ткани найдены также специфические протеинфосфатазы, дефосфорилирующие основной белок миелина, синапсин 1, МАР-2, белки цитоскелета, никотиновые рецепторы ацетилхо-лина. Наибольшая активность фосфопротеинфосфатаз нервной ткани выявлена в мембранной фракции по сравнению с цитозолем, что свидетельствует о возможном участии этих ферментов в синаптической передаче.
Заметим, что ранее протеинфосфатаза 2В была названа кальцинейрином, так как впервые она была идентифицирована в нервной ткани как термолабильный ингибитор КМ-стимулируемой фосфодиэстеразы циклических нуклеотидов. Кальцинейрин принадлежит к семейству КМ-связывающих белков, содержащих Са-связьшающие субъединицы. Активность кальцинейрина контролируется ионами кальция.
Недавно обнаружено, что кальцинейрин, кроме серина и треонина, способен дефосфорилироеать также тирозиНовые остатки белков. Это предполагает участие кальцинейрина в процессах трансформации и клеточного роста, контролируемых, как известно, тнрозинкиназами. Интересно, что в N-конце субъединицы В кальцинейрина содержится миристиновая кислота,
что может облегчать встраивание белка в мембрану.
В мозге кальцинейрин локализован в основном в постсинаптических мембранах и тесно связан с микротрубочками дендритов, что предполагает его участие в транссинаптической передаче и функционировании микротрубочек. Основными субстратами кальцинейрина в нервной ткани являются белки DARPP-32, G-субстрат и Р-субъединица II типа протеинкиназы А.
В мозге содержатся также ингибиторы протеинфосфатаз: так называемый фосфатазный ингибитор 1 и белок DARPP-32 найдены в мозге и фосфорилируются эндогенной А-киназой по единственному остатку треонина. В фосфорилированной форме DARPP-32, как и фосфатазный ингибитор 1, ингибирует активность протеинфосфатазы I. DARPP-32 сопряжен в мембранах с дофаминовыми рецепторами аденилатциклазы и, таким образом, может принимать участие в транссинаптическом действии дофамина.
Кальцинейрин и DARPP-32 локализованы вместе в синаптических мембранах. Следовательно, степень фосфорилирования DARPP-32 и медиаторное действие дофамина могут регулироваться цАМФ и Са+
.
Отметим, что кальцинейрин может выступать в роли своеобразного антагониста биохимических эффектов цАМФ, модулируя тем самым взаимодействие двух систем вторичных посредников – цАМФ и Са+
, Так, кальцинейрин дефосфорилирует многие субстраты протеинкиназы А, в том числе аутофосфорилированную форму регуляторной субъединицы протеинкиназы АII типа. В последнем случае кальцинейрин может прямо контролировать цАМФ-зависимую протеинкиназную активность, так как степень фосфорилирования Р-субъединицы II типа определяет характер диссоциации холофермента протеинкиназы и. соответственно, скорость фосфорилирования.
цГМФ регулирует активность протеинфосфатаз 1 и 2А в клетках Пуркинье мозжечка с помощью фосфорилирования G-субстрата протеинкиназой G. G-субстрат, как упоминалось, является специфическим протеинфосфатазным ингибитором. Дефосфорилирование этого ингибитора кальцинейрином может, таким образом, сопрягать влияние цГМФ и Са+
на функциональную активность клеток Пуркинье.
В синаптических мембранах обнаружены также две эндогенные, тесно связанные с этими мембранами специфические протеинфосфатазы. Эти протеинфосфатазы дефосфорилируют белки синаптических мембран: синапсин 1 и Р-субъединицу II типа протеинкиназыА. При этом фосфатаза, имеющая высокое сродство к Р-субъединице, не дефосфорилирует синапсин 1, а фосфатаза синапсина 1 – Р-субъединицу. Кроме того, специфичная протеинфосфатаза Р-субъединицы стимулируется цАМФ, в то время как протеинфосфатаза синапсина 1 нечувствительна к этому нуклеотиду. Таким образом, цАМФ может стимулировать как аутофосфорилирование, так и дефосфорилирование Р-субъединицы А-киназы II типа.
Для понимания многообразия и важности функций систем фосфорилирования – дефосфорилирования важны недавние сообщения о выделении эндогенной Са-независимой протеиназы, тесно ассоциированной с нейрофиламентами и другими компонентами цитоскелета. Эта протеиназа "атакует" только нефосфорилированные нейрофиламенты, расщепляя их на лишенные биологической активности фрагменты. Следовательно, фосфорилирование защищает белки цитоскелета от деградации, обусловленной действием эндогенных, Са-независимьгх протеиназ.
Напротив, Са-активируемые нейтральные протеиназы с помощью ограниченного протеолиза расщепляют фосфорилированную форму нейрофиламентов на биологически активные фрагменты. Установлено, что фосфорилирование белков цитоскелета, в частности нейрофиламентов, – необходимое условие для их сборки в организованные, морфологически единые структуры.
Таким образом, состояние цитоскелета нервных клеток определяется как цАМФ-зависимым фосфорилированием его компонентов, так и Са-зависимым дефосфорилированием: степень фосфорилирования белков цитоскелета, в свою очередь, может регулировать их избирательную чувствительность к Са-зависимой и Са-независимой протеиназной атаке. Протеинфосфатазы играют весьма важную роль в функционировании нервной ткани. Так, наряду с протеинфосфатазами 1, 2А, 2С, 2В и фосфатазным ингибитором 1 в мозге присутствуют эндогенные фосфатазы синапсина, миелина, Р-субъединицы А-киназы II типа, а также специфические ингибиторы фосфопротеинфосфатазной активности – DARPP-32 и G-субстрат, активность которых регулируется фосфорилированием. Можно думать, что в нервной ткани физиологическое действие нейромедиаторов в ряде случаев модулируется протеинфосфатазной активностью.
Выводы
1. G-белки сопрягают рецепторы клеток с системами, генерирующими вторичные посредники.
2. К вторичным посредникам относятся: цАМФ, цГМФ, инозитолфосфаты, диацилглицерол и ионы кальция.
3. Вторичные посредники активируют протеинкиназы, осуществляющие фосфорилирование определенных белков клетки, или воздействуют на метаболизм олигоаденилатов. Нейромедиаторы, гормоны и сам по себе нервный импульс регулируют фосфорилирование-дефосфорилирование многих регуляторных субстратов в нервной ткани. Огромное разнообразие физиологических эффектов, вызываемых этими агентами, обусловлено специфичностью систем протеинфосфорилирования, контролируемых различными вторичными посредниками.
4. Нервная ткань уникальна в отношении высокого содержания практически всех протеинкиназ, активность которых регулируется цАМФ, цГМФ, Са+
, кальмодулином и фосфолипидами.
5. По субстратной специфичности все протеинкиназы и протеинфосфатазы в нервной ткани могут быть разделены на две основные категории. Протеинкиназа G, протеинкиназа В I типа, киназа легких цепей миозина, киназа фосфорилазы и кальцинейрин имеют узкую субстратную специфичность и принимают участие в специализированной нервной регуляции. Напротив, протеинкиназа А, киназа В II типа, С-киназа и ряд протеинфосфатаз проявляют широкую субстратную специфичность и вовлечены в регуляторные процессы практически всех типов нервных клеток.
6. Определенные протеинкиназы, протеинфосфатазы и их специфические субстраты локализованы не равномерно, а в специальных отделах нервной системы и в том числе мозга.
7. Вещества, активирующие синтез или ингибирующие гидролиз цАМФ, оказывают на нервные клетки антипролиферативное действие, связанное с влиянием этого нуклеотида на систему метаболизма 2', 5'-олигоаденилатов.
|