«Установление и использование межпредметных связей при изучении элементов III и V группы периодической системы Д.И. Менделеева»
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ
ГЛАВА I. МЕЖПРЕДМЕТНЫЕ СВЯЗИ В КУРСЕ ШКОЛЬНОГО ПРЕДМЕТА ХИМИИ
1.1 Использование межпредметных связей для формирования у учащихся основ диалектико-материалистического мировоззрения
1.2 Пути и методы реализации межпредметных связей
1.3 Межпредметные связи в процессе изучения химии
ГЛАВА 2. СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
2.1 Элементы III-А группы периодической системы
2.1.1 Положение алюминия в периодической системе и строение его атома
2.1.2 Нахождение алюминия в природе, его получение и свойства
2.1.3 Важнейшие соединения алюминия
2.2 V-A группа. Азот
2.2.1 Некоторые соединения азота и их свойства
2.2.1.1 Оксиды азота
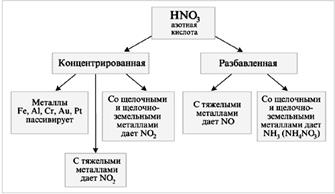
2.2.1.2 Азотная кислота
ГЛАВА 3. МЕЖПРЕДМЕТНЫЕ СВЯЗИ ПРИ ИЗУЧЕНИИ III И V ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.МЕНДЕЛЕЕВА
3.1 III-А группа
3.1.1 Бор
3.1.1.1 Распространение в природе
3.1.1.2 Биохимическая роль
3.1.2 Алюминий
3.1.2.1 Распространение в природе
3.1.3 Галлий
3.1.3.1 Распространение в природе
3.1.3.2 Токсикологическая характеристика
3.2 V-A группа периодической системы
3.2.1 Круговорот азота
3.2.2 Соединения азота
3.2.2.1 Взаимодействие нитрат-иона с фауной и флорой
ГЛАВА 4. МОИ УРОКИ
4.1 Урок на тему «III-А группа периодической системы химических элементов Д. И. Менделеева»
4.1.1 Экологические аспекты преподавания темы «Азот. Соединения азота»
4.1.2 Урок по теме «Получение азотной кислоты»
4.1.3 Практическая работа на тему «Азотная кислота и ее соли»
ГЛАВА 5. ЗАДАЧИ И ТЕСТЫ
5.1 Задачи и тесты по теме «V-A группа ПС»
5. 2 Тесты
ЛИТЕРАТУРА
ВВЕДЕНИЕ
Актуальность выбранной темы не может вызывать сомнений, так как элементы III и V группы периодической системы Д.И. Менделеева применяются самым широким образом. Это и фармацевтическая, и горно-перерабатывающая промышленности, производство красителей, поверхностно-активных веществ, гербицидов, инсектицидов (применение в сельском хозяйстве) и др., применение в органическом синтезе, и прочее.
При разработке данной темы особое внимание следует уделить экологическому аспекту производства, применения и утилизации элементов и соединений на их основе. Реализацию целей школьного экологического образования можно осуществлять разными путями: это экологизация учебных дисциплин, создание интегрированных курсов, введение в практику обучения специального предмета, раскрывающего вопросы экологии и защиты окружающей среды от загрязнения.
Реклама

Немаловажную роль в реализации экологического подхода играет включение в учебный процесс наряду с общеучебными также задач и тестовых заданий с экологическим содержанием [1].
Цели работы: проследить и изучить межпредметные связи при преподавании темы «Элементы III и V группы периодической системы Д.И. Менделеева» в школьном курсе химии, а также пути их реализации; на основе анализа как теоретического материала, так и экологических аспектов их использования, сформировать у учащихся экологическое понимание химических производств и проблемы загрязнения окружающей среды.
Гипотеза – Использование межпредметных связей при изучении темы «Элементы III и V группы периодической системы Д.И. Менделеева» с акцентированием на научные и экологические аспекты позволит сформировать положительную мотивацию к учению, развить у учащихся ценностную ориентацию и сделать очередной шаг в процессе формирования научного и экологического мировоззрения учащихся.
ГЛАВА I. МЕЖПРЕДМЕТНЫЕ СВЯЗИ В КУРСЕ ШКОЛЬНОГО ПРЕДМЕТА ХИМИИ
Межпредметные связи – это современный принцип обучения в средней школе. Он обеспечивает взаимосвязь предметов естественнонаучного и естественно-гуманитарного циклов и их связь с трудовым обучением школьников.
По определению Д. П. Ерыгина: «Межпредметные связи можно рассматривать как дидактическую систему, которая отражает в школьных курсах объективно существующие взаимосвязи, обеспечивает посредством согласованного взаимодействия ее учебных компонентов осуществления целенаправленного процесса обучения школьников».
Использование межпредметных связей – одна из наиболее сложных методических задач учителя химии. Она требует знания содержания программ и учебников по другим предметам. Реализация межпредметных связей в практике обучения предполагает сотрудничество учителя химии с учителями других предметов.
Учитель химии разрабатывает индивидуальный план реализации межпредметных связей в курсе химии. Методика творческой работы учителя в этом плане проходит следующие этапы:
1. Изучение программы по химии, ее раздела «Межпредметные связи», программ и учебников по другим предметам, дополнительной научной, научно-популярной и методической литературы;
2. Поурочное планирование межпредметных связей с использованием курсовых и тематических планов;
3. Разработка средств и приемов реализации межпредметных связей на конкретных уроках (формулировка межпредметных познавательных задач, домашних заданий, подбор дополнительной литературы для учащихся, подготовка необходимых учебников и наглядных пособий по другим предметам, разработка методических приемов их использования);
4. Разработка методики подготовки и проведения комплексных форм организации обучения (обобщающих уроков с межпредметными связями, комплексных семинаров, экскурсий, занятий кружка, факультатива по межпредметным темам и т.д.);
5. Разработка приемов контроля и оценки результатов осуществления межпредметных связей в обучении (вопросы и задания на выявление умений учащихся устанавливать межпредметные связи).
Реклама

Планирование межпредметных связей позволяет учителю успешно реализовать их методологические, образовательные, развивающие, воспитательные и конструктивные функции; предусмотреть всё разнообразие их видов на уроках, в домашней и внеклассной работе учащихся.
Для установления межпредметных связей необходимо осуществить отбор материалов, то есть определить те темы химии, которые тесно переплетаются с темами из курсов других предметов.
Курсовое планирование предполагает краткий анализ содержания каждой учебной темы курса с учетом внутрипредметных и межпредметных связей.
1.1 Использование межпредметных связей для формирования у учащихся основ диалектико-материалистического мировоззрения
Использование опорных знаний других предметов при изучении отдельных тем курса химии – важнейшее средство формирования у учащихся диалектико-материалистического мировоззрения, целостного представления о явлениях природы и взаимосвязи между ними.
Решение этой задачи успешно осуществляется при совместной согласованной работе учителей различных дисциплин: природоведения, химии, физики, географии, биологии, математики, обществоведения, истории и др. Рассмотрим те межпредметные связи курса химии, которые касаются формирования основ научно-материалистического мировоззрения учащихся.
После изучения темы «Вода. Растворы. Основания» предлагаем учащимся выполнить самостоятельные практические работы. При этом используем вещества, которые изучались в курсе природоведения («Воздух», «Вода» и др.), в курсе ботаники («Дыхание семян», «Дыхание листьев»), а также в курсе физики. Даем задание осуществить превращения:
C ® CO2
® H2
CO3
®Na2
CO3
Практические работы такого характера раскрывают взаимосвязь между различными классами химических соединений, развивают идею о познаваемости мира.
Исходя из превращений, осуществляемых при переходе от одних веществ к другим, даем определение понятия «развитие» (переход от одного качественного состояния к другому).
Не менее важно и то, что межпредметные связи позволяют более целесообразно планировать изучение материала, экономить время, при этом знания по другим предметам конкретизируются, углубляются, обобщаются.
1.2 Пути и методы реализации межпредметных связей
Вопрос о путях и методах реализации межпредметных связей – это один из аспектов общей проблемы совершенствования методов обучения. Отбор методов обучения учитель производит на основе содержания учебного материала и на подготовленности учащихся к изучению химии на уровне межпредметных связей.
На первых этапах обучения учащихся приемам установления межпредметных связей преобладает объяснительно-иллюстративный метод. Учитель весь материал межпредметного содержания объясняет сам. Когда у учащихся сформируются умения работы с материалом межпредметного содержания, можно применять репродуктивный и частично-поисковый методы и творческие межпредметные задачи.
Средства реализации межпредметных связей могут быть различны:
вопросы межпредметного содержания: направляющие деятельность школьников на воспроизведение ранее изученных в других учебных курсах и темах знаний и их применение при усвоении нового материала.
межпредметные задачи, которые требуют подключения знаний из различных предметов или составлены на материале одного предмета, но используемые с определенной познавательной целью в преподавании одного другого предмета. Они способствуют более глубокому и осмысленному усвоению программного материла, совершенствованию умений выявить причинно-следственные связи между явлениями.
домашнее задание межпредметного характера – постановка вопросов на размышление, подготовка сообщений, рефератов, изготовление наглядных пособий, составление таблиц, схем, кроссвордов, требующих знаний межпредметного характера.
межпредметные наглядные пособия – обобщающие таблицы, схемы, диаграммы, плакаты, диаграммы модели, кодопозитивы. Они позволяют учащимся наглядно увидеть совокупность знаний из разных предметов, раскрывающую вопросы межпредметного содержания.
химический эксперимент – если предметом его являются биологические объекты и химические явления, происходящие в них.
Использование межпредметных связей вызвало появление новых форм организации учебного процесса: урок с межпредметными связями, комплексный семинар, комплексная экскурсия, межпредметная экскурсия и др.
Уроки с межпредметным содержанием могут быть следующих видов: урок-лекция; урок-семинар; урок-конференция; урок-ролевая игра; урок-консультация и др.
уроки межпредметного обобщения или тематические задания – проблема педагогики и методики как соединить знания с практической полезной деятельностью. Научить применять знания.
Суть тематического планирования заключается в следующем: группам учащихся дается задание разработать рекомендации по использованию удобрений, веществ, реакций относительно данной местности. Эти задания имеют МПС и готовятся совместно с учителями биологии, географии, черчения, рисования – это бинарные уроки.
Ход проведения: группа из 4-6 человек выбирает руководителя проекта, специалистов (биолог, агроном, чертежников, художник-оформитель), определяет задания каждому ученику. Группы собираются и отчитываются о работе.
Каждой группе дается своеобразное домашнее задание, которое будет завершено защитой своих работ. Вначале такого урока – краткая беседа учителя, в ходе которой ставится цель, представляются учащиеся, определяется порядок защиты. Затем идут выступление групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание. Обязательно прослеживается связь с окружающей средой.
По этим урокам можно сделать вывод:
1. Все уроки связаны педагогической логикой.
2. Строго выполняется учителем тема по программе.
3. Включено обязательно решение задач.
4. Главное достоинство – ученики учатся учиться по указанию учителя.
5. Но самое главное – все задания выполняются самостоятельно.
1.3 Межпредметные связи в процессе изучения химии
Отражение межпредметных связей и определение содержания в программах: а) для обычных классов без специализации – программа курса химии для 8-11 классов средней общеобразовательной школы – разработана в лаборатории химического образования Института общеобразовательной школы РАО – Москва “Просвещение” 1993 год, тема “Основания” – 2 часа. б) программа курса неорганической химии для 8-9 классов химико-биологического профиля (авторы: Н.Е. Кузнецова, Г.П. Никифорова, И.М. Титова, А.Ю. Жегин) на тему “Элементы III и V группы” отводится 6 часов, является своевременным и важным положением в системе обучения учащихся, поскольку методически обоснованное осуществление внутри- и межпредметных связей в процессе изучения школьных дисциплин способствует повышению качества знаний учащихся, развитию их мыслительной деятельности.
Реализация внутри- и межпредметных связей при изучении химии является одной из форм логического повторения, углубления и совершенствования приобретенных знаний.
Поскольку внутри- и межпредметные связи обеспечивают привлечение учащимися на уроках знаний из области других предметов, важно с учетом требований программ выделить наиболее общие, устойчивые и долговременно действующие внутри- и межпредметные понятия. Примером таких понятий могут быть понятия о составе, строении, химических свойствах и биологических функциях веществ. При отборе и использовании межпредметной информации важно не нарушить логику построения учебных предметов и не допускать перегрузки их содержания.
Способы привлечения знаний из других предметов различны. Можно предложить учащимся при подготовке к занятиям восстановить в памяти ранее изученные вопросы. В отдельных случаях учитель при изложении нового материала сам напоминает сведения, полученные при изучении других предметов, включая при этом учащихся в активную беседу. Опыт учителей-методистов показывает, что установление взаимосвязей между предметами успешно проходит при включении в содержание урока (или в задание на дом) примеров и задач межпредметного характера.
Для того, чтобы успешно реализовать внутри- и межпредметные связи в учебной деятельности, учитель химии должен, прежде всего овладеть содержанием соответствующих дисциплин.
Конкретизация использования внутри- и межпредметных связей в процессе обучения достигается с помощью поурочного планирования. Последнее осуществляется с учетом вида урока:
· фрагментальный, когда лишь фрагменты, отдельный этап урока, требует реализации связей с другими предметами;
· узловой, когда опора на знания из других предметов составляет необходимое условие усвоения всего нового материала или его обобщения в конце учебной темы;
· синтезированный, который требует синтеза знаний из разных предметов на протяжении всего урока и специально проводится для обобщения материала ряда учебных тем или всего курса.
Поурочный план-разработка показывает, когда, на каком этапе урока и какими способами включаются знания из других курсов в изучении нового или закрепления учебного материала. Особенно необходима тщательная разработка обобщающего урока с внутри- и межпредметными связями. Выделение таких уроков производится на основе тематического планирования. Поурочное планирование может быть выполнено в виде плана конспекта или в виде таблицы
этапы
урока
|
вопросы МП содержания |
методы и приемы |
средства наглядности |
внутрипредметные и межпредметные связи |
Составляя поурочные планы, учителю важно знать, что учащиеся уже усвоили из необходимых опорных знаний на уроках по другим предметам, согласовать с учителями смежных предметов постановку вопросов и заданий, чтобы избежать дублирования и достигнуть развития общих идей и понятий, их углубления и обогащения. Этому помогает взаимопосещение уроков и изучение составляемых коллегами планов реализации внутри- и межпредметных связей.
Таким образом, планирование составляет необходимое и существенное условие подготовки учителя к эффективному осуществлению внутри- и межпредметных связей и является одним из средств их реализации в практике обучения школьников [2, 3].
ГЛАВА 2. СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
2.1 Элементы III-А группы периодической системы
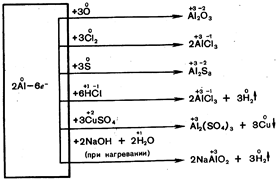
Алюминий Al (лат. Aluminium, от лат. alumen — квасцы). Аl— элемент III группы 3-го периода периодической системы Д. И. Менделеева, п. н. 13, атомная масса 26,9815, имеет один стабильный изотоп 27
Al (100 %). Металлический Аl был получен в 1827г. Вёлером. По содержанию в земной коре (8,8 %) Аl занимает 3-е место после О и Si, с которыми Аl (в виде различных алюмосиликатов) составляет более 82% массы земной коры. В свободном виде не встречается. Основное сырье для производства Аl – бокситы. Аl – серебристо-белый металл, легкий, прочный, пластичный, ковкий, обладает высокой электро- и теплопроводимостью, высокой химической активностью. В соединениях А. проявляет степень окисления +3. А. легко соединяется о кислородом воздуха, покрываясь плотной пленкой оксида Al2
O3
, это обусловливает высокую коррозионную стойкость; концентрированная HNO3
на Аl не действует. Аl легко растворяется в щелочах, разбавленных НС1 и H2
SO4
. Гидроксид Аl (и Аl2
О3
) амфотерен: с кислотами водных растворах он дает соли, содержащие гидратированный ион [Al(H2
O)6
]з+
, со щелочами — алюминаты. Аl получают электролизом Аl2
О3
(из боксита), растворенного в расплавленном криолите Na3
AlF6
, Аl применяют для производства легких сплавов (дуралюмин, силумин) в самолетостроении, автомобилестроении, при строительстве зданий, для изготовления химической аппаратуры, электрических проводов, конденсаторов, как материал для ядерных реакторов и др. Аl служит восстановителем при получении ряда металлов. Применяются различные соединения Al — алюминия оксид, хлорид алюминия АlС13
или водный А1С13
.
6Н2
О как катализатор в органическом синтезе, сульфат алюминия А12
(SО4
)3
×18H2
O и алюмокалиевые квасцы KAl(SO4
)2
× 12Н2
О — для очистки воды, при крашении тканей, для дубления кож и в производстве бумаги. В строительстве и архитектуре для защиты от коррозии и в декоративных целях применяют серебряную краску — смесь алюминиевого порошка с минеральным маслом. Алюминийорганические соединения используют при синтезе других металлоорганических соединений; соединения Аl с алкилами применяют как катализаторы при полимеризации олефинов.
Бор В – элемент III группы 2-го периода п.с. В природе встречается в виде борной кислоты и различных минералов. Бор является сильным восстановителем. Гидриды бора применяют в топливе для ракет, как катализаторы при получении полимеров, для покрытия металлов бором, в металлургии, в ядерной промышленности.
Галлий Ga – элемент III группы п.с. Химически активен, применяется в качестве модифицирующих присадок в сплавах, в полупроводниковой промышленности.
Иттрий Y- элемент III группы 5-го периода п.с., в природе встречается вместе с лантаноидами. Иттрий используется в атомной технике и авиации.
Скандий Sс – элемент III группы 4-го периода п.с. Скандий содержится в виде примесей во многих минералах, химически активен. Применяют скандий в основном в виде сплавов с различными металлами, в ядерной технике, металлургии, медицине и пр.
Лантан La – элемент III группы 6-го периода п.с. В природе La встречается в виде сложного по составу минерала монацита.
Лантаноиды – 4f-семейство из 14 элементов VI периода п.с. В природе лантаноиды сопутствуют друг другу. Все лантаноиды – металлы серебристо-белого цвета, пластичны и легко поддаются ковке, литью. Лантаноиды химически активны, разлагают воду, реагируют с кислотами. Лантаноиды находят очень широкое применение – в изготовлении лаков и красок, в производстве кожи, в текстильной промышленности, в радиоэлектронике и пр.
Таллий Tl – элемент III группы 6-гопериода п.с., относится к рассеянным элементам, легко разлагает кислоты. Производство таллия связано с комплексной переработкой сульфидных руд цветных металлов. Токсичен.
Актиний Ас – радиоактивный элемент III группы п. с. Период полураспада Ас составляет 22 года, испускает b-частицы (98 %) и a-частицы. Получают облучением радия нейтронами. Ас – металл серебристо-белого цвета, в соединениях проявляет с.ок. +3, по химическим свойствам близок к лантану. Ас – опасный радиоактивный яд.
Актиноиды – 5f-семейство элементов 7 периода п. с., все радиоактивны [2].
К III группе периодической системы относятся следующие элементы: бор В, алюминий Al, скандий Sc, галлий Ga, иттрий Y, лантан La (лантаноиды), таллий Tl, актиний Ac (актиноиды).
Данная тема изучается в школьной программе в 9 классе по учебнику Ф. Г. Фельдмана и Г. Е. Рудзитиса [3]. На изучение элементов III группы отводится лишь 2 часа.
В школьном учебнике Ф. Г. Фельдмана и Г. Е. Рудзитиса этой теме посвящен лишь один параграф, к тому же тема освещена не лучшим образом. Авторы учебника подробно рассматривают лишь один из элементов III группы – алюминий. В этом параграфе рассматриваются следующие подпункты.
2.1.1 Положение алюминия в периодической системе и строение его атома
Алюминий находится в главной подгруппе III группы. Схема расположения по энергетическим уровням следующая:
+3
Al 2e-
, 8e-
,3e-
Так как у атомов алюминия на внешнем уровне 3 электрона, то алюминий в соединениях проявляет степень окисления 4-3.
К такому же выводу приходим, руководствуясь представлениями о характере движения электронов в атомах и расположении их не только по энергетическим уровням, но и по подуровням. В атоме алюминия легко происходит распаривание 3s2
-электронов и один электрон переходит 3p-орбиталь:
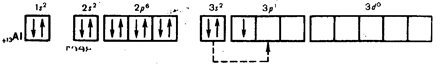
В результате получаются три неспаренных электрона. Ответьте на вопрос 1 (с. 138 [4]).
2.1.2 Нахождение алюминия в природе, его получение и свойства
Алюминий — третий по распространенности элемент в земной коре. Он встречается только в соединениях. Важнейшие из них указаны на схеме 19.
Схема 19

Окрашенные кристаллы Al2
O3
красного цвета — рубины, синего цвета – сапфиры.
Получение
Немецкий химик Ф. Вёлер в 1827 г. получил алюминий при нагревании хлорида-алюминия со щелочными металлами калием или натрием без доступа воздуха.
AlCl3
+3K 3KCl + Al 3KCl + Al
Для промышленного получения алюминия эти методы экономически невыгодны, поэтому был разработан электрохимический метод получения алюминия из бокситов.
Физические свойства
Алюминий — серебристо-белый металл, легкий (r = 2,7 г/cм3
), плавится при 660 °С. Он очень пластичен, легко вытягивается в проволоку и прокаливается в листы и фольгу. По электрической проводимости алюминий уступает лишь серебру и меди (она составляет 2/3 от электрической проводимости меди).
Химические свойства
В электрохимическом ряду напряжения алюминий помещается за самыми активными металлами. Однако из повседневного опыта известно, что на алюминиевые изделия (посуду и т. д.) не действует ни кислород, ни вода даже при температуре ее кипения. На алюминий не действует также концентрированная холодная азотная кислота. Это объясняется наличием на поверхности алюминия тонкой оксидной пленки, которая предохраняет его от дальнейшего окисления. Если поверхность алюминия потереть солью ртути, то происходит реакция:
2А1 + 3HgCl2
® 2А1С13
+ 3Hg
Выделившаяся ртуть растворяет алюминий, и образуется его сплав с ртутью — амальгама алюминия. На амальгамированной поверхности пленка не удерживается, поэтому алюминий реагирует с водой при обычных условиях (рис. 46):
2А1 + 6НОН ® 2А1(ОН)3
¯ + 3Н2
При повышенной температуре алюминий реагирует со многими неметаллами и сложными веществами без амальгамирования:
Применение
Алюминий применяют для производства различных сплавов. Наибольшее распространение имеют дюралюмины, содержащие медь и магний, и силумины — сплавы алюминия с кремнием. Основные преимущества этих сплавов—легкость и высокая прочность. Упомянутые сплавы широко используют в авиа-, авто-, судо- и приборостроении, в ракетной технике и в строительстве. В виде чистого металла алюминий идет на изготовление электрических проводов и различной химической аппаратуры.
Алюминий используют также для алитирования, т. е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии.
На практике часто используют термит (смесь оксида Fе3
O4
с порошком алюминия). Если эту смесь поджечь (с помощью магниевой ленты), то происходит бурная реакция с выделением большого количества теплоты:
8Al + 3Fe3
O4
® 4Al2
O3
+ 9Fe
Этот процесс используют при так называемой термитной сварке, а также для получения некоторых металлов в свободном виде.
Ответьте на вопросы 2—6 (с. 138). Решите задачи 1 – 2 (с. 138). [4]
2.1.3 Важнейшие соединения алюминия
Оксид алюминия
Аl2
О3
можно получить следующими способами:
1. Непосредственным сжиганием порошка металлического алюминия (вдуванием порошка алюминия в пламя горелки):
4Al+ 3O2
® 2А12
O3
2. Путем превращения по приведенной ниже схеме:
Оксид алюминия — твердое, тугоплавкое (темп. пл. 2050 °С) вещество белого цвета.
По химическим свойствам это амфотерный оксид (I, § 37). Реагирует с кислотами, проявляет свойства основных оксидов:
А12
O3
+ 6НС1 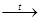 2А1С13
+ 3Н2
O 2А1С13
+ 3Н2
O
Al2
O3
+ 6H+
+6С1-
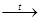 2Al3+
+ 6С1-
+ 3Н2
O 2Al3+
+ 6С1-
+ 3Н2
O
А12
O3
+ 6Н+
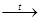 2A13+
+ 3Н2
O 2A13+
+ 3Н2
O
Оксид алюминия реагирует со щелочами и проявляет свойства кислотных оксидов. Причем при сплавлении образуются соли метаалюминиевой кислоты НА1O2
, т. е. мета-алюминаты:
Al2
O3
+ 2NaOH 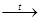 2NaA102
+ H2
0 2NaA102
+ H2
0
В присутствии воды реакция протекает иначе:
А12
О3
+ 2NаОН + Н2
O® 2[NaA1O2
.
H2
O]
Это объясняется тем, что в водном растворе алюминат натрия NaA1O2
присоединяет одну или две молекулы воды, что можно изобразить так:
а) NaA1O2
-Н2
О, или NaH2
A1O3
; б) NaA1O2
-2H2
O, или NaAl(OH)4
.
Гидроксид алюминия
Гидроксид алюминия А1(ОН)3
получают при взаимодействии раствора щелочи с растворами солей алюминия (раствор щелочи нельзя брать в избытке):
АlCl3
+ NaOН®Al(OH)3
¯ + 3NaCl
A13+
+ 3Cl-
+ 3Na+
+ 3OH-
® Al(OH)3
¯ + 3Na+
+ 3С1-
Аl3+
+ 3ОН-
® А1(ОН)3
¯
Если белую желеобразную массу гидроксида алюминия выделить из раствора и высушить, то получается белое кристаллическое вещество, практически не растворяющееся в воде.
Гидроксид алюминия (как и его оксид) обладает амфотерными свойствами. Подобно всем основаниям гидроксид алюминия реагирует с кислотами. При сплавлении гидроксида алюминия со щелочами образуются метаалюминаты, а в водных растворах — гидраты метаалюминатов:
А1(OH)3
+ NaOH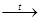 NaА1O2
+ 2Н2
O NaА1O2
+ 2Н2
O
А1(OH)3
+ NaOH®NaH2
А1O3
+ Н2
O
Соли алюминия получают в основном при взаимодействии металлического алюминия с кислотами. По физическим свойствам это твердые кристаллические вещества, хорошо растворимые в воде. Химические свойства солей алюминия аналогичны свойствам других солей ([3], с. 98—99). Так как соли алюминия образованы слабым основанием и сильной кислотой, то они в водных растворах подвергаются гидролизу (с. 18).
Ответьте на вопросы 7—10 (с. 138). Решите задачу 3 (с. 138 [4]).
Генетическая связь между алюминием и его важнейшими соединениями (схема 20).
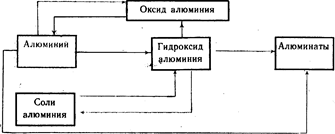
Выполните упражнение 11.
Далее в учебнике по этой теме приводятся задачи на закрепление материала. Также в учебнике приводится лабораторный эксперимент (с. 139) [4].
Таким образом, из вышеизложенного материала можно сделать вывод, что в школьной программе на изучение данной темы отводится очень мало часов, и, кроме этого, практически нет сведений об экологических аспектах этой темы.
Азот образует ряд оксидов, формально отвечающих всем возможным степеням окисления от +1 до +5: N2
O, NО, N2
O3
, NO2
, N2
O5
, однако всего два из них – оксид азота(II) и оксид азота(IV) – не только устойчивы при обычных условиях, но и активно задействованы в природном и промышленном круговоротах азота.
N2
+1
O – оксид азота(I), закись азота, «веселящий» газ, несолеобразующий оксид. Получают N2
O разложением аммиачной селитры:
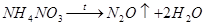
N2
O имеет слабый приятный запах и сладковатый вкус. С кислородом, водой, растворами кислот и щелочей не реагирует. Разлагается на элементы при температуре выше 500 °С, иными словами, достаточно устойчив.
Строение: у кислорода 2 неспаренных электрона, у азота 3 – образуется двойная связь и один неспаренный электрон в остатке. Можно предположить, что молекулы NO будут спариваться и образовывать димерную молекулу ONNO. Строение молекулы: линейная молекула О=N=N, в которой центральный атом N четырехвалентен. Он образует две двойные связи: одну – с кислородом по типичной схеме создания ковалентной связи (два электрона азота, два электрона кислорода), другую – с атомом азота (который два из своих трех неспаренных электронов спаривает и образует за счет этого пустую орбиталь), одна из связей ковалентная, вторая донорно-акцепторная (рис. 1).
Установка для получения оксида азота(I) состоит из штативов, пробирки, пробки с газоотводной трубкой, кристаллизатора, цилиндра и спиртовки (рис. 2). В пробирку помещают NH4
NO3
, закрывают пробкой с газоотводной трубкой и нагревают. Газ собирают в цилиндр, наполненный водой.
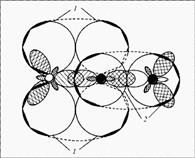
Рис. 1. Молекула оксида азота(I) – N2
O
Оксид N2
O разлагается при нагревании:
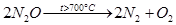
Оксид N2
O реагирует с водородом:
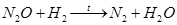
N+2
O – оксид азота(II), несолеобразующий оксид. Получают NO реакцией меди с кислотой HNO3
(разб.) (рис. 3).
Кристаллическая решетка молекулярная; молекула легкая, слабополярная (электроотрицательность кислорода немного выше, чем у азота). Можно предположить, что температуры плавления и кипения будут низкими, но выше, чем у азота, т. к. полярность молекулы дает возможность подключать электростатические силы притяжения к просто межмолекулярным силам. Образование димера тоже способствует повышению температуры кипения. Строение молекулы позволяет предположить и невысокую растворимость в воде. Оксид азота(II) не имеет ни цвета, ни запаха.
Для получения оксида азота(II) в пробирку помещают немного медных стружек и заливают разбавленную азотную кислоту. Пробирку закрывают пробкой с газоотводной трубкой и укрепляют в штативе. Конец газоотводной трубки опускают в кристаллизатор с водой и далее в цилиндр (рис. 3). При нагревании выделяется NO. NO легко окисляется кислородом воздуха, т. е. действует как восстановитель:
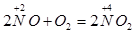
В реакции с сернистым газом оксид NO – окислитель:
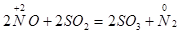
N+2
2
O3
– оксид азота(III), азотистый ангидрид (ему соответствуют азотистая кислота HNО2
и соли нитриты); это кислотный оксид, для него характерны все свойства кислотных оксидов. Получают оксид N2
O3
по реакции:
NO2
+ NO 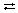 N2
O3
. N2
O3
.
N+4
O2
– оксид азота(IV), диоксид азота, бурый газ (токсичен).
Рассмотрим электроны азота в молекуле NО. Это неспаренный электрон, свободная пара электронов и еще два электрона на связи с кислородом – всего пять. А у атома кислорода, «выходящего на связь», шесть электронов на четырех орбиталях. Если расположить их по два, то одна орбиталь останется свободной. Именно ее и занимает пара электронов атома азота (рис. 4, 5).
Рис. 4. Схема электронного строения молекулы NO2
(первый вариант). (Точками обозначены электроны атомов О, крестиками – электроны атома N)
Рис. 5. Схема электронного строения молекулы NO2
(второй вариант). (Звездочкой обозначен возбужденный атом O, стрелкой – донорно-акцепторная связь.
Раз пара электронов, находящаяся на s-орбитали, «пошла на связь», она просто обязана подвергнуться гибридизации. Возникает вопрос: какой тип гибридизации использует атом? Ответ: три электронные орбитали азота находятся в состоянии sp2
-гибридизации. Молекула NO2
угловая, угол 134° (угол больше 120° потому, что 1 электрон отталкивает от себя электроны связи слабее, чем пара электронов) (рис. 6, 7).
Кристаллическая решетка молекулярная, однако, поскольку сама молекула тяжелее NO и склонность к димеризации у нее заметно выше, то плавиться и кипеть это вещество должно при заметно более высоких температурах. Температура кипения составляет 21 °С, поэтому при обычных условиях – 20 °С и 760 мм рт. ст. – оксид азота(IV) жидкий.
Оксид азота (IV) в воде растворяется, одновременно с ней реагируя, и получается при этом сразу две кислоты.
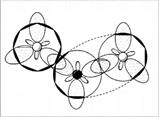 
Рис. 6. Молекула NO2
— вид «сверху»
Рис. 7. Молекула NO2
– вид «сбоку», со стороны донорно-акцепторной связи. (Второй атом кислорода не виден за орбиталями атома азота. Заштрихованные кружки – это гибридизованные орбитали атомов, направленные к читателю.)
Оксид азота(IV) имеет и характерный резкий запах, и рыжевато-бурый цвет, оттенки которого отличаются друг от друга в зависимости от концентрации. Именно за этот цвет выбросы оксидов азота в атмосферу называют «лисьими хвостами» [4].
Реакции оксида NO2
1) С водой:
2NO2
+ Н2
O = НNO3
+ НNO2
.
2) С щелочами:
2NO2
+ 2NaOH = NаNО3
+ NаNО2
+ Н2
O.
3) Димеризация при охлаждении:
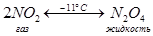
При температуре –11 °С равновесие полностью смещено вправо, а при +140 °С – целиком влево.
N+5
2
O5
– оксид азота(V), азотный ангидрид, кислотный оксид, сильный окислитель. Оксид N2
O5
легко разлагается:
2N2
O5
= 4NO2
+ O2
.
Из гидроксидов азота мы рассмотрим наиболее многотоннажный – азотную кислоту.
Молекула азотной кислоты полярна (из-за разной электроотрицательности кислорода и водорода, потому что азот как бы скрыт внутри молекулы) и асимметрична. Все три имеющихся в ней угла между связями азота с кислородом разные. Формальная степень окисления азота высшая (+5). Но при этом только 4 связи у атома азота с другими атомами – валентность азота равна 4.
Строение молекулы легче понять, если рассмотреть процесс ее получения. Азотная кислота получается при реакции оксида азота(IV) с водой (в присутствии кислорода): две молекулы NO2
одновременно «атакуют» молекулу воды своими неспаренными электронами, в результате связь водорода с кислородом разрывается не как обычно (пара электронов у кислорода и «голый протон»), а одной молекуле NO2
достается водород со своим электроном, другой – радикал ОН (рис. 8). Образуются две кислоты: обе кислоты сильные, обе быстро отдают свой протон ближайшим молекулам воды и остаются в итоге в виде ионов NO2
-
и NO3
-
. Ион NO2
-
нестоек, две молекулы НNО2
разлагаются на воду, NО2
и NО. Оксид NO реагирует с кислородом, превращаясь в NО2
, и так до тех пор, пока не получится одна только азотная кислота.
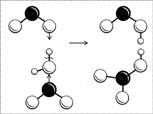
Рис. 8. Схема образования молекул азотной и азотистой кислот. (Черный шар – атом N, большие белые шары – атомы O, маленькие белые шарики – атомы H.)
Формально выходит, что с одним атомом кислорода атом азота связан двойной связью, а с другим – обычной одинарной связью (этот атом кислорода связан еще и с атомом водорода). С третьим атомом кислорода азот в HNO3
связан донорно-акцепторной связью, причем в качестве донора выступает атом азота. Гибридизация атома азота при этом должна быть sр2
из-за наличия двойной связи, что определяет структуру – плоский треугольник. Реально получается, что действительно фрагмент из атома азота и трех атомов кислорода – плоский треугольник, только в молекуле азотной кислоты этот треугольник неправильный – все три угла ОNО разные, следовательно, и разные стороны треугольника. Когда же молекула диссоциирует, треугольник становится правильным, равносторонним. Значит, и атомы кислорода в нем становятся равноценными. Одинаковыми становятся и все связи.
Физические свойства азотной кислоты
Соединение ионизированное, пусть даже и частично, сложно перевести в газ. Таким образом, температура кипения должна бы быть достаточно высокой, однако при такой небольшой молекулярной массе температура плавления высокой быть не должна. Следовательно, агрегатное состояние при 20°С жидкое. Что касается растворимости, то, как и многие другие полярные жидкости, азотная кислота легко смешивается с водой в любых соотношениях. Чистая азотная кислота бесцветна и не имеет запаха. Однако из-за разложения на кислород и оксид азота(IV), который в ней же и растворяется, можно сказать, что обычная концентрированная азотная кислота имеет желто-бурый цвет и характерный для NO2
резкий запах. Посмотрим, как влияет строение молекулы азотной кислоты на ее химические свойства.
НNО3
– cильный окислитель
При взаимодействии НNО3
с металлами (М) водород не выделяется:
М + НNО3
® соль + вода + газ.
Смесь HNO3
(конц.) с HCl (конц.) в объемном соотношении 1:3 (1V HNO3
+ 3V HCl) называют «царской водкой».
Au + HNO3
+ 3HCl = AuCl3
+ NO + 2H2
O. + 2H2
O.
Азотная кислота не реагирует с другими кислотами по типу реакций обмена или соединения. Однако вполне способна реагировать как сильный окислитель. В смеси концентрированных азотной и соляной кислот протекают обратимые реакции, суть которых можно обобщить уравнением:
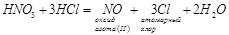
Образующийся атомарный хлор очень активен и легко отбирает электроны у атомов металлов, а хлорид-ион образует устойчивые комплексные ионы с получающимися ионами металлов. Все это позволяет перевести в раствор даже золото. Концентрированная H2
SO4
как сильное водоотнимающее средство способствует реакции разложения азотной кислоты на оксид азота(IV) и кислород. Азотная кислота – одна из сильных неорганических кислот и, естественно, со щелочами реагирует. Реагирует она также и с нерастворимыми гидроксидами, и с основными оксидами [4].
При изучении темы «Азот. Соединения азота» пользуются учебником химии под редакцией Г.Е. Рудзитис, Ф.Г. Фельдман, также учебником за 9 класс под редакцией Н.С. Ахметова. Дидактическим материалом служит книга по химии для 8-9 классов под редакцией А. М. Радецкого, В. П. Горшкова; используются задания для самостоятельной роботы по химии за 9 класс под редакцией Р.П. Суровцева, С.В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г.П. Хомченко, И.Г. Хомченко. На изучение этой темы отводится 7 ч [4, 5].
ГЛАВА 3. МЕЖПРЕДМЕТНЫЕ СВЯЗИ ПРИ ИЗУЧЕНИИ III И V ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.МЕНДЕЛЕЕВА
3.1 III-А группа
Бор никогда не встречается в природе в свободном состоянии, он всегда оказывается связанным с кислородом. В этой форме он присутствует в борной кислоте Н3
BO3
, которая содержится в воде горячих источников вулканических местностей. Кроме того, в природе распространены многочисленные соли борной кислоты. Из этих солей наиболее известна бура или тинкал Na2
B4
О7
.
10Н2
О. Техническое значение имеют борацит 2Mg3
B8
O15
.
MgCl2
, пандермит Са2
B6
О11
.
3Н2
О, колеманит Са2
B6
О11
.
5Н2
О, кернит Na2
B4
О7
.
4Н2
О.
Необходимо указать и следующие минералы, которые являются производными борной кислоты: борокальцит СаB4
О7
.
4Н2
О, борнонатрокальцит NaСаB5
О9
.
6Н2
О, гидроборацит MgCaB6
О11
.
6Н2
О, боромагнезит 2Mg5
B4
О11
.
5Н2
О, сингалит MgAlBО4
и др. [9-11].
Бор и его соединения имеют большое значение в народном хозяйстве. Изотоп 5
10
B, поглощающий нейтроны, применяют в ядерной технике для замедления ядерных цепных реакций. Бура и борная кислота издавна применяется в медицине как антисептики.
Физиологическая и биологическая активность бора очень высока. Бор способен влиять на важнейшие процессы биохимии животных и растений. Вместе с Mn, Cu, Zn и Мо бор входит в число пяти жизненно важных микроэлементов. Бор концентрируется в костях и зубах, в мышцах, в костном мозгу, печени и щитовидной железе. Вероятно, что он ускоряет рост и развитие организмов. Это видно из влияния бора на растения. При борном голодании значительно уменьшается урожай и особенно количество семян. Для жизнедеятельности животных важно его нахождение в молоке (коровьем) и в желтке куриных яиц. Некоторые растения (кормовые травы и сахарная свекла) собирают по несколько граммов бора с гектара угодий. Бор содержится в значительных количествах в жировых тканях некоторых животных, пасущихся на пастбищах, обогащенных бором. Состав соединений бора в организме неизвестен. Установлено, что бор тормозит кишечную амилазу и кишечные протеиназы, усиливает действие инсулина и тормозит окисление адреналина, ослабляет витамины В2
и В12
. При избытке бора появляются борные энтериты. Избыточное содержание бора ведет к заболеванию растений. Пшеница и овес страдают при наличии 0,7 - 0,8 мгВ/кг почвы. Борьба с засолением почв бором ведется с помощью промывки борных почв [9-11].
3.1.2 Алюминий
По своей распространенности алюминий среди элементов занимает третье место, среди металлов - первое. Он встречается главным образом в виде двойных силикатов, в полевых шпатах и слюдах и в продуктах их выветривания - глинах. В свободном состоянии алюминий никогда не встречается. Окись алюминия Al2
O3
встречается в виде корунда и наждака. Из гидроокисей боксит AlO(OH) имеет наибольшее техническое значение в качестве основного исходного продукта для получения, Большое значение имеет также криолит Na3
AlF6
.
Из двойных силикатов следует отметить: калиевый полевой шпат или ортоклаз K[AlSi3
O8
] - главная составная часть изверженных пород: гранита, сленита, базальта, кальциевый полевой шпат или анорит Сa[Al2
Si2
O8
], плагиоглаз, далее слюды: биотит, мусковый лепидалит, которые также содержатся в изверженных породах. Силикат алюминия, содержащий фтор - топаз, относится к числу драгоценных камней Al2
(OH, F)2
[SiO4
] [9-11].
При выветривании полевых шпатов образуется каолин (фарфоровая глина), содержащий воду силикат алюминия состава Al2
O3
.
2SiO2
.
2H2
O.
Сульфат алюминия Al2
(SO4
)3
используется в качестве протравы при крашении, для дубления кожи, в бумажном производстве. Сульфат алюминия применяют для очистки природных вод от коллоидных частиц, загрязняющих воду, которые захватываются гидроксидом алюминия, образующимся при этом гидролизе соли.
Алюминий имеет большое биологическое значение. Низкие концентрации ионов алюминия Al3+
стимулируют некоторые процессы жизнедеятельности растений. Например, прорастание семян. Но более высокие концентрации снижают интенсивность фотосинтеза, нарушают фосфорный обмен, задерживают рост корневой системы. Некоторые производные алюминия применяют в медицине. Например, KAl(SO4
)2
служит вяжущим средством. Основной ацетат алюминия AlOH(COOCH3
)2
используется для дезинфекции [9-11].
3.1.3 Галлий
Галлий встречается в природе как спутник цинка во многих обманках, но только в исключительно малых количествах (0,002 % и меньше). В виде следов он встречается почти как постоянный спутник алюминия. В всех сортах технического алюминия его можно открыть спектрально. Самый богатый галлием минерал - германит. В нем содержится 0,6 - 0,7 % галлия [9].
3.1.3.2 Токсикологическая характеристика
Долгое время считалось, что галлий токсичен. Лишь в последнее время это мнение было опровергнуто. Легкоплавкость галлия представляет интерес для стоматологов. Еще в 1930 г. была испытана композиция для пломбирования зубов, в которой ртуть Hg была заменена на галлий. И в настоящее время используются пломбы для пломбирования зубов с использованием галлия [10].
3.2
V-A группа периодической системы
Газообразный N2
возникает в результате реакции окисления NHH3
, образующегося при извержении вулканов и разложении биологических отходов:
4NH3
+ 3O2
® 2N2
+ 6H2
O.
Круговорот азота – один из самых сложных, но одновременно самых идеальных круговоротов. Несмотря на то, что азот составляет около 80% атмосферного воздуха, в большинстве случаев он не может быть непосредственно использован растениями, т.к. они не усваивают газообразный азот. Вмешательство живых существ в круговорот азота подчинено строгой иерархии: только определённые категории организмов могут оказывать влияние на отдельные фазы этого цикла. Газообразный азот непрерывно поступает в атмосферу в результате работы некоторых бактерий, тогда как другие бактерии – фиксаторы (вместе с сине-зелёными водорослями) постоянно поглощают его, преобразуя в нитраты. Неорганическим путём нитраты образуются и в атмосфере в результате электрических разрядов во время гроз.
Самые активные потребители азота – бактерии на корневой системе растений семейства бобовых. Каждому виду этих растений присущи свои особые бактерии, которые превращают азот в нитраты. В процессе биологического цикла нитрат-ионы (NO3
-
) и ионы аммония (NH4
+
), поглощаемы растениями из почвенной влаги, преобразуются в белки, нуклеиновые кислоты и т.д. Далее образуются отходы в виде погибших организмов, являющихся объектами жизнедеятельности других бактерий и грибов, преобразующих их в аммиак. Так возникает новый цикл круговорота. Существуют организмы, способные превращать аммиак в нитриты, нитраты и в газообразный азот. Основные звенья круговорота азота в биосфере представлены схемой на рис. 10.
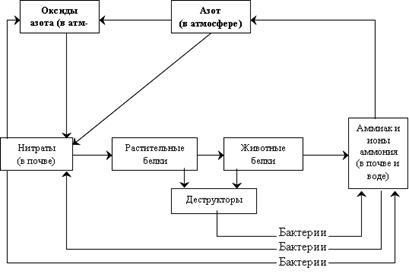
Рис. 10. Круговорот азота
Биологическая активность организмов дополняется промышленными способами получения азотосодержащих органических и неорганических веществ, многие из которых применяются в качестве удобрений для повышения продуктивности и роста растений.
Антропогенное влияние на круговорот азота определяется следующими процессами:
1. Сжигание топлива приводит к образованию оксида азота, а затем реакциям:
2NO + O2
® 2NO2
,
4NO2
+ 2H2
O + O2
® 4HNO3
,
способствуя выпадению кислотных дождей;
2. В результате воздействия некоторых бактерий на удобрения и отходы животноводства образуется закись азота – один из компонентов, создающих парниковый эффект;
3. Добыча полезных ископаемых, содержащих нитрат-ионы и ионы аммония, для производства минеральных удобрений;
4. При сборе урожая из почвы выносятся нитрат-ионы и ионы аммония;
5. Стоки с полей, ферм и из канализаций увеличивают количество нитрат-ионов и ионов аммония в водных экосистемах, что ускоряет рост водорослей и других растений; при разложении последних расходуется кислород, что приводит к гибели рыб. [12]
3.2.3 Соединения азота
Оксид азота(I) относительно инертен, а потому «экологически нейтрален». Однако на человека он оказывает наркотическое действие, начиная от просто веселья (за что он и был прозван «веселящим газом») и, заканчивая глубоким сном, что нашло свое применение в медицине. Интересно, что он безвреден, и для медицинского наркоза применяют смесь оксида азота(I) с кислородом в таком же соотношении, что и соотношение азота и кислорода в воздухе. Наркотическое действие снимается сразу после прекращения вдыхания этого газа.
Два других устойчивых оксида азота легко переходят один в другой, затем в кислоты, а затем в анионы NO2
-
и NO3
-
. Таким образом, эти вещества представляют собой естественные минеральные удобрения, если находятся в естественных количествах. В «неестественных» количествах эти газы редко попадают в атмосферу в одиночестве. Как правило, образуется целый «букет» ядовитых соединений, которые действуют комплексно.
Например, всего один завод азотных удобрений выбрасывает в воздух кроме оксидов азота, азотной кислоты, аммиака и пыли от удобрений еще и оксиды серы, соединения фтора, некоторые органические соединения. Ученые выясняют устойчивость различных трав, кустов и деревьев к подобным «букетам». Уже известно, что, к сожалению, ель и сосна неустойчивы и быстро погибают, однако белая акация, канадский тополь, ивы и некоторые другие растения могут существовать в таких условиях, более того, они способствуют удалению из воздуха этих веществ.
Сильное отравление оксидами азота можно получить в основном при авариях на соответствующих производствах. Ответная реакция организма будет разной из-за различия в свойствах этих газов. «Едкий» NО2
в первую очередь действует на слизистые оболочки носоглотки, глаз, вызывает отек легких; NО, как малорастворимое в воде и не едкое вещество, проходит через легкие и попадает в кровь, вызывая нарушения в центральной и периферийной нервных системах. Оба оксида реагируют с гемоглобином крови, результат – гемоглобин перестает переносить кислород.
Экологические свойства азотной кислоты складываются из двух «половинок». Как сильная кислота, она разрушающе действует не только на живые ткани (кожу человека, лист растения), но и на почву, что достаточно актуально – кислотные (из-за присутствия оксидов азота и серы) дожди, увы, не редкость. При попадании кислоты на кожу возникает химический ожог, который болезненнее и заживает значительно дольше, чем термический. Это были основные экологические свойства катиона водорода.
3.2.3.1 Взаимодействие нитрат-иона с фауной и флорой
Нитрат-ион – неотъемлемая часть круговорота азота в природе. В обычных условиях и в разбавленных растворах устойчив, слабо проявляет окислительные свойства, не осаждает катионы металлов, тем самым способствуя транспортировке этих ионов с раствором в почве, растениях и т. п.
Нитрат-ион становится ядовитым только в больших количествах, нарушающих баланс других веществ. Например, при избытке нитратов в растениях уменьшается количество аскорбиновой кислоты. (Стоит напомнить, что живой организм настолько тонко организован, что любое вещество в больших количествах нарушает равновесие и, следовательно, становится ядовитым.)
Растения и бактерии используют нитраты для построения белков и других необходимых органических соединений. Для этого надо перевести нитрат-ион в ион аммония. Эта реакция катализируется ферментами, содержащими ионы металлов (меди, железа, марганца и др.). Из-за гораздо большей ядовитости аммиака и иона аммония в растениях хорошо отработана и обратная реакция перевода иона аммония в нитрат.
Животные не умеют строить все необходимые им органические соединения из неорганических – отсутствуют соответствующие ферменты. Однако микроорганизмы, живущие в желудке и кишечнике, этими ферментами обладают и могут переводить нитрат-ион в нитрит-ион. Именно нитрит-ион и действует как отравитель, переводя железо в гемоглобине из Fe2+
в Fe3+
.
Соединение, содержащее Fe3+
и называемое метгемоглобином, слишком прочно связывает кислород воздуха, следовательно, не может отдавать его тканям. В результате организм страдает от недостатка кислорода, при этом происходят нарушения в работе мозга, сердца и других органов.
Обычно нитрит-ион образуется не в желудке, а в кишечнике и не успевает перейти в кровь и произвести все эти разрушения. Поэтому отравления нитратами достаточно редки. Существует, правда, и другая опасность: в нашем организме есть много веществ, в которых атомы водорода аммиака замещены на органические радикалы. Такие соединения называют аминами. При реакции аминов с нитрит-ионами образуются нитрозамины – канцерогенные вещества:
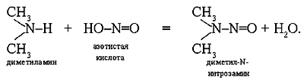
Они действуют на печень, способствуют образованию опухолей в легких и почках. Интересно, что активным замедлителем реакции образования нитрозаминов является давно нам знакомая аскорбиновая кислота [4, 11-14].
4.1 Урок на тему «III-А группа периодической системы химических элементов Д. И. Менделеева»
Занятие 1. Характеристика химических элементов III-а группы периодической системы
Алюминий
Основные цели. Формирование основополагающих понятий, умений и навыков. Характеристика химических элементов III-a группы периодической системы. Строение атома, физические и химические свойства, применение и получение алюминия.
Оборудование. Периодическая система химических элементов, рис. 2, 1 б.
Вещества. Алюминий.

ХОД ЗАНЯТИЯ| Основное содержание |
Формы обучения |
Методы обучения |
Средства обучения |
1. Актуализация знаний, умений и навыков учащихся.
1) Перечислите химические элементы IIIa группы периодической системы в порядке усиления их металлических свойств.
|
Рис. 2
|
2) Электронная формула внешнего энергетического уровня 3s2
3p1
принадлежит атому:
а) бора; б) алюминия; в) галлия; г) таллия.
|
| 3) Перечислите физические и химические свойства и области применения алюминия, используя рис. 21.3 |
| 2. Получение алюминия |
Рис. 1, б |
| 3. Подведение итогов |
Краткое сообщение на тему «Металлы III группы с точки зрения химика-эколога»
Опросить учащихся.
Информация о домашнем задании. § 50 ([3]). Напишите уравнения реакций, при помощи которых можно осуществить превращения веществ:
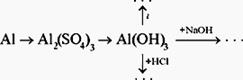
Самоанализ урока
Занятие 2. Оксиды и гидроксиды алюминия
Основные цели. Формирование основополагающих понятий, умений и навыков. Углубить знания учащихся об амфотерности оксидов и гидроксидов. Аквакомплексы, гидроксокомплексы, химизм производства алюминия электролизом оксида алюминия.
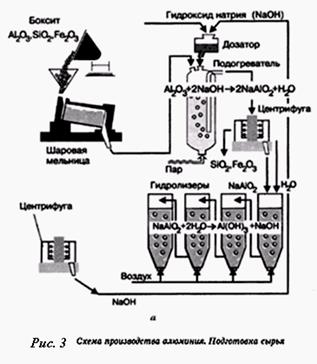
Оборудование. Схема производства алюминия (процесс электролиза), штатив с пробирками, рис. 1, а.
Вещества. Растворы AlCl3
, NaOH, H2
SO4
.
ХОД ЗАНЯТИЯ
| Основное содержание |
Формы обучения |
Методы обучения |
Средства обучения |
| 1. Амфотерность оксида алюминия |
| 2. Запись уравнений реакций взаимодействия оксида алюминия с гидроксидом натрия и азотной кислотой |
| 3. Амфотерность гидроксида алюминия. Запись ионных уравнений реакций. Разбор образования аква- и гидроксокомплексов. Сверить запись уравнений реакций с домашним заданием. Коллоидные частицы |
Лабораторный опыт 21 |
| 4. Разбор химизма образования гидроксида алюминия в производстве алюминия |
рис. 3 |
| 5. Подведение итогов |
Сообщение на тему «Экологические аспекты переработки алюминийсодержащих руд»
Опросить учащихся.
Информация о домашнем задании. § 50; таблица 21.1 ([13, 28]).
Самоанализ урока
Занятие 3. Гидролиз солей алюминия
Основные цели. Формирование основополагающих понятий, умений и навыков. Расширить знания о гидролизе солей. Применение гидролиза солей.
Оборудование. Штатив с пробирками, схема «Гидролиз солей».
Вещества. Растворы сульфата или хлорида алюминия, лакмусовая бумага (лакмус) синяя, фиолетовая.

ХОД ЗАНЯТИЯ
| Основное содержание |
Формы обучения |
Методы обучения |
Средства обучения |
| 1. Актуализация знаний, умений и навыков учащихся об амфотерности оксида и гидроксида алюминия |
2. Гидролиз солей алюминия:
а) анализ результата опыта;
б) запись ионных уравнений проделанного опыта;
в) вывод
|
Лабораторный опыт 22(1) |
Схема «Гидролиз солей» |
3. Выполнение задания. Напишите уравнения реакций, при помощи которых можно осуществить превращения веществ:
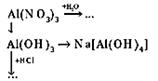
|
| 4. Подведение итогов |
Опросить учащихся
Информация о домашнем задании. § 50 ([13-15]).
Самоанализ урока.
Знать: важнейшие свойства и применение азота, аммиака, оксидов азота, азотной кислоты, нитратов; важнейшие минеральные удобрения, условия их рационального хранения и использования; устройство прибора для получения аммиака в лабораторных условиях; качественные реакции на нитрат-ионы и ион аммония; химические реакции, лежащие в основе производства аммиака и азотной кислоты, условия их осуществления; общие научные принципы химического производства.
Уметь: давать характеристику подгруппе элементов; составлять уравнения изученных реакций, рассматривать их с точки зрения окислительно-восстановительных и ионных представлений; определять на практике нитрат-ионы, а также ион аммония; решать комбинированные задачи.
Основные понятия: донорно-акцепторный механизм образования связи, ион аммония, несолеобразующий (безразличный) оксид, селитры, удобрения (туки), азотистый ангидрид, азотный ангидрид, нитриды.
Контрольные вопросы
1. Каково строение атома азота?
2. Каковы возможные валентности и степени окисления азота?
3. Где в природе встречается азот?
4. Как получают азот в лаборатории и в промышленности?
5. Каковы физические свойства азота?
6. Каковы химические свойства азота? Напишите уравнения реакций.
7. Где применяется азот?
8. Каково строение молекулы аммиака? Какой тип химической связи в молекуле NH3
?
9. Как образуется донорно-акцепторная связь в ионе аммония?
10. Почему аммиак способен окисляться?
11. Каковы физические свойства аммиака?
12. Как аммиак взаимодействует с водой и кислотами?
13. Какие два способа окисления аммиака вам известны? Приведите уравнения соответствующих реакций.
14. Где применяется аммиак?
15. Почему соли аммония схожи с солями калия?
16. Какова растворимость в воде солей аммония?
17. Как получают аммиак в лаборатории и на производстве? Составьте уравнения реакций получения NH3
.
18. Каковы общие свойства солей аммония? Напишите уравнения реакций.
19. Каковы специфические свойства солей аммония? Подтвердите свой ответ уравнениями реакций.
20. Какова качественная реакция на соли аммония? Составьте уравнение реакции.
21. Какие оксиды азота вам известны?
22. Как можно получить монооксид азота? Каковы его физические свойства?
23. Как можно получить диоксид азота? Каковы его физические свойства?
24. Как диоксид азота взаимодействует с водой и щелочами? Напишите уравнения реакций.
25. Каковы физические свойства азотной кислоты?
26. Каково строение молекулы азотной кислоты?
27. Каковы валентность и степень окисления азота в азотной кислоте?
28. Как можно получить азотную кислоту? Приведите уравнение реакции.
29. Почему азотная кислота является сильным окислителем?
30. Как азотная кислота взаимодействует с металлами?
31. Какие газообразные вещества могут выделяться при восстановлении азота в азотной кислоте?
32. Какие металлы не взаимодействуют с концентрированной азотной кислотой? Почему?
33. Как взаимодействуют с разбавленной азотной кислотой медь и серебро? Напишите уравнения реакций.
34. В какой таре можно хранить азотную кислоту?
35. Как разлагается азотная кислота?
36. Как взаимодействуют неметаллы с азотной кислотой? Приведите уравнения реакций.
37. Какие еще соединения азота вам известны?
38. Как называют соли азотной кислоты? Каковы их физические свойства?
39. Какие нитраты являются удобрениями?
40. Какие способы получения нитратов вам известны? Составьте уравнения реакций.
41. Как могут разлагаться нитраты при нагревании? Напишите уравнения реакций разложения KNO3
, Cu(NO3
)2
и AgNO3
.
42. Почему нитраты могут быть окислителями?
43. Как отличить нитраты от других солей?
44. Какие вещества называют удобрениями?
45. Какие виды удобрений вам известны?
46. Перечислите важнейшие удобрения каждой группы.
47. Какие элементы составляют семейство азота?
48. Как изменяются свойства элементов группы Vа и их соединений с увеличением атомного номера? Почему?
Рассмотрим в качестве примера разработки некоторых уроков по теме «Производство азотной кислоты».
4.1.2 Урок по теме «Получение азотной кислоты»
Цель урока: Рассмотреть процесс получения азотной кислоты в лабораторных условиях, изучить и закрепить химизм процесса.
Приборы и материалы: штатив, реторта, воронка, тубус, резиновая пробка, чашка с холодной водой, печь или спиртовка
Реактивы: концентрированная серная кислота, 15-20 г. нитрата натрия.
ХОД УРОКА
Собрать прибор по рисунку 3. В реторту поместить 15-20 г NaNO3
и прилить через воронку, вставленную в тубус столько концентрированной H2
SO4
, чтобы она покрыла соль. Закрыть тубус стеклянной или резиновой пробкой и опустить конец реторты в сухую колбу, помещенную в чашку с холодной водой. Осторожно нагревать реторту. Когда в приемнике соберется несколько миллилитров кислоты, нагревание прекратить и, дав реторте охладиться, разобрать прибор. Кислоту сохранить для следующих опытов. Объяснить появление у нее окраски..
Остерегаться попадания HNO3
на одежду или на руки: она быстро разрушает ткань, а на руках появляются желтые пятна и ожоги.
Написать уравнение реакции:
H2
SO4
+ NaNO3
®HNO3
+ NaHSO4
Вопросы: Почему реакция проводят при несильном нагревании?
Сделайте вывод о проведенной работе[16-19].
4.1.3 Практическая работа
на тему «Азотная кислота и ее соли»
Цель урока: Научиться применять полученные знания о свойствах азотной кислоты и ее солей на практике.
ХОД УРОКА
I. Организационный момент.
II. Фронтальный опрос:
- Какие реакции называют окислительно-восстановительными?
- Какие химические свойства HNO3
вы знаете?
- Дождевая вода после грозы содержит следы азотной кислоты. Чем это объясняется?
III. Индивидуальный опрос
1-й учащийся - задание №
2-й учащийся - задание №
IV. Самостоятельная работа
На оставшееся время учитель раздает всем карточки с тремя заданиями, два из которых уже разбирались на уроке, а третье задание - творческое, направлено на выявление дополнительных знаний по данной теме.
Например, такая карточка может выглядеть следующим образом:
Карточка № 1
1) Рассчитайте массовую долю азота в следующих веществах:
а) N2O; б) N2O4; в)Cu(NO3)2; г)NH4NO3; д)Fe(NO3)3.
2) Напишите уравнения реакций, с помощью которых можно осуществить цепь следующих превращений:
NO2 ® HNO3 ® Ba(NO3)2 ® KNO3
3) Почему молекула NO2 легко димеризуется, а для SO2 подобный процесс не характерен?
V. Домашнее задание:
Задача № 7; 2) Составить кроссворд на тему: «Азотная кислота и ее большое семейство». [3 (c. 55-60), 17-20]
ГЛАВА 5. ЗАДАЧИ И ТЕСТЫ
5.1 Задачи и тесты по теме «
V
-
A
группа ПС»
Задача 1. На гашеную известь, взятую в небольшом количестве подействовали 3,15 кг чистой азотной кислоты. Какую массу нитрата кальция Ca(NO3)2 получили, если практический выход составляет 98%?
Дано:
m(HNO3) = 3,15кг.
wвых (CaNO3) = 98%
m(CaNO3)-?
Решение:
Ca(OH)2 +2HNO3 ®Ca(NO3)2 + 2H2O
M (HNO3
)=63 г/моль; m (HNO3
)=2×63 =126 кг.; M (Ca(NO3
)2
)=164 г/моль; m (Ca(NO3
)2
)=164 кг.
Находим теоретический выход:
126:3,15=164×X1
; m(Ca(NO3
)2
)теор
=4,1кг.
Находим 98% - ный выход:
4,1 кг (Ca(NO3
)2
) соотв. 100% - ному выходу
X2
-//- 98% - ному выходу
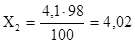 кг кг
Ответ: m (Ca(NO3
)2
)практ.
= 4,02 кг.
Задача 2. Химический завод выбрасывает в атмосферу 120 т. нитрата аммония. Какова ежесуточная потребность в аммиаке (в м3
, при 0°С и 101,3 кПа)?
Дано
:
m(NH4
NO3
)=120 т/сут.
M(NH4
NO3
) = 80г.
V(NH3
)-?
Решение:
NH3
+ HNO3
®NH4
NO3
M(NH4
NO3
) = 80г.
Составим пропорцию:
X литров NH3
соответствуют 120×106
граммам NH4
NO3
22,4 литров NH3
соответствуют 80 граммам NH4
NO3
,
Тогда 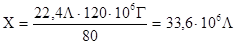 
Ответ: Ежесуточная потребность завода в аммиаке составляет 33600м3
Задача 3. Как известно, памятник Кузьме Минину выполнен из бронзы (75% Cu, 25% Sn), поэтому он постепенно разрушается под действием кислотных дождей. Написать реакцию коррозии памятника. Какой объем газа выделится при полном разрушении памятника? Какие меры принимаются для предотвращения коррозии? Масса памятника принимается равной 2750 кг.
Дано:
w(Сu) = 75%
m= 2750кг.
_____________
V(NO2
) - ?
Решение:
4HNO3
+ Cu = Cu(NO3
)2
+ 2NO2
+ 2NO2
2750 кг.®100%
X1
кг®75% Сu
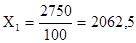 кг. кг.
Составляем пропорцию:
2062,5 ×103
г. Cu ® X2
л. NO2
64 л. Cu ® 44,8 л. NO2
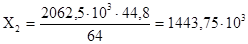 л. л.
Ответ: 1) при полном разрушении памятника Кузьме Минину под действием кислотных осадков выделится 1443,75 м3
NO2
; 2) для предотвращения коррозии памятник несколько раз в год протирают антикоррозионными органическими веществами.
Задача 4. Почва содержит 3,1 % органического вещества. Вычислить процентное содержание (W) углерода и азота в почве, если органическое вещество содержит 60% углерода и массовое отношение С:N=8:1.
Дано:
w(орг. в-ва) = 3,1%
w(C) = 60%
С:N=8:1.
_________________
Wс
-? WN
-?
Решение:
Допустим, что 100% - это 100 г, тогда m (орг. в-ва) = 3,1г.
m(С) = 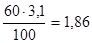 г. г.
m(N) = 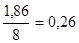 г. г.
Процентное содержание углерода и азота в 100 г почвы:
Wс
=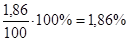
WN
= (m(N) / m(почвы))× 100 %
WN
= (0,23г./100г.) × 100 % = 0,23%
Ответ: Процентное содержание углерода и азота в 100 г = 1,86% и 0,23%.
Задача 5. Свекла, выращенная в г. Курске имеет содержание нитратов 3000 мг/кг(что в 2 раза больше предельно допустимой концентрации). Сколько килограммов этой свеклы надо счесть, чтобы смертельной дозы для человека (15гр.)?
 Решение: Решение:
в 1кг. свеклы ® 3гр (NO3
-
)
d x кг. свеклы ® 15гр (NO3
-
)
Ответ: 5кг свеклы, выращенной в г. Курске, содержит смертельную дозу нитрат ионов [20, 26, 27].
Задача № 6. При нормальных условиях 12 л газовой смеси, состоящей из аммиака и углекислого газа, имеют массу 18 г. Сколько литров каждого из газов содержит смесь? Каковы объемные доли каждого компонента в смеси?
Решение
Обозначим V(NH3
) = x л, V(CO2
) = (12 - x) л.
Тогда n(NH3
) = x/22,4 моль, n(СО2
) = (12 – x)/22,4 моль,
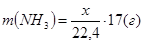 , , 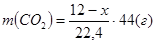 . .
Составим уравнение:
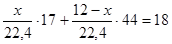 , х = 4,62 л NH3
; , х = 4,62 л NH3
;
V(CO2
) = 12 – 4,62 = 7,38 л.
Найдем объемные доли газов в смеси:
j (NH3
) = 4,62/12 = 0,385 или 38,5%,
j (СО2
) = 1 – 0,385 = 0,615 или 61,5%.
Задания для самоконтроля
1. Напишите уравнения практически осуществимых реакций:
а) NH4
Cl + AgNO3
® …;
в) AgCl + NH4
NO3
® …;
д) HNO3
+ SiO2
® …;
ж) Hg(NO3
)2
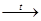 …; …;
и) Fe2
O3
+ HNO3
® …;
|
б) (NH4
)2
SO4
+ NaOH ® …;
г) HNO3 (
разб
.)
+ Cu ® …;
е) HNO3
+ MgCO3
® …;
з) NH3
+ O2
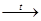 …; …;
к) NH4
Cl 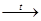 …; …;
|
2. Напишите уравнения реакций следующих превращений:
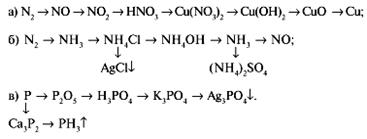
3. Составьте схемы электронного баланса, расставьте коэффициенты в уравнениях реакций:
а) HNO3
+ С  СО2
+ NO + H2
O; СО2
+ NO + H2
O;
б) HNO3
+ AsH3
 H3
AsO4
+ NO2
+ H2
O; H3
AsO4
+ NO2
+ H2
O;
в) HNO3
+ P + H2
O  H3
PO4
+ NO; H3
PO4
+ NO;
г) HNO3
+ CuS  Сu(NO3
)2
+ H2
SO4
+ NO + H2
O; Сu(NO3
)2
+ H2
SO4
+ NO + H2
O;
д) MnO2
+ K2
CO3
+ KNO3
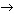 K2
MnO4
+ KNO2
+ CO2
; K2
MnO4
+ KNO2
+ CO2
;
е) K2
CrO4
+ (NH4
)2
S + H2
O 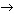 Сr(OH)3
+ KOH + NH4
OH + S. Сr(OH)3
+ KOH + NH4
OH + S.
4. При взаимодействии 28 л (н. у.) аммиака с раствором азотной кислоты массой 400 г, в котором содержится 0,24 массовые доли HNO3
, образуется нитрат аммония массой 90 г. Вычислите выход продукта реакции в процентах от теоретически возможного. Ответ. 90%.
5. При нагревании технического нитрата меди(II) массой 75,2 г выделяется кислород объемом 4 л (н. у.). Рассчитайте массовую долю примесей в образце нитрата. Ответ. 10,7%.
6. Имеется смесь хлорида, карбоната и нитрата натрия массой 50 г. Определите массовую долю каждого компонента смеси, если известно, что при действии на нее избытка соляной кислоты выделяется газ объемом 2,24 л (н. у.), а при прокаливании такой же массы смеси выделяется кислород объемом 2,24 л (н. у.). Ответ. w(NaCl) = 44,8%, w(Na2
CO3
) = 21,2%, w(NaNO3
) = 34%.
7. При действии избытка разбавленной азотной кислоты на образец известняка массой 80 г, содержащий 20% примесей, выделяется оксид углерода(IV), который пропускают через раствор, содержащий 25,6 г гидроксида натрия. Определите, какая соль (кислая или средняя) образуется. Какова ее масса? Ответ. 53,76 г NaHCO3
.
8. Определите, какая соль образовалась и какова ее масса, если раствор гидроксида кальция объемом 200 мл, концентрация которого 0,2 моль/л, прореагировал с 9,8%-м раствором ортофосфорной кислоты массой 200 г.
Ответ. 9,36 г Са(Н2
РО4
)2
.
9. Оксид фосфора(V), полученный окислением 31 г фосфора, растворен в 495 г воды с образованием ортофосфорной кислоты. В этот раствор пропущено 44,8 л аммиака. Определите состав полученной соли и ее концентрацию в растворе (массовую долю в процентах). Ответ. 22% (NH4
)2
НРО4
[19-29].
.
5.2 Тесты
1. Определите содержание по следующей характеристике: применяется в домашних холодильниках в качестве охлаждающего средства, устойчив, сильно разрушает озоновый слой.
а) NH3
б) CF2
Cl2
+
в) CFCl3
г) H2
SO4
2. “Нашатырь” получают на производстве в результате взаимодействия аммиака с хлороводородом, реакция протекает ступенчато: NH3
+ H2
O = NH3
×H2
O, NH3
×H2
O + HCl = NH4
Cl + H2
O. Определите роль воды в суммарном процессе:
а) растворитель
б) промежуточный продукт
в) конечный продукт
г) катализатор +
3. Выберите вещество, которое при возгорании нельзя тушить водой:
а) метан
б) аммиак
в) калий +
г) фосфор
4. Выберите наиболее экологически чистое топливо из перечисленных ниже:
а) нефть
б) уголь
в) биомасса
в) природный газ
д) солнечная энергия +
5. В атмосфере какого газа производят сварку активных или средней активности металлов, хранят и перевозят произведения живописи:
а) неон
б) водород
в) азот +
г) аммиак
6. Как влияет уменьшение содержания связанного азота в почве на растения?
а) при недостатке азота задерживается рост и развитие растений, листья приобретают бледно-зеленую окраску, а затем желтеют; +
б) при недостатке азота задерживается рост и развитие растений и листья чернеют;
в) при недостатке азота растения начинают цвести и листья приобретают особый оттенок, так как азот является сдерживающим фактором.
7. В современных установках получения азотной кислоты нет постоянных источников сточных вод. Почему?
а) для получения азотной кислоты нет необходимости использовать воду;
б) эти установки потребляют большое количество оборотной охлаждающей воды, которую периодически сливают в приямок и нейтрализуют; +
в) системы, в которых используется для охлаждения вода, полностью заменены на системы с воздушным охлаждением.
8. Назовите важнейшие области применения аммиака в народном хозяйстве:
а) получение сложных и азотных минеральных удобрений;
б) производство синтетических красителей;
в) взрывчатые вещества, нитролаки;
г) пластические массы и лекарственные вещества;
д) все варианты. +
9. Что привело к существенному снижению количества сточных вод при производстве аммиака?
а) применение воздушного охлаждения; +
б) в результате замены поршневых компрессоров трубокомпрессорами; +
в) существенное снижение забора воды.
10. Какие выбросы в окружающую среду характеризуют крупнотоннажное производство NH3
?
а) газовые, содержащие в своем составе NH3
, оксиды азота и углерода и др. примеси;
б) сточные воды, состоящие из конденсата, продуктов промывки реакторов и систем охлаждения,
в) низкопотенциальную теплоту.
Ответ: все
11. Между атомами в молекуле азота существует:
а) двойная связь;
б) тройная связь; +
в) одинарная связь;
г) пять химических связей.
12. Азот достаточно инертен по отношению к металлам, но сравнительно легко протекает следующая реакция:
а) Cu + N2
= ... ;
б) Zn + N2
= ... ;
в) Al + N2
= ... ;
г) Li + N2
= ... . +
13. Летучее водородное соединение азота имеет формулу:
a) NH2
;
б) N2
H4
;
в) NH3
; +
г) NО2
.
14. В какой реакции азот проявляет восстановительные свойства? (б)
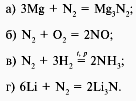
15. Вещество Mg3
N2
называют:
а) нитрат магния;
б) нитрит магния;
в) сульфат магния;
г) нитрид магния. +
16. Сколько свободных электронных пар имеет азот в молекуле аммиака?
а) 2;
б) 4;
в) 1; +
г) 3.
17. Аммиак в лаборатории получают по реакции:
а) NH4
Cl + Ca(OH)2
= ... ; +
б) N2
+ 3H2
= ... ;
в) Са3
(PO4
)2
+ (NH4
)2
SO4
= ... ;
г) (NH4
)3
РO4
+ HCl = ... .
18. Выберите ряд веществ, соответствующий нарастанию молекулярных масс:
а) озон, аммиак, кислород;
б) аммиак, кислород, озон; +
в) кислород, аммиак, озон;
г) кислород, озон, аммиак.
19. Аммиак может реагировать с соляной кислотой по реакции NH3
+ HCl = NH4
Cl. Четвертый атом водорода присоединяется по донорно-акцепторному механизму, при этом донором является:
а) водород;
б) хлор;
в) азот; +
г) группа NH4
+
.
20. В аммиаке и катионе аммония степень окисления азота одинаковая: –3. Какие валентности у атомов азота в этих соединениях?
а) Обе – III;
б) обе – IV;
в) III и II;
г) III и IV. +
21. Нашатырный спирт – это:
а) NH3
;
б) NH3
•H2
O; +
в) NH4
Сl;
г) N2
H4
.
22. Для какой реакции повышение давления сместит равновесие вправо?
а) N2
(г.) + О2
(г.) = 2NO (г.);
б) Н2
(г.) + S (ж.) = Н2
S (г.);
в) N2
(г.) + 3Н2
(г.) = 2NН3
(г.); +
г) Н2
+ Сl2
= 2НCl.
23. В лаборатории азотную кислоту получают по реакции: (б)
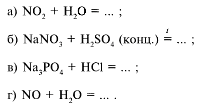
24. При взаимодействии концентрированной азотной кислоты с серебром помимо соли и воды выделяется газ:
а) NO2
; +
б) NO;
в) N2
;
г) N2
О.
25. При термическом разложении нитрата калия выделяется газ:
а) N2
;
б) NO2
;
в) О2
; +
г) N2
О.
26. Формула аммиачной селитры:
а) КNO3
;
б) (NH4
)3
PO4
;
в) NH4
NO3
; +
г) (NH4
)2
SO4
[30-34].
ЛИТЕРАТУРА
1. Исидоров. Химия атмосферы. М.: Мир, 1991.
2. А.И. Бусев, И.П. Ефимов. Определения, понятия, термины в химии. М.: Просвещение, 1981, 192 с.
3. Рудзитис Г.Е. Химия: Неорган. химия. Орган. Химия: Учеб. для 9 кл. общеобразовательных учреждений. / Г. Е. Рудзитис., Ф. Г. Фельдман. – 10-е изд., испр. – М.: Просвещение, 2001, с. 133 – 139.
4. Экологическая химия азота / www.1september.ru
5. Ахметов Н.С. Учебник для 9 класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
6. Программы для общеобразовательных учреждений: Химия. 8-11 кл. Сост. Н.И.Габрусева. — М.: Дрофа, 2000. — 192 с.
7. Примерная программа среднего (полного) общего образования по химии (профильный уровень). www.edu.ru
8. Асадник В.Н. Неорганическая химия. Блок-схемы, таблицы, формулы: Учеб. пособие. / В.Н. Асадник. – Мн.: Книжный Дом, 2004. – с. 28 – 41.
9. Реми. Неорганическая химия. Т. 1.
10. Олеин С.С., Фадеев Г.Н. Неорганическая химия. Учебник для с/х вузов. М., 1979.
11. Хомченко Г.П. Неорганическая химия. М., 1978.
12. М.Д. Гольдфейн, Н.В. Кожевников, А.В. Трубников, С.Я. Шулов. Проблемы жизни в окружающей среде. Учебное пособие. Химия. 1996г, №16.
13. Денисов В.В., Дрововозова Т.И. и др. // Химия. М.: Р- н/Д, Март, 2003
14. Алпатьев А.М. Развитие и преобразование окружающей среды. Л.: Наука, 1983
15. Богдановский Г.А. Химическая экология. М.: МГУ, 1994.
16. Тарасова Н.П., Кузнецов В.А. и др. Задачи и вопросы по химии окружающей среды. М.: Мир, 2002.
17. Химия в школе // Журнал. - М.: Просвещение, 2001, № 4, стр.16.
18. Кутепов А.М. и др. Общая химическая технология. Учеб. для техн. вузов. 2-е изд. М.: Высш. шк., 1990, стр.148-162.
19. Практикум по неорганической химии. Учеб. пособие для студ. хим.-биол. фак-в пединст-в. Изд. 2-е. М.: Просвещение, 1978. стр.180-183.
20. Бабич Л.И. Практикум по неорганической химии. Учеб.пособие.М.:Просвещение.1978,с. 312.
21. Система уроков по теме «Кислотные дожди» для 10–11 классов с углубленным изучением экологии http://www.1september.ru/ru/him/
22. Государственные доклады Госкомэкологии «О состоянии окружающей природной среды Российской Федерации». Российская экологическая газета «Зеленый мир», 1994–1998.
23. Миллер Т. Жизнь в окружающей среде. В 3 кн. М: Пангея, 1996, т. 3.
24. Фелленберг Г. Загрязнение природной среды. М.: Мир, 1997.
25. Небел Б. Наука об окружающей среде. В 2 т. М.: Мир, 1993.
26. Гольбрайх З.Е. Сборник задач и упражнений по химии. Учеб. пособие для хим.-техн. вузов. М.: Высш. шк., 1984, стр. 224.
27. Р.П. Суровцева, С.В. Сафронов. Задания для самостоятельной работы по химии. М.: Просвещение, 1993 г.
28. Сайт «Я иду на урок химии» www.1september.ru
29. Ахметов М.А. Система обучающих заданий: творческий уровень. / Химия в школе, 2004, № 1, с. 21 – 28.
30. Сорокин В.В., Злотников Э.Г. Проверь свои знания: Тесты по химии: Кн. для учащихся. – М.: Просвещение: Учеб. лит., 1997.
31. Н.Н. Черняев, М.А. Ахметов. Тестовые задания и индивидуализация обучения / Химия в школе, 2001, № 9.
32. Суровцева Р.П., Гузей Л.С., Останний Н.И., Татур А.О. Тесты по химии. 8-9 классы. Учебно-методическое пособие. М.: Дрофа, 1997.
33. Глориозов П.А., Рысс В.Л. Проверочные работы по химии. 7, 8, 9, 10 классы. М.: Просвещение, 1980, 1981, 1985.
34. Гаврусейко Н.П. Проверочные работы по неорганической химии. 8-9 классы. М.: Просвещение, 1990.
|