Выпускная квалификационная работа
«Роль и место самостоятельной работы на уроках и во внеурочное время в формировании научного мировоззрения и экологической культуры учащихся»
Содержание
Введение
I. Литературный обзор
1.1 Экологическое образование как важнейший фактор нравственного формирования личности
1.2 Процесс развития познавательной деятельности учащихся
1.3 Технология педагогических мастерских
1.4 Задания - элемент методической системы
II. Экологическая составляющая химического образования
III. Методические разработки данной темы на уроках
3.1 Мои уроки
Урок №1 Ролевая игра "Международный конгресс по охране атмосферы"
Урок № 2. Интегрированный урок: пресс-конференция о воде и ее свойствах
3.2 Контрольные задания
3.2.1 Задачи с решением
3.2.2 Задачи с правильным ответом
3.2.3 Задачи для самостоятельного решения
3.3 Тестовые задания и индивидуализация обучения
Обсуждение результатов. Выводы
Литература
Среди современных проблем, стоящих перед мировым сообществом, особенно выделяется одна проблема – ухудшение качества среды обитания человека. Она носит глобальный характер и волнует людей всех стран и волнует людей всех стран. Рост загрязнения среды проявляется наглядно и вызывает эмоциональную критику людей. К сожалению, такая критика бывает малоаргументированной. Чаще основные претензии обращены к химии.
В сложившихся условиях необходимо провести объективный анализ причин расширения масштабов загрязнения окружающей среды и учащения катастроф, связанные с неконтролируемым распространением химических соединений технического или биологического происхождения.
Первый из них касается известной хаотичности и противоречивости развития экономики, второй – самого человека, уровня его подготовленности к осознанному использованию современных достижений в производственных и бытовых сферах. Особенно важно решение вопроса элементарной «химической» подготовленности людей, т.к. с веществами, способными нанести определенный вред человеку, сегодня контактирует практически каждый. В повседневной жизни человек использует лекарства, косметические и парфюмерные средства, красители, различные виды топлива, пластики, удобрения.
Поэтому сегодня общеобразовательная школа призвана заложить основу формирования личности с новым образом мышления и типом поведения в окружающей среде – экологическом [1].
Актуальность данной темы не вызывает никаких сомнений, т.к. пути реализации целей школьного экологического образования могут быть самыми разными, а среди них особое место занимает самостоятельная работа на уроках и во внеурочное время.
Основная цель
данной работы - выявить уровень отражения этой темы в общеобразовательной программе, исследование имеющихся методических разработок и пути их реализации на уроках. Изучение соответствия используемых материалов целям и задачам по целенаправленному развитию познавательных потребностей, установке на самостоятельное пополнение знаний и является конкретной задачей данного исследования.
Реклама

В связи с этим в работе решались следующие конкретные задачи
:
1)аналитический обзор существующих школьных методик преподавания химии в средней школе;
2) разработка научно – методических материалов, ориентированных на самостоятельную работу на уроках и во внеурочное время.
3) составление банка контрольных заданий по изучаемой теме.
4) апробация разработанной методики в 9 –х классах МОУ СОШ.
5) оценка и обсуждение полученных результатов;
Предмет исследования
–
выбор соответствующих форм организации занятий, способствующих формированию научного и экологического мировоззрения в процесс данной изучения темы.
Объект исследования
– процесс изучения темы: «Роль и место самостоятельной работы на уроках и во внеурочное время в формировании научного мировоззрения и экологической культуры учащихся» в средней школе.
Гипотеза:
использование самостоятельной работы на уроках химии и во внеурочное время способствует формированию научного мировоззрения и экологической культуры учащихся.
Экологическое образование призвано формировать экологическое мировоззрение, нравственность и культуру личности. Человек появился на определенном этапе совершенствования биосферы, и никогда не потеряет связь с природой, вечно изменчивой, угрожающей, с одной стороны, и дающей убежище от любой опасности – с другой.
Разрыв между человеком и окружающей его естественной средой существует давно. Во второй половине XX в. произошла своего рода экологизация современной науки. Это было связано с осознанием человечеством того, что деятельность людей тесно связана с биосферой и от этого взаимодействия зависит равновесие состава биосферы.
Экологическое образование предполагает формирование убежденности каждого жителя планеты в объективной необходимости сохранять созданные природой и человеком ценности. Уровень экологической культуры личности определяется также пониманием социальной значимости экологических проблем, их связи с политическими, социально-экономическими задачами человечества и отдельно взятой личности.
Экологические проблемы стали настолько серьезными, что для формирования экологического сознания необходимо использовать все каналы воздействия на личность. Передача знаний, умений, навыков – это задача специалистов – преподавателей экологии, но формирование бережного отношения к природе, готовности выбирать целесообразные экологические стратегии деятельности – это задача всех педагогов. Уровень экологического сознания каждого выпускника в дальнейшем может оказаться небезразличным для природы, даже, если он и не станет впоследствии руководителем, принимающим глобальные решения, а будет простым рабочим. Любой человек должен быть элементарно экологически образован.
Реклама

Основы экологического мировоззрения следует формировать на протяжении всего учебно-воспитательного процесса, а не только при изучении естественно-научных дисциплин. Экологические проблемы должны стать составной частью всех курсов образовательной области «Естествознание», эти знания необходимы и важны в качестве основы формирования экологического мировоззрения.
Весьма актуальной становится идея непрерывного экологического образования, сущность которого выражается в единстве развития экологического сознания, экологической культуры личности и общества.
Трудовая деятельность и образ жизни современного общества превратились в мощную преобразующую силу, которая воздействует на биосферу и нарушает ход ее естественной эволюции. Выход из экологического кризиса техническими средствами невозможны.
Экологическое образование выступает необходимым условием преодоления негативных последствий антропогенного влияния на окружающую среду и фактором формирования экологической культуры личности как регулятора отношений в системе «человек - окружающая среда».
В педагогической науке существуют два разных термина: «экологическое воспитание» и «экологическое образование». Первое невозможно без второго, и в то же время знания сами по себе еще не определяют направленность деятельности человека. Результат экологического образования и воспитания заключается в обретении каждым человеком чувства природы, умения вникать в ее мир, осознавать ничем не заменимую ценность и красоту; в понимании того, что природа есть основа существования всего живого на Земле.
Экологическое образование как важнейший фактор нравственного формирования личности позволит преодолеть целый ряд негативных явлений в жизни общества, гармонизировать отношения человека с другими людьми и природой, с самим собой как частью природы. Цель экологического образования – формирование нравстенно-ценностных отношений к природе и к людям, способности к самоограничению, чувства личной ответственности за состояние окружающей среды, готовности принять практическое участие в возрождении нарушенного равновесия между человеком и природой [2].
Развитие учащихся - многомерный процесс, который зависит от особенностей их нервной системы, индивидуальных особенностей, воспитания. Поэтому показателей, по которым можно судить об уровне развития учащихся, несколько. Важнейшее из них – качество знаний и умение использовать их в новых учебных ситуациях.
В практике преподавания, как правило, учитываются три уровня познавательной деятельности учащихся.
Первый уровень – первоначальное усвоение учебных знаний и способов действий. Это репродуктивный уровень развития познавательной деятельности учащихся. Результатами этого этапа усвоения становится понимание изученного.
Второй уровень – процесс совершенствования знаний. Его называют продуктивным несамостоятельным уровнем развития познавательной деятельности.
Третий уровень – процесс полного овладения знаниями. Это продуктивный самостоятельный уровень развития познавательной деятельности учащихся. Он характеризует тех из них, кто обладает умениями осуществлять перенос знаний с набольшей глубиной, широтой и самостоятельностью. Проверить знания учащихся можно с помощью специально подобранных заданий, в которых предусмотрены описания, объяснения и самостоятельное применение учащимися учебных знаний и умений.
Самостоятельность в действиях учащихся проявляется в умении использовать знания или сформированные приемы работы. Глубина действия определяется умением учащихся устанавливать между знаниями определенные связи. При развитии уровня познавательной деятельности учащихся развивается и их самостоятельность.
Развитие самостоятельности учащихся предполагает учет следующих показателей: уровня развития мыслительных операций, характера познавательной деятельности, степени руководства учителя.
Учет индивидуальных особенностей учащихся предполагает учет его возможностей для дальнейшего их развития.
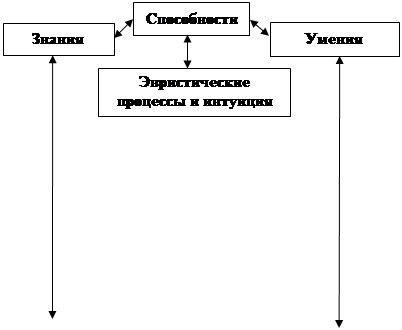
Возможности учащегося
сравнение
абстрагирование
обобщение
анализ
синтез
 выделение главного выделение главного
конкретизация
систематизация
классификация
ощущение
восприятие
память
мышление
речь
воображение
Возможности учащихся складываются из знаний, умений, интуиции и эвристических процессов.
Знания – это отражение в мышлении человека объективного мира.
Умения – это характеристика выполнения человеком определенных действий, осознанное применение знаний на практике.
Эвристические (творческие) задачи – это такие для решения, которых имеющихся знаний и умений недостаточно. Решение таких задач осуществляется с помощью особых эвристических приемов.
Интуиция – это такое протекание эвристического процесса, при котором поиск способа решения творческой задачи происходит так, что некоторая часть этого процесса не осознается человеком, и лишь тогда, когда решение им найдено, оно как бы всплывает из подсознания и осознается как нечто неожиданное. Умения – это имеющиеся у учащегося возможности для решения задач изученных типов. Способности – это потенциальные возможности для решения любых задач.
Способности и умения взаимообусловлены: без наличия определенного уровня их развития у учащегося не могут формироваться умения и наоборот. Овладение учащимися знаниями и умениями, формирование у них интуиции и эвристических процессов во многом зависят от развития их творческих процессов [3].
Приобретение определенного объема знаний и есть цель образования. Необходимо, чтобы знания стали для учащихся инструментом взаимодействия с окружающим миром. А для этого нужно формировать умения применять полученные знания. Именно степень овладения умениями применять знания позволяет судить о качестве усвоения учащимися учебного материала и направлять процесс их учения.
Очень часто учителя химии обращают внимание на формирование знаний учащихся и гораздо меньше – на формирование умений. Сокращение числа часов в учебном плане, отводимых на изучение химии, объективно способствует такому положению. Поэтому так важны методические приемы, позволяющие при катастрофическом недостатке времени сосредоточить максимум внимания учителя на активизации мыслительной деятельности учащихся, на организации их самостоятельной работы по приобретению и применению знаний в различных условиях.
Школьный курс химии дает прекрасную возможность организовать частично-поисковую и исследовательскую деятельность учащихся, так как логика его построения такова, что приходится постоянно повторять применительно к конкретным веществам некоторые основные понятия [4].
Нужно организовать познавательную деятельность учащихся не на репродуктивном, а на творческом уровне, обеспечить их максимальную самостоятельность, поскольку только самостоятельная деятельность развивает способности. В IX и X классах часто можно использовать самостоятельную работу учащихся при изучении нового материала. Таким образом, у учащихся формируются умения применять ранее полученные знания в новых условиях.
Самостоятельная познавательная деятельность учащихся способствует более осмысленному и заинтересованному изучению материала, приобретению навыков самообразования; повышает прочность и осознанность знаний; вырабатывает навыки общения.
Необходимость использования в учебном процессе самостоятельной работы учащихся с учебником не вызывает сомнений. Учебник – это основной источник знаний по предмету, средство формирования учебных умений и овладения приемами познавательной деятельности. В процессе обучения учебник выполняет информативную, обучающую, развивающую и воспитывающую функции.
Умение учащихся работать с учебником во многом зависит от того, как эту деятельность организует учитель.
Проводить работу с учебником можно на каждом уроке, исходя из его задач.
Работа с учебником необходима, когда объем учебного материала велик. В этом случае учащиеся могут какую-то часть его проработать на уроке под руководством учителя. Полезно организовать работу с учебником и в том случае, когда текст сложен и требует разъяснения по частям, с привлечением различных средств наглядности. Работа с учебником на уроке важна еще и для того, чтобы научить учащихся использовать книгу при выполнении домашних заданий.
Существующая система образования в значительной степени построена на передаче знаний от учителя к ученику, на пассивной позиции обучающегося, что не позволяет личности самой строить свое знание, активно и творчески пользоваться им в жизни как свои приобретением. Этот подход к образованию не раскрывает творческий потенциал человека, заложенный при его рождении, а закрепляет его зависимость от решений, принимаемых другими.
С целью активизации познавательной активности учащихся на уроке возможны методические приемы следующего характера: выполнение индивидуальных занятий познавательного характера, домашние практические занятия, решение занимательных задач и т.д. Но и это не всегда эффективно.
Наиболее результативны уроки, проведенные в форме творческих мастерских.
Мастерская – это такая модель обучения школьников, которая позволяет развивать творческие способности учащихся. Одна из основных идей мастерской: каждый человек должен развивать свои способности, возможности, а не копировать кого-то другого.
Основополагающие принципы мастерской:
– учитель не над учеником, а с учеником;
– в работу включаются не только органы чувств, но и эмоциональная сфера ребенка;
– всю работу учащиеся выполняют по-своему, исходя из своих способностей, интересов, личного опыта;
– чередование индивидуальной и коллективной работы создает атмосферу сотрудничества;
– учитель не формулирует тему урока, а создает мотивационный фон, вызывая у учащихся информационный запрос.
Выделяют несколько видов мастерских: мастерские творческого письма и пластики, мастерские построения знаний и т.д. Каждая несет в себе свой секрет, свою тайну познания и творчества.
Мастерская – одна из методических разработок в поддержку этой программы [5].
Задания как элемент методической системы, используемой для развития умения учащихся рассуждать, должна составлять определенную совокупность. Неупорядоченное стихийное применение заданий в обучении полезно, необходимо, но недостаточно для достижения каждым учеником должного уровня развития этого умения. И исходя из этого, следующая методика предполагает разработеку типологии заданий и разделение их на три группы.
Таблица 1
Типология заданий, способствующих развитию умения учащихся рассуждать
| I |
Определение цели умозаключения и тезиса, нуждающегося в
доказательстве
|
Рассуждение с целью объяснения фактов или обоснования суждений («Потомучки») |
Постановка вопроса
к предмету
рассуждения
(«Почемучки»)
|
 |
| II |
Обобщение и
подтверждение результатов эксперимента
|
Определение понятий |
Осуществление классификации и
нахождение закономерностей
|
 |
| III |
Прогнозирование на основе данных эксперимента, теоретического материала и фактов |
Последовательный переход от задания одного типа к заданиям другого типа затруднителен, что приводит к сочетанию заданий разных типов на уроках [6].
Современная экология – обширный междисциплинарный научный комплекс. Наряду с общей экологией, исследующей отношения организмов и условий среды на уровне особей, популяций, биоценозов и экосистем, этот комплекс включает прикладную экологию и социальную экологию. Столь широкий круг проблем экологии привел к тому, что в школах Российской Федерации нет специального предмета «Экология» и получил распространение так называемый интегрированный вариант экологического образования. При этом варианте практически все предметы составляют единое образовательное экологическое пространство.
Большая роль в экологическом образовании отводится химии, т.к. в основе любых процессов, протекающих в организме и экосистеме, лежат химические реакции. На уроках химии наиболее целесообразно изучать вопросы, связанные с химическим загрязнением окружающей среды, знакомиться с методами мониторинга загрязнения и способами снижения его пагубного влияния на живые организмы, включая человека.
На уроках химии с учащимися профессионально можно обсуждать новые малоотходные технологии производства и методы очистки жидких стоков и газовых выбросов, а также проблему утилизации твердых отходов. На уроках химии надо рассматривать биосферные круговороты веществ и последствия влияния на них человека, химизацию сельского хозяйства, проблемы энергетики с использованием углеродистых энергоносителей и водорода.
Экологическая составляющая содержания образования.
Общая экология.
1. Химические процессы и потоки энергии в экосистеме. Дыхание и фотосинтез. Роль озона. Потоки энергии. Экологическое равновесие в экосистеме как проявление принципа Ле Шателье-Брауна.
2. Биосфера и влияние на нее человека. Круговорот углерода, азота и фосфора. Влияние аэрозолей на состояние озонового слоя атмосферы. Проблема парникового эффекта. Роль лесов. Фотодиссоциация кислорода как фактор разрушения озонового слоя. Проблема загрязнения Мирового океана.
Прикладная экология.
3. Энергетика. Полезные ископаемые – источники углеводородов. Экологические проблемы нефтедобычи, транспортировки нефти и газа, нефтепереработки. Метан как составная часть природного газа и биогаза. Топливные элементы. Проблемы экологически чистого топлива. Водородная энергетика.
4. Химическое загрязнение окружающей среды и методы его уменьшения.
Классификация загрязняющих веществ и экологические нормативы.
Загрязнение атмосферы. Оксиды серы и азота как загрязнителя атмосферы и причины кислотных дождей и туманов. Фреоны. Аэрозоли.
Загрязнение воды. Оксиды фосфора как загрязнители воды. Загрязнение воды синтетическими моющими средствами. Загрязнение окружающей среды ионами тяжелых металлов. Жесткость воды и способы ее устранения. Активированный уголь и бытовые фильтры.
Загрязнение жилища. Загрязнение воздуха газовыми плитами и табачным дымом.
Химические производства как факторы загрязнения окружающей среды и возможности их экологизации. Очистные сооружения. Механическая очистка. Химическая очистка. Биологическая очистка.
Влияние загрязнения окружающей среды на генотип и генофонд растений, животных и человека.
1. Радиоактивное загрязнение окружающей среды.
2. Проблема утилизации отходов. Утилизация гальванических элементов и аккумуляторов. Ядерные отходы. Состав и количество бытового мусора.
3. Экология сельского хозяйства. Роль химии в сельском хозяйстве.
Социальная экология.
Экология человека. Влияние отдельных химических элементов на здоровье человека. Влияние оксидов на живые организмы. «Оловянная чума». Фенол, бензол, антифризы. Краски и растворители. Этанол и проблема алкоголизма. Экологически чистые продукты питания. Натуральная пища и синтетические заменители. Биодобавки. Снижение иммунитета человека под влиянием загрязнения окружающей среды, развитие аллергических, онкологических и других заболеваний. Проблема СПИДа [7, 8].
Таблица 2
Содержание экологической составляющей в предмете «Химия».
| Концентры и их содержание |
| VIII класс |
IX класс |
X класс |
XI класс |
| 1. Химические процессы в экосистеме |
Значение кислорода в
живой природе. Дыхание и
фотосинтез. Роль озона в природе
|
Потоки энергии в экосистеме. Экологическое равновесие. Принцип Ле
Шателье - Брауна применительно к экосистеме
|
Кинетика химических процессов в
экосистеме. Принцип Ле
Шателье - Брауна
|
| 2. Биосфера и влияние на нее человека |
| Проблема разрушения озонового слоя |
Круговорот азота и фосфора в природе. Круговорот углерода. Проблема парникового эффекта. Фотодиссоциация кислорода как
фактор разрушения озонового слоя
|
Проблема сохранения и
увеличения площади лесных массивов, парковых зон и заповедников
|
Влияние аэрозолей на
атмосферу Земли. Проблема парникового эффекта
|
| 3. Энергетика |
| Топливные элементы. Проблема экологически чистого топлива. Водородная энергетика |
Полезные ископаемые - источники углеводородов. Экологические проблемы нефтедобычи, транспортировки нефти и газа, нефтепереработки |
Экологические проблемы ис-
пользования углеводородных энергоносителей. Метан как составная часть
природного газа и биогаза
|
| 4. Химическое загрязнение окружающей среды и методы его уменьшения |
| Загрязнение атмосферы. Проблема загрязнения и очистки воды |
Оксиды серы и азота как загрязнители атмосферы и
причины кислотных дождей и туманов.
Оксиды фосфора как загрязнители воды. Загрязнение окружающей среды ионами
тяжелых металлов. Фреоны.
Аэрозоли. Жесткость воды и способы ее устранения. Активированный уголь и бытовые фильтры
|
Проблема качества транспортного топлива. Опасность ис-
пользования феноло-формальдегидных смол для
изготовления мебели и отделки жилых помещений. Загрязнение воды синтетическими моющими средствами. Влияние
загрязнения окружающей среды на генотип и генофонд растений, животных и
человека
|
Химические производства как
фактор загрязнения окружающей среды и возможности их
экологизации
|
| 5. Радиоактивное загрязнение окружающей среды |
| Влияние радиоактивности на организмы |
Радиоактивность и ее влияние на живые организмы. Последствия ядерных взрывов. Последствия чернобыльской трагедии |
| 6. Проблема утилизации отходов |
Проблема утилизации гальванических элементов и
аккумуляторов
|
Проблема утилизации каучуков, металлопластиков и других полимерных материалов |
Проблема утилизации ядерных отходов. Способы утилизации гальванических элементов и
аккумуляторов
|
| 7. Экология сельского хозяйства |
Минеральное питание растений. Почвы и
почвообразующие породы. Плодородие почв. Разнообразие почв. Проблема
истощения и
загрязнения почв
|
Экологические проблемы использования пестицидов (инсектициды, гербициды, фунгициды). Использование формалина в
сельском хозяйстве
|
Неметаллы и их соединения
- основа современных минеральных удобрений. Роль химии в сельском хозяйстве
|
| 8. Экология человека |
Влияние оксидов на организм
человека. «Оловянная чума»
|
Влияние бензола, фенола, этанола, антифризов на организм человека. Проблема алкоголизма. Проблема экологической чистоты продуктов питания.
Натуральная пища и синтетические заменители. Биодобавки. Снижение иммунитета человека под
влиянием загрязнения окружающей среды, увеличение аллергических, онкологических и других заболеваний. Проблема СПИДа
|
Влияние отдельных химических элементов на
организм человека. Влияние красок и
растворителей на организм человека
|
Таблица 3
Поурочное планирование экологического материала в предмете «Химия» (VIII-XI классы)
| Тема урока |
Обсуждаемые экологические вопросы |
| VIII класс |
| Экспериментальное подтверждение сложности строения атома |
Радиоактивность, ее влияние на организмы |
| Кислород в природе |
Значение кислорода в живой природе. Дыхание и фотосинтез. Загрязнение атмосферы. Проблема экологически чистого топлива. Озон и его влияние на атмосферу. Проблема разрушения озонового слоя |
| Применение кислорода |
Топливные элементы. Источники химического загрязнения жилища: газовые шиты, табачный дым и др. |
| Применение водорода |
Водородная энергетика. Топливные элементы |
| Вода в природе. Очистка природной воды |
Проблема загрязнения и очистки воды. Загрязнение Мирового океана.
Классификация загрязняющих веществ и экологические нормативы (ПДВ, ПДЦ, ПДК, понятие ИЗА). Уровень загрязнения воды в городах
|
| Значение воды. Охрана водных ресурсов |
Проблема рационального использования водных ресурсов. Очистные сооружения. Механическая, химическая и биологическая очистка |
| Ионизация кислот, оснований и солей в водных растворах |
рН среды как экологический фактор |
Органические и
неорганические вещества
|
Представители неорганических и
органических веществ - загрязнители окружающей среды
|
| Оксиды |
Угарный газ, оксиды серы, азота и фосфора, свинца, хрома и других металлов как загрязнители атмосферы. Биологическое значение углекислого газа |
| Кислоты |
Биологическое значение кислот. Кислотные дожди |
| Соли |
Биологическая роль солей в живых организмах. Соли тяжелых металлов как загрязняющие вещества |
| IX класс |
| Энтальпийный и энтропийный факторы. Свободная энергия |
Энергетический обмен в организме и экосистеме. Проблема парникового эффекта атмосферы |
| Скорость химических реакций и ее зависимость от различных факторов |
Влияние внешних условий на химические процессы в живой природе |
| Химическое равновесие |
Экологическое равновесие. Принцип Ле Шателье - Брауна применительно к экосистеме |
| Электрохимические процессы. Гальванический элемент |
Проблема утилизации гальванических элементов и аккумуляторов |
| Электролиз |
Влияние электрического тока на живой организм |
| Коррозия металлов и меры борьбы с ней |
Коррозия металлов как источник загрязнения. Биологическая коррозия. «Оловянная чума» |
Соединения галогенов в
природе. Получение и
применение галогенов
|
Фреоны. Аэрозоли, их роль в загрязнении окружающей среды |
Общая характеристика
элементов VI А группы
|
Фотодиссоциация кислорода как фактор разрушения озонового стоя |
| Характеристика соединений серы |
Оксиды серы как загрязнители атмосферы, кислотные дожди и туманы |
| Соединения азота и фосфора в природе |
Оксиды азота и фосфора как загрязнители воды и воздуха, их вклад в образование кислотных дождей и туманов. Влияние оксидов на здоровье человека. Соединения мышьяка, их биологическое и медицинское значение. Круговорот азота и фосфора в природе |
| Круговорот углерода в природе |
Круговорот углерода. Активированный уголь и бытовые фильтры. Табачный дым как источник загрязнения жилища |
| Минеральные удобрения |
Минеральное питание растений. Проблема истощения и загрязнение почв. Почвы и почвообразующие породы. Плодородие почв |
| Жесткость воды и способы ее устранения |
Жесткость воды. Виды жесткости и способы ее определения и устранения |
| Металлы побочных подгрупп |
Загрязнение окружающей среды ионами тяжелых металлов |
| Природные источники углеводородов |
Полезные ископаемые - источники углеводородов. Экологические проблемы нефтедобычи, транспортировки нефти и газа, нефтепереработки |
| Сложные эфиры и жиры |
Экология пищевых продуктов |
| Углеводы |
Фотосинтез как биохимический процесс |
X класс
| Физические и химические свойства алканов |
Метан как составная часть биогаза. Качество транспортного топлива как важнейшая экологическая проблема |
| Синтетические каучуки |
Внедрение малоотходных технологий. Опыт передовых стран (ФРГ, Япония). Утилизация каучуков, металлопластиков и других ВМС |
Циклоалканы и
ароматические уг-
леводороды
|
Инсектициды, гербициды, фунгициды и другие пестициды, их экологическая роль. Бензол как канцерогенное вещество |
Природные источники
углеводородов
|
Полезные ископаемые - источники углеводородов. Экологические проблемы нефтедобычи, транспортировки нефти и газа, нефтепереработки |
Химические свойства
спиртов
|
Этанол как наркотическое средство. Проблема алкоголизма: причины, последствия, пути решения |
| Многоатомные спирты |
Антифризы, их воздействие на организм человека |
| Фенолы и ароматические спирты |
Влияние фенола на здоровье человека |
Химические свойства
альдегидов и кетонов
|
Последствия использования феноло-формальдегидных смол для изготовления мебели и отделки жилых помещений. Использование формалина в сельском хозяйстве |
| Сложные эфиры. Жиры |
Проблема экологической чистоты продуктов питания. Натуральная пища и синтетические заменители. Биодобавки. Сложные эфиры - ПАВ - основа CMC |
| Полисахариды |
Необходимость сохранения и увеличения площади лесных массивов, парковых зон и заповедников |
| Белки |
Иммунитет. Влияние загрязнения окружающей среды на снижение иммунитета человека, развитие у него аллергических, онкологических и других заболеваний. Проблема СПИДа |
XI класс
| Нуклеиновые кислоты |
Влияние состояния окружающей среды на генотип. Проблема сохранения генофонда растений, животных и человека |
| Применение полимеров |
Утилизация полимерных материалов |
| Ядерные реакции. Синтез сверхтяжелых металлов |
Радиоактивность и ее влияние на живые организмы. Ядерные реакции. Последствия ядерных взрывов. Последствия чернобыльской трагедии. Проблема утилизации ядерных отходов. Влияние радионуклидов на здоровье человека |
| Термодинамика химических реакций |
Проблема парникового эффекта атмосферы |
| Химическая кинетика и катализ |
Принцип Ле Шателье - Брауна применительно к экосистеме |
| Электрохимические процессы |
Проблема утилизации гальванических элементов и аккумуляторов |
| Дисперсные системы в природе |
Влияние красок и растворителей на организм человека. Влияние аэрозолей на озоновый слой атмосферы Земли |
Неметаллы в природе и
сельском хозяйстве
|
Состояние природных ресурсов неметаллов в России. Неметаллы и их соединения - основа современных минеральных удобрений. Трансграничный перенос загрязняющих веществ |
Роль химии в развитии
общества
|
Совершенствование технологии химических производств. Состав и количество бытового мусора. Опыт переработки бытовых отходов в развитых странах. Роль химии в сельском хозяйстве |
3.1 Мои уроки
“Главное делать все с увлечением, это страшно украшает жизнь”
И. Ландау.
Урок №1. Ролевая игра «Международный конгресс по охране атмосферы»
Предлагаю разработку интегрированного урока химии и биологии, который направлен на обобщение знаний об оксидах азота, серы и углерода как загрязнителя атмосферы и их влиянии на организм человека. Урок проводится как ролевая игра – международный конгресс по охране атмосферы.
Задачи урока.
Учащиеся должны знать оксиды – наиболее опасные загрязнители воздуха; основные источники загрязнения; основные пути попадания окисдов-загрязнителей в атмосферу; отрицательное влияние оксидов серы, азота, углерода на различные органы человека; экологические проблемы, возникающие в результате попадания этих оксидов в атмосферу; области использования оксидов.
Учащиеся должны уметь: выявлять последствия загрязнения атмосферы; предлагать меры по борьбе с ее загрязнением; организовывать самостоятельную поисковую деятельность и продуктивную работу с различными источниками информации; владеть приемами активного общения в ходе коллективного обсуждения и принятия решения.
На уроке учащиеся играют роли: экспертов, представителей «Союза промышленников» и ассоциации «Врачи – за чистый воздух», ученых из различных городов мира, где проблема загрязнения атмосферы стоит наиболее остро, членов фракции «Защитники грязного воздуха» (Смог Лондович, Диоксид серы, Оксиды азота, Угарный и Углекислый газы).
Урок включает несколько блоков, в каждом из которых идет представление членов фракции «Защитники грязного воздуха», при этом учащиеся повторяют физические, химические свойства оксидов-загрязнителей атмосферы, пути и источники их поступления в воздух и заполняют схемы.
В начале урока учитель говорит о целях урока, о его содержании. В дальнейшем слово предоставляется ведущему.
Ведущий.
За последние десятилетия стало очевидным, что человек перенасытил природу загрязняющими веществами. Согласно расчетам их поступление из антропогенных источников в десятки, а то и в тысячи раз больше, чем из естественных в зависимости от веществ.
Остро встает проблема – уберечь окружающую среду и здоровье человека. На обсуждение конгресса выносится проект закона «О чистоте воздуха».
Проект предусматривает следующие меры по охране атмосферы от загрязнения:
1. Разработать стандарты по выхлопным газам для грузовых и легковых автомобилей.
2. Прекратить вырубку лесов.
3. Устанавливать очистные сооружения на предприятиях химической промышленности.
4. Осуществить переход на использование бестопливных источников энергии.
Конгрессу предстоит принять закон. Для этого необходимо выслушать представителей различных фракций и внести поправки в проект.
Ведущий предоставляет участников конгресса. Группам ученых раздаются пакеты документов.
1. Проект закона «О чистом воздухе».
2. Схемы 1, 2, 3.
3. Протокол заседания международного конгресса.
Ведущий.
Слово имеет член фракции «Защитники грязного воздуха» Смог Лондович.
Учитель.
(Зачитывает характеристику Смога Лондовича). Смог - это туман, смешанный с пылью, сажей и ядовитыми газами. В 1952 г. В Лондоне в течение 3-4 суток погибло от смога более 4000 человек. Первое появление смога отмечено в 50-е гг. XX в., с тех пор он часто появляется в крупных городах. Поражает, прежде всего, слизистые оболочки глаз и дыхательных путей.
Смог Лондович представляет других членов фракции, которые будут вносить поправки в закон.
Угарный газ.
Я оксид углерода (II), химическая формула CO. С самого рождения причисляю себя к этой замечательной фракции. Я самый таинственный, загадочный и коварный среди моих друзей.
Ведущий.
Как вы думаете, о каких физических свойствах угарного газа идет речь?
Угарный газ
. Я попадаю в воздух при сжигании топлива в промышленных печах и двигателях автомобилей. Закон «О чистом воздухе» требует сокращения этих выбросов на 90%, но ведь я тоже имею право на существование в атмосфере.
Представитель «Союза промышленников».
Без угарного газа не смогут существовать многие отрасли промышленности. Оксид углерода (II) – ценное топливо, в металлургии его используют как восстановитель металлов.
Ведущий.
Чем опасен угарный газ для организма человека?
Врач.
Десятиминутное вдыхание человеком воздуха, в котором содержание угарного газа составляет 5,7 г/м3
, может привести к летальному исходу. Ядовитость оксида углерода (II) обусловлена тем, что этот оксид соединяется с гемоглобином крови, в результате чего кровь теряет способность переносить кислород из легких к тканям. Сродство гемоглобина к угарному газу гораздо больше, ем к кислороду, поэтому достаточно самой ничтожной концентрации этого газа, чтобы вызвать удушье. Однако при вдыхании чистого воздуха или, еще лучше, чистого кислорода оксид углерода (II) постепенно удаляется из крови.
Угарный газ.
Прошу записать мою поправку в закон: «Отменить все стандарты по выхлопным газам для грузовых и легковых автомобилей».
Группы ученых работают по заполнению схемы 1, отражающей пути и источники поступления угарного газа в атмосферу.
Схема 1
Угарный газ один из основных загрязнителей атмосферы
Углекислый газ.
Моя химическая формула CO2
, я кислотный оксид, вхожу в состав воздуха. Непонятно, почему нужно очищать воздух именно от меня? Я вообще безвреден для организма человека.
Представитель «Союза промышленников».
Мы используем углекислый газ для тушения пожаров, для получения мочевины – ценного минерального удобрения.
Ведущий.
Чем опасно накопление этого безобидного газа в атмосфере?
Участники конгресса рассуждают о причинах и последствиях данного явления.
Углекислый газ.
Запишите мою поправку: «Чтобы на Земле было теплее, предлагаю увеличить вырубку лесов – основных потребителей углекислого газа, а также сжигать больше топлива на теплоэлектростанциях».
Группы ученых работают над заполнением схемы 2, отражающей пути, источники поступления углекислого газа в атмосферу и последствия увеличения его содержания.
Диоксид серы.
Я оксид серы (IV), химическая формула – SO2
, ядовит, вызывает заболевания дыхательных путей. Я существую только благодаря моим спонсорам – металлургическим заводам и угольным электростанциям.
Представитель «Союза промышленников».
Мы применяем оксид серы (IV) в качестве отбеливателя шелка, шерсти. Так как он ядовит, им окуривают склады, подвалы для уничтожения плесени. В ветеринарии он используется для лечения животных от чесотки.
Диоксид серы.
А какие смешные претензии ко мне предъявляют – будто бы я вызываю кислотные дожди! Но всем известно, что, реагируя с водой, я образую слабую кислоту, которая сразу разлагается, а серную кислоту из меня никак не получить.
Схема 2.
Углекислый газ один из основных загрязнителей атмосферы.
Ведущий.
В чем лукавит Диоксид серы? Как из него получить серную кислоту?
Учащиеся составляют уравнения реакций получения серной кислоты
2SO2
+ O2
= 2SO3
SO3
+ H2
O = H2
SO4
Диоксид серы.
Почему вы так боитесь кислотных дождей? Ведь любой дождь имеет слабокислую среду, в дождевой воде всегда присутствует кислота.
Ведущий.
О какой кислоте идет речь? Назовите источник ее поступления в воду. Кислотным считается дождь при pH< 5,0. Причина возникновения кислотных дождей – массовые промышленные выбросы диоксида серы и оксидов азота в атмосферу. Взаимодействуя с атмосферной влагой, сернистый газ создает кислотную среду. Растворимость его в воде достаточно велика и составляет 40 объемов на 1 объем воды. В районах сосредоточения промышленных производств 60% кислотности дождевой воды дает серная кислота, 30% - азотная, 5% - соляная и 2% - углекислый газ.
Учащиеся обсуждают последствия выпадения кислотных дождей для природной среды и человека.
Диоксид серы.
Предлагаю вычеркнуть из закона все мероприятия по моему устранению из атмосферы.
Оксиды азоты.
Мы оксиды азота: NO – бесцветный газ, NO2
– бурый газ, ядовит. Мы поступаем в атмосферу при сгорании топлива (90%) и в составе выбросов химической промышленности (5%).
Представитель «Союза промышленников».
Оксиды азота – важнейшее сырье для производства азотной кислоты, о значении которой говорить не приходится.
Оксиды азота.
Вы, наверное, забываете, что благодаря нам в почву естественным путем вносится азот в форме нитрат- и нитрит-анионов. Мы повышаем плодородие почвы.
Учащиеся повторяют реакции получения азотной и азотистой кислот:
2NO + O2
= 2NO2
2NO2
+ H2
O = HNO2
+ HNO3
Врач.
Оксиды азота обладают выраженным общетоксичным и раздражающим действием. При контакте диоксида азота с влажной поверхностью легких происходит образование азотистой и азотной кислот, которые поражают альвеолярную ткань, что приводит к отеку легких.
Оксиды азота.
Запишите нашу поправку: «Содействовать сжиганию топлива, развитию автомобильной промышленности».
Группы ученых работают над заполнением схемы 3.
Схема 3
Диоксид серы и оксиды азота как загрязнители атмосферы.
Ведущий.
Мы подошли к самому главному – формулировке закона «О чистоте воздуха». Если вас устраивают поправки членов фракции «Защитники грязного воздуха», то вы дополняете ими закон, если нет – вносите свои.
Группы ученых работают над заполнением протокола заседания конгресса, формулировкой положений закона по борьбе с загрязнением атмосферы.
Протокол заседания международного конгресса по охране атмосферы.
1. Из перечисленных отраслей народного хозяйства выберите те, выбросы которых загрязняют атмосферу:
а) машиностроение;
б) металлургия;
в) лесная промышленность;
г) сельское хозяйство;
д) топливная промышленность;
е) химическая промышленность;
ж) транспорт.
2. Заполните схему 4.
Схема 4.
Основные источники загрязнения атмосферы.
3. Сформулируйте поправки к закону «О чистом воздухе».
Международный конгресс постановил внести в закон «О чистом воздухе» следующие поправки, связанные с мерами борьбы с загрязнениями атмосферы: …
Лучший закон «О чистом воздухе» учитель зачитывает классу.
Урок заканчивается поведением итогов, оценивается работа учащихся [8, 11, 14].
Предлагаем разработку интегрированного урока по теме «Вода. Свойства воды», который мы проводим в форме пресс-конференции. Учащиеся играют роли жителей планеты Акватоид — ученых, журналистов и гостей конференции. Учителя же выступают в роли землян-экспертов.
Звучит запись: «Приветствуем вас, жители планеты Земля, именующие себя человечеством. За помощью к вам обращается отряд наблюдателей с планеты Акватоид звездной системы Тау из созвездия Кит.
История нашей планеты трагична и поучительна. К сожалению, различные цивилизации Акватоида не могли сосуществовать мирно. Как правило, более грубая и примитивная, а в силу этого более жестокая цивилизация уничтожала более развитую и гуманную, чтобы, в свою очередь, оказаться уничтоженной еще более грубой.
В результате бессмысленных войн и варварского использования планетарных ресурсов Акватоид потерял почти всю жидкость, являющуюся основой жизни.
Чтобы выжить, Организация Объединенного Разума планеты предприняла попытки поиска вещества, способного по своим свойствам заменить жидкость жизни Акватоида. В архивах радиообменов с планетой Земля Солнечной системы было найдено сообщение, в котором упомянуто вещество, удовлетворяющее заданным параметрам: «Вода - самое драгоценное минеральное сырье, это не только средство для развития промышленности и сельского хозяйства, вода — это действительный проводник культуры, это живая крошка, которая создает жизнь там, где ее не было» (академик. Л.П. Карпинский).
В течение года специальная научно-исследовательская экспедиция тайно изучала вещество, которое вы, земляне, называете словом «вода». Обращаемся к вам с просьбой быть экспертами на конференции ученых, проводивших исследования свойств воды, и журналистов Акватоида, информирующих жителей планеты о ходе исследований».
Пресс-конференцию начинает сотрудник химической лаборатории планеты Акватоид. По ходу выступления он и следующие докладчики прикрепляют к классной доске карточки, на которых написаны важнейшие данные. В результате на доске получается краткий конспект по теме (рис. 1).
Сотрудник химической лаборатории
. Это вещество встречается на Земле в трех агрегатных состояниях — жидком, твердом, газообразном. Среди ученых Земли оно известно под названием «оксид водорода», причем по химическим свойствам его относят к амфотерным оксидам.
Далее он приводит формулу воды, ее молярную массу, количественный и качественный состав, рассказывает о химических связях в молекуле, молекулярной кристаллической решетке этого вещества, последовательно прикрепляя на доску карточки 1-5 и демонстрируя схему образования ковалентной полярной связи.
Сотрудник физической лаборатории.
Сотрудники нашей лаборатории пришли к выводу, что наличие воды на планете Земля (около 1387 млн. км3
) — наиболее важное условие зарождения и существования жизни. Вода на Земле существует не только в явном виде: четыре океана, моря, озера, реки; она присутствует и в воздушном океане Земли, и в почве, и во всех породах, слагающих земную кору. Много ее и в живых организмах. Даже в изливающейся из жерла вулканов огненной магме есть вода: каждый год они извергают из недр Земли до 40 млн. тонн воды.
Мы изучили теплофизические свойства воды.
Удельная теплоемкость воды составляет 4,2 кДж/(кг ·°С) (карточка 6). Это в 10 раз больше, чем у железа, в 40 раз больше, чем у золота. Только немногие вещества, например водород и аммиак, обладают большей удельной теплоемкостью. Из-за этой исключительной способности поглощать тепло температура воды при нагревании и охлаждении изменяется незначительно, поэтому водным обитателям никогда не угрожает ни сильный перегрев, ни чрезмерное охлаждение. Большая удельная теплоемкость воды определяет и климат планеты: вода нагревается значительно медленнее суши, забирая большое количество теплоты, и дольше сохраняет полученное тепло, выполняя при этом терморегулирующую функцию. На этом свойстве воды, кстати, основан и принцип обогрева жилых помещений землян — использование горячей воды в батареях отопительной системы.
Aqua omnia sunt
(лат.) - вода существует везде
Рис. 1. Вид доски к концу урока.
Удельная теплота парообразования воды составляет 2300 кДж/кг (карточка 7). Это означает, что при испарении 1 г воды поглощается 2300 Дж теплоты. Данное свойство воды тоже важно для терморегуляции: например, если бы люди не потели при совершении работы, то они перегревались бы. Пот, основой которого является вода, при испарении понижает температуру тела.
Значительна и удельная теплота плавления льда. При 0° С и атмосферном давлении она составляет 334 кДж/кг (карточка 8). Из распространенных на Земле металлов только алюминий, железо и медь имеют удельную теплоту плавления выше 200 кДж/кг (при соответствующих температурах плавления). Таким образом, замерзая, вода выделяет тепло и согревает окружающий воздух. Это свойство воды также играет немаловажную роль в формировании климата планеты: замерзание воды в реках, озерах, морях не позволяет переохлаждаться воздуху в данной местности, поэтому часто можно наблюдать, как птицы в сильный мороз греются, сидя на льду.
Журналист.
Объясните, почему лед плавает.
На этот вопрос отвечают учащиеся, затем слово берет учитель физики (эксперт-физик), который демонстрирует подкрашенный плавающий лед.
Эксперт-физик
. Стоит задуматься, почему твердая вода (т. е. лед) легче жидкой. Это свойство воды аномальное и требует дополнительных разъяснений.
У большинства веществ при затвердевании образуется кристаллическая структура, средние расстояния между частицами при этом сокращаются, таким образом, объем уменьшается, а плотность растет.
При снижении температуры воды до +4°С расстояния между молекулами и небольшими ассоциатами (группами молекул) тоже становятся меньше, а также уменьшаются размеры самих молекул за счет снижения интенсивности колебаний атомов в них, что и приводит к увеличению плотности воды. Но затем происходит процесс кристаллизации с образованием дополнительных водородных связей, которые образуют ассоциаты крупных размеров с полостями внутри (карточки 9, 10). Именно это и приводит к уменьшению плотности, а следовательно, к возрастанию объема (карточка 11).
Журналист.
Каким образом аномальное изменение плотности воды влияет на облик Земли?
Отвечают учащиеся.
Эксперт-физик
. Это свойство необходимо всегда учитывать. Например, надо сливать воду из радиаторов автомобилей, из системы водяного отопления, если она не подогревается. При замерзании объем воды увеличивается примерно на 11 %. Если такой процесс происходит в замкнутом пространстве, то возникает громадное избыточное давление, превышающее атмосферное порой в 2500 раз. Замерзая, вода может разрывать горные породы, дробить многотонные глыбы, не говоря уже о трубах водяного отопления жилых помещений.
Учитель демонстрирует треснувшую стеклянную бутылку с замерзшей водой.
Сотрудник химической лаборатории.
Из свойств воды особенно важна ее способность растворять вещества. Вода — универсальный растворитель. В ней могут растворяться вещества различной химической природы, образованные ковалентными полярными и ионными связями. В воде могут растворяться твердые, жидкие и газообразные вещества. Но не все они одинаково хорошо растворяются в воде. Вещества бывают хорошо растворимые, малорастворимые и практически нерастворимые.
Докладчик демонстрирует таблицу растворимости, затем показывает через кодоскоп, как постепенно растворяются кристаллы различных окрашенных солей, помещенные на мокрую фильтровальную бумагу.
Журналист.
Какой величиной характеризуется способность веществ растворяться в воде?
Сотрудник химической лаборатории.
Эта величина — растворимость, которая определяется массой вещества, способной раствориться в 100 г воды при определенной температуре.
Журналист.
Растворимость зависит от температуры?
Сотрудник химической лаборатории.
Да, но не всегда одинаково; на нее влияет еще и агрегатное состояние вещества.
Демонстрирует заранее подготовленный стакан с водой, на стенках которого появились пузырьки воздуха. Проводит опыты — растворение газов в холодной и горячей воде, растворение сахара в холодной и горячей воде. Делает вывод, что при повышении температуры растворимость твердых веществ увеличивается, а газообразных — уменьшается.
Журналист.
Отличаются ли свойства растворов веществ от свойств чистой воды?
Сотрудник химической лаборатории.
Да, они имеют разные температуры кипения и кристаллизации, некоторые растворы электропроводны, а чистая вода — диэлектрик.
Испытывает электропроводность раствора поваренной соли и дистиллированной воды.
Журналист.
Молярная масса воды равна 18 г/моль. В обычном состоянии вода — жидкость. Как можно объяснить, что вещества, имеющие большее значение молярной массы (например, углекислый и сернистый газы, метан), находятся при тех же условиях в газообразном состоянии?
Эксперт-химик
. Действительно, температуры плавления и кипения воды аномально высоки в сравнении с соответствующими температурами водородных соединений аналогов кислорода (рис. 2). Если бы вода подчинялась этой закономерности, то ее температура кипения была бы равна примерно - 75о
С, а температура замерзания составила бы - 90о
С. Но тогда она не смогла бы стать эликсиром жизни.
Рис. 2. Зависимость температур плавления и кипения веществ от молекулярной массы: 1 — tnn
; 2 — tкип
Молекулы воды, образованные ковалентной полярной связью, электростатически притягиваются друг к другу {демонстрирует схему образования водородных связей). Такое взаимодействие называют водородной связью. Водородные связи могут связывать три, четыре, пять, шесть молекул воды, образуя ассоциаты (карточки 12-15), имеющие значительно большие значения молярных масс, поэтому вода при обычных условиях — жидкость. Между молекулами водородных соединений других элементов подгруппы кислорода водородные связи не возникают, и эти вещества при обычных условиях газообразны. Образованием водородных связей можно объяснить и хорошую растворимость некоторых веществ.
Журналист.
Мы поняли, что на Земле встречается не чистая вода, а растворы различных веществ. А много ли в них растворено веществ?
Сотрудник химической лаборатории
. Общий объем растворенных в Мировом океане солей равен 48 000 000 млрд. тонн. Если эти соли выпарить и равномерно распределить по всей поверхности земного шара, то образуется слой толщиной 45 м, а если распределить эту соль только по суше, то толщина слоя составит 153 м - это высота 50-этажного небоскреба.
Журналист.
Имеет ли значение для живых организмов Земли способность воды растворять твердые, жидкие и газообразные вещества?
Сотрудник биолаборатории
. Именно с водой к клеткам животных и растений поступают необходимые для жизнедеятельности вещества, продукты жизнедеятельности удаляются из клеток тоже с водой.
Вода участвует в явлениях осмоса, играющего важную роль в поддержании постоянства химического состава клетки. Осмос — это проникновение молекул растворителя через полупроницаемую мембрану в раствор какого-либо вещества. Вода поступает в клетку именно путем осмоса. Давление, которое нужно приложить к раствору, чтобы прекратить этот процесс, называют осмотическим, оно возрастает с увеличением концентрации раствора. Осмотическое давление жидкостей организма человека соответствует давлению 0,86%-ного раствора хлорида натрия. Более концентрированные растворы принято называть гипертоническими, менее концентрированные — гипотоническими. Направление диффузии воды — в клетку или из нее — обусловлено значением осмотического давления окружающего клетку раствора. Если, например эритроциты, поместить в гипотонический раствор, вода будет поступать в них и давление ее на наружную клеточную мембрану будет возрастать до тех пор, пока клеточная оболочка не лопнет. Напротив, в гипертоническом растворе вода стремится наружу, и клетки обезвоживаются.
На явлениях осмоса основано движение воды по проводящей системе зеленых растений от корней к листьям. Вода, всасываемая корневыми волосками, содержит мало растворенных веществ. Проникая в клетки через мембраны и создавая в них повышенное давление, вода придает упругость листьям, лепесткам цветков, стеблям трав.
Вода поддерживает кислотно-основное равновесие организма — это чисто химическая роль воды. Под действием специальных ферментов она вступает в реакции гидролиза, при которых образуются вещества, необходимые для жизни клетки.
Эксперт-биолог.
Вода - самое распространенное неорганическое соединение в живых организмах нашей планеты. Например, даже в клетках эмали зубов ее около 10%, а в теле медузы - до 98%. В среднем в многоклеточном организме вода составляет около 80% общей массы тела.
Количество воды в организме зависит от возраста. Эмбрион человека на 97% состоит из воды, а у новорожденных ее количество составляет 77% массы. К 50 годам человек немного «усыхает» и вода составляет только 60% от его массы.
Основная масса воды — 70% — сосредоточена внутри клеток, а 30% - вне клеток (7% — это кровь и лимфа, а большая часть омывает клетки, это вода межтканевая — интерстициальная).
Вода в организме постоянно обновляется. В кактусах полное обновление воды происходит в течение 28 лет, у черепах - за 1 год, у верблюдов — за 3 месяца, у человека—за 1 месяц. Без воды человек может прожить только 3 дня, в то время как без пищи — 30-50 дней.
Живые организмы чутко реагируют на потерю воды. Человек, например, тяжело переносит потерю даже 0,68% воды. При этом у него повышается температура, краснеет кожа, учащается сердцебиение, начинается головная боль. Потеря 10% воды может привести к необратимым изменениям в организме, потеря 15-20% воды при 30о
С (25% при 20° С) смертельна.
Журналист
. Как происходит обезвоживание организма?
Эксперт-биолог
. Этот процесс происходит на клеточном уровне. Растворы солей или Сахаров высокой концентрации, находящиеся вокруг клетки, вытягивают из нее воду. При этом цитоплазма отходит от стенок клетки. Это явление получило название плазмолиз.
Учитель демонстрирует опыты.
Опыт 1. «Выделение воды при плазмолизе». В небольшой цилиндр, наполненный глицерином, опускает кубик картофеля, нагрузив его для предотвращения всплытия. Постепенно из картофеля выделяется вода и поднимается вверх.
Опыт 2. «Потеря растением тургорного движения». Примерно за 30 мин до демонстрации в цилиндры с водой и раствором поваренной соли нужно опустить кусочки листьев капусты. На роке необходимо сравнить внешний вид образцов, сделать вывод.
Журналист
. Мы знаем, что для сохранения тканей живыми вне организма ученые Акватоида опускали их в воду, но ткани погибали. Однако ткани, помещенные в 0,95%-ный раствор хлорида натрия, сохранились. Почему?
Сотрудник биолаборатории
. Если ткани поместить в простую воду, концентрация солей в них снижается, что приводит к гибели клеток. В физиологическом растворе (0,95%-ный раствор хлорида натрия) клетки не погибают, так как концентрации солей в клетке и вне ее равны.
Журналист.
Эксперименты показали, что если прилить в кровь чистую воду, то клетки крови человека лопаются, если же поместить их в концентрированный раствор соли, то они сморщиваются. Почему же этого не происходит, когда человек пьет воду и употребляет в пищу соль?
Сотрудник биолаборатории
. В организме поддерживается постоянная внутренняя среда. Излишки воды и солей быстро удаляются через почки и кожу.
Журналист.
Подлетая к зелено-голубой планете Земля, наши ученые заметили на поверхности воды темные пятна непонятного происхождения. Что это такое?
Эколог.
Большая часть всей воды на Земле сосредоточена в морях и океанах. Запас пресной воды составляет всего 2%. Основное количество пресных вод (85%) сосредоточено во льдах полярных зон и ледников. Возобновление запасов пресных вод происходит в результате круговорота воды. С появлением жизни на Земле круговорот воды стал сложнее, так как к физическим явлениям испарения и конденсации добавились более сложные процессы, связанные с жизнедеятельностью живых организмов. Все более значительной становится роль человека в этом круговороте. Деятельность человека порой приводит к загрязнению природных вод.
Один из основных загрязнителей воды — нефть и нефтепродукты, которые могут попадать в воду из естественных источников, при нефтедобыче, транспортировке, переработке и использовании в качестве топлива и промышленного сырья.
Из других загрязнителей необходимо назвать металлы (например, ртуть, свинец, цинк, медь, хром, олово, марганец), радиоактивные элементы, ядохимикаты, поступающие с сельскохозяйственных полей, и стоки животноводческих ферм. Из металлов наибольшую опасность для водной среды представляют ртуть, свинец и их соединения. Накопление в водоемах органических веществ приводит к эвтрофикации — обогащению их биогенными элементами, следствием чего являются уменьшение содержания кислорода, обеднение фауны и флоры, неприятный запах.
Электростанции, промышленные предприятия часто сбрасывают в водоемы подогретую воду. Это приводит к повышению температуры воды — так называемому тепловому загрязнению. При этом уменьшается количество кислорода, увеличивается токсичность загрязняющих воду примесей, нарушается биологическое равновесие. В таких водоемах возникает и биологическое загрязнение — накапливаются микробы.
Деятельность человека — это геологическая сила, способная привести как к нарушению природных закономерностей, так и к улучшению состояния природных вод. На Земле разработаны химические и биологические способы очистки сточных вод, но самая эффективная мера — применение безотходных технологий, при которых использованную воду очищают от примесей и загрязнений, а затем вновь используют в технологическом процессе. Повторное использование очищенных вод в 20-25 раз снижает потребление свежей воды и уменьшает сброс сточных вод в водоемы. Это одно из главных условий рационального использования воды.
Эксперт-эколог.
Человечество потребляет огромное количество пресной воды — в основном на промышленные и сельскохозяйственные нужды (рис. 3). Главный потребитель воды — сельское хозяйство. Наиболее водоемкие отрасли промышленности - горнодобывающая, сталелитейная, химическая, нефтехимическая, целлюлозно-бумажная и пищевая. На них уходит до 70 % всей воды, затрачиваемой в промышленности.
На все виды водопользования тратится 2200 км3
воды в год. На разбавление стоков уходит почти 20% ресурсов пресных под мира. Расчеты показывают, что даже если очищать все сточные воды, то все ришт и их разбавление потребуется 30-35 тыс. км3
пресной воды. Это означает, что водные ресурсы близки к истощению.
Потребление воды связано с развитием цивилизации: чем выше ее уровень, тем больше потребляется воды (рис. 4). К началу XXI в. среднее потребление воды составило более 200 л в сутки на человека. Все это приводит к недостатку пресной воды.
Рис. 3. Потребление пресной воды в различных отраслях человеческой деятельности (в процентах)
Вода занимает особое положение среди природных богатств Земли - она незаменима, поэтому человечество должно рационально использовать и беречь воду — основу жизни на Земле.
Рис. 4. Потребление пресной воды человечеством
Руководитель экспедиции ученых Акватоида.
Итак, мы выяснили, что вода может служить основой жизни не только для землян, но и для цивилизации планеты Акватоид. Овладение способами получения этого вещества позволит нам восстановить условия, необходимые для существования жизни на нашей планете.
Учитель химии.
Закончим урок словами А. де Сент-Экзюпери: «Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни! Ты сама жизнь! Ты наполняешь нас радостью, которую не объяснить нашими чувствами. С тобой возвращаются к нам силы, с которыми мы уже простились. По твоей милости в нас вновь начинают бурлить высохшие родники нашего сердца. Ты самое большое богатство на свете...»
Учащимся предлагается кроссворд. Лучшие ответы оцениваются. Отметки по физике, биологии, химии и экологии получают школьники, исполнявшие роли ученых, журналистов, а также активно работавшие на уроке.
Кроссворд
| 1
|
Р
|
| 2
|
А
|
| 3
|
С
|
| 4
|
Т
|
| 5
|
В
|
| 6
|
О
|
| 7
|
Р
|
| 8
|
И
|
| 9
|
Т
|
| 10
|
Е
|
| 11
|
Л
|
| 12
|
Ь
|
1. Химическая система, образованная несколькими веществами, не имеющими поверхности раздела. 2. Процесс обособления цитоплазмы клетки от оболочки вследствие частичной потери воды. 3. Переход молекул растворителя из области с высокой их концентрацией в область с низкой концентрацией через полупроницаемую мембрану. 4. Физическая величина, показывающая, какое количество теплоты необходимо сообщить телу, чтобы нагреть его на 1 °С. 5. Самый распространенный химический элемент Вселенной. 6. Потеря воды организмом. 7. Прибор для получения дистиллированной воды. 8. Самый распространенный химический элемент на Земле. 9. Переход вещества из жидкого состояния в твердое. 10. Процесс увеличения объема тела. 11. Твердое состояние воды. 12. Неорганическое вещество, образованное атомами металлов и кислотными остатками.
Ответы. 1. Раствор. 2. Плазмолиз. 3. Осмос. 4. Теплоемкость. 5. Водород. 6. Обезвоживание. 7. Дистиллятор. 8. Кислород. 9. Кристаллизация. 10. Расширение. 11. Лед. 12. Соль. [6-9, 11, 17-18].
3.2 Контрольные задания
3.2.1 Задачи с решением
Бесспорно, что сегодня образованному человеку не обойтись без экологических знаний. В общеобразовательных учреждениях проблема решается через экологизацию школьных дисциплин. На уроках химии учитель поднимает многие экологические проблемы, обсуждает вместе с учащимися возможные пути их решения. При обобщении знаний в конце изучения курса неорганической химии можно предложить следующие задачи.
Задача 1.
В сточных водах цеха гальванических покрытий содержится AgNO3
массой 120 кг. Вычислите массу 30 %-ного раствора пероксида водорода Н2
О2
, необходимого для восстановления ионов серебра до металлического состояния.
Решение:
4AgNO3
+ 2Н2
O2
= 4Ag¯ + 4HNO2
+ O2
m(AgNO3
) ® v(AgNO3
) ® v(H2
O2
) ® m(H2
O2
) ® m0
(H2
O2
)
120 ·103
г 0,706 · 103
моль 0,353·105
моль 12,0 · 103
г 40 ·103
г
Ответ:
m0
(H2
O2
) = 40 кг.
Задача 2.
Целлюлозно-бумажный комбинат произвел сброс сточных вод. Вычислите объем хлора при н.у., необходимого для очистки 1000 м3
сточных вод от сероводорода. Концентрация сероводорода в сточных водах - 0,05 мг/л.
Решение:
H2
S + Cl2
= S + 2НС1
c(H2
S)
¯ 0,05 · 103
г/л
m (H2
S) ® v (H2
S) ® v (Cl2
) ® V(Cl2
)
50 г 1,47 моль 1,47 моль 32,94 л (н.у.)
V0
1000 · 103
л
Ответ:
V(Cl2
) = 32,94л.
Задача 3.
В результате аварии на производстве серной кислоты в сточные воды массой 400 кг попало 3,2 кг SO3
. Вычислите массовую долю образующейся серной кислоты в сточных водах.
Решение:
SO3
+ Н2
О ® Н2
SO4
m(SO3
) ® v (SO3
) ® v (H2
SO4
) ® m(H2
SO4
) ®w(H2
SO4
)
3,2 · 10-3 г
40 моль 40 моль 3920 г 9,72 · 10-3
Ответ: w(H2
SO4
) = 9,72 · 10-3
(0,972%)
Задача 4.
На нефтеперерабатывающем заводе из-за поломки произошел аварийный сброс нефтепродуктов в ближайшее озеро. Масса сброшенных нефтепродуктов составила 500 кг. Выживут ли рыбы, обитающие в озере, если известно, что примерная масса воды в озере 10000 т. Токсическая концентрация нефтепродуктов для рыб составляет 0,05 мг/л.
Решение:
с = m/V0
; с = 500 кг / (10 · 106
) л = 500 ´ 106
мг / (10 · 106
) л = 50 мг/л.
Ответ: с = 50 мг/л, что значительно больше токсической концентрации (0,05 мг/л).
Задача 5.
При производстве фенолформальдегидных пластмасс произошел аварийный сброс фенола в ближайший водоем. Рассчитайте молярную концентрацию фенола в водоеме, если масса воды в нем — 10 000 m, a масса сброшенного фенола составляет 0,5 кг.
Решение:
m (С6
Н5
ОН) ® v (С6
H5
OH) ® c (С6
H5
OH)
500 г 5,3 моль 5,3 · 10-7
моль/л
Ответ: c (С6
H5
OH) = 5,3 · 10-7
моль/л.
Задача 6.
В сточных водах химико-фармацевтического комбината был обнаружен хлорид ртути HgCl2
, концентрация которого составила 5 мг/л. Для их очистки решили применить метод осаждения и в качестве осадителя использовали сульфид натрия Na2
S массой 420 г. Будут ли достаточно очищены сточные воды, чтобы допустить их сброс в соседний водоем, содержащий 10000м3
воды? ПДК(НgС12
) = 0,0001 мг/л. Объем сточных вод 300 м3
.
Решение:
HgCl2
+ Na2
S = HgS¯ + 2NaCl
 с (HgCl2
) с (HgCl2
)
5 · 10-3
г/л
 m (HgCl2
) ® v(HgCl2
) m (HgCl2
) ® v(HgCl2
)
1500 г 5,52 моль
V0
300 · 10-3 л
по ур. реак.
m (Na2
S) ® v (Na2
S) ® v (HgCl2
) ® vост
(HgCl2
) ® m (HgCl2
)®с (HgCl2
)
420 г 5,38 моль 5,38 моль 0,14 моль 39 г 0,127 мг/л
Ответ:
с (HgCl2
) = 0,127 мг/л, что значительно больше ПДК.
Задача 7.
Выживут ли караси в озере объемом 500 000 м3
, в воду которого попало 100м3
сточных вод сернокислотного завода, содержащих 1600 кг оксида серы(V1)? Токсическая концентрация серной кислоты для карасей равна 138 мг/л.
Решение:
m (SO3
) ® v (SO3
) ® v (Н2
SO4
) ® m (Н2
SO4
) ® с (Н2
SO4
)
1600 · 103
г 20 · 103
моль 20 · 103
моль 1960 · 103
г 3,92 мг/л
Ответ:
c(H2
SО4
) = 3,92 мг/л, что значительно меньше токсической концентрации.
Задача 8.
В результате вулканической деятельности образовалась смесь газов объемам 2000 м3
(н.у.), в которой объемная доля сероводорода составила 0,15. Сероводород полностью растворился в соседнем водоеме, объем воды в котором 5 · 10 м3
. Можно ли использовать воду из данного источника в хозяйственно-питьевых целях, если ПДК(Н2
S) = 0,05 мг/л?
Решение:
V0
(смесь) ® V(H2
S) ® v(H2
S) V (H2
O)
2000 м3
300 м3
(н.у.) 13,4 · 103
моль 5 · 109
л
® m (H2
S) ® c (H2
S)
455,4 · 103
г 91,1 · 10-6
г/л (0,091 мг/л)
Ответ:
c (H2
S) = 0,091 мг/л, т. е. больше ПДК. [10]
Задача 9.
Концентрация ионов водорода в дождевых водах Нигерии во время грозы достигает 0,001 моль/л. Выполните следующие задания: 1) объясните появление ионов водорода в дождевой воде и напишите уравнения соответствующих реакций; 2) рассчитайте массу кислоты в дождевой воде массой 1 · 105
т (масса среднего грозового облака); 3) оцените массу углекислого газа, поступающую в атмосферу после выпадения таких осадков в районах, содержащих карбонатные породы.
Решение
1) при электрическом разряде (молнии) в воздухе образуются оксиды азота, которые в дальнейшем образуют азотную кислоту, эти процессы можно упрощенно записать в виде уравнений:
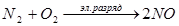
2NO + О2
® 2NО2
,
4NO2
+ O2
+ 2Н2
О ® 4HNO3
;
2) рассчитаем массу кислоты, образующейся при грозовых разрядах:
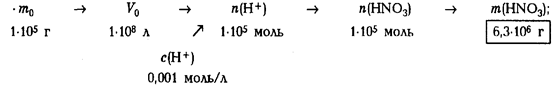
3) рассчитаем массу углекислого газа, образующегося при действии
кислотного дождя на карбонатные породы:Ответ:
1) см. химические уравнения в п. 1 решения; 2) m(НNО3
) = 6,3 т; 3) m(СО2
) = 2,2 т.
Задача 10
. В Центральной Европе и Северной Америке бывают дожди, в которых концентрация ионов водорода достигает 1-10~4
моль/л (рН ss
4). Оцените массы серной и азотной кислот в 1 т дождевой воды, исходя из следующих предположений: 1) кислую среду создает только серная кислота; 2) только азотная кислота; 3) смесь кислот в молярном отношении 1:1. Проанализируйте, какая дождевая вода (из указанных) опаснее для мраморных и известняковых сооружений?
Решение:
1) рассчитаем массу серной кислоты, содержащейся в 1 т дождевой воды:2) рассчитаем массу азотной кислоты, содержащейся в 1 т дождевой воды:
3) рассчитаем массы серной и азотной кислот, исходя из того, что их количества одинаковы. Пусть х — количество (моль) каждой кислоты,
содержащейся в 1 т воды. Учитывая, что общее количество ионов водорода равно 0,1 моль, записываем уравнение:2х + x = 0,1 Þ х = 0,0333 моль.

Пояснение к решению. В этой задаче рассматривают разбавленные растворы сильных кислот и поэтому расчеты сделаны на основе предположений, что степени диссоциации кислот равны 100 % (в том числе для I и II ступени диссоциации серной кислоты).
Ответ:
1) m(Н2
SO4
) = 4,9 г; 2) m(НNО3
) = 6,3 г; 3) m(Н2
SO4
) = 3,27 г; 4) m(НNО3
) = 2,1 г. Дождевые воды равного объема и с одинаковой концентрацией ионов водорода реагируют с одинаковым количеством карбоната натрия, что видно из ионного уравнения:
СаСО3
+ 2Н+
® Ca2+
+ Н2
О + СО2
.
Однако азотная кислота образует нитрат кальция, растворимость которого выше растворимости сульфата кальция и дигидрата сульфата кальция (гипса), и поэтому можно ожидать, что в присутствии азотной кислоты разрушение мраморных и известняковых сооружений будет идти быстрее.
Задача 11.
В помещении V = 54 м3
разлилось 5,0 мл этиламина (r = 0,689 г/см3
). Превышает ли его концентрация пдк (18 мг/м3
)?
Решение
:
Зная объем вещества и его плотность, найдем массу:
m = V. r
m = 5,0.0,689 = 3,445 г = 3445 мг
Для сравнения концентрации со значением ПДК этиламина найдем его концентрацию в приведенном помещении:
С = m/V = 3445 мг/ 54 м3
= 63,8 мг/м3
.
63,8 / 18 = 3,5 раза
Ответ:
Концентрация этиламина в помещении превышает значение его ПДК в 3,5 раза.
Задача 12
. В результате аварии в цеху, размеры которого составляют 4 ´ 9 ´ 10 м произошла утечка 23 г 50 %-ного раствора триэтиламина (ПДК = 10 мг/м3
). Превышает ли концентрация триэтиламина а помещении его ПДК?
Решение
:
Найдем объем помещения:
V = 4´9´10 = 36000 м3
Найдем массу триэтиламина, зная его концентрацию:
23 г´ 0,5 = 11,5 г триэтиламина
С = m/V = 1150 мг/3600 м3
= 0,32 мг/м3
Ответ
: концентрация триэтиламина не превышает значение его ПДК
Задача 13.
В цеху хранится 8,5 г аллиламина. Каков должен быть объем помещения, чтобы в случае аварии концентрация аллиламина не превысила значение его ПДК (ПДК = 0,5 мг/м3
)?
Решение:
Найдем объем помещения из выражения для его концентрации:
С = m/V; V = m/C
V = 8500 / 0,5 = 17000 м3
Ответ
: Объем помещения должен быть больше 17000 м3
.
Задача 14.
В лаборатории размерами 28 ´ 20 ´ 3 м было разлито 1,62 мл бутиламина (ПДК = 10 мг/м3
, r = 0,7401 г/мл) и 1,2 мл дипропиламина (ПДК = 5 мг/м3
,r = 0,7384 г/мл). Составляет ли угрозу здоровью персонала такая ситуация?
Решение:
Найдем массу веществ:
m = r´ V
для бутиламина m = 0,7401 ´ 1,62 = 1,2 г = 1200 мг
для дипропиламина m = 0,7384 ´ 1,2 = 0,9 г = 900 мг
Найдем объем помещения:
V = 28 ´ 20 ´ 3 = 1680 м3
Концентрация веществ:
С1
= m/V = 1200 / 1680 = 0,71 мг/м3
С2
= m/V = 900 / 1680 = 0,54 мг/м3
Ответ:
Данная утечка не представляет особой угрозы здоровью персонала.
По вышеприведенным схемам учащимся предлагается составить задачи.
Задача 15.
Самый дешевый щелочной реагент для нейтрализации кислотных промышленных стоков – гашеная известь (гидроксид кальция). Используют как суспензию гидроксида кальция ("известковое молоко"), так и прозрачный раствор ("известковую воду"). Рассчитайте рН 0,02М раствора Ca(OH)2
.
Решение.
Запишем уравнение реакции и условие задачи в формульном виде:
Ca(OH)2
= Ca2+
+ 2 OH-
; рН > 7
c{Ca(OH)2
} = 0,02 моль/л; pH = ?
В соответствии с уравнением реакции равновесная молярная концентрация анионов OH-
вдвое больше концентрации гидроксида кальция c{Ca(OH)2
}:
[OH-
] = 2c{Ca(OH)2
}
рН = 14 - pOH = 14 + lg[OH--
] = 14 + lg 2c{Ca(OH)2
} = 12,6
Ответ.
Водородный показатель известковой воды равен 12,6.
Задача 16.
Рассчитайте, на сколько градусов поднялась бы температура вашего тела после стакана сладкого чая, если бы весь поступивший с чаем сахар сразу окислился в организме до углекислого газа и воды. В расчетах следует принять, что в одной чайной ложке содержится 10 г сахара; теплоемкость тела равна теплоемкости воды и составляет 4,2 кДж/(кг * К); тепловой эффект реакции окисления сахарозы равен 5650 кДж/моль; масса человека 60кг.
Решение
С тремя чайными ложками (m = 30г) в организм попадет сахароза количеством вещества:
n = m/M;
n = 30/342 = 0,088 (моль).
В результате его полного окисления выделится примерно 497 кДж (5650 кДж/моль * 0,088 моль) энергии.
Если вся эта энергия пойдет на нагрев тела, его температура поднимется на 2˚C(497/(60×4,2)), т.е. с 36,6 до 38,6˚C. На самом деле перегревания организма после приема пищи человек не чувствует, так как выделение тепловой энергии идет медленно и компенсирует естественные затраты, в том числе и на поддержание постоянной температуры тела.
Задание 17
. Кислотность выше нормы могут иметь различные виды атмосферных осадков (дождь, снег, туман, роса). Главными кислотообразующими выбросами в атмосферу являются диоксид серы SO2
и оксиды азота. Назовите еще два вида кислотообразующих видов, их основные источники. Предложите способ обнаружения в воздухе вредных выбросов.
Решение
За счет выбросов химических предприятий, сжигания отходов, фотохимического разложения фреонов в атмосфере происходит образование радикалов хлора, которые при соединении с метаном образуют газообразный хлороводород. Последний, в свою очередь, хорошо растворяется в воде, образуя аэрозоль соляной кислоты:
Cl*
+ CH4
= CH*
3
+ HCl
CH*
3
+ Cl2
= Cl*
+ CH3
Cl.
Для обнаружения в воздухе вредных выбросов можно использовать индикаторную трубку с оксидом кремния(IV) – силикагелем, который является хорошим сорбентом. Силикагель предварительно следует пропитать химическим реагентом, способным давать цветную реакцию с определяемым выбросом. Так, для обнаружения хлора применяется силикагель, пропитанный раствором йодида калия и крахмала. В результате продувания через индикаторную трубку воздуха, содержащего примесь хлора, выделяется йод, дающий с крахмалом синее окрашивание. По степени окраски сорбента достаточно точно можно определить концентрацию примеси.
Еще один источник кислотных дождей – аэрозоль плавиковой кислоты – образуется в воздухе за счет выбросов фтороводорода. Источник выбросов – производство алюминия и стекла.
Задача 18
. Будет ли вредна для здоровья питьевая вода, если в ней обнаружено:
а) 3,3*10-6
моль/л ионов железа (II);
б) 1,7*10-7
моль/л ионов никеля (II);
в) 1,9*10-7
моль/л ионов хрома (III)?
Санитарные нормы допускают присутствие в питьевой воде ионов железа(II)в количестве 0,2 г/м3
; ионов никеля(II) – 0,1 г/м3
; ионов хрома(III) – 0,05 г/м3
.
Решение
В 1 м3
такой воды содержится примерно 0,184 г ионов железа(II), 0,01 г ионов никеля(II), 0,01 моль ионов хрома(III). Вода невредна для здоровья, поскольку содержание обнаруженных ионов ниже допустимых норм.
Задача 19
. Желудочный сок – это бесцветная жидкость, имеющая кислотную реакцию среды благодаря присутствию соляной кислоты HCl, которая относится к числу сильных кислот. Рассчитайте pH желудочного сока, если массовая доля HCl в нем составляет 0,5%.Плотность желудочного сока практически равна плотности воды.
Решение
Хлороводородная кислота – сильная, диссоциирует необратимо:
HCl = H+
+ Cl-
.
Значит, концентрация ионов водорода равна концентрации раствора (в моль/л), которую можно определить следующим образом:
c(HCl) = (p*w*1000)/M(HCl);
c(HCl) = (1*0,005*1000)/36,5 = 0,137 (моль/л).
Отсюда pH = -lg(H+
) = -lg 0,137 = 0,86.
Задача 20.
Одно из самых дешевых азотных удобрений - аммиачная вода, раствор аммиака. Определите степень диссоциации гидрата аммиака NH3
.
H2
O в 0,002М растворе, если его рН равен 10,3 при 25 o
С.
Решение.
Запишем уравнение реакции и условие задачи в формульном виде:
NH3
.
H2
O <<здесь знак обратимости>> NH4
+
+ OH-
; рН > 7
c(NH3
.
H2
O) = 0,002 моль/л; pH = 10,3
a = ?
В соответствии с уравнением реакции равновесная молярная концентрация анионов OH-
связана с концентрацией гидрата аммиака и степенью диссоциации:
[OH-
] = a.c(NH3
.
H2
O)
рН = 14 - pOH = 14 + lg[OH--
] = 14 + lg {a.c(NH3
.
H2
O)}
a = (10 pH - 14
): с = 10 10,3 -- 14
/ 0,002 = 0,093 = 9,3%
Ответ.
Степень диссоциации гидрата аммиака равна 9,3. [9 – 11]
3.2.2 Задачи с правильным ответом
Задача 1.
В стратосфере на высоте 20-30 км находится слой озона O3
, защищающий Землю от мощного ультрафиолетового излучения Солнца. Если бы не "озоновый экран" атмосферы, то фотоны большой энергии достигли бы поверхности Земли и уничтожили на ней все живое. Подсчитано, что в среднем на каждого жителя Белгорода в воздушном пространстве над городом приходится по 150 моль озона. Сколько молекул озона и какая его масса приходится в среднем на одного белгородца? (Ответ: 9,03*1025
; 7,2 кг)
Задача 2.
Одинаковое ли (и какое именно) число молекул содержится в 1г воды и в 1г кислорода? Какова роль этих веществ в биосфере Земли? (Ответ: 0,33*1023
; 0,37*1027
)
Задача 3.
Чтобы приготовить бордосскую смесь (препарат против фитофторы – грибкового заболевания огородных растений), используют медный купорос CuSO4
?5H2
O. Рассчитайте число атомов кислорода и водорода, которые содержатся в 350 г этого вещества. (Ответ: 75,8*1023
; 84,2*1023
)
Задача 4.
В сутки человек вдыхает приблизительно 25 кг воздуха. На каждые 100 км пути автомобиль расходует 1825 кг кислорода. Сколько суток сможет дышать человек воздухом, если одна из машин проедет на 100 км меньше? Используя приведенные факты и результаты ваших расчетов, подготовьте:
а) рекламный проспект автомобилей;
б) текст обращения к президенту России о защите природы.
(Ответ: 347 суток 14 часов 52 минуты)
Задача 5.
Основной компонент природного газа – метан. Некоторые крупные месторождения природного газа, например Астраханское, Оренбургское, помимо углеводородных газов содержат значительное количество сероводорода. Эта примесь, с одной стороны опасна, так как вызывает сильную коррозию трубопроводов и перекачивающей аппаратуры. Кроме того, при сгорании такого газа получается оксид серы (IV), что вызывает загрязнение атмосферы. С другой стороны сероводород является ценным химическим сырьем, из которого можно получить, например, серную кислоту. Предложите рациональные, по вашему мнению, способы очистки природного газа от сероводорода.
Задача 6.
Белгородский мел содержит карбонат кальция и карбонат магния в пересчете на CaO и MgO соответственно 54 и 0,5 %.
Сколько примеси содержит белгородский мел?
Какой объем CO2
выделится в атмосферу при обжиге образца такого мела массой 1 кг? (Ответ: 2,5%)
Задача 7.
В природе постоянно происходит круговорот биогенных элементов: углерода, водорода, кислорода, фосфора, азота и др. Человек в процессе своей деятельности вмешивается в круговорот веществ, использую минеральное сырье для своих нужд. Какая масса углерода должна превратиться в CO2
, чтобы получить 1 л минеральной газированной воды с концентрацией углекислоты 2%, ρ=1г/см3
. (Ответ: 3,84 г.)
Задача 8.
Азот – незаменимый биогенный элемент, поскольку входит в состав белков и нуклеиновых кислот. Атмосфера – неисчерпаемый резервуар азота, однако основная часть живых организмов не может непосредственно использовать этот азот: он должен быть предварительно связан в виде химических соединений. Существуют азотфиксирующие бактерии, способные фиксировать азот воздуха и превращать его в доступную для растений форму. С помощью таких бактерий при хорошем урожае клевер может накапливать за сезон 150-160 кг/га азота. Какой объем воздуха в м3
содержит такую массу азота? Какую массу 10 % раствора аммиачной воды (используемой в качестве удобрений) может заменить 1 га клевера, накопивший за сезон 100 кг/га азота? (Ответ: 120 м3
, 2100 кг)
Задача 9.
Растения поглощают минеральные вещества и углекислый газ и под действием ультрафиолета синтезируют глюкозу, выделяя кислород.
Какой объем CO2
усвоили зеленые листья сахарной свеклы для получения 100 г сахарозы, из которой можно изготовить 10 конфет (одна конфета содержит примерно 10 г сахара)? (Ответ: 26 л СО2
).
Задача 10.
Листья растения махорки содержат лимонную кислоту, примерно 3%. Какая масса зеленых листьев этого растения потребуется для получения 1 кг лимонной кислоты, если потери при производстве составляют 15 %? (Ответ: 39,1 кг). [21, 26-27].
3.2.3 Задачи для самостоятельного решения
1.
Большой ущерб водным организмам наносят соединения мышьяка. Особенно ядовиты соединения мышьяка (III) Предложите способ очистки сточных вод от арсенатов и арсенитов, принимая во внимание, что мышьяк является аналогом фосфора.
2.
Накопление углекислого газа в атмосфере становится опасным загрязнением – приводит к парниковому эффекту. Какой объем CO2
попадает в атмосферу при сжигании 100 г полиэтилена (100 шт. использованных пакетов)?
3.
Поскольку нефтепродукты горючи, очистку от них водной поверхности можно было бы проводить путем сжигания нефтяной пленки. Такой способ, конечно, не экономичен, он связан с потерей топлива, но охрана природы, сохранение морской и прибрежной фауны и флоры важнее, чем экономия нефти. Трудность сжигания нефтяной пленки заключается в том, что поджечь можно только относительно толстый слой плавающей на поверхности воды нефти. Если же пленка тонкая (так бывает в большинстве случаев), поджечь ее не удается. Предложите способ сжигания тонких пленок нефтепродуктов на поверхности воды.
4.
Большие неприятности доставляет наличие в сточных водах карбоновых кислот и их солей. Предложите физико-химический способ очистки воды от этих загрязнений.
5.
При нейтрализации промышленных стоков белгородского завода "Ритм" было получено 300 кг осадка Cr(OH)3
. Какую массу металлического хрома можно получить из осадка, если производственные потери составляют 10 %
6.
Маршрутный автобус расходует за день 60 кг бензина. Сколько кубометров газа выделяет он в городе, загрязняя среду? Плотность этого газа при температуре 0°С равна 0,002 кг/м3
. Какие способы защиты атмосферного воздуха от загрязнения выбросами автотранспорта вы можете назвать?
7.
Для обогрева почвы в парниках применяется нагревательный элемент, изготовленный из стальной проволоки длиной 693 м и сечением 7 мм2
. Определите количество теплоты, выделяемой ежесекундно нагревательным элементом, если по нему проходит ток силой 22,7 А. В чем сущность «парникового эффекта», играющего важную роль в тепловом балансе нашей планеты?
8.
Во время пахоты на влажной почве колесный трактор забуксовал. Выполняется ли в этом случае трактором работа? Какая экологически нежелательная проблема возникает при этом?
9.
Рыжие лесные муравьи обладают феромоном тревоги - кислотой, которая одновременно служит оружием. Установите его структурную формулу, если вещество разлагается при нагревании, дает реакцию серебряного зеркала.
10.
Рассчитайте объем СО2
, возвращенного в круговорот углерода в результате деятельности метанокисляющих бактерий, если ими было утилизировано из воздуха 4,8 т СН4
. Процесс биологического окисления метана при этом идет ступенчато.
11
. ПДК фенола у мест водопользования составляет 0,001 мг/л. Рассчитайте, во сколько раз концентрация фенола будет превышать ПДК, если в водоем вместимостью 104
м3
со сточными водами коксохимического предприятия было сброшено 47 кг фенола.
12
. В лабораторных спиртовках этиловый спирт сгорает с выделением СО2
и Н2
О. Вычислите объем СО2
, который накопился в химическом кабинете объемом 288 м3
, если на каждом из 18 столов за время работы учеников сгорает 2,3 г спирта.
Рассчитайте объемную долю СО2
и поясните, окажет ли он влияние на самочувствие учащихся, работающих в кабинете, если учесть, что объемная доля СО2
в атмосферном воздухе составляет 0,03%. Если же его содержание превышает 4%, то происходит раздражение дыхательных путей, возникают шум в ушах и головная боль.
13
. В питьевой воде были обнаружены следы вещества, обладающего общетоксическим и наркотическим действием. На основе качественного и количественного анализов этого вещества было установлено, что это производное фенола и массовые доли элементов в нем равны: 55% С, 4,0% Н, 14,0% О, 27% Cl.
Установите молекулярную формулу вещества. Составьте уравнения реакции его получения, укажите возможные причины попадания этого вещества в среду.
14
. Один из способов очистки коксового газа от оксидов азота(II) – использование метана:
Какой объем СН4
расходуется в час на взаимодействие с NO на установке по очистке коксового газа производительностью 130 тыс. м3
/ч, если в 1 м3
коксового газа содержится 6 см3
NO?
15
. В промышленности винилхлорид получают пиролизом дихлорэтана (1-я стадия):
В настоящее время осуществлен сбалансированный (безотходный) синтез винилхлорида. Для этого выделяющийся при пиролизе HCl смешивают с этиленом и кислородом, а затем эту смесь подвергают окислительному хлорированию в присутствии катализатора хлорида меди(II) CuCl2
на носителе (2-я стадия):
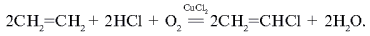
16
. Рассчитайте объем НСl (н. у.), выделившегося при пиролизе 19,8 кг дихлорэтана, и массу винилхлорида, полученного при сбалансированном синтезе. Какой объем займет этилен (н. у.), необходимый для второй стадии процесса? Оцените новую технологию получения винилхлорида с позиции защиты окружающей среды от загрязнения [20, 25-28].
3.3 Тестовые задания и индивидуализация обучения
Оптимальным можно считать только такое обучение, которое способствует овладению приемам самостоятельного приобретения знаний и их применения.
Чаще всего используют тесты со свободно конструируемыми ответами и тесты с выборочными ответами. Последние дают возможности учащимся лучше понимать общие и отличительные качества изучаемых объектов, легче классифицировать различные явления.
Применение данного метода позволяет учителю получить сведения об усвоении того или иного материала, не затрагивая время на беседу с учащимися.
1
. Впервые термин «экология» в науку ввел:
а) К. Мебиус;
б) В.Н. Сукачев;
в) Э. Геккель;
г) В.И. Вернадский.
2
. Термин «экосистема» впервые предложил ученый:
а) Мебиус;
б) Фобс;
в) Тенсли;
г) Сукачев.
3.
Способность экосистемы к поддержанию динамического равновесия называется:
а) выживаемостью;
б) гомеостазом;
в) плотностью;
г) дигрессией.
4
. Минимальный уровень энергии в экосистеме будет у:
а) продуцентов;
б) консументов первого порядка;
в) редуцентов;
г) Консументов.
5
. Закончите определение. Биосфера – это:
а) оболочка Земли, в которой существуют и взаимодействуют с окружающей средой (или когда-либо существовали и взаимодействовали) живые существа;
б) оболочка Земли, включающая часть литосферы, атмосферы и гидросферы;
в) Оболочка Земли, в которой существует человечество.
6
. Вещество, сформировавшееся без участия живых организмов, В.И. Вернадский назвал
а) Живым веществом;
б) Биокосным веществом;
в) Биогенным веществом;
г) Косным веществом;
7
. Круговорот углерода отличается от круговоротов воды, фосфора и азота тем, что
а) запасы углерода в горных породах недоступны;
б) не весь углерод усваивается растениями вновь;
в) углерод концентрируется в горных породах;
г) углерод вымывается в океан безвозвратно.
8
. Процесс разрушения соединений азота до молекулярного состояния
а) аммонификация;
б) редукция;
в) денитрификация;
г) деструкция.
9
. Определите, к каким факторам среды –– можно отнести следующие факторы: а)хищничество, б)вырубка лесов, в)влажность воздуха, г)температура воздуха, д) паразитизм, е)свет, ж)строительство зданий, з)давление воздуха, и)конкуренция, к)выброс углекислого газа заводами, л)соленость воды.
1. абиотическим – в, г, е, з, л.
2. биотическим – а, д, и.
3. антропогенным - ж, к
10
. В каждом из предложенных примеров выберите тот фактор, который можно считать лимитирующим:
а) Для растений на глубине 6000 м:
Вода, температура, углекислый газ, свет
б) Для растений в пустыне летом:
Температура, свет, вода.
в) Для скворца зимой в подмосковном лесу:
Температура, пища
, кислород, влажность воздуха, свет.
г) Для речной обыкновенной щуки в Черном море:
Температура, свет, пища, соленость воды
, кислород.
д) Для кабана зимой в северной тайге:
Температура, свет, кислород, влажность воздуха, высота снежного покрова.
11
. Расположите перечисленные источники энергии в порядке убывания их экологической опасности:
а) ГЭС;
б) ТЭЦ на природном газе;
в) солнечные электростанции;
г) АЭС;
д) ТЭЦ на угле;
е) приливно-отливные электростанции.
Правильный ответы-е, в, б, а, д, г
12
. В крупных городах более половины выбросов в атмосферу производят:
а) Промышленные предприятия;
б) Энергетика;
в) Химическая и угольная отрасли промышленности вместе;
г) Транспорт.
13
. Сохранение природной среды и решение экологических проблем бассейна р. Баксан относится к проблемам:
а) Локального характера;
б) Регионального характера;
в) Глобального характера;
г) Районного масштаба.
14.
Проблема разрушения озонового слоя относится к проблемам:
a) Локального характера;
б) Глобального характера;
д) Районного масштаба;
с) Регионального характера;
15.
Способность ядовитых веществ оказывать вредное действие на живые организмы называется
а) токсичность;
б) техногенез;
в) автогенез;
г) куммулятивность.
16.
Тератогенное действие на живые организмы – это действие:
а) на поджелудочную железу;
б) на почки;
в) на плод в утробе матери;
г) на рядом находящиеся живые организмы;
17
. Развитие злокачественных опухолей под воздействием вредных факторов, называется:
а) Онтогенез;
б) Канцерогенез;
в) Филогенез;
г) Биогенез;
18
. Одними из самых сильных канцерогенов признаны:
а) Хлорорганические соединения;
б) Галогены;
в) Тяжелые металлы;
г) Фосфорорганические соединения;
19.
Использованные люминесцентные лампы являются источником одного из наиболее опасных ядов – ионов:
а) Pb – свинца;
б) Cd – кадмия;
в) Hg – ртути;
г) Ni – никеля;
20.
Свинец (Pb), негативное биологическое воздействие которого связано с замещением ионов кальция (Ca) в костях, используется в производстве:
а) Красок и автомобильного топлива;
б) Ламп и батарей;
в) Калийных и фосфорных удобрений;
г) Пестицидов;
21
. Болезнь Минамата, приводящая к глухоте, параличу и смерти людей, вызывается:
а) Повышеным содержанием в пище кобальта (Co);
б) Повышеным содержанием в пище ртути (Hg);
в) Нехваткой микроэлементов;
г) Обезвоживанием организма;
22
. Основным компонентом атмосферы является:
а) Кислород;
б) Водяные пары;
в) Аргон;
г) Азот;
23.
Наиболее значимым для живых организмов из основных компонентов атмосферы является:
а) Кислород;
б) Водяные пары;
в) Аргон;
г) Азот;
24
. Атмосфера защищает живые организмы, населяющие поверхность планеты, от воздействия:
а) Вулканических выбросов;
б) Жесткого ультрафиолетового излучения;
в) Хозяйственной деятельности человека;
г) Парникового эффекта;
25.
Постепенное потепление климата на планете называют:
а) Озоновым экраном;
б) Парниковым эффектом;
в) Фотохимическим смогом;
г) Локальным загрязнением атмосферы;
26.
Основной причиной глобального потепления климата является:
а) Изменение естественного радиоактивного фона;
б) Увеличение в атмосфере концентрации диоксида углерода (СО2
);
в) Истончение озонового слоя;
г) Увеличение в атмосфере концентрации диоксида серы (SO2
);
27
. Озоновый слой атмосферы разрушается под действием:
а) Жесткой солнечной радиации;
б) Углекислого газа;
в) Хлорфторуглеводородов;
г) Изменения геомагнитных свойств атмосферы;
28.
Основной причиной выпадения кислотных дождей считают воздействие на атмосферу:
а) Электромагнитных излучений;
б) Выбросов сернистого газа;
в) Высокотоксичных соединений;
г) Мелких частиц сажи.
29
. Ядовитый туман, образующийся при воздействии солнечного света на смесь выбросов промышленных предприятий и транспорта, называют:
а) Фотохимическим смогом;
б) Задымлением атмосферы;
в) Лондонским смогом;
г) Парниковым эффектом.
30
. Какие из нижеперечисленных органов и тканей человека наиболее чувствительны к радиационному излучению?
а) Кости;
б) Жировая ткань;
в) Костный мозг;
г) Мышечная ткань.
31.
Воды Мирового Океана относятся к:
а) Неисчерпаемым природным ресурсам;
б) Возобновляемым (исчерпаемым) природным ресурсам;
в) Невозобновляемым (исчерпаемым) природным ресурсам;
г) Вечным природным ресурсам.
32
Запасы пресной питьевой воды сосредоточены в основном в:
а) Озерах и прудах;
б) Ледниках;
в) Реках;
г) Почве.
33.
Возросший дефицит пресной воды вызван в основном:
а) Ухудшением климата;
б) Резким уменьшением объема грунтовых вод;
в) Загрязнением водоемов;
г) Глобальным засолением почв;
34.
Приоритетным загрязнителем Мирового Океана является:
а) Бытовой мусор;
б) Нефть и нефтепродукты;
в) Биологические отходы;
г) Твердые промышленные отходы;
35.
Незамерзание водоемов в холодное время года – один из признаков:
а) Естественной эвтрофикации водоема;
б) Теплового загрязнения водоема;
в) Здорового состояния водоема;
г) Засорение поверхностного водоема;
36.
Эвтрофикацией водоемов называют:
а) Быстрое накопление органических веществ, ускоренное развитие микрофлоры и микрофауны
б) Быстрое бытовое загрязнение водоемов синтетическими моющими средствами;
в) Активное загрязнение водоемов продуктами нефтепереработки;
г) Активное поступление в водоемы солей тяжелых металлов;
37
. Эвтрофикации водоемов в наибольшей степени способствует:
а) Энергетика;
б) Транспорт;
в) Металлургия;
г) Земледелие;
38.
Наиболее чувствительными к загрязнителям воздуха (в первую очередь – к SO2
) являются:
а) Газонные травы;
б) Широколиственные породы;
в) Многолетние травы;
г) Хвойные породы;
41.Сила наркотического действия и токсичность веществ возрастает:
а) с увеличением числа атомов углерода в молекуле;
б) с уменьшением числа атомов углерода в молекуле;
в) с увеличением содержания атомов кислорода в молекуле;
г) с увеличением содержания атомов азота в молекуле;
42.Наркотическое и токсическое действие веществ ослабляется:
а) при разветвлении углеродных цепей;
б) при замыкании углеродных цепей;
в) при увеличении длины углеродных цепей;
43. С увеличением кратности химической связи:
а) увеличивается токсическое действие;
б) уменьшается токсическое действие;
в) токсикологические свойства соединения не меняются;
44.Избыточное образование свободных радикалов в организме может привести:
а) К раковым заболеваниям;
б) К повышению иммунитета;
в) К простудным заболеваниям;
г) Не повлияет на работу организма;
45. Бром концентрируют в себе:
а) Боровики;
б) Опята;
в) Лисички;
г) Шампиньоны;
46. С живыми тканями организма совместим:
а) Тантал;
б) Ванадий;
в) Висмут;
г) Вольфрам.
47. Химический элемент селен извлекает из почвы и концентрирует цветок:
а) Астра;
б) Пион;
в) Роза;
г) Тюльпан;
48.В качестве консервирующего средства при сушении слив и абрикосов применяют
а) оксид серы;
б) оксид азота;
в) оксид фосфора;
г) оксид магния;
49. Фенол используется в качестве:
а) дезинфицирующего средства;
б) катализатора;
в) ингибитора;
г) инициатора;
50. Тривиальное название фенола:
а) муравьиная кислота;
б) царская водка;
в) уксусная кислота;
г) карболовая кислота.
51. Формальдегид применяют для изготовления:
а) игрушек;
б) пластмасс;
в) кирпича;
г) взрывчатых веществ;
52. Фенолформальдегидные смолы получают в результате реакции:
а) поликонденсации;
б) полимеризации;
в) присоединения;
г) замещения;
53. При производстве фенолформальдегидных смол в окружающую среду выделяется:
а) фенол;
б) аммиак;
в) формальдегид;
г) углекислый газ.
54. Одно из наиболее опасных соединений, которое выделяется при горении ДСП:
а) циановодород;
б) серная кислота;
в) азотная кислота;
г) бензапирен;
55. Формальдегид вызывает:
а) отеки;
б) бронхиальную астму;
в) экзему;
г) ринит;
56. Основной поставщик фенола и формальдегида в атмосферу:
а) медицина;
б) деревообрабатывающая промышленность;
в) химическая промышленность;
г) пищевая промышленность;
57. ПДК фенола в воздухе:
а) 1 мг/м3
б) 20 мг/м3
в) 17 мг/м3
г) 5 мг/м3
58. ПДК фенола в сточных водах:
а) 20 мг/м3
б) 1-2 мг/м3
в) 12 мг/м3
г) 4 мг/м3
59. ПДК формальдегида в воздухе:
а) 0,05 мг/м3
б) 0,007 мг/м3
в) 0,003 мг/м3
г) 2 мг/м3
60. Смертельная доза 35% водного раствора формальдегида равна:
а) 1 г;
б) 100 г;
в) 10-50г;
г) 200г;
61. Один из отходов при производстве фенолформальдегидных смол:
а) ацетон;
б) кумол;
в) фенольная смола;
г) метиловый спирт.
62. Норма образования фенольной смолы:
а) 200 кг/т;
б) 10 кг/т;
в) 130 кг/т;
г) 500 кг/т;
63. Одно из направлений использования фенольной смолы:
а) строительство;
б) добавка к топочному маслу;
в) медицина;
г) нигде не используется.
64. Метод утилизации фенольной смолы:
а) термическая деструкция;
б) конверсия;
в) закапывают в землю;
г) электрохимический метод;
65. При гидрировании фенольной смолы в качестве катализатора применяют:
а) никель, палладий, кадмий;
б) вольфрам, алюминий, никель;
в) алюминий, кобальт, молибден;
г) медь, платина, золото.
66. Отход при производстве фенолформальдегидной смолы:
а) фенольная вода;
б) метаналь;
в) уксусная кислота;
г) углекислый газ;
67. Норма образования фенольной воды составляет:
а) 100 кг/т;
б) 500кг/т;
в) 145кг/т;
г) 200-300кг/т
68. При получении фенола кумольным способом, кроме фенола образуется:
а) этиловый спирт;
б) ацетон;
в) уксусная кислота;
г) метан;
69. Один из методов получения формальдегида, который характеризуется очень малым количеством побочных продуктов:
а) окисление синтез-газа кислородом;
б) окисление метанола кислородом;
в) окисление метана кислородом;
г) окисление пропана кислородом;
70. Наименьшая опасность при получении фенола достигается при использовании в качестве катализатора:
а) перманганата калия;
б) диоксид марганца;
в) кислорода воздуха;
г) хромовой смеси;
71. Ионы водорода при диссоциации образуют
а) соли;
б)
кислоты;
в) щелочи;
г) оксиды;
72. Гидроксид-ионы в результате диссоциации образуют
а) кислоты;
б) соли;
в)
щелочи;
г) оксиды;
73. Кислотную реакцию раствора обуславливают илны
а) OH-
;
б) Cl-
;
в)
H+
;
г)SO4
2-.
74. Щелочную реакцию раствора обуславливают ионы
а) K+;
б) Na+;
в)
OH-;
г) H+;
75. Белый осадок при введение ионов Ag+
образует раствор
а)
NaCl;
б) NaNO3
;
в) Ca(NO3
)2;
г) KNO3.
76. По обильному выделению пузырьков газа при добавлении кислоты можно обнаружить ион
а)
Cl;
б) SO2
4
;
в) CO2-
3;
г) H+.
77. В красный цвет лакмус окрашивается в растворе соли
а)
Al(NO3
)3;
б) K2
CO3
;
в) Na2
CO3;
г) Ba(NO3
)2;
78. В синий лакмус окрашивается в растворе соли
а)
NaCl;
б) AlCl3
;
в) KOH;
г) Ba(NO3
)2;
79. Белый осадок при введении ионов SO2-
4
образует раствор
а) Al(NO3
)3
;
б) FeCl3
;
в) KOH;
г)
Ba(NO3
)2.
80. В трех пронумерованных пробирках находятся растворы хлорида бария, хлорида натрия, карбоната натрия. В каждую пробирку добавили раствор серной кислоты. В пробирке 1 выпал белый осадок, в пробирке 2 наблюдалось обильное выделение пузырьков газа, а в пробирке 3 видимых изменений не произошло. Растворы распределены по пробиркам следующим образом:
а) 1- BaCl2
; 2 – NaCl; 3 – Na2
CO3
б) 1- NaCl; 2 – Na2
CO3
; 3 – BaCL2
в) 1 – Na2
CO3
; 2 – BaCL2
; 3 - NaCl
г) 1 - BaCl2
; 2 – Na2
CO3
; 3 – NaCl
81. Во втором периоде, VI группе периодической системы химических элементов Д.И. Менделеева находятся элементы:
а) S;
б) Bа;
в) Br;
г)
O.
82. Строение атома серы отображает электронная формула:
а) 1S2
2S2
2P3
;
б)
1S2
2S2
2P6
3S2
3P4
;
в) 1S2
2S2
2P4
;
г) 1S2
2S2
2P5
;
83. Формула серной кислоты:
а)
H2
SO4
;
б) NaHCO3
;
в) H2S;
г) H2
SO3.
84. Формула гидросульфата натрия:
а) Na2
SO3
;
б) NaHCO3
;
в)
NaHSO4
;
г) Na2
CO3
85. Формула сернистой кислоты:
а)
H2
SO3
;
б) H2
S;
в) H2
SO4
;
г) HCL
86. Формула сульфата калия.
а) CaSO4
;
б) KHSO4
;
в)
K2
SO4
;
г) K2
SO3
87. Формула оксида серы (VI) (ангидрида серной кислоты)
а) SO4
;
б) SeO3
;
в) SO2
;
г) SO3
88. Число электронов на внешнем энергетическом уровне атома теллура равно:
а) 7;
б)
6;
в) 5;
г) 4
89. Качественный реактив на серную кислоту и ее соли – это раствор.
а) AgNO3
;
б)
BaCl2
;
в) лакмуса;
г) крахмала
90. В трех пронумерованных пробирках даны растворы серной и соляной кислот, сульфата калия. Лакмусовая бумага окрасилась в красный цвет в пробирках 2 и 3. Затем во все пробирки прилили раствор хлорида бария, отчего в пробирках 1 и 2 выпал белый осадок. Растворы распределены по пробиркам следующим образом:
а) 1 – H2
SO4
; 2 – K2
SO4
; 3 - HCl
б) 1 – K2
SO4
; 2 – HCl; 3 – H2
SO4
в) 1 – HCl; 2 – H2
S; 3 – K2
SO4
г) 1 – K2
SO4
; 2 – H2
SO4
; 3 – HCl
91. Жесткость воды обусловлена содержанием в ней:
а) сульфатов и бикарбонатов кальция и магния;
б) сульфатов кальция и магния;
в) бикарбонатов кальция и магния;
г) сульфатов и бикарбонатов кальция;
92. Земная кора подразделяется на подслои: Это:
а) гранитный, базальтовый, метаморфический;
б) осадочный, гранитный, базальтовый;
в) осадочный, гранитный, метаморфический;
г) осадочный, базальтовый, метаморфический;
93. Естественные минеральные агрегаты, возникающие при
переотложении продуктов выветривания и разрушения горных пород. Это:
а) магматические горные породы;
б) осадочные горные породы;
в) метаморфические горные породы; г) вулканические горные породы;
94. Все элементы земной коры делятся на:
а) литофильные, халькофильные, биофильные;
б) литафильные, атмоильные, биофильные, сидерофильные;
в) литофильные, халькофильные, сидерофильные, атмофильные, биофильные
;
г) литофильные, сидерофильные, атмофильные;
95. Растворимые элементы, жизненно необходимые организмам, называются:
а) макробиогенными; в) микробиогенными;
б) биогенными;
г) биохимическими.
96. К невозобновимым энергетическим ресурсам относятся:
а) солнечная энергия, ядерное топливо, водородное топливо;
б) уголь, водородное топливо;
в) энергия фотосинтеза, ветровая энергия, гидроэнергия;
г) природный газ, геотермальная энергия, уголь, нефть;
97. К методам очистки сточных вод от примесей относятся:
а) экстракция, ректификация, адсорбция, флотация;
б) дистилляция, ионный обмен, обратный осмос;
в) электровоздействие, вымораживание;
г) отдувка, нагрев, реагентные воздействия;
98. Метаболические превращения включают процессы:
а) окисление, выделение, горение;
б) окисление, восстановление, выделение;
в) окисление, гидролиз, восстановление;
г) окисление, горение, восстановление;
99. Конъюгация - это:
а) взаимодействие с серной кислотой, аминокислотами;
б) взаимодействие с азотной кислотой;
в) взаимодействие с функциональными группами;
г) взаимодействие с ферментами;
100. В каких формах медь (Си) может содержаться в водной среде: а) взвешенной и растворенной;
б) коллоидной и растворенной;
в) взвешенной и коллоидной;
г) взвешенной, коллоидной и растворенной
[23, 32, 37, 39-40].
Обсуждение результатов. Выводы
В эксперименте участвовали ученики 9 классов, общая выборка которых составляет 66 человек.
В этих классах проводились уроки традиционным методом, в 9 «А» классе, и по методикам, разработанным в данной работе, в 9 «Б» и в 9 «В» классах.
Для выявления результатов исследования проводилось анкетирование, самостоятельные и контрольные работы. Анкеты и тесты содержали вопросы как экологического характера, так и личностного.
Результаты проделанной работы показали, что у группы учеников, которые занимались по разработанной методике, заметно повышает мыслительная способность, создается благоприятная атмосфера для целостного восприятия окружающего мира, самостоятельность в преодолении негативных последствий.
Собранные анкетные данные, результаты контрольных и самостоятельных работ, наблюдения за учащимися дают возможность утверждать что, у 60 % учащихся повышается интерес к самостоятельному познанию предмета.
На диаграмме 1 показан уровень успеваемости и качество знаний учеников в контрольном и экспериментальном классе.
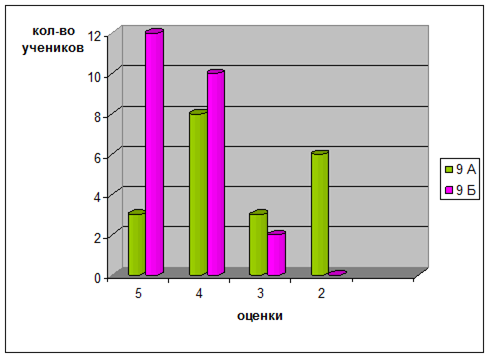
Диаграмма 1. Уровень успеваемости и качество знаний учеников в контрольном и экспериментальном классах
На диаграмме 2 показаны результаты контрольной работы по теме «Охрана атмосферы».
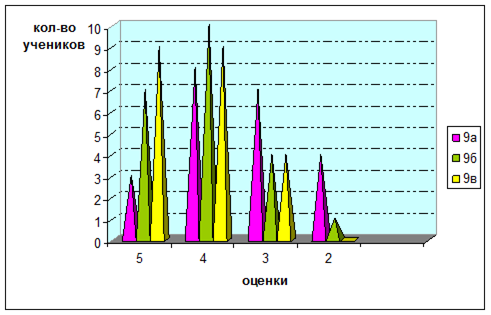
Диаграмма 2. Результаты контрольной работы по теме «Охрана атмосферы»
Таким образом, приведенные нами теоретические и экспериментальные исследования выявили потребность объемного использования самостоятельной работы в изучении экологических аспектов предмета.
Избранная тематика оказалась не только полезной в смысле интеграции и систематизации материала, умений, навыков из различных областей знания, но и способствовала повышению качества знаний, научного и экологического мировоззрения, а главное вызвала интерес учащихся к более глубокому изучению химии и экологии.
На основе проведенной работы можно сделать следующие выводы:
1. Показана возможность организации самостоятельных работ на разных этапах процесса обучения: при подготовке учащихся к восприятию нового материала, а также при совершенствовании знаний и повторений пройденного;
2. Проведена апробация разработанных занятий в МОУ СОШ.
3. Оценен уровень сформированности знаний при изучении тем по разработанным методическим подходам;
4. Доказано, что самостоятельные работы, содержащие конкретный материал, изучаемый школьниками и соответствующий целям и задачам урока, способствует развитию знаний и умений учащихся, постепенному и целенаправленному развитию познавательных потребностей, установки на самостоятельное пополнение знаний.
1. Программно-методические материалы. Химия 8-11 классы. – М.: Дрофа, 2001.
2. Боброва О.В. Организация самостоятельной работы учащихся при изучении нового материала // Химия в школе. – 1996. - №5. – С. 23.
3. Чернобельская Г. М. Методика обучения химии в средней школе: Учеб. для студ. высш. учеб. заведений. - М.: Владос, 2000. – С. 336.
4. Дьякович С.В. Методика факультативных занятий по химии. – М.: Просвещение, 1985. – С. 175.
5. Егорова Н.В. Вопросы экологического образования при изучении – химии // Химия в школе. - 2001. -№5. - С.46.
6. Ефимова Е.В., Чупанова Л.В. и др. Об экологической составляющей химического образования // Химия в школе. - 2003. - №9. - С.25-30.
7. Игнатьева С.Ю. Ролевая игра «Международный конгресс по охране атмосферы». // Химия в школе. – 2004. - №5. – С.22-25.
8. Иодко А.Г., Емельянова Е.О., Волков А.В. Система заданий для развития умения рассуждать // Химия в школе. - 2000. - №7. - С.11.
9. Монахов В.М. Некоторые вопросы построения системы факультативных курсов естественно-математического цикла // Педагогика. – 1977. - №5. – С.25.
10. Монахова В.М., Орлова В.А. Теория и практика проведения факультативных занятий. – М.: Просвещение, 1983. – С. 150.
11. Никитина М.А., Петровичев А.А. и др. интегрированный урок: пресс-конференция о воде и ее свойствах // Химия в школе. – 2005. - №6. – С.36-42.
12.Пидкасистый П.И. Самостоятельная деятельность учащихся. – М.: Педагогика, 1972. – С.200.
13.Скаткина М.Н. Дидактика средней школы. – М.: Просвещение, 1982. – С.180.
14.Соколова О.Е. Технология педагогических мастерских: развитие творческих способностей учащихся // Химия в школе. – 2001. - №7. – С.14-15.
15.Табуева Э.М. Экологическое образование как фактор формирования культурного потенциала личности // Химия в школе. – 2004. - №5. – С.18-19.
16.Шиленков Р.В., Чернобельская Г.М. Развитие самостоятельности учащихся в условиях индивидуализации обучения // Химия в школе. – 2004. - №5. – С.18-19.
17.Эпштейн Д.А. Факультативные занятия по химии. – М.: Просвещение, 1971. – С.175.
18. Т. Н. Кровельщикова, А. В. Коршунов. Из опыта реализации экологического подхода к обучению химии // Химия в школе.- 2002. - № 8. - С. 40-42.
19. H. В. Егорова. Вопросы Экологического образования при изучении химии //Химия в школе. – 2001. - № 5. - С. 46 – 49.
20. Зверев И. Охрана природы и экологическое воспитание школьников. //Воспит. школьников.- 1985.- N6.- С. 30-36.
21. Программы для средних общеобразовательных учебных заведений. Химия. // Под ред. В. И. Сивоглазова. - М.: «Просвещение», 1993.
22. Обучение химии в 11 классе. В 2 ч. Ч 1: Кн. Для учителя // Под ред. И. Н. Черткова. – М.: Просвещение, 1992. – С. 6 – 20.
23. Азотсодержащие органические соединения. // Химия в школе. – 1996. - № 6. - С. 18-22.
24. И. Г. Афонина. Тестовые задания в курсе химии. // Химия в школе. – 2002. - № 7. - С. 43 – 45.
25. Единый государственный экзамен 2002: Контрольные измерительные материалы: Химия // А. А. Каверина, Д. Ю. Добротин, М. Г. Снастина и др.; М-во образования РФ. – М.: Просвещение, 2002. – С. 20-35.
26. Безуевская В. А. Химические задачи с экологическим содержанием //Химия в школе. – 2000. - № 2. - С. 59 – 61.
27. A.B. Краснянский. Экологические проблемы расчетных задачах по химии // Химия в школе. – 1996. - № 6. - С. 22 – 27
28. А. В. Краснянский. Экологические проблемы в расчетных задачах по химии // Химия в школе. – 1996. - № 5. - С. 32 – 37.
29. H. В. Егорова. Наш подход к экологическому образованию учащихся // Химия в школе. – 2002. - № 5. - С. 40 – 43.
30. H. В.Егорова. Вопросы экологического образования при изучении химии // Химия в школе. – 2001. - № 5 - С. 46 – 49.
31. Ф. Г. Фельдман, Г. Е. Рудзитис. Химия, 8 кл. - М.: Просвещение, 1985.
32. Д. М. Кирюшкин, В. С. Полосин. Методика обучения химии. - М.: Просвещение, 1970. - C. 297 – 302.
33. Хомченко Г.П. Химия для поступающих в вузы. - М.: Высшая школа, 1993.
34. Малышкина В. Занимательная химия. – Санкт-Петербург.: “Тригон”, 2001;
35. Книга для чтения по неорганической химии. Сост. В.А. Крицман. - М.: Просвещение, 1984;
36. Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения. – М.: Химия, 1995.
37. Я иду на урок Химии. Книга для учителя. – М.: Первое сентября, 2000.
38. Кузьменко Н. Е., Еремин В. В. Химия. 2400 задач для школьников и поступающих в вузы.- М.: Дрофа, 1999;
39. И. Г. Афонина. Тестовые задания в курсе химии. // Химия в школе. -2002. - № 7. - С. 43 – 45.
40. Химия: Сборник тестовых заданий для подготовки к итоговой аттестации (варианты и ответы, решение расчетных задач). 9 класс (базовый уровень) / Н.В. Ширшина. – Волгоград.: Учитель, 2004. – С.81.
|