Реферат по химии ученика 11 класса средней шк.№ 653 Николаева Алексея
В качестве классификационных признаков могут быть выбраны следующие:
1. Число и состав исходных веществ и продуктов реакции.
2. Агрегатное состояние реагентов и продуктов реакции.
3. Число фаз, в которых находятся участники реакции.
4. Природа переносимых частиц.
5. Возможность протекания реакции в прямом и обратном направлении.
6. Тепловой эффект.
7. Явление катализа.
Классификация по числу и составу исходных веществ и продуктов реакции.
Реакции соединения.
При реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава:
A + B + C = D
Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений.
Неорганическая химия.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности:
СаСО3
+ СО2
+ Н2
О = Са(НСО3
)2
,
так и относиться к числу окислительно-восстановительных:
2FеСl2
+ Сl2
= 2FеСl3
.
Органическая химия.
В органической химии такие реакции часто называют реакциями присоединения. В них обычно участвуют соединения, содержащие двойную или тройную связь. Разновидности реакций присоединения: гидрирование, гидратация, гидрогалогенирование, полимеризация. Примеры данных реакций:
to
Н2
С = СН2
+ Н2
→ CН3
– СН3
этилен этан
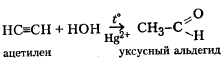
to
HC=CH + HCl → H2
C=CHCl
ацетилен хлорвинил
to
n СН2
=СН2
→ (-СН2
-СН2
-)n
этилен полиэтилен
Реакции разложения.
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества.
Неорганическая химия.
Из реакций разложения, протекающих без изменения валентных состояний, следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
| to
|
| CuSO4
5H2
O |
= |
CuSO4
+ 5H2
O |
| to
|
| H2
SiO3
|
= |
SiO2
+ H2
O. |
К реакциям разложения окислительно-восстановительного характера относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления:
| to
|
| 4HNO3
|
= |
2H2
O + 4NO2
O + O2
O. |
2AgNO3
= 2Ag + 2NO2
+ O2
,
Реклама

(NH4
)2Cr2
O7
= Cr2
O3
+ N2
+ 4H2
O.
Органическая химия.
В органической химии к реакциям разложения относятся: дегидратация, дегидрирование» крекинг, дегидрогалогенирование, а также реакции деполимеризации, когда из полимера образуется исходный мономер. Соответствующие уравнения реакций:
to
С2
Н5
ОН → C2
H4
+ Н2
O
to
С6
Н14
→ С6
Н6
+ 4Н2
гексан бензол
C8
H18
→ C4
H10
+ C4
H8
Октан бутан бутен
C2
H5Br → C2
H4
+ НВг
бромэтан этилен
(-СН2
– СН = С - СН2
-)n → n СН2
= СН – С = СН2
\СНз \ СНз
природный каучук 2-метилбутадиен-1,3
Реакции замещения.
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С.
Неорганическая химия.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe2
O3
= 2Fе + Аl2
О3
Zn + 2НСl = ZnСl2
+ Н2
2КВr + Сl2
= 2КСl + Вr2
2КСlO3
+ l2
= 2KlO3
+ Сl2
.
Примеры реакций замещения, не сопровождающихся изменением валентных состояний атомов, крайне немногочисленны. Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие ангидриды:
СаСО3
+ SiO2
= СаSiO3
+ СО2
Са3
(РО4
)2
+ ЗSiO2
= ЗСаSiO3
+ Р2
О5
Органическая химия.
В органической химии реакции замещения понимаются шире, то есть замещать может не один атом, а группа атомов или замещается не атом, а группа атомов. К разновидности реакции замещения можно отнести нитрование и галогенирование предельных углеводородов, ароматических соединений и спиртов:
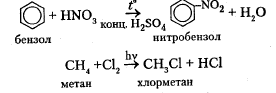
C6
H6
+ Br2
→ C6
H5
Br + HBr
бензол бромбензол
C2
H5
OH + HCl → C2
H5
Cl + H2
O
этанол хлорэтан
Реакции обмена.
Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Неорганическая химия
Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами - оксидами, основаниями, кислотами и солями:
ZnO + Н2
SО4
= ZnSО4
+ Н2
О
AgNО3
+ КВr = АgВr + КNО3
СrСl3
+ ЗNаОН = Сr(ОН)3
+ ЗNаСl.
Частный случай этих реакций обмена - реакции нейтрализации:
НСl + КОН = КСl + Н2
О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:
Реклама

NаНСО3
+ НСl = NаСl + Н2
О + СО2
↑
Са(НСО3
)2
+ Са(ОН)2
= 2СаСО3
↓ + 2Н2
О
Органическая химия
НСООН + NaOH → HCOONa + Н2
O
муравьиная кислота формиат натрия
реакции гидролиза:
Na2
CO3 + Н2
О  NaHCO3
+ NaOH NaHCO3
+ NaOH
карбонат натрия гидрокарбонат натрия
СО3
+ Н2
О  НСО3
+ ОН НСО3
+ ОН
реакции этерификации:
CH3
COOH + C2
H5
OH 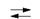 CH3
COOC2
H5
+ H2
O CH3
COOC2
H5
+ H2
O
уксусная этанол этиловый эфир уксусной кислоты
Агрегатное состояние реагентов и продуктов реакции.
Газовые реакции
| to
|
| H2
+ Cl2
|
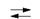 |
2HCl. |
Реакции в растворах
NaОН(рр) + НСl(p-p) = NaСl(p-p) + Н2
О(ж)
Реакции между твердыми веществами
| to
|
| СаО(тв) +SiO2
(тв) |
= |
СаSiO3
(тв) |
Число фаз, в которых находятся участники реакции.
Под фазой понимают совокупность однородных частей системы с одинаковыми физическими и химическими свойствами и отделенных друг от друга поверхностью раздела.
Гомогенные (однофазные) реакции.
К ним относят реакции, протекающие в газовой фазе, и целый ряд реакций, протекающих в растворах.
Гетерогенные (многофазные) реакции.
К ним относят реакции, в которых реагенты и продукты реакции находятся в разных фазах. Например:
газожидкофазные реакции
CO2
(г) + NaOH(p-p) = NaHCO3
(p-p).
газотвердофазные реакции
СO2
(г) + СаО(тв) = СаСO3
(тв).
жидкотвердофазные реакции
Na2
SO4
(рр) + ВаСl3
(рр) = ВаSО4
(тв)↓ + 2NaСl(p-p).
жидкогазотвердофазные реакции
Са(НСО3
)2
(рр) + Н2
SО4
(рр) = СО2
(r)↑ +Н2
О(ж) + СаSО4
(тв)↓.
Природа переносимых частиц.
Протолитические реакции.
К протолитическим реакциям относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим.
В основе этой классификации лежит протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое вещество, отдающее протон, а основанием - вещество, способное присоединять протон, например:
| CH3
COOH |
+H2
O= |
CH3
COO-
+ |
H3
O+
|
| кислотаI |
основаниеI |
основаниеI |
кислотаII |
| NH3
+ |
H2
O= |
NH4
+
+ |
OH-
|
| основаниеI |
кислотаII |
кислотаII |
основаниеII |
К протолитическим реакциям относят реакции нейтрализации и гидролиза.
Окислительно-восстановительные реакции.
Все химические реакции подразделяются на такие, в которых степени окисления не изменяются (например, реакция обмена) и на такие, в которых происходит изменение степеней окисления. Их называют окислительно-восстановительными реакциями. Ими могут быть реакции разложения, соединения, замещения и другие более сложные реакции. Например:
Zn + 2H+
→ Zn2
+
+ H2
↑
FeS2
+ 8HNO3
(конц) = Fe(NO3
)3
+ 5NO↑ + 2H2
SO4
+ 2H2
O
Подавляющее большинство химических реакций относятся к окислительно-восстановительным, они играют исключительно важную роль.
Лиганднообменные реакции.
К таковым относят реакции, в ходе которых происходит перенос электронной пары с образованием ковалентной связи по донорноакцепторному механизму. Например:
Cu(NO3
)2
+ 4NH3
= [Cu(NH3
)4
](NO3
)2
Fe + 5CO = [Fe(CO)5
]
Al(OH)3
+ NaOH = [NaAl(OH)4
]
Характерной особенностью лиганднообменных реакций является то, что образование новых соединений, называемых комплексными, происходит без изменения степени окисления.
Возможность протекания реакции в прямом и обратном направлении.
Необратимые реакции.
Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании:
2КСlО3
→ 2КСl + ЗО2
↑,
или окисление глюкозы кислородом воздуха:
С6
Н12
О6
+ 6О2
→ 6СО2
+ 6Н2
О
Обратимые реакции.
Обратимыми называют такие химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ.
Для обратимых реакций уравнение принято записывать следующим образом:
А + В 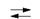 АВ. АВ.
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция, например:
СН3
СООН + С2
Н5
ОН 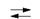 СН3
СООС2
Н5
+ Н2
О. СН3
СООС2
Н5
+ Н2
О.
2SO2
+O2
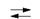 2SO3
+ Q 2SO3
+ Q
Следовательно, данные реакции не идут до конца, потому, что одновременно происходят две реакции — прямая (между исходными веществами) и обратная (разложение продукта реакции).
Классификация по тепловому эффекту.
Количество теплоты, которое выделяется или поглощается в результате реакции, называется тепловым эффектом данной реакции. По тепловому эффекту реакции делят:
Экзотермические.
Протекают с выделением тепла
СН4
+ 2O2
→ СО2
+ 2Н2
O + Q
Н2
+ Cl2
→ 2HCl + Q
Эндотермические.
Протекают с поглощением тепла
N2
+ О2
→ 2NO-Q
2Н2
O → 2Н2
+ O2
- Q
Классификация с учетом явления катализа.
Каталитические.
К ним относятся все процессы с участием катализаторов.
кат.
2SO2
+ O2
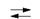 2SO3 2SO3
Некаталитические.
К ним относятся любые мгновенно протекающие реакции в растворах
BaCl2
+ H2
SO4
= 2HCl + BaSO4
↓
Список литературы
Ресурсы Интернет:
http://chem.km.ru – «Мир Химии»
http://chemi.org.ru – «Пособие для абитуриентов. Химия»
http://hemi.wallst.ru – «Альтернативный учебник по химии для 8-11 классов»
«Руководство по химии. Поступающим в ВУЗы» - Э.Т. Оганесян, М. 1991г.
Большой Энциклопедический Словарь. Химия» - М. 1998г.
|