Введение. 2
1. Свойства о-хлорстирола. 3
2. Стадии синтеза о-хлорстирола: 6
3. Установки для проведения синтеза о-хлорстирола и его промежуточных продуктов. 11
4. Очистка и идентификация полученного вещества. 17
5. Техника безопасности при получении и хранении о-хлорстирола. 19
Выводы. 22
Список использованной литературы. 23
Введение.
В настоящее время существующие в различных химических производствах, антикоррозионной технике, машиностроении, авиастроении и других отраслях промышленности прокладочно-уплотнительные, конструкционные и защитные коррозионно-, озоно-, и термостойкие резины, пластмассы, парониты, эбониты, асборезины, пентапласты и т.п. материалы уже не отвечают возросшим требованиям промышленности.
Эти материалы обладают низкой коррозионной и термической стойкостью, быстро набухают и разрушаются а агрессивных средах, загрязняют эти среды, меняют их цвет и рассчитаны на длительную эксплуатацию не выше 70 – 90°С, в то время как многие современные химические процессы уже проводятся при 100 – 200°С и выше.
Поэтому одним из заданий химической промышленности и науки было создание новых коррозионностойких материалов. Эти материалы получают сополимеризацией этилена или пропилена с бромированными и хлорированными производными бензола. Поэтому и вызывает интерес методика получения о-хлорстирола, который может быть использован к качестве сополимера для производства таких коррозионностойких материалов. О-хлорстирол также находит применение как растворитель органических веществ, красок и лаков.
Главной задачей данной работы будет рассмотреть процесс получения о-хлорстирола из наиболее легкодоступного на данный момент сырья - природного газа (метана). В работе мы рассмотрим последовательность химического синтеза данного вещества, условия его получения.
Свойствао-хлорстирола.
О-хлорстирол является производным ароматических веществ. В соей молекуле он содержит бензольное кольцо. К бензольному кольцу присоединен атом хлора в ортоположение.
О-хлорсирол также называют: 2-хлорстирол, 2- хлорвинилбензол.
Химическая формула вещества: C8
H7
Cl
Молекулярная масса: 138.6
Структурная формула вещества приведена ниже:
Реклама

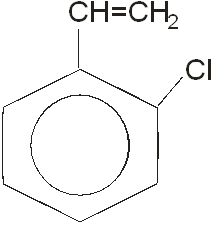
По физическим свойствам о-хлорстирол – это желтая жидкость, довольно вязкая, с резким неприятным запахом. При сгорании образует токсичные газы , включая хлористый водород, фосген. Вещество при определенных условиях образует перекиси, приводящие к началу взрывной полимеризации. Вещество может полимеризоваться.
Рассмотрим физические свойства о-хлорстирола.
Таб.1. физические свойства о-хлорстирола.
| Свойства |
Величина |
| Температура кипения |
188.7°C |
| Температура плавления |
-63.2°C |
| Относительная плотность (вода = 1) |
1.1 |
| Растворимость в воде |
очень плохая |
| Давление паров, кПа при 25°C |
0.13 |
| Относительная плотность пара (воздух = 1) |
4.8 |
| Относительная плотность смеси пар/воздух при 20°C (воздух = 1) |
1.01 |
| Температура вспышки |
58°C |
Мы рассмотрели основные физические свойства о-хлорстирола. Коснемся также его основных химических свойств. Его химические свойства обусловлены наличием в молекуле о-хлорстирола ароматического ядра и ненасыщенной группы. Как представитель ароматических соединений о-хлорстирол будет вступать во все реакции присущие ароматическим соединениям. Он будет реагировать с водородом, галогенами, галогеноводородами с получением циклических насыщенных соединений.
С водородом о-хлорстирол реагирует, вступая в еракцию присоединения водорода:
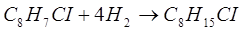
Но в молекуле о-хлорстирола есть также ненасыщенная группа, которая является высокореакционной и может вступать в реакции окисления до галогенокислот, вступать в реакции присоединения водорода, галогенов и галогеноводородов, но такая реакция будет конкурировать с реакцией присоединения водорода бензольным ядром. Реакция окисления легко проходит при действии окислителей:
 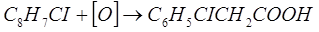
Также возможна полимеризация о-хлорстирола:
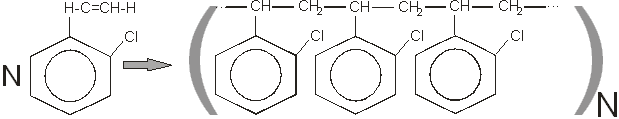
В результате реакции мы получим полихлорстирол. Как полимер он не имеет большого значения и используется только как сополимердля получения бутадиенхлорстирольных и других каучуков.
Синтез о-хлорстирола состоит из нескольких последовательных стадий, в процессе синтеза мы получим ацетилен, бензол, стирол и другие органические вещества. Сам процесс синтеза схематически изображен на рисунке (рис. 1).
 рис. 1. рис. 1.
Как видно из рисунка 1 синтез о-хлорстирола включат в себя такие последовательные синтезы:
а. Синтез ацетилена из метана;
б. Синтез бензола из ацетилена;
в. Синтез этилбензола из бензола и этилена;
г. Синтез стирола из этилбензола;
д. Синтез о-хлорстирола.
Этапы г) и д) могут быть различными для разных видов производств, их можно менять в зависимости от условий.
В дальнейшем мы рассмотрим последовательно каждый из указанных процессов, условия его проведения, используемые катализаторы, температуры реакции.
а) синтез ацетилена из метана, его условия;
Наиболее распространенным видом углеводородного сырья есть природный газ, который на 95 – 98 % состоит из метана. Современная органическая химия должна выходить из того, что в будущем именно природный газ (метан) станет основным сырьем для органического синтеза.
Реклама

Уже сейчас широко применяются методы получения ацетилена из природного газа – метана. Для этого применяют электрокрекинг, который проходит по уравнению:
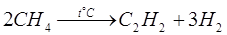
Струю метана пропускают между электродами при температуре 1600° С и быстро охлаждают, чтобы предотвратить разложение ацетилена. Также разработан термоокислительный крекинг (неполное окисление метана кислородом воздуха)
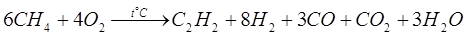
В реакции используют теплоту частичного сгорания ацетилена. Но в данной реакции мы получаем больше продуктов и выделение ацетилена из них более сложно, чем в случае электрокрекинга.
б) синтез бензола;
ацетилен при температуре красного каления вступает в реакцию тримеризации и в результате мы получим бензол. Эту реакцию открил еще в ХІХвеке М. Бертло.
Н. Д. Зелинский и Б. А. Казанский показали, что Даная реакция значительно лучше проходит при более низких температурах и каталитическом воздействии активированного угля:

Даная реакция получения бензола еще не имеет большого распространения из-за существования более дешевых методов получения его, например из отходов коксирования угля и нефтепеработки.
в) синтез этилена из ацетилена;
Для получения стирола необходим этилен, который можно довольно легко получить, выходя из ацетилена и водорода. Ацетилен как ненасыщенный углеводород легко вступает в реакцию присоединения водорода. Реакция каталитическая, катализатором может быть платина или свинец. При использовании платины и большом количестве водорода в смеси, возможно, получение не только этилена, но и этана, тогда как при применении свинцового катализатора реакция будет продолжаться только до получения этилена.
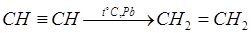
Реакция проводится при температуре около 300°С.
г) синтез стирола из бензола и этилена;
Рассмотрим процесс синтеза этилбензола из бензола. Продуктами этого синтеза будут бензол и этилен, получение которых мы рассмотрели выше. Реакция проходит за уравнением:
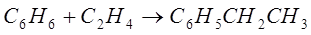
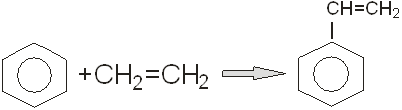
Синтез этилбензола алкилированием бензола этиленом осуществляют, применяя катализаторы на основе хлорида алюминия, фторида бора, фосфорной кислоты или цеолитов. Использование низких концентраций катализатора позволяет проводить процесс в жидкой фазе (катализатор суспензирован или растворен). Процесс проводят при 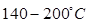 и давлении 0,3-1,0 МПа. В оптимальных условиях проведения процесса селективность получения этилбензола 99%. При проведении процесса очень важно не допускать избытка этилена в реакторе, так как это приводит к образованию диэтил- и полиэтилбензолов. Расход АІСІ3
составляет 0,25 г на тонну этилбензола. Алкилирование бензола олефинами – типичная реакция электрофильного замещения.
и давлении 0,3-1,0 МПа. В оптимальных условиях проведения процесса селективность получения этилбензола 99%. При проведении процесса очень важно не допускать избытка этилена в реакторе, так как это приводит к образованию диэтил- и полиэтилбензолов. Расход АІСІ3
составляет 0,25 г на тонну этилбензола. Алкилирование бензола олефинами – типичная реакция электрофильного замещения.
В современной химической технологии используют также процесс производства стирола выходя из пропилена и этилбензола:
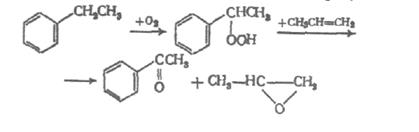
В результате этой реакции кроме стирола получают и довольно ценный оксид пропилена, который используют в других химических производствах. Рассматриваются также и возможности получения стирола в одностадийном процессе путем окислительного алкилирования бензола в присутствии ацетата палладия при 80°С и давлении 2,15 МПа:
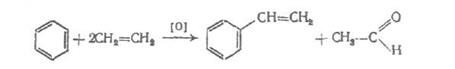
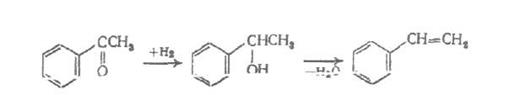
д) синтез стирола из этилбензола.
Для получения стирола проводят дегидратацию этилбензола. Она проходит согласно уравнения реакции:
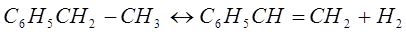

Процесс проводят в присутствии катализатора. Наибольшее применение нашли катализаторы на основе оксида железа. Оптимальная температура при работе на этих катализаторах - 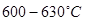 , равновесный выход стирола не превышает 40-50 %. Для более полного превращения этилбензола в стирол понижают парциальное давление паров этилбензола, разбавляя его водяным паром (массовое отношение водяной пар : этилбензол 2,5 – 3 : 1).
, равновесный выход стирола не превышает 40-50 %. Для более полного превращения этилбензола в стирол понижают парциальное давление паров этилбензола, разбавляя его водяным паром (массовое отношение водяной пар : этилбензол 2,5 – 3 : 1).
е) хлорирование стирола.
Группу –СН=СН2
в молекуле стирола можно отнести к заместителям первого рода. Они имеют электронодонорные свойства.
При хлорировании стирола в отсутствии катализаторов галоген присоединится к боковой цепи согласно правила Бельштейна.
Если надо ввести галоген в ароматическое ядро, то используют катализаторы. Катализаторами выступают: FeCl3
, AlCl3
, SbCl3
, SbCl5
. роль катализатора заключается в создании положительного иона галогена, который осуществляет электрофильное замещение в бензольном ядре. В присутствии FeCl3
хлорирование идет по схеме:
FeCl3
+ СІ2
= 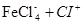
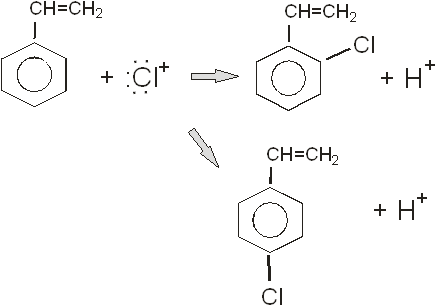
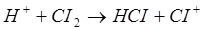
В данной реакции мы получим не только о-хлорстирол, но и п-хлорстирол, который изомерен первому. Выход данных продуктов реакции будет равен между собой и составит 50%.
Рассмотрим процесс алкилирования бензола и получение этилбензола.
Рис. 2. Принципиальная схем алкилирования бензола на твердых катализаторах:
1 - теплообменник;
2 - реактор;
3 - холодильник;
4 - газосепаратор;
5, 6, 7 - ректификаторы,
а - бензол;
б - оборотный бензол;
в - олефин;
г -смесь бензола и олефина;
д - неконденсирующиесягазы;
в - жидкий алкилат;
ж - моноалкилбензол;
з - диалкилбензолы;
и - кубовый остаток.
Технологическая схема алкилирования бензола на твердом гетерогенном катализаторе, например цеолите, довольно несложна (рис. 2) [4, 5]. По этой схеме непрореагировавшие бензол и диэтилбензол возвращаются на алкилирование, а кубовый остаток может служить топливом и вместе с отходящими газами обеспечивает потребности установки в топливе (на 60%). В процессе отсутствуют отходы, катализатор не вызывает коррозии и не загрязняет окружающей среды.
Однако, пока что во всем мире наиболее широко в качестве катализаторов применяют комплексные соединения хлорида алюминия с ароматическими углеводородами, несмотря на такие их существенные недостатки, как необходимость осушки сырья, образование хлористого водорода и хлорида натрия при промывке и нейтрализации алкилата, коррозия аппаратуры и необходимость очистки сточных вод. Использование в большей мере хлорида алюминия вызвано и тем, что он является катализатором не только алкилирования, но и диспропорционирования, что снижает выход неизбежно образующихся при алкилировании ди- и полиалкилпроизводных. На практике используют жидкий катализаторный комплекс – хлорид алюминия в диэтилбензоле или в полиалкилбензольных фракциях, получаемых при алкилировании. Действие хлорида алюминия усиливается сокатализаторами, в качестве которых используют хлороводород или небольшие количества воды. Однако, чтобы избежать разложения катализатора, бензол тщательно сушат перед подачей на алкилирование.
Принципиальная схема процесса с использование катализаторных комплексов приведена на рисунке 3.
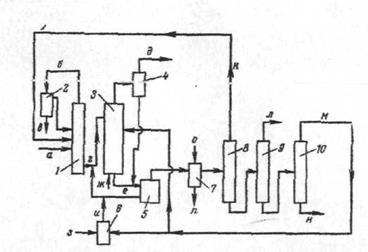
Рис. 3. Принципиальная схема получения этилбензола при использовании катализаторного комплекса.
1 – колонна обезвоживания,
2 - сепаратор,
3 - реактор;
4 – газосепаратор,
5 - сепаратор для отделения катализаторного комплекса;
6 - блок приготовления свежего катализаторного комплекса;
7 - система промывки алкилата;
8, 9,10 - ректификационные агрегаты;
а - исходный бензол;
б - азеотропная смесь вода + бензол;
в - вода;
г - обезвоженный бензол;
д -газы;
е - циркулирующий катализаторный комплекс;
ж - этилен;
з - хлорид алюминия;
и - свежий катализаторный комплекс;
к - оборотный бензол;
л - этилбензол;
м - диэтилбензол;
н - кубовый остаток;
о - вода на промывку;
п - сточные воды.
При получении этилбензола алкилирование ведут с избытком бензола (200 – 300% от стехиометрического), чтобы уменьшить образование ди- и полиалкилбензолов. И все же содержание последних оказывается значительным. Диалкилпроизводные подвергаются переалкилированию в реакторе алкилирования. Но можно непосредственно использовать их в качестве товарных продуктов.
В процессе алкилирования бензола с хлоридом алюминия циркулируют значительные объемы жидкого катализаторного комплекса. Причем в реакционной массе две жидкие фазы: катализаторный комплекс и смесь бензола и алкилбензолов. В результате возможность подъема температуры процесса ограничена, так как при температурах выше 130 °С комплекс дезактивируется и разрушается (3, 6).
Более интересно гомогенное алкилирование в присутствии хлорида алюминия. В этом случае количество катализатора определяется его растворимостью в бензоле, а давление процесса подирается таким, чтобы олефин находился в жидкой фазе.
Реактор работает в адиабатическом режиме, и на выходе из него температура достигает 200 °С. При этом резко уменьшился выход побочных продуктов, а выход этилбензола стал близок к количественному.
По такой технологии работает установка мощностью 760 тыс. т/год. Ее особенностью является высокий выход продуктов алкилирования (99%) и более низкие удельные затраты хлорида алюминия (в два раза) по сравнению с обычным процессом. В схеме отсутствует рецикл катализатора. Последний выделяется при нейтрализации в виде гидроксида алюминия и используется на установках очистки сточных вод в качестве осадителя. Большая единичная мощность установки в сочетании с высокой температурой в реакторе создает благоприятные условия для утилизации тепла реакции, в результате 90% потребности в тепловой энергии установка покрывает за счет использования названного тепла.
Рассмотрим технологическую схему получения стирола.
Ряс. 2. Принципиальная схеме получения стирола:
1 – контактный аппарат;
2 – теплообменник;
3 – подогреватель;
4 – холодильник;
5 – газосепаратор;
6 сепаратор воды;
7 – смеситель;
8, 9, 10 – ректификационные агрегаты;
а – бензол;
б –. водяной пер;
в – водородсодержащие газы;
г – вода;
д – ингибитор;
е – оборотный бензол;
ж – «печное масло»;
л – стирол-сырец;
ы – товарный стирол;
к – кубовый остаток.
Этилбензольная шихта подогревается в теплообменнике до 70-95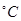 за счет теплоты химически загрязненного конденсата и подается в испаритель вместе с небольшим количеством водяного пара. Из испарителя пары шихты с температурой 160
за счет теплоты химически загрязненного конденсата и подается в испаритель вместе с небольшим количеством водяного пара. Из испарителя пары шихты с температурой 160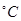 поступают в перегреватель, где перегреваются до 500-550
поступают в перегреватель, где перегреваются до 500-550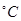 за счет теплоты перегретого водяного пара, выходящего из межступенчатого подогревателя реактора. Из перегревателя пары шихты направляются на дегидрирование в реактор. Теплота, необходимая для реакции, подводиться с водяным паром, перегретым в печи до 700-750
за счет теплоты перегретого водяного пара, выходящего из межступенчатого подогревателя реактора. Из перегревателя пары шихты направляются на дегидрирование в реактор. Теплота, необходимая для реакции, подводиться с водяным паром, перегретым в печи до 700-750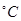 .
.
Пароэтилбензольная смесь на входе в реактор имеет температуру 560-630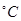 . За счет эндотермической реакции после первого реактора температура контактного газа снижается до 570
. За счет эндотермической реакции после первого реактора температура контактного газа снижается до 570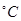 . Контактный газ из реактора поступает в межступенчатый подогреватель, где подогревается до 580-630
. Контактный газ из реактора поступает в межступенчатый подогреватель, где подогревается до 580-630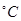 , и затем направляется во второй реактор. Контактный газ из реактора с температурой 570
, и затем направляется во второй реактор. Контактный газ из реактора с температурой 570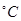 поступает в котел-утилизатор. Охлажденный до 180-200
поступает в котел-утилизатор. Охлажденный до 180-200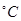 контактный газ из котла-утилизатора направляется в пенный аппарат, где происходит дальнейшее охлаждение контактного газа и отмывка его от механических примесей.
контактный газ из котла-утилизатора направляется в пенный аппарат, где происходит дальнейшее охлаждение контактного газа и отмывка его от механических примесей.
Охлажденный контактный газ поступает на конденсацию. Конденсация осуществляется последовательно в нескольких конденсаторах. Полученные конденсаты стекают в отстойную емкость, где происходит расслаивание на водный и углеводородные слои. Верхний углеводородный слой, называемый печным маслом, самотеком поступает в сборник, где заправляется ингибитором гидрохиноном, и направляется на ректификацию. Нижний водный слой – химически загрязненный конденсат – собирается в емкость и насосом подается на отмывку контактного газа в пенный аппарат, откуда конденсат после охлаждения в теплообменнике направляется на очистку от механических примесей. Несконденсировавшийся газ после конденсаторов компримируется и поступает в линию топливного газа.
Основным процессом получения стирола в промышленности остается каталитическое дегидрирование. Увеличению равновесного выхода стирола благоприятствует повышение температуры и понижение давления. Поэтому дегидрирование ведут при температуре около 600°С, используя разрежение или подачу острого пара. Выход стирола за проход составляет 25–35%. Катализатором служат смеси оксидов железа и хрома, продотированные, например, карбонатом калия. Ректификация стирола-сырца проводится в вакууме при добавлении ингибиторов полимеризации. Принципиальная схема процесса представлена на рис. 2. Сравнительно небольшая разница температур кипения стирола и этилбензола требует применения высокоэффективных ректификационных колонн.
Лучшие современные предприятия по производству стирола характеризуются следующими расходными показателями на 1 т стирола:
Этилен, т .... 0,307
Бензол, т........ 0,820
Пар (Р=О,53 МПа) . .1,70
Электроэнергия, кВт-ч 65
Топливо, ГДж . . .6,35
Перспективным методом производства стирола является окислительное дегидрирование этилбензола диоксидом серы – необратимый процесс, малочувствительный к примесям, содержащимся в этилбензоле, и позволяющий получить стирол с высоким выходом. Перспективен и процесс сопряженного окислительного дегидрирования, по которому получают стирол и оксид пропилена [ 4, с. 206 –207]. По этой технологии сооружен ряд крупных производств, в частности в Нидерландах.
Очисткаиидентификацияполученноговещества.
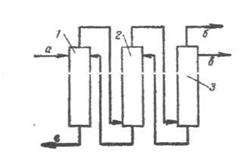 В промышленности для выделения о-хлорстирола из смеси изомеров (п-хлорстирол) используют ректификационные колонны (рис. 2) с большим числом тарелок: 300 – 450. В промышленности для выделения о-хлорстирола из смеси изомеров (п-хлорстирол) используют ректификационные колонны (рис. 2) с большим числом тарелок: 300 – 450.
Рис. 2.
На рисунке приведена схема очистки и выделения о-хлорстирола из смеси изомеров.
1, 2, 3 – ректификационные колонны,
а) сырье на разделение.
б) головная фракция,
в) о-хлорстирол.
г) другие продукты.
Ректификацию проводят на трех последовательно расположенных колоннах с числом тарелок в каждой 130 – 150. Капитальные затраты по сравнению с работой на одной колонне аналогичной суммарной эффективности безусловно выше, но эксплуатационные расходы ниже.
Кратность орошения при выделении о-хлорстирола составляет 60 – 100, отбор от потенциала находится на уровне 70 – 90%.
Полученный о-хлорстирол можно идентифицировать по продуктам сгорания, среди которых должен находится хлороводород, а также по реакциям присущим стиролу, то есть окислению, присоединению водорода и галогенов в боковую цепь.
При получении о-хлорстирола используют многие органические вещества, многие из которых сильно токсичны (бензол) или огнеопасны, например, метан, этилен. Также используются высокие давления и температуры в химических реакторах. Поэтому надо соблюдать все необходимые по меры безопасности, рабочие должны пройти необходимый инструктаж и иметь необходимые допуски к работе с высокими давлениями и токсичными и легкогорючими веществами.
О-хлорстирол является органическим веществом и производным бензола. Поэтому он, как и другие органические вещества горюч. При горении выделяют раздражающие или токсичные пары (или газы). Поэтому важно не допускать открытого огня и искр. Тушить горящий о-хлорстирол можно порошком, разбрызгиванием воды, пеной, двуокисью углерода.
При температуре выше 58°C могут образоваться взрывоопасныe смеси состоящие из паров о-хлорстирола и воздуха.
В случае пожара надо сохранять бочки с веществом охлажденными, обливая их водой или пенными растворами.
При температурах выше 58° C применять закрытую систему вентиляции, защищенное от взрыва электрооборудование.
О-хлорстирол является умеренно токсичным, поэтому при работе с ним надо соблюдать осторожность, не допускать попадания капель вещества на незащищенные участки кожи. Следует также соблюдать осторожность и не допускать вдыхания паров вещества.
Для рабочих зон химических предприятий приняты следующие нормативы содержания 0-хлорстирола в воздухе:
TLV(предельная пороговая концентрация, США) : 50 ppm
TWA (среднесменная концентрация, США); 75 ppm
Российские нормативы: максимально разовая ПДК в воздухе рабочей зоны 50мг/м3. Класс опасности: 4
Согласно полученным данным вещество может всасываться в организм при вдыхании паров. Опасное загрязнение воздуха будет достигаться довольно медленно при испарении этого вещества при 20°C. При кратковременном воздействии на организм вещество раздражает глаза и кожу.
Ароматические углеводные токсичны, имеют наркотическое действие, но некоторые могут вызвать возбуждение, судороги. Поступают в организм преимущественно через легкие, на слизистую оболочку и кожу действуют раздражающе. Высокие концентрации ароматических углеводородов, в частности, бензола, могут вызвать потерю сознания, и даже смерть на протяжении нескольких минут. При отравлении высокими концентрациями бензола слизистые оболочки становятся вишнево-красного цвета, а лицо –земленисто-синюшнього цвета. Меньшие концентрации вызывают возбуждение, галлюцинации, а потом сонливость, общую слабость, дурноту, рвоту, потерю сознания. Появляются подергивания, которые переходят в судороги. Повреждаются кроветворные органы.
Вдыхание паров о-хлорстирола приводит к головокружению, чувству слабости, жалобам на головной боль, потере сознания, синюшности лица, возможны перебои в работе сердца. При отравлении необходимо вывести пострадавшего на чистый воздух или в хорошо вентилируемое помещение. Вызвать медицинскую помощь. В случае ослабления или остановки дыхания– искусственная вентиляция легких, покой, согревание тела, горчичники на руки и ноги, оксигенотерапия. Внутривенно вводят глюкозу (30 – 40 мл 40 % раствора), проводят витаминотерапию (цианокобаламин - до 1000 мкг, 5 % раствор тиамина хлорида и пиридоксин гидрохлорида – до 3 мл внутривенно. При возбуждении назначают успокоительные средства, а также средства, которые нормализуют дыхание и деятельность сердечно-сосудистой системы. При отравлении через рот промывают желудок, дают адсорбенты (активированный уголь), солевое слабительное. Рвотные средства противопоказаны.
Для недопущения отравлений использовать средства защиты органов дыхания, респираторы и противогазы. При больших концентрациях – противогазс принудительной подачей воздуха. При небольших концентрациях– противогаз марки А или М. Спецодежа хлопчатобумажная с хлорвиниловым покрытием. При работе использовать безискровой инструмент и такие же фонари.
При попадании о-хлорстирола на открытую кожу наступает покраснение последней. Для лечения и профилактики дальнейшего отравления пораженные участки промыть теплой водой с мылом. Для профилактики использовать в работе с веществом защитную одежду или хотя бы защитные перчатки и очки, особо следует опасаться попадания вещества на слизистые оболочки глаз и ротовой полости. Для лечения используется промывание большим количеством воды в течение нескольких минут (снять контактные линзы, если это не трудно), затем доставить к врачу.
Хранение вещества допускается только в защищенном от огня месте. Хранить в хорошо проветриваемом помещении. На холоде. Хранение допускается только в стабилизированном состоянии.
При ликвидации утечек надо немедленно удалить все источники огня. В помещении создать хорошо вентилированную атмосферу и не допускать возникновения опасных концентраций 0-хлорстирола. Поскольку это может привести в возможности взрыва паро – воздушной смеси. Собрать подтекающую жидкость в герметичные контейнеры. Засыпать оставшуюся жидкость песком или инертным абсорбентом, собрать и удалить его в безопасное место. При работе необходимо использовать дополнительную личную защиту: фильтрующий респиратор для органических газов и паров, а также спецодежду.
Выводы.
В работе было детально рассмотрено производство такого вещества как о-хлорстирол из метана. Мы рассмотрели основные этапы его получения, особенности производства и технологические схемы.
Как видно получение о-хлорстирола из метана – это довольно сложный и многостадийный химический процесс. И надо отметить что в наше время бензол чаще получают не из метана, а из каменноугольной смолы при коксировании угля или из продуктов каталитического риформинга нефти при ее переработке. Получение бензола из метана возможно и в некоторых странах (США, Германия) существуют опытные установки по его получению, но они не настолько экономически выгодны для массового использования. Пока что бензола и его производных для промышленного использования хватает и при использовании старых методов получения.
Возрастание производства пластиков, синтетических волокон и каучуков (особенно с улучшенными свойствами, кислотоустойчивых материалов для химической промышленности) в будущем может привести к необходимости расширить сырьевую базу для получения бензола, тогда-то производство последнего из метана природного газа и станет востребованным. Тогда – то и будет практически осуществлен тот путь получения о-хлорстирола, который найдет свое применение в производстве новых марок кислото- и морозоустойчивых каучуков, искусственных волокон и пластмасс.
Списокиспользованнойлитературы.
1. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
2. Рабинович В. А., Хавин З. Я. Краткий химический справочник. – Л.: Химия, 1978. – 331 с.
3. Химия: Справочное издание/ под ред. В. Шретер, К.-Х, Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. – М.: Химия, 1989.– 648 с.
4. Химическая энциклопедия в 5 т. / под ред. И. Л. Кнунянца. – М.: Советская энциклопедия, 1990.
5. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1988.
6. Ошанина О.В., Брук Л.Г., Темкин О.Н. Альтернативные методы получения продуктов основного органического синтеза. – М.:МИТХТ, 2002.
|