Введение
Нуклеофильные реакции
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Нуклеофильные ("любящие ядро") реагенты, или нуклеофилы - это частицы (анионы или молекулы), имеющие неподеленную пару электронов на внешнем электронном уровне.
Примеры нуклеофильных частиц:
OH, Cl, Br, CN, H2O, CH3OH, NH3.
Строение некоторых нуклеофильных реагентов

Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
CH2=CH2, CH2=CH–CH=CH2, C6H6 ит.п.
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
1.Примеры нуклеофильных реакций
Нуклеофильное замещение:
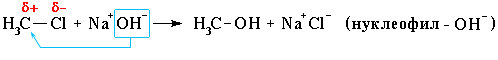
Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Нуклеофильное присоединение:
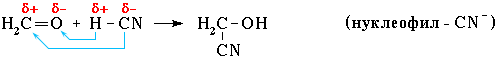
Обозначение механизма - AdN (Ad – addition [присоединение]).
2.Мономолекулярное нуклеофильное замещение и отщепление
Нуклеофильное замещение при насыщенном атоме углерода — это тот тип органических реакций, механизмы которого изучались наиболее подробно. Возможность широкого, варьирования структуры реагентов, одновременного исследования кинетических и стереохимических закономерностей, удобство экспе риментального измерения констант скорости в разнообразных-растворителях — все это сделало реакции нуклеофильного замещения удобным модельным процессом для установления общих закономерностей, связывающих строение органических соеди-: нений с их реакционной способностью. Не случайно, что именно при изучении этих реакций были сформулированы многие общие концепции, ставшие основой теоретической органической химии. Следует иметь в виду, что понятия, которые будут формулиро ваться и анализироваться в последующих двух главах, имеют общее значение и могут быть использованы для описания реакционной способности органических соединений и в других типах органических процессов. Закономерности, характеризующие; реакции нуклеофильного замещения, в значительной степени могут быть перенесены и на другие нуклеофильные процессы :реакции отщепления, замещения в ароматическом ряду, присоединения по кратным связям и многие другие.
Реклама

Наше внимание будет сосредоточено на двух основных проблемах. Во-первых, мы постараемся понять, каким образом механизм реакции зависит от строения реагирующих соединений и условий ее проведения. Во-вторых, мы должны научиться предсказывать, каким образом изменяется реакционная способность при изменении строения реагентов и условий проведения реакции!Как мы увидим, эти зависимости могут быть совершенно различными для реакций, идущих по разным механизмам. Это может приводить не только к качественно различному влиянию изменения структурных факторов на скорость процесса, но и к полному изменению его направления. Далее нами будет показано, как можно закономерности, рассмотренные в этой и следующей главах, использовать для описания других процессов.
3.ОБЩИЕ ПРЕДСТАВЛЕНИЯ О МЕХАНИЗМАХ РЕАКЦИЙ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ
В общем виде реакцию нуклеофильного замещения можно представить следующей схемой: R-Xm + Yn → R-Yn+1+ Xm-1
В качестве нуклеофильного агента Y может выступать как анион, так и нейтральная молекула, обладающая хотя бы одной неподеленной парой электронов (т. е. основание Льюиса), например:
Y = H2O, ROH, H2S, RSH, NH3, NR., OH", OR", SH~, SIT, Hal", CN~, SCN-, NO2, RCOCT. RC=-CHR и т д.
Замещаемая группа X (называемая уходящей группой) обычно обладает высокой электроотрицательностыо и может уходить как в виде аниона, так и в виде незаряженной молекулы, отщепляясь с электронами нарушающейся связи:
Х=На1, ОН, OR,
OSO2R, OCOR, NR3, SR2 и т. д.
Следует иметь в виду, что в большинстве случаев реакции нуклеофильного замещения сопровождаются конкурирующими с ними реакциями нуклеофильного отщепления, так как нуклео-фильиый реагент может взаимодействовать не только с положительно заряженным атомом углерода, но и с атомом водорода, находящимся в положении, отщепляя его в виде протона. В связи с этим многие аспекты реакций замещения и отщепления будут рассматриваться параллельно.
Реакции нуклеофильного замещения обозначаются как Sn, а отщепления — En.
Как мы увидим, реакция замещения при С может осуществляться как диссоциативный или как синхронный процесс. В первом случае реакция начинается с мономолекулярной диссоциации по связи С—X с образованием карбкатиона, который на второй стадии взаимодействует с нуклеофильным реагентом.
Реклама

Во втором случае образование связи с нуклеофильным реагентом и разрыв связи с уходящей группой осуществляются одновременно, и процесс идет в одну стадию:
RX + Y- --► [X6--R-Ye'-l4fc--- RY + X-.
Можно рассмотреть еще один механизм реакции, при котором процесс осуществляется как двухстадийный: за счет атаки куклеофила на молекулу субстрата образуется пентаковалент-ный интермедиат и затем происходит отщепление уходящей группы. Для замещения при атоме углерода этот механизм маловероятен, так кок требует расширения электронной оболочки атома углерода до десяти электронов. Есть указания, что в газовой фазе анионы СХ5 могут быть достаточно устойчивы, однакоз и в этом случае они, по-видимому, не имеют симметричного] строения, и замещение идет через переходное состояние, анало-i гичное имеющему место в случае синхронного процесса. В реакциях в растворе двухстадийиый accoциативный механизм не осуществляется. О том, что реакции нуклеофильного замещения действительно могут осуществляться по двум различным механизмам, свидетельствуют как стереохимические, так и кинетические данные.
4.Стереохимическое течение реакций нуклеофильного замещения.
При исследовании реакций нуклеофильного замещения y асимметрического атома углерода было показано, что в зависимости от строения исходных реагентов и условий проведения реакции стереохимическое течение реакции может быть различным. Так, при проведении следующего цикла реакций оптическая активность практически полностью сохраняется, но знак вращения изменяется на противоположный.
На первой и третьей стадиях реакции связи асимметрического атома углерода не затрагиваются и, следовательно, eго конфигурация остается неизменной. Отсюда следует, что вторая стадия — замещение п-толуолсульфонатной группы на ацетат- анион — происходит с полным обращением конфигурации у акционного центра (вальденовское обращение).
Аналогичные выводы были сделаны при сравнении скоростей рацемизации и обмена галогена в оптически активных галогенпроизводных (поскольку исходное и конечное соединение идентичны, для изучения скорости процесса использовали радиоактивные галоген-ионы).
Это было показано методом меченых атомов.
Если предположить, что каждый акт обмена сопровождается обращением конфигурации, то при прохождении реакции на 50 % должен образовываться полностью рацемизованный продукт, т. е. скорость обмена должна быть в два раза меньше скорости рацемизации. Экспериментальные данные полностью согласуются с этим предположением. Таким образом, обмен иода в 2-иодоктане идет с полным обращением конфигурации.
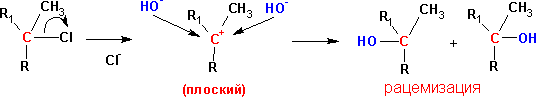
В то же время многие реакции нуклеофильного замещения идут с полной потерей оптической активности при каждом акте реакции. Так, реакция сольволиза оптически активного а-хлорбензола в 80%-м водном растворе ацетона сопровождается 97%-й рацемизацией:
Кинетический характер реакций нуклеофильного замещения
Наиболее часто реакции нуклеофильного замещения описываются одним из двух кинетических уравнений.
Реакция может описываться уравнением первого порядка. этом случае скорость процесса не зависит ни от концентрации, ни от природы нуклеофила.
Такое кинетическое уравнение свидетельствует о том, что' нуклеофил не принимает участия в скоростьопределяющей стадии процесса и предшествующих ей предравновесных стадиях. В то же время изменение соотношения образующихся продуктов при использовании смесей нуклеофилов и при варьировании их концентраций является доказательством того, что нуклеофил участвует в реакции на быстрой стадии, следующей за скорость-определяющей.
Во втором случае реакция имеет суммарный второй порядок и первый порядок по субстрату, так и по нуклеофилу.
Для этих реакций характерна высокая зависимость скорости процесса от природы нуклеофила.
5.
SN
1 и
SN
2 реакции.
Основополагающий вклад в изучение реакций замещения у sp3-гибридизованного атома углерода внес Ингольд. Классическим примером реакции нуклеофильного замещения является превращение алкилгалогенида в спирт:
R-Cl + HO- --> R-OH + Cl-
При изучении кинетики реакций такого типа было установлено, что они могут протекать по двум механизмам (мономолекулярное и бимолекулярное замещение), которым отвечают кинетические зависимости:
V1=k’[R-Hal] (SN1)
V2= k[R-Hal][HO-] (SN2)
Обозначение реакций (SN1) и (SN2) было также предложено Ингольдом и расшифровывается, соответственно, как нуклеофильное замещение мономолекулярное и бимолекулярное (от англ. Substitution nucleophilic).
МОНОМОЛЕКУЛЯРНОЕ НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ (SN1)
БИМОЛЕКУЛЯРНОЕ НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ (SN2)
Предполагается, что реакция протекает по следующей схеме:
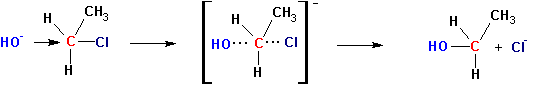
Если в исходном соединении существовала какая-нибудь оптическая конфигурация (D-, L- ), то в результате реакции происходит ее обращение (L-, D-).
В реакции этого типа преимущественно вступают пространственно незатрудненные первичныеалкилгалогениды, при отщеплении уходящей группы от которых не образуется стабилизированного карбкатиона.
6.ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ У НАСЫЩЕННОГО АТОМА УГЛЕРОДА
| Факторы |
(SN1) |
(SN2) |
| Строение субстрата |
Реакционная способность падает в ряду:
Бензильный, аллильный > третичный > вторичный > первичный
|
Реакционная способность растет в ряду:
Бензильный, аллильный < третичный < вторичный < первичный
|
| Вступающая группа |
Практически нет влияния |
Чем больше нуклеофильность, тем вероятнее протекание реакции |
| Уходящая группа |
Чем ниже энергия связи, тем легче протекает реакция |
Замещение затрудняется с увеличением нуклеофильности (основности) уходящей группы |
| Стерические факторы |
Увеличение числа алкильных заместителей и электронодонорных групп у нуклеофильного центра способствует протеканию реакции. |
Препятствуют атаке нуклеофильного центра и затрудняют реакцию |
| Влияние растворителя |
Реакции способствуют протонные полярные растворители |
Влияние растворителя сказывается значительно меньше, но реакцию затрудняют растворители, сольватирующие нуклеофил. В целом, лучше протекают с апротонными полярными растворителя. |
| Концентрация нуклеофила |
На скорость реакции не влияет |
Скорость реакции пропорциональна концентрации нуклеофила |
7.Применение реакций нуклеофильного замещения
При помощи этих реакций нуклеофильного замещения может быть замещено большое количество различных групп. Баннетт и Цейлер [68] дали следующий приблизительный порядок легкости замещения групп: _ F> —N02 > —Cl, —Br, — J > —OS02R > — NRt> - OAr > -— OR > - SR, SAr > - S02 R > - NR2.
Значительно менее удовлетворительное положение в отношении свободно-радикального и нуклеофильного замещения. В случаях свободно-радикального замещения доказано существование п- и сг-комплексов, они, по-видимому, участвуют в механизме замещения в ароматических соединениях. Однако отсутствуют пока определенные данные о существовании и стойкости этих промежуточных соединений и сравнительно мало можно сказать о деталях интимного механизма свободно-радикального замещения. В случаях нуклеофильного замещения положение еще менее удовлетворительно, поскольку дело касается замещения «неактивированных» ароматических соединений. В, настоящее время невозможно дать достаточно обоснованного объяснения замещениям этого типа.
В присутствии галоидов или подобных им электроотрицательных заместителей в кольце становится возможной вся область реакций нуклеофильного замещения, которые не идут с самими исходными углеводородами. Эти реакции замещения распадаются, естественно, на два различных класса: 1) класс, включающий замещение «иеактивированных», и 2) класс реакций, в которых замещению подвергается «активированный» заместитель.
Реакции замещения ароматических углеводородов удобно классифицировать с точки зрения электронных представлений о типах замещения. Так, например, промежуточные соединения типа R+ с недостатками электронов стремятся к центрам с высокой плотностью электронов в. молекулах, с которыми они реагируют. Такие промежуточные соединения называются электрофильными (электронно-акцептерными), и реакции замещения, в которых участвуют такие промежуточные соединения, обозначаются как реакции электрофильного заещенияhttp://www.anchemistry.ru/ref/8lektrofil5nogo_zame4eni9.html. Подобным же образом промежуточные соединения типа R~: стремятся к реакционным центрам молекулы с низкой плотностью электронов и называются нуклеофильными. Реакции замещения, включающие участие таких промежуточных соединений, известны как реакции нуклеофильного замещения. Промежуточные соединения в виде свободных радикалов вследствие их электронейтральности мало подвержены влиянию центров большой и малой плотности электронов. Замещения, включающие участие промежуточных соединений в виде свободных радикалов, называются реакциями свободно-радикального замещения.
Из реакций нуклеофильного замещения можно отметить реакции пиридина с амидом натрия и с сухим КОН при 250-300°С (реакции А.Е. Чичибабина):
Реакции замещения в ароматических углеводородах элоктрофиль-ными группами и свободными радикалами рассматривались в предыдущих разделах. Настоящий раздел посвящен обзору нуклеофильного замещения.
Актуальность широко проводимых в Институте химии АН ТадяССР исследований по изучению тиаинданов обусловлена наличием последних в нефтях таджикской депрессии - самой сернистой и смолистой нефти страны. Основные результаты этих работ содержатся в докладе к.х.н. И.И.Насырова и члена-корреспондента АН ТадхССР И.Нуаанова. Ими не только подробно изучены многочисленные извращения I-тиаинданов и их производных, реакции электрофильного, радикального и нуклеофильного замещения, во также синтезированы вещества, обладающие пестицид-шши свойствами, красители, мономеры, стабилизаторы синтетических волокон и т.д.
Нортон относит реакцию замещения водорода металлом к реакциямэлектрофильного замещения, основываясь на убеждении (признанном в настоящее время неправильным), что атакующим реагентом является катион щелочного металла, а карбанион играет только второстепенную роль акцептора протонов . С другой стороны, основываясь на расположении пары электронов углерод-водородной связи, которая разрывается, и связи углерод — металл (ионной), которая образуется , реакция замещения водорода металлом может быть определена как электрофильное замещение. По той же причине гидролиз торе/я-бутилхлорида определяют как реакцию нуклеофильного замещения изомеризации углеводородов проявляется большое число закономерностей, связанных с особенностями реакций нуклеофильного замещения у насыщенного углеродного атома. Так, при относительно высоких скоростях реакции наблюдается стереоспецифичность и стереонаправленность перегруппировок, что указывает на механизм псевдо-5л2-замещения, предполагающий сохранение тетраэдрической структуры карбоний-иона с атакой мигрирующей группы со стороны, противоположной уходящей группе (гидрид-ион).
Заключение
Итак, мы рассмотрели реакции нуклеофильного замещения в тетраэдрическом атоме углерода, рассмотрели два возможных механизма данного процесса, показали, какие факторы влияют на него, а именно: строение субстрата, особенности строения встпающей и уходящей групп, природа растворителя, различные стерические факторы. И, наконец, указали возможные варианты применения реакций данного типа.
Список литературы
1. Т.Беккер. Механизмы электронных процессов в органических соединениях.-М,1969.-687 с.
2. Нейланд О. Органическая химия: учеб. Для хим. спец вузов.- ,М.: Высш. шк., 1990.-751 с.
3. Р. Моррисон, Р. Бойд. Органическая химия.-М.: Мир, 1974.- 1132 с.
|