|
НБН, нор – С7Н10 – норборнен – 2, бицикло [2.2.1] гепт –2 – ен
НБД, нор – С7Н8 – норборнадиен – 2,5, бицикло [2.2.1] гепта –2,5 – диен
ЦПД – циклопентадиен – 1,3
АА – аллилацетат
АФ – аллилформиат
БАН – бис(η3-аллил) никель
acac – ацетилацетон
Ме – метил
Et – этил
Pr – пропил
Bu – бутил
Ph – фенил
all – аллил
Норборненна- 2,5-диен (НБД) или бицикло [2.2.1] гептан-2,5-диен и его производные приобретают все большее значение в различных сферах человеческой деятельности, появляются все новые области их использования. Эти соединения нашли применение в медицине, сельском хозяйстве, ракетной технике, в производстве полимерных материалов с уникальными свойствами, микроэлектронике и в качестве конверторов солнечной энергии. Количество патентов, связанных с получением и применением производных НБД и норборнена-2 (НБН) достигает 10 тыс.
Исключительно важным является то обстоятельство, что сам НБД и некоторые его простейшие производные имеют надежную сырьевую базу. Это крупнотоннажные продукты нефтепереработки: циклопента-1,3-диен (ЦПД), ацетилен, алкены и алкадиены различного строения. Производство ЦПД может легко сочетаться с производством других продуктов нефтепереработки, в частности этилена.
Чрезвычайно интересными и привлекательными в отношении реакций с участием НБД и НБН-производных представляются возможности металлокомплексного катализа.
Реакции циклоприсоединения с участием НБД являются наиболее интересными и перспективными для практического использования. Несмотря на большое количество работ в этом направлении, синтетические возможности НБД в такого рода превращениях далеко не исчерпаны.
Реакция каталитического аллилирования НБН впервые описана в работе M. Catellani и G. Chiusoli в 1979 году. Необычный характер ее протекания связан не только с образованием интересных карбоциклических структур, но и возможностью активации С-С и С-Н – связей в мягких условиях.
Необычность реакции заключается в характере присоединения аллильной группы – не традиционным, а циклическом и даже с разрывом С – С-связи.
Катализируемое аллильное алкилирование норборненовых НБД и НБН – производных позволяет в одну технологическую стадию получить сложные полициклические углеводороды, содержащие метиленциклобутеновый фрагмент или метиленовую и винильную группы.
Реклама

Дальнейшее развитее и усовершенствование методов металлокомплексного катализа применительно к реакции аллилирования НБД и его производных, детальное изучение механизма процесса, несомненно, приведут к увеличению выхода и селективности уникальных продуктов, сделают их производство технологичным и экономически оправданным.
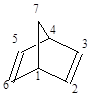 Норборненна - 2,5-диен 1 (бицикло [2.2.1] гептан-2,5-диен) (НБД) является бициклическим диеновым углеводородом норборненового ряда. Впервые он был получен в 1951 г. По реакции диенового синтеза из циклопента-1,3-диена и ацетилена. Норборненна - 2,5-диен 1 (бицикло [2.2.1] гептан-2,5-диен) (НБД) является бициклическим диеновым углеводородом норборненового ряда. Впервые он был получен в 1951 г. По реакции диенового синтеза из циклопента-1,3-диена и ацетилена.
1
Наличие в молекуле НБД метиленового мостика, "стягивающего" С1 - и С4 - атомы приводит к цисоидному напряжению сжатия и значительному искажению валентных углов, а следовательно, и к повышению внутренней энергии молекулы.
Расстояния между атомами углерода и валентные углы в молекуле НБД
| Расстояние, Å |
Валентные углы, град. |
| С12 1,522 |
С123 109,1 |
| С17 1,558 |
С217 96,4 |
| С23 1,333 |
С216 102,2 |
В первую очередь это сказывается на реакционной способности двойных связей, энергия напряжения в которых оценивается в 25 кДж/моль для НБН и в 58 кДж/моль для НБД (на две двойные связи). π-Электронные орбитали последнего взаимодействуют, что обуславливает их гомосопряжение и делает возможным участие НБД в реакции диенового синтеза в качестве как диена, так и диенофила. Таким образом, наличие двух внутрициклических двойных связей, обладающих повышенной реакционной способностью, и их гомосопряжение определяют основные свойства НБД.
Среди реакций НБД можно выделить основные группы: изомеризации (распада) и присоединения. Помимо этого НБД свойственны реакции окисления и полимеризации.
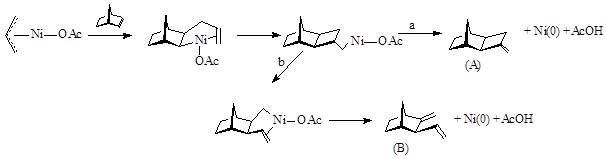 В 1979 году в работе Кателлани и сотр.1 впервые была показана возможность протекания реакции аллилирования НБН под действием комплексов никеля(0). В 1979 году в работе Кателлани и сотр.1 впервые была показана возможность протекания реакции аллилирования НБН под действием комплексов никеля(0).
Схема
1.1. Механизм образования продуктов аллилирования НБН
Этот процесс включает гидридное элиминирование после встраивания молекулы субстрата по связи Ni – аллил. В присутствии НБН образуется интермедиат А cis, exo – строения. Далее происходит замыкание четырехчленного кольца (направление a), с образованием cis, exo продукта I, имеющего метиленциклобутановый фрагмент. Реакция может реализовываться по направлению b с образованием продукта II (exo), имеющего метиленовую и винильную группу.
Соотношение продуктов зависит от температуры: если при 800С А/В =3/7, то при 200С соотношение продуктов А и В равно 1/1.
Диспропорционирование аллильных лигандов в η3-аллильных комплексах переходных металлов при взаимодействии с норборнадиеном и НБН - производными
.
Реклама

Перераспределение водорода между η3-аллильными лигандами – наименее изученное направление превращения комплексов переходных металлов. Это свойство проявляется количественно в реакции Ni(C3H5) 2 с НБД, приводящей к широкой гамме продуктов окислительного аллилирования (I – III) и восстановления (СзН6) 10.
Ni(C3H5) 2 + 3,3C7H8 → C10H12 + 0,3 C10H14 + 0,7 C3H6 + Ni(C7H8) 2 (1) Указанные соединения образуются в результате присоединения к НБД аллильной группы, ранее принадлежавшей комплексу.
Взаимодействие Ni(C3H5) 2 с НБД протекает количественно при 25°С за несколько минут и сопровождается изменением окраски реакционного раствора. Желтый цвет, обусловленный Ni(СзН5) 3, переходит в темно-красный, характерный для олефиновых комплексов Ni(0). Интенсивность окрашивания пропорциональна исходной концентрации аллильного комплекса. При образовании темно-красных растворов существенно уменьшается концентрация НБД, расход которого составляет 3,3 моля на 1 моль Ni(C3H5) 2. Реакцию (1) удобно анализировать в виде суммы двух уравнений,
0,7 Ni(C3H5) 2 + 3C7H8 → С10Н12 + С3Н6 + Ni(C7H8) 2 (2)
0,3 Ni(C3H5) 2 + 4С7Н8 → С10Н12 + С10Н14 + Ni(C7H8) 2 (3)
относительный вклад которых составляет 0,7 и 0,3 соответственно.
Каждое уравнение формально описывает реакцию переноса атома водорода между аллильными лигандами. При этом более ненасыщенный фрагмент С3Н4 всегда входит в состав аддуктов С10Н12, в то время как фрагмент С3Н6 может находиться как в связанном состоянии (С10Н14), так и в виде пропилена. Суммарное количество пропилена и соединения С10Н14 эквимолярно сумме продуктов с брутто-формулой С10Н12.
Анализируя зависимость выхода продуктов I-IIIот мольного отношения НБД/NiA112, видно, что увеличение отношения до 10: 1 способствует образованию продукта восстановительного аллилирования. Дальнейший рост отношения практически не влияет на его выход, максимальное значение которого при данной температуре определяется природой комплекса. Прослеживается увеличение выхода I-IIIза счет С3Н6 (С4Н8) с ростом эффективного положительного заряда на никеле: Ni(2-CH3C3H4) 2> Ni(C3H5) > Ni(l-CH3C3H4) 2.
Температура в меньшей степени влияет на образование продуктов восстановительного аллилирования. Их выход незначительно падает с повышением температуры.
При исследовании влияния концентрации НБД на соотношение Сва/СAll+H было выяснено, что эта зависимость для всех комплексов никеля носит линейный характер, этот факт свидетельствует о более высоком кинетическом порядке по НБД для продуктов восстановительного аллилирования по сравнению с пропиленом или бутенами.
Общий характер диспропорционирования водорода между η3-аллильными лигандами подтвержден для комплексов различных переходных металлов Со, Fe, Ni, Rh, Pd и Pt. Из данных таблицы видно, что строение аддуктов определяется закономерностями, присущими и другим процессам циклоприсоединения с участием НБД 12313131. Так, при использовании комплексов никеля, палладия и платины образуются соединения, имеющие двойную связь в норбоненовом кольце. Этот факт предполагает монодентатный характер координации НБД в комплексах переходных металлов подгруппы никеля. Близость соотношений продуктов для этих металлов указывает на сходство их координационных возможностей. Однако активность комплексов в изучаемой реакции существенно уменьшается от никеля к платине, что связано с возрастанием эффективного положительного заряда металла в этом ряду.
Крайне неустойчивые комплексы Fе(С3Н5) 3 и Со(С3Н5) 3 активно взаимодействуют с НБД уже при температуре его плавления (-19°С). Помимо продуктов с НБН-фрагментом I – II в значительных количествах образуется соединение с нортрициклановой структурой III. Такой набор продуктов обусловлен большими координационными возможностями железа и кобальта по сравнению с переходными металлами подгруппы никеля. Подобным образом с НБД взаимодействует Rh(С3Н5) 3, однако его активность в исследуемой реакции существенно ниже.
Результаты балансовых и кинетических опытов, а также информация о строении образующихся продуктов позволяют высказать некоторые соображения о механизме взаимодействия Маlln с НБД (рис.1.1).
Механизм реакции основан на известных свойствах η3-аллильных комплексов: η3→ η1-изомеризации аллильных лигандов, внедрении ненасыщенных молекул по η1-связи металл-углерод, стадиях β-элиминирования и гидридного переноса, а также способности молекулы НБД как к монодентатной, так и хелатной координации.
Образование продуктов восстановительного аллилирования обусловлено координацией и внедрением второй молекулы НБД. При распаде общего комплекса в результате различных направлений протекания стадии гидридного переноса происходит формирование продуктов восстановительного аллилирования и С3Н6 (C4H8).
Образующийся после внедрения второй молекулы НБД координационно ненасыщенный комплекс должен быть крайне неустойчивым. Вследствие этого в аллилнорборненовом фрагменте не успевают произойти многочисленные превращения, имеющие место при внедрении первой молекулы НБД. В результате образуется только один продукт восстановительного аллилирования (C10H14) в отличие от широкого ассортимента соединений C10H12.

Рисунок 1.1. Механизм взаимодействия Мalln с НБД
Ключевая стадия – β-гидридный перенос - подтверждается хромато-масс-спектрометрическим исследованием продуктов модельных систем: Ni(C3D5) 2 – НБД и Ni(С3Н5) 2 – НБД-D8. Их строение указывает на участие в процессе атомов водорода, принадлежащих как НБД, так и аллильному фрагменту и занимающих β-положение по отношению к металлу (рис.1.2).
Предложенный механизм объясняет строение всех продуктов аллилирования НБД. Для каждого переходного металла характерен индивидуальный набор соединений и, следовательно, определенная совокупность стадий, приводящая к их образованию.
Так для Malln подгруппы никеля характерна совокупность стадий, объединенная общим направлением (а). Для комплексов железа, кобальта и родия реализуются оба направления: (а) - связанное с монодентатной координацией НБД в комплексе и (б) - проявляющееся при хелатной его координации.
Реакции окислительно-восстановительного диспропорционирования для различных субстратов (различные классы ненасыщенных соединений, отличающиеся природой и реакционной способностью кратной связи) могут быть разделены на три группы:
Реакция не идет (А)
Ni(C3H5) 2 + ненасыщенный углеводород Гексадиен-1,5 (Б)
Продукты аллилирования (В)
А. этилен, пропилен, пентен-1, пентен-2, 2-метиопентен-2, гексадиен-1,5, винилциклопропан, метиленциклобутан, циклопентен, циклогексен;
Б. аллен, бутедиен-1,3, метиленциклопропан, циклопентадиен-1,3, трансциклооктадиен-1,5;
В. Норборнадиен, норборнен и его 5,6-производные.
В первую группу входят соединения, не взаимодействующие с бис(π-аллил) никелем. Это линейные и циклические алкены, диены с изолированными двойными связями (гексадиен-1,5), а также соединения, у которых двойная связь примыкает к умеренно напряженному углеродному кольну (метиленциклобутан).
Во вторую группу соединений входят диеновые углеводороды с кумулированными (аллен) и сопряженными (бутадиен-1,3, циклопентадиен) двойными связями, а также олефины у которых двойная связь примыкает к напряженному углеродному кольцу (метиленциклопропан). Эти соединения вытесняют из бис(π-аллил) никеля гексадиен-1,5. При этом образуется π-комплекс никеля с соответствующим соединением, способный в ряде случаев катализировать его циклическую олигомеризацию.
Наконец, в третью группу входят НБД, НБН и его многочленные 5,6-производные.
Таким образом, субстратом для реакции аллилирования являются соединения с внутрициклической двойной связью.
Анализ величин энергий напряжения двойных связей (табл.1.1) в циклоалкенах приводит к выводу, что уникальная реакционная способность двойных связей в НБД - и НБН-производных связана с внутримолекулярным напряжением углеродного каркаса. Эта энергия, частично высвобождающаяся при координации, полностью компенсирует затраты на только одного аллильного лиганда. Рисунок 1.2. Фрагмент механизма для модельной системы Ni(C3D5) 2 – НБД.
Таблица 1.1. Энергия напряжения двойной связи в некоторых циклоалкенах и метиленциклоалканах.
| Субстрат |
Напряжение двойной связи, кДж/моль |
Субстрат |
Напряжение двойной связи, кДж/моль |
 |
58,2 (две связи) |
 |
34,8 |
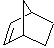 |
25,1 |
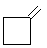 |
12,6 |
Продолжение.
Это условие, видимо, играет важнейшую роль для дальнейшего протекания процесса по пути окислительно-восстановительного диспропорционирования. Энергия напряжения двойной связи должна находиться в пределах 25-30 кД ж/связь. Следовательно, в реакции аллилирования могут вступать непредельные углеводороды имеющие напряженную внутрицеклическую двойную связь.
Таким образом, стехиометрическое взаимодействие может служить своего рода индикатором, указывающим на принципиальную возможность того или иного соединения вступать в реакцию каталитического аллилирования.
Гомогенно – каталитическое аллилирование НБД и НБН - производных.
Аллилирование норборнена.
Катализируемое аллильное алкилирование норборненовых (НБ) производных позволяет в одну технологическую стадию получить сложные полициклические углеводороды, содержащие метиленциклобутеновый фрагмент или метиленовую и винильную группы (реакция 4) 1:
(4)
Катализаторами этой и родственных реакций являются системы на основе комплексных соединений никеля и палладия. Аллилирующими агентами служат сложные аллиловые эфиры органических кислот, среди которых наиболее часто используется аллилацетат. Аналогичные результаты могут быть полученны при использовании аллилпропионата, аллилбутирата или аллилбензоата [2,3]. При 80 0С суммарный выход продуктов составляет 80% при их соотношении 7/5. При 20 0С соотношение продуктов равно 1/1. Необычность этой реакции заключается в характере присоединения аллиьной группы – не традиционно линейном, а циклическом, и даже, с разрывом С-С – связи 2.
Строго говоря, взаимодействие НБН и аллилацетата не является содимеризацией. Аллилацетат выступает лишь как источник фрагмента С3Н4, присоединяющегося к НБН при помощи каталитического комплекса. Эта реакция является первым примером использования аллиловых эфиров органических кислот в подобных процессах и представляется интересным методом получения полициклических соединений.
Универсальность этого метода продемонстрирована в работах Джемилева и сотр.3 4 5 6, которые осуществили масштабное исследование этой реакции применительно к широкому кругу соединений НБН-ряда. Каталитическая система –Ni(асас) 2-АlEt3-Р(ОR) 3 весьма активна и достаточно селективна при получении экзо-метиленциклобутановых производных.
Каталитическое аллилирование НБН и НБН-производных - весьма сложный многопараметрический процесс. В системе, образованной большим количеством компонентов – металлоорганическими комплексами катализатора, фосфорорганическими соединениями, субстратами – (НБД) и сложными аллиловыми эфирами, а так же продуктами, возможно протекание как желательных, так и многочисленных побочных реакций, воздействующих на каталитическую систему и снижающих ее технологические показатели.
На состав продуктов существенное влияние оказывает природа растворителя. Так содимеризация АА с НБД наиболее успешно протекает в среде толуол – алифатический спирт (исключение составляет метанол) при различных соотношениях компонентов. В среде толуол – АсОН (1: 2) наблюдается изменение направления реакции в сторону образования продукта димеризации НБД, хотя меньшие количества АсОН, образующиеся за счет самой реакции, не влияют на активность и селективность каталитической системы 3.
Реакция чрезвычайно чувствительна к природе фосфорорганического лиганда. Наиболее активные катализаторы могут быть получены при использовании в качестве лигандов (i-PrO) 3P, (втор-BuO) 3P и (C6H11O) 3P 3. Каталитические системы на их основе проявляют активность в интервале 20 – 1200С.
Низкая активность каталитических систем на основе (MeO) 3P, (EtO) 3P, (PrO) 3P, (PhO) 3P и в особенности фосфинов может быть объяснена тем, что эти лиганды образуют достаточно прочные комплексы с Ni, препятствуя тем самым подходу к центральному атому катализатора и активированию НБН и АА.
На активность каталитических систем существенное влияние оказывает также температура. В работах 3 4 5 6 отмечается, что при 200С активность проявляют лишь каталитические системы, в которых в качестве лигандов используются (i-PrO) 3P, (втор-BuO) 3P и (C6H11O) 3P. И только при 800С высокие значения конверсии НБН и выхода продуктов достигаются для КС на основе (MeO) 3P, (EtO) 3P, (PrO) 3P, (PhO) 3P.
Строение аллилирующего агента – сложного аллилового эфира – не имеет решающего значения. Так, помимо аллилиацуетата с теми же результатами использованы аллилпропионат, аллилбутират. Аллилбензоат и аллилформиат. Однако, в случае последнего не удается добится высоких конверсий реагентов из-за разрушения каталитической системы. Аллиловый спирт, аллилгалогениды, простые аллиловые эфиры и тиоэфиры в реакции с НБН в данных условиях не вступают.
Природа восстановителя мало влияет на состав продуктов. Наиболее эффективными являются AlEt3, Al(i-Bu) 3, Mg(Bu) 2, и LiAlH4.
Стерические особенности субстратов, имеющих экзо-заместители в положениях 5 и 6 относительно внутрициклической двойной связи не оказывают существенного влияния на скорость циклоприсоединения. Содимеризация АА с подобными соединениями протекает строго избирательно и затрагивает только не замещенную двойную свзь. Однако, 5,6-эндо-заместители в зависимости от размера могут существенно затруднять реакцию вплоть до полной ее остановки. Процесс полностью блокируется также при наличии заместителя непосредственно у норборненовой двойной связи.
Сравнительное изучение каталитической активности для системы – Ni – (АА) 2 –AlEt3 – P(Oi-C3H7) 3 и индивидуального комплекса Ni [P(Oi-C3H7) 3] 4 указывают на существенные различия в их поведении.
Комплекс, выделенный в ходе реакции и охарактеризованный по продуктам распада, криоскопически имеет предположительный состав [(i-PrO) 3P] 3NiEt.
По-видимому, он является одним из интермедиатов в достаточно сложной цепочке превращений, приводящих к малоустойчивым каталитически активным гидридным (Ni-H) и кластерным (Ni-Ni) комплексам.
На основании кинетических и спектральных данных проведенных В.Р. Флидом и сотр., проведенных с 1980 по 2000 год 7 8 9 10 впервые был предложен был предложен механизм каталитического аллилирования НБН аллилиацетатом в присутствии никелевого катализатора.
В его основе лежат следующие положения:
Соединения никеля (0) являются четырехкоординационными с тетраэдрическим строением полиэдра. Это относится как к гомолигандным, так и смешанным с НБН никель - фосфитным комплексам.
Аллилацетат окислительно присоединяется к никелю, образуя пяти - и шестикоординационные комплексы.
Формирование продуктов аллилирования НБН осуществляется внутримолекулярно на моноядерном никелевом центре.
1. NiP4↔NiP3 + P
2. NiP3↔NiP2 + P
3. NiP2↔NiP + P
4. NiP + НБН↔Ni(НБН) + P
5. NiP2 + НБН↔NiP(НБН) + P
6. NiP3 + НБН↔NiP2(НБН) + P
7. NiP4 + НБН↔NiP3(НБН) + P
8. NiP4 + AA↔NiP4(AA)
9. NiP3 + AA↔NiP3(AA)
10. NiP2 + AA↔NiP2(AA)
11. NiP + AA↔NiP(AA)
12. NiP3(AA) + НБН↔NiP3(AA) (НБН)
13. NiP2(AA) + НБН↔NiP2(AA) (НБН)
14. NiP(AA) + НБН↔NiP(AA) (НБН)
15. NiP3(AA) (НБН) ↔S1 + AcOH + NiP3
16. NiP3(AA) (НБН) ↔S2 + AcOH + NiP3
17. NiP2(AA) (НБН) ↔S1 + AcOH + NiP2
18. NiP2(AA) (НБН) ↔S2 + AcOH + NiP2
19. NiP(AA) (НБН) ↔S1 + AcOH + NiP
20. NiP(AA) (НБН) ↔S2 + AcOH + NiP
21. P(O-iC3H7) 3 + AcOH↔H(O) P(O-iC3H7) 3 + C3H7Oac
Схема 1.2. Механизм каталитического аллилирования НБН.
P ≡ P(O-iC3H7) 3; НБН ≡ норборнен; АА ≡ аллилацетат; S1, S2 ≡ продукты аллилирования НБН.
К наиболее кинетически значимым стадиям меанизма следует отнести:
формирования в реакционном растворе комплексов (C3H5) PnNi(OAc), где n=2 или3. Эти комплексы доминируют в условиях реакции;
присоединение молекулы НБН к комплексу (C3H5) PnNi(OAc), сопровождающееся η3 – η1 – изомеризацией аллильного лиганда;
внедрение НБН по связи η1 – аллил – метал;
формирование никелациклических интермедиатов и их распад в резултате β-гидридного переноса с образованием продуктов аллилирования НБН и уксусной кислоты.

Рисунок 1.2. Заключительная часть механизма каталитического аллилирования НБН аллилиацетатом.
В реакции образуются изомеры исключительно экзо-строения, что связано с экзо-координацией молекул НБН-в комплексе.
β-гидридный перенос является завершающей и, как показывают проведенные исследования, лимитирующей стадией каталитического процесса. Следует отметить, что в стадии гидридного переноса могут участвовать атомы водорода как из аллильной группы аллилацетата, так и молекулы НБН.
Таким образом, в механизме протекания заключительного этапа наблюдается полная аналогия со стехиометрическими процессами, описанными в разделе 1.1.
Анализ изученных литературных данных 1 3 9 10 свидетельствует, что образование индивидуальных продуктов происходит из комплексов никеля, содержащих различное число фосфитных лигандов. Комплекс NiP3 ответственен за образование соединения II, а NiP2 – за продукт I. Этот факт играет важную роль при регулировании селективностию.
Серьезным препятствием на пути эффективного осуществления каталитического процесса и устойчивой работы катализатора является его дестабилизация одним из продуктов – уксусной кислотой. Образование последнего соединения происходит вэквивалентвых по отношению к продуктам аллилирования колличествах. Уксусная кислота переводит триизопрпилфосфит в неактивную форму, изменяя соотношение компонентов каталитической системы. В этой ситуации очень сложно добиться высоких технологических показателей процесса – селективности по индивидуальным продуктам и времени работы катализатора.
Проблема выведения уксусной кислоты из реакционной зоны представляется весьма непростой. Весьма перспективным в этом отношении представляется использование цеолитов типа NaA, которые являются абсолютно инертными по отношению к гомогенным никелевым комплексам 11 12. Применение цеолитов с диаметром пор 4Å позволяет весма эффективно и избирательно погощать уксусную кислоту (эффективный диаметр ≈3,8 Å).
Таким образом при использовании цеолитов количество каталитических циклов достигает 1,5 – 2 тыс.
Аллилирование соединений норборненового ряда.
Закономерности, выявленные при каталитическом аллилировании НБН, справедливы для многочисленных НБН-производных 3 10 Киузоли 85 (табл.1.2).
Варьирование двух параметров - соотношения P/Ni и температуры - позволяет получать метилен циклобутановые соединения типа I с селективностью 80-95%, а метилен-винильные производные типа II – с селективностью 75-85%.
В реакцию вступают только НБН-производные с незамещенной двойной связью. Соединения, имеющие несколько ненасыщенных связей различной природы, участвуют в реакции только с использованием двойной НБН-связи.
Пространственный фактор оказывает влияние на скорость процесса, но соотношение изомеров маю от него зависит. Наиболее активны норборнены с неэкранированной внутри циклической двойной связью, имеющие экзо-заместители в положениях 5 или 6 НБН-кольца. Активность эндо-замещенных производных в реакции несколько ниже.
Соединения, имеющие две изолированные НБН-двойные связи последовательно аллилируются по каждой из них, причем активность в каждой из стадий практически неизменна. Здесь возможно образование большого количества изомеров, но варьирование вышеуказанных параметров позволяет преимущественно получать два из них.
Сопоставляя закономерности протекания стехиометрического (раздел 4.6) и каталитического аллилирования, можно отметить ряд качественных аналогий по составу и строению продуктов.
Как правило, в обеих реакциях образуются одни и те же соединения. В каталитическом процессе полностью отсутствуют изомеры эндо-строения, тогда как в стехиометрическом варианте такие соединения образуются, хотя и в незначительных количествах.
Каталитический вариант в отличие от стехиометрического позволяет направленно воздействовать на соотношение изомеров.
Механизм протекания ключевых стадий полностью аналогичен.
Таблица 1.2
Продукты аллилирования замещенных норборненов.
Каталитическое аллилирование норборнадиена.
Использование в этой реакции норборнадиена (НБД) существенно расширяет ее синтетические возможности (реакция 5). Впервые возможность проведения реакции аллилирования НБД была показана У.М. Джемилевым и сотр. в статье 5. Реакция НБД с аллилацетатом (1: 1) в присутствии каталитической системы Ni – (acac) 2 –AlEt3 – P(Oi-C3H7) 3 (1: 3: 4) в отличее от норборнена протекает более сложно и сопровождается образованием трех изомерных продуктов (I – III).
Аллилирование НБД во многом напоминает аналогичную реакцию для НБН - производных. Существенное отличие заключается в способности молеулы НБД к хелатной координации на атоме катализатора. Следствием этого является разнообразное, чем для НБН, строение возможных продуктов. В ходе реакции, кроме уже известных продуктов, могут образовываться так же продукты двойного аллилирования 5.
Набор продуктов в реакции 5 для никелевого катализатора несколько иной, чем при стехиометрическом взаимодействии. Следует отметить отсутствие норборненовых продуктов эндо-строения и образование квадрацикленовых производных III.
Кинетика реакции качественно напоминает аллилирование НБН 10. Совокупность спектральных и кинетических исследований дает представление о механизме процесса.
Механизм реакции аллилирования НБД аллтлацетатом в присутствии комплексов никеля включает 24 стадии: Схема 1.3. Механизм каталитического аллилирования НБД
1. NiP4↔NiP3 + P
2. NiP3↔NiP2 + P
3. NiP2↔NiP + P
4. NiP + НБД↔Ni(НБД) + P
5. NiP2 + НБД↔NiP(НБД) + P
6. NiP3 + НБД↔NiP2(НБД) + P
7. NiP4 + НБД↔NiP3(НБД) + P
8. NiP4 + AA↔NiP4(AA)
9. NiP3 + AA↔NiP3(AA)
10. NiP2 + AA↔NiP2(AA)
11. NiP + AA↔NiP(AA)
12. NiP3(AA) + НБД↔NiP3(AA) (НБД)
13. NiP2(AA) + НБД↔NiP2(AA) (НБД)
14. NiP(AA) + НБД↔NiP(AA) (НБД)
15. NiP3(AA) (НБД) ↔S1 + AcOH + NiP3
16. NiP3(AA) (НБД) ↔S2 + AcOH + NiP3
17. NiP3(AA) (НБД) ↔S3 + AcOH + NiP3
18. NiP2(AA) (НБД) ↔S1 + AcOH + NiP2
19. NiP2(AA) (НБД) ↔S2 + AcOH + NiP2
20. NiP2(AA) (НБД) ↔S3 + AcOH + NiP2
21. NiP(AA) (НБД) ↔S1 + AcOH + NiP
22. NiP(AA) (НБД) ↔S2 + AcOH + NiP
23. NiP(AA) (НБД) ↔S3 + AcOH + NiP
24. P(O-iC3H7) 3 + AcOH↔H(O) P(O-iC3H7) 3 + C3H7Oac
P ≡ P(O-iC3H7) 3; НБД ≡ норборнадиен; АА ≡ аллилацетат; S1, S2 и S3 ≡ продукты аллилирования НБД.
Ключевой стадией является формирование каталитически активного комплекса никеля, где образуется аллильный фрагмент. Формирование подобных комплексов описано в работах Ямамото и сотр 15. В процессе окислительного присоединения оргонических вществ, имеющих связь С-О, происходит встраивание металла с образованием аллильного комплекса:
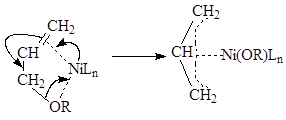
Рисунок 1.3. Механизм образования аллильного комплекса никеля.
Далее молекула НБД координируется на атоме металла, вызывая η3 – η1 – изомеризацию аллилиьного лиганда, а затем внедряется по связи η1 – металл.
Анализ данных позволил авторам утверждать, что образование индивидуальных продуктов I – III связано с наличеем в каталитической системе комплексов никеля, содержащих различное число фосфитных лигандов 7 9 10.
В зависимости от количества фосфорорганических заместителей реализуются различные направления циклизации, которые завершаются β-гидридным переносом, образованием продуктов аллилирования и регенерацией NiPn:
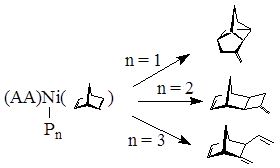
Рисунок 1.4. Зависимость направления реакции аллилировани НБД от соотношения P(O-iC3H7) /Ni.
Совокупность литературных и экспериментальных данных 7 9 10 позволили авторам предложить механизм каталитического аллилирования НБД (рис 1.4) В соответствии с ним комплексы allNiPnOAc доминируют в реакционной среде. Молекула НБД, координируясь на атоме никеля вызывает η3 – η1 – изомеризацию аллилиьного лиганда, а затем внедряется по связи η1 – аллил – металл. Затем, в зависимости от колличества фосфорорганического заместителя, осуществляются различные направления циклизации, которые завершаются β – гидридным переносом, образованием продуктов и регенирацией NiPn, к которому быстро окислительно присоединяется молекула аллилацетата из раствора. При n=1 происходит хелатная координация НБД в комплексе, что вызывает образование продукта III, имеющего нортрициклическое строение 10.

Рисунок 1.5. Заключительная часть механизма каталитического аллилирования НБД аллилацетатом.
Стадия гидридного переноса, очевидно, лимитирует процесс. Протекание такой стадии с участием β – углеродного атома подтверждено при использовании модельной системы C3D5OCOCD3.
Рисунок 1.6. Фрагмент мехпнизма каталитического аллилрования НБД аллилацетатом для модельной системы C3D5OCOCD3 – НБД.
Малекулярные массы продуктов I и II различаются, что подтверждает возможность отрыва атома водорода как из НБД – кольца, так и аллильного фрагмента.
Уксусная кислота как и в случае НБН, дестабилизирует каталитическую систему. По этой причине в статическом реакторе количество оборотов катализатора, как правило, не превышает 150 – 200.
Применение цеалитов 11 12 позволяет существенно повысить время жизни катализатора и увеличить число каталитических циклов до 2000.
Влияние соотношения реагентов – НБД и аллилиацетата – на закономерности процесса.
Выше было показано, что максимальный выход продуктов аллилирования НБД I – III наблюдается при эквимолярном соотношении реагентов. При избытке НБД образуется незначительное количество его димеров и падает суммарная скорость процесса 5.
Если взаимодействие НБД проводить с двукратным мольным избытком аллилацетата (200С, НБД: Ni(acac) 2, 10-15: 1), то в реакционной смеси на ряду с продуктами I – III, появляется продукт IV, образование которого представлено авторами как присоединение к НБД 2 молей аллилацетата. Позднее было показано 9 10, что в этих условиях наблюдается вторичное аллилирование соединений с норборненовыми структурами I и II, приводящее к большому количеству изомерных продуктов (реакция 6):
(6)
Строение и соотношение продуктов двойного аллилирования НБД зависит от условий – температуры и соотношения P/Ni. Скорость аллилирования двойной связи НБД в несколько раз превышает скорость стадии повторного аллилирования.
Аллилирование НБД комплексами палладия.
Модель единичного каталитического цикла, описанная в разделе 1.2.1, оказалась очень удобной для изучения для изучения основных направлений циклоприсоединения аллильного фрагмента к НБД и установления деталей механизма. В работе Берселлини и сотр.15 показано, что в этой стехиометрической реакции помимо соединений никеля могут быть использованы аллильные комплексы других металлов – железа, родия, палладия и платины. На основании совокупности литературных данных в 1991 году была высказана гипотеза о возможности разработки каталитических систем с участием широкого круга переходных металлов 7. В 2000 году появилось сообщение об использовании палладиевого катализатора для аллилирования НБН 16.
Строение продуктов аллилирования НБД, образующихся в присутствии комплексов палладия 17 18, аналогично строению продуктов никель-катализируемой реакции 5. При этом для различных исходных палладиевых систем наблюдается примерно одинаковая активность и близкие соотношения продуктов реакции. Что свидетельствует о генерировании одних и тех же каталитически активных комплексах. В качестве предшественников каталитически активных частиц реакции 5 использовались Pd(dba) 2+2PPh3, Pd(OAc) 2+2PPh3, PdCl2(PPh3) 2, [(C3H5) Pd] NO3+2PPh3. В качестве аллилрующего агента использовали аллилацетат.
Палладиевые катализаторы проявляют активность как на воздухе, так и в инертной атмосфере, тогда как никелевые системы активны только в условиях полного отсутствия кислорода. Однако, несмотря на то, что присутствие воздуха не приводит к разрушению палладиевой каталитической системы, скорость реакции в этих условиях низкая. Причиной дезактивации катализатора является побочная реакция окисления трифенилфосфина.
Соотношение продуктов аллилирования НБД зависит от температуры. При 25 – 60 0С преимущественно образуются продукты I и II, в которых сохраняется норборненовая двойная связь. При более высокой температуре (80 0С) наблюдается рост относительного количества соединения III, являющегося [2+4] -циклоаддуктом.
Проведение реакции в спиртовых средах способствует незначительному увеличению относительного количества соединения I.
При мольном соотношении АА/НБД более единицы происходит вторичное аллилирование незамещенной норборненовой двойной связи в соединения содержащих метилен циклобутановый фрагмент (I) или винильную г и метиленовую группу(II) (реакция 7) 17.
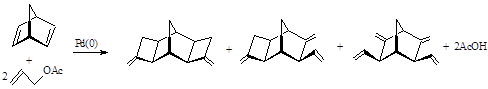
(7)
Общий характер диспропорционирования водорода между η3-аллильными лигандами подтвержден для комплексов различных переходных металлов Со, Fe, Ni, Rh, Pd и Pt 19 20 21. Таким образом, в работе Берселлини и сотрудников 15 показана η3 – η1 – изомеризацию аллилиьного лиганда в комплексах палладия в присутствии непредельных углеводородов.
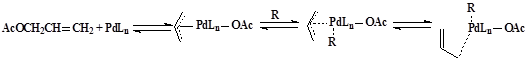
R ≡ непредельный углеводород.
Сравнивая каталитические системы на основе на основе комплексов никеля и палладия, следует отметить, что никелевые катализаторы более активны, а оптимизация ряда параметров каталитического процесса (температуры, соотношение фосфит-никель, удаление образующейся кислоты) позволяет повысить селективность по каждому из продуктов до 80 – 95%. Палладиевые катализаторы проявляют меньшую удельную активность, но более стабильны в присутствии кислорода и легко регенерируются.
Аллилирующие агенты в реакциях циклоприсоединения НБД и НБН – производных.
Аллилирующими агентами служат сложные аллиловые эфиры органических кислот, среди которых наиболее часто используется аллилацетат. Аналогичные результаты могут быть полученны при использовании аллилпропионата, аллилбутирата или аллилбензоата 3 22. В ряде работ в качестве источника аллильных фрагментов упоминается аллилформиат, но конкретные данные, связанные с его использованием в реакциях аллилирования с НБД и НБН-производными в литературе отсутствуют.
Циклосодимеризация аллилформиата с НБН лает возможность получать циклический продукт аллилирования I с селективностью 100%, однако общий выход содимера в этих опытах намного ниже, чем с АА 3. Как было выяснено авторами, причиной разрушения катализатора в опытах с аллилформиатом является образующаяся в ходе реакции НСООН. Муравьиная кислота образуется в больших каллилчествах в реакционной среде и в данных условиях накапливается без разложения.
Этими же авторами было показано, что участие в реакции аллилирования НБН других аллиловых производных – аллиловый спирт, диаллиловый эфир, аллилгалогениды – в данных условиях невозможно.
В качестве других классов органических соединений способных участвовать в реакции аллилирования в работах Киузоли упоминаются аллилигалагениды и потенциально – аллиловый спирт и диалллиловый эфир 13.
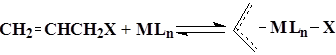
X ≡ Cl, Br, I, OH и OR;
M ≡ Ni0, Pd0.
В этой работе показано, что реакции цикклоприсоединения с участием аллилгалогенидов протекает в атмосфере монооксида углерода, молекула которого, встраиваясь по связи С – М, облегчает η3 – η1 – изомеризацию и формирование аллильного фрагмента. В этих условиях возможно формирование аллильного фрагмента и каталттически активного комплекса металла. В присутствии непредельного углеводорода происходит его координация на активном атоме, а затем образование продуктов присоединения. В качестве побочных продуктов образуется кислота.
Из анализа литературных данных следует, что в настоящее время известны многочисленные каталитические системы для реакции аллилирования НБД и НБН – производных.
Имеющиеся в литературе данные позволяют выявить основные закономерности, присущие процессам с участием НБД и катализируемые никелевыми катализаторами. Факторы и тенденции, определяющие образование продуктов определенного строения и регулирования селективности процесса, недостаточно изучены.
Имеются лишь отдельные работы, посвященные исследованию механизма каталитического аллилирования НБД и НБН – производных, выявлению природы и строения каталитически активных комплексов, определяющих структуру образующихся соединений и ответственных за селективность процесса, а также позволяющих целенаправленно проводить синтезы продуктов заданного строения.
Только незначительное количество работ посвящено исследованию кинетических закономерностей. Небольшое количество подобных данных затрудняет возможность делать обоснованные выводы о механизме этих реакций и целенаправленный поиск новых селективных каталитических систем.
Малоизученна возможность проведения каталитического аллилирования НБД и НБН – производных при использовании в качестве катализаторов не только комплексов никеля, но и комплексов других переходных металлов. В частности, комплексов переходных металлов Pt, Co, Rh. Следует отметить, что в последнее время большое внимание уделяется возможности использования в данной реакции каталитических систем на основе комплексов Pd.
В изученной литературе достаточно полно изучено взаимодействие НБД и НБН – производных с аллилацетатом, используемом в качестве аллилирующего агента. В ряде работ приведены аналогичные результаты и для других сложных аллиловых эфиров органических кислот: аллилпропионата, аллилбутирата и аллилбензоата. Наименее изученым аллиловым эфиром является аллилформиат.
В изученной литературе отмечено о возможности использования в качестве аллилирующих агентов и других классов аллильных соединений: аллилового спирта, простых аллиловых эфиров, аллилгалогенидов. Однако, отсутствуют конкретные данные об использовании этих веществ в реакции каталитического аллилирования НБД и НБН – произвоных.
Анализ литературных данных по реакции аллилирования НБД и НБН – производных показывает, что металлокомплексные катализаторы обеспечивают уникальные возможности для получения разнообразных полициклических углеводородов, а их использование является наиболее перспективным путем развития этого синтетического направления. Тем не менее, несмотря на обилие экспериментальных данных, в настоящее время лишь в небольшом количестве работ выявлены особенности механизма данного процесса.
Реакция аллилирования НБД и НБН – производных облавает чрезвычайно богатыми синтетическими возможностями. Но этот фактор порождает проблемы, связанные с одновременной реализацией сразу нескольких реакций в одной и той же реакционной системе. Трудности разделения и анализа изомерных продуктов, вопросы рационвльного использования реагентов и недостаточная эффективность катализаторов во многом ограничивают крупномасштабное применение НБД.
Как было отмечено, для НБД-производных существуют все известные на сегодняшний день виды изомерии: скелетная (для продуктов, полученных циклоприсоединением различного типа), регио, стерео (цис/транс, экзо/эндо, син/анти), оптическая. Переходные металлы принципиально способны влиять на селективность любого уровня, однако для этого необходима детальная информация о механизме их действия. К сожалению, в литературе практически отсутствуют такие данные. Большую редкость представляют кинетические исследования, необходимые для установления механизма и оценки реакционной способности.
В большинстве работ, посвященных реакции аллилирования НБД и НБН – производных, рассматривается процесс содимеризации с аллиловыми эфирами карбоновых кислот в присутствии каталитических систем на основе комплексных соединений никеля. В ряде работ упоминается возможность использования комплексов других переходных металлов. В связи с этим было интересно выяснить особенности поведения комплексов палладия, которые так же проявляют каталитическую активность и являются более устойчивыми.
Как уже было отмечено, аллилирующими агентами служат сложные аллиловые эфиры органических кислот, среди которых наиболее часто используется аллилацетат. Аналогичные результаты могут быть полученны при использовании аллилпропионата, аллилбутирата или аллилбензоата. Особняком в этом списке стоит аллилформиат. Хотя в ряде работ он упоминается в качестве источника аллильных фрагментов, но конкретные данные, связанные с его использованием в реакциях аллилирования с НБД и НБ-производными в литературе отсутствуют. Этот факт вызывает удивление, учитывая коммерческую доступность АФ и легкость формирования из него η3-аллильных производных переходных металлов – ключевых интермедиатов каталитического процесса. В связи с вышеизложенным изучение особенностей поведения АФ в реакции аллилирования НБД представляется весьма актуальным.
Кроме того, в литературе отсутствуют данные о возможности использования других классов аллильных производных, что также является актуальным направлением в исследовании реакции.
Вызывает также интерес выяснение роли образующейся в ходе реакции карбоновой кислоты, природа которой, несомненно, оказывает влияние на устойчивость каталитической системы.
Использованные реактивы, их квалификация и очистка.
Применявшиеся в качестве растворителя вещества (ацетонитрил, метанол) квалификации "осч" очищали стандартными методами 23.
Ацетонитрил перегоняли над пентаоксидом фосфора. Метанол очищали дистиляцией.
Применявшийся в качестве реагентов аллилформиат, аллиловый спирт, диаллиловый эфир, НБД марки "ч" сушили над хлоритым кальцием, подвергали фракционной перегонке. Чистота не менее 98%.
Дейтерированый реагент: 6 – D – аллиловый спирт – содержание дейтерия не менее 99%.
Аргон "осч", азот "осч" очищали на установке ПГ. Остаточное содержание кислорода не более 10-4% об.
Монооксод углерода получали разложением муравьиной кислоты при воздействии концентрированной серной кислотой. Затем сушили над хлористым кальцием.
Диоксид углерода "ч" очищали от примесей кислорода и влаги на установке ПГ; от других газов – двукратной переконденсацией при 0,1 Па и температуре –1960С.
Трифенилфосфин фирмы Aldrich применяли без дополнительной очистки. Чистота не менее 99%.
2.1. Физико – химические методы исследования и условия их применения.
Масс-спектрометрия. Регистрацию масс-спектров проводили на спектрометре "MS80 Kratos" при энергии ионизирующих электронов 70 эВ, токе эмиссии катода 100 мкА и температуре системы напуска 150°С. Спектры получали в режиме электронного удара, а также химической ионизации. Образцы вводили в источник ионов через хроматографическую приставку. Хроматограф 689 ONAgilentTechnologiesс капиллярной колонкой длиной 30 м, с диаметром 0.75 мм, фаза "OV – 1", толщина пленки 1мкм.
ГЖХ – анализ. Хроматограф "Хром-5", пламенно-ионизационный детектор, капиллярные колонки SPB-20 и β-DEX фирмы "Supleco" длиной 30 м, с диаметром 0,75 мм, толщина пленок 1 мкм. ЛХМ – 8MD, пламенно-ионизационный детектор, капиллярная колонка, активированный уголь, 3м.
Методики проведения экспериментов.
Аллилирование НБД аллилформиатом.
Исследования проводили в термостатированном вакуумируемом реакторе, снабженном магнитной мешалкой и устройством для отбора проб (рис.2.1). После загрузки всех компонентов реактор обескислороживали. Реакцию проводили в вакууме или в атмосфере аргона при варьировании температуры от 25 до 650С. Соотношение исходных реагентов: НБД/АФ=1/1, Pd3(OAc) 6/НБД=1/10, ТФФ/ Pd3(OAc) 6=2/1. Растворитель – ацетонитрил или метиловый спирт – 0,5 мл.
Взятую навеску диацетата палладия растворяли в ацетонитриле (метаноле) раствор приобретал бурый цвет.д.олее добавляли необходимое количество НБД и аллилформиат, при этом наблюдается покраснение раствора. Далее в полученный раствор вносили заранее взятую навеску трифенилфосфин. Для обескислороживания системы, реактор многократно подвергали вакуумированию при – 1960С при 0,1 Па.
В зависимости от выбранной температуры процесса длительность проведения реакции различная. Процесс сопровождается изменением окраски реакционного раствора. При завершении процесса выделяется неактивный комплекс палладия – осадок черного цвета.
Исследования проводили в термостатированном вакуумируемом реакторе, снабженном магнитной мешалкой и устройством для отбора проб (рис.2.1). После загрузки всех компонентов реактор обескислороживали. Реакцию проводили в атмосфере монооксида (диоксида) углерода при варьировании температуры от 25 до 650С. Соотношение исходных реагентов: НБД/АФ=1/1, kat/НБД=1/10, ТФФ/ Pd3(OAc) 6=2/1. Растворитель – ацетонитрил или метиловый спирт – 0,5 мл.
Взятую навеску диацетата палладия растворяли в ацетонитриле (метаноле) раствор приобретал бурый цвет.д.олее добавляли необходимое количество НБД и аллилформиат, при этом наблюдается покраснение раствора. Далее в полученный раствор вносили заранее взятую навеску трифенилфосфин. Для обескислороживания системы, реактор многократно подвергали вакуумированию при – 1960С при 0,1 Па.
В зависимости от выбранной температуры процесса длительность проведения реакции различная. Процесс сопровождается изменением окраски реакционного раствора. При завершении процесса выделяется неактивный комплекс палладия – осадок черного цвета.
Аллилирование НБД диаллиловым эфиром.
Исследования проводили в термостатированном вакуумируемом реакторе, снабженном магнитной мешалкой и устройством для отбора проб (рис.2.1). После загрузки всех компонентов реактор обескислороживали. Реакцию проводили в атмосфере монооксида углерода при варьировании температуры от 25 до 650С. Соотношение исходных реагентов: НБД/диаллиловый эфир =1/1, Pd3(OAc) 6/НБД=1/10, ТФФ/ Pd3(OAc) 6=2/1. Растворитель – ацетонитрил или метиловый спирт – 0,5 мл.
Взятую навеску диацетата палладия растворяли в ацетонитриле (метаноле) раствор приобретал бурый цвет.д.олее добавляли необходимое количество НБД и аллилформиат, при этом наблюдается покраснение раствора. Далее в полученный раствор вносили заранее взятую навеску трифенилфосфина. Для обескислороживания системы, реактор многократно подвергали вакуумированию при – 1960С при 0,1 Па. Далее к реактору присодиняли балон с СО, предворительно продувая сединительные трубки, исклучая возможность попадания в реакционный объем кислорода воздуха и влаги.
В зависимости от выбранной температуры процесса длительность проведения реакции различная. Процесс сопровождается изменением окраски реакционного раствора. При завершении процесса выделяется неактивный комплекс палладия – осадок красного цвета.
Аллилирование НБД 6 –
D – аллиловым спиртом.
Исследования проводили в термостатированном вакуумируемом реакторе, снабженном магнитной мешалкой и устройством для отбора проб (рис.2.1). После загрузки всех компонентов реактор обескислороживали. Реакцию проводили в атмосфере монооксида углерода при варьировании температуры от 25 до 650С. Соотношение исходных реагентов: НБД/6 – D – аллиловый спирт=1/1, Pd3(OAc) 6/НБД=1/10, ТФФ/ Pd3(OAc) 6=2/1. Растворитель – ацетонитрил или метиловый спирт – 0,5 мл.
Взятую навеску диацетата палладия растворяли в ацетонитриле (метаноле) раствор приобретал бурый цвет. Далее добавляли необходимое количество НБД и аллилового спирта, при этом наблюдается покраснение раствора. Далее в полученный раствор вносили заранее взятую навеску трифенилфосфина. Для обескислороживания системы, реактор многократно подвергали вакуумированию при – 1960С при 0,1 Па. Далее к реактору присодиняли балон с СО, предворительно продувая сединительные трубки, исключая возможность попадания в реакционный объем кислорода воздуха и влаги. В зависимости от выбранной температуры процесса длительность проведения реакции различная. Процесс сопровождается изменением окраски реакционного раствора. При завершении процесса выделяется неактивный комплекс палладия – осадок черного цвета.
Физико – химические свойства продуктов аллилирования.
| №№ |
Структура |
Молек. масса |
Т кип., 0С (Р, мм рт. ст) |
nD20 |
| I |
 |
132 |
54,0 (20) |
1,4800 |
| II |
 |
132 |
52,5 (20) |
1,4785 |
| III |
 |
132 |
67,5 (20) |
1,5094 |
| IV |
 |
172 |
59 – 60 (20) |
1,5035 |
| V |
 |
172 |
56,5 – 57,0 (20) |
1,5185 |
| VI |
 |
172 |
52,0 – 53,0 (20) |
1,5134 |
| VII |
 |
134 |
78,0 – 80,0 (20) |
1,4940 |
| VIII |
 |
134 |
76,5 – 77,5 (20) |
1,5005 |
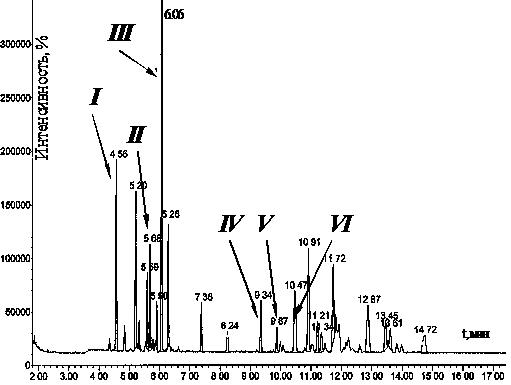
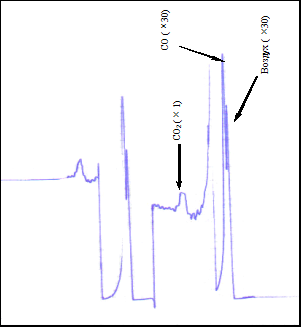
Типичный вид хроматограммы реакционного раствора при взаимодействии НБД и АФ.
Массспектры продуктов аллилирования и двойного аллилирования НБД.
Типичная хроматограмма газовой фазы.
Глава 3. Результаты и их обсуждение
Взаимодействие НБД с АФ приводит к образованию разнообразных соединений количественно превышающих число продуктов аллилирования НБД другими аллиловыми эфирами. Типичная хроматограмма реакционного раствора приведена в пункте 2.5.
Многие продукты аллилирования НБД аллилформиатом и аллилацетатом имеют одинаковое строение. Это моноаддукты I – III, характеризующиеся молекулярной массой 132, и пространственные изомеры продуктов двойного аллилирования НБД IV – VI с массами 172 (таблица 3).
Новые соединения при использованиии АФ имеют массы 134, 174 и 176. Очевидно они образуются при гидрировании I, II, V, VI. Гидрированию преимущественно подвергаются соединения, имеющие активную внутрициклическую двойную связь (I и II), или вещества, содержащие винильные группы (I, V, VI). Продукты гидрирования метиленовых групп в указанных условиях не наблюдаются.
Помимо указанных соединений обнаружены продукты присоединения АФ к НБД (XIII и XIV), а также в незначительных количествах (2 – 5%) норборнен. В газовой фазе обнаружено до 3% углекислого газа СО2.
Таблица 3
Строение продуктов аллилирования НБД аллилформиатом.
Все соединения, образующиеся в ходе реакции, можно формально классифицировать как аддукты НБД с С3Н4, С3Н6, Н2 и НСООН. Очевидно, источником этих гипотетических частиц или молекул являются аллильные фрагменты, изначально входящие в состав аллилформиата. Аллил (С3Н5) образует фрагмент С3Н4, а акцептором атома водорода формально служат или другой аллил, или формильный остаток. Возможна также рекомбинация двух атомов водорода (рисунок 3.1):
Рассматривая эту реакцию как окислительно-восстановительное диспропорционирование, связанное с гидридным переносом, представляется возможным провести оценку материального баланса продуктов "окисления" и "восстановления". К продуктам окисления с этой точки зрения следует отнести соединения I – VI и СО2, восстановительными продуктами являются, продукты гидрирования и гидрокарбоксилирования. Молекулярный водород и муравьиная кислота – потенциальные продукты восстановления – в реакционной системе не образуются. При сведении материального баланса следует учитывать, что соединения IV – VI – являются дважды окисленными (С7Н8+2С3Н4), а соединение XII – дважды восстановленным.
Рисунок 3.1. Механизма каталитического аллилирования НБД аллилформиатом. Предварительные результаты свидетельствуют, что окислительно-восстановительный баланс удовлетворительно соблюдается не только между конечными продуктами, но и в ходе каждого эксперимента при различных конверсиях реагентов.
Дополнив предложенный ранее механизм каталитического аллилирования НБД аллилацетатом можно объяснить образование всех наблюдаемых продуктов (рис.2).
 В соответствии с ним формирование соединений I – VI в присутствии АФ происходит аналогично другим аллиловым эфирам. В соответствии с ним формирование соединений I – VI в присутствии АФ происходит аналогично другим аллиловым эфирам.
Ключевая роль в образовании продуктов гидрирования и гидроформилирования НБД и соединений I, II, IV – VI по-видимому играет гидридный комплекс, образующийся на стадии β – гидридного переноса.
Для всех R, являющихся алкильными или арильными радикалами, распад этого интермедиата в результате восстановительного элиминирования приводит к образованию кислоты RCOOH. В случае R = H ситуация принципиальна иная. Известно, например, что в присутствии комплексов Pd, муравьиная кислота является является гидрирующим агентом и распадается с образованием CO2.

Тогда можно предположить, что формирующийся комплекс может участвовать в следующих превращениях:
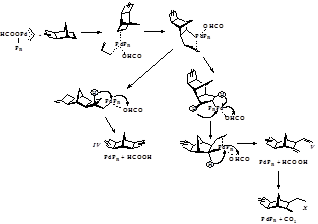

Рисунок 3.2. Заключительная часть механизма каталитического аллилирования НБД аллилформиатом.
Все направления реализуются одновременно, их соотношение зависят от концентрации всех реагентов, что, в свою очередь, определяется степенью конверсии НБД.
Восстановление двойных связей, вероятно связано с образованием в реакционной смеси муравьиной кислоты, являющейся гидрирующим агентом, т. к. при ее разложение, по одному из возможных путей, в присутствии катализатора, образуется углекислый газ и водород. При анализе газовой фазы в реакторе действительно был обнаружен углекислый газ, что подтверждает наши предположения.
Следует отметить, при анализе реакционной смеси молекулярный водород и муравьиная кислота – потенциальные продукты восстановления – не обнаружены. Возможно, вся образующаяся кислота расходуется на образование продуктов гидрирования.
Заметим, если аллилирующим агентом является аллилацетат, в ходе реакции образуется устойчивая уксусная кислота. Она оказывает дезактивирующее действие на катализатор, накапливаясь в реакторе. Таким образом, при использовании аллилформиата, как аллилирующего агента, образуется более устойчивая каталитическая система. Следует также отметить, что по качественным наблюдениям реакция с аллилформиатом протекает значительно быстрее, чем с аллилацетатом. Этот факт требует дополнительного исследования.
Необходимо также отметить, что в ходе реакции образуется углекислый газ. Причем СО2, образующийся в качестве побочного продукта реакции, абсолютно индеферентен и не оказывает дезактивирующего влияния на каталитическую систему.
3.2. Каталитическое аллилирование НБД аллиловым спиртом.
Как показано в пункте 1.3, протекание реакции каталитического аллилирования НБД при использовании аллилового спирта, в обычных условиях проведения данного процесса, невозможно.
Анализируя механизм реакции (рис.3.1), нами было установлено, что для протекания реакции необходимо, чтобы аллильные производные (All-X) окислительно присоединялись к палладию, с образованием аллильного фрагмента (рис.3.2). Рисунок 3.2. Образование аллильного фрагмента при взаимодействии аллилового спитра и комплекса палладия, в присутствии монооксида углерода.
На этом основании было сделано предположение возможности протекания реакции при использовании аллилового спирта, как аллилирующего агента (реакция 8). Если в реакционной смеси устанавливается равновесие между спиртом, палладием(0) и комплексом типа C3H5O-Pd-H. Однако, следует заметить, что в атмосфере инертного газа реакция аллилирования не протекает, т.е. не происходит формирования алилильного фрагмента. В атмосфере монооксида углерода в последнем комплексе возможно встраивание молекулы СО по связи О-Pd или Pd-H, наблюдается смещение равновесия, при этом высвобождается каталитически активный палладий(0) и образуется аллилформиат. В результате реакции действительно образовывались продукты аллилирования и двойного аллилирования НБД, продукты одновременного аллилирования и гидрирования, а также продукты содержащие остаток муравьиной кислоты (группу –ОСОН) с массой 138, что может подтверждать образование аллилформиата, как промежуточного соединения.
(8)
Последующее стадии механизма аллилирования напоминают механизм аллилилрования НБД аллилиформиатом. Т.е. на активном атоме аллильного комплекса паладия происходит координация молекулы НБД. В комплексе происходит η3 – η1 – изомеризация аллильного фрагмента и циклоприсоединение аллильного фрагмента к молекуле НБД. Стадия гидридного переноса, как и в случае с аллилацетатом и аллилформиатом, лимитирует процесс.
Так же как и в случае с аллилформиатом при анализе газовой фазы обнаружен диоксид углерода, что свидетельствует о протекании подобных процессов.
Следует заметь, что образование муравьиной кислоты и молекулярного водорода не наблюдалось.
Чтобы подтвердить протекание данной реакции по механизму, аналогичному рассмотренному выше, мы заменили аллиловый спирт на 6-D-аллиливый спирт. Здесь были обнаружены продукты аналогичного строения, имеющие массу 136, 137, 178 и 179. Рисунок 3.3. Взаимодействие НБД с 6-D-вллиловым спиртом.
Малекулярные массы продуктов I и II, IV и V различаются, что подтверждает возмоность отрыва атома водорода как из НБД – кольца, так и аллильного фрагмента.
Таким образом, в реакционной системе формально наблюдается кинетическое сопряжение двух реакций – окисление СО в СО2 и собственно реакция аллилирования НБД.
Следует отметить, что в ходе исследований была проведена реакция палладийкаталитического аллилирования НБД аллиловым спиртом в присутствии диоксида углерода.
Предпосылкой для проведения такого процесса, была высказана в связи с возможностью образования аллильного комплекса палладия.
Рисунок 3.3. Образование аллильного фрагмента при взаимодействии аллилового спитра и комплекса палладия, в присутствии монооксида углерода. Формирование аллильного комплекса палладия напоминает механизм аллильного комплекса в присутствии монооксида углерода.
В атмосфере диоксида углерода в последнем комплексе возможно встраивание молекулы СО2 по связи Pd-H, наблюдается смещение равновесия, при этом высвобождается каталитически активный палладий(0) и образуется аллилкарбонат. В результате реакции действительно образовывались продукты аллилирования и двойного аллилирования НБД, продукты одновременного аллилирования и гидрирования.
Необходимо также отметить, что в качестве побочного продукта образуется диоксид углерода. Таким образом диоксид углерода формально является сокатализатором в данном процессе.
Однако, механизм образования СО2 до конца еще не выяснен и этот факт требует проведения дополнительных исследований.
Для подтверждения механизма реакции каталитического аллилирования НБД, показанного в пункте 3.1. была проведена реакция взаимодействия НБД с аллиловым спиртом в присутствии муравьиной кислоты.
Рисунок 3.4. Схема образования продуктов аллилирования и гидрирования НБД, в присутствии НСООН. В данных условиях действительно образуются продукты аллилирования и гидрирования НБД. Однако, образование продуктов может быть связано с процессами переэтерификации и образование аллилацетата. Поэтому, в данном случае требуется проведение дополнительных экспериментов.
Каталитическое аллилирование НБД диаллиловым эфиром.
Еще одним аллильным производным, выбранном нами, как возможный аллилирующий агент, стал диаллиловый эфир.
Предположение о возможности протекания данной реакции была высказана в связи с наличием связи С–О. Палладий может встраиваться по сязи С-О, с образованием аллильного комплекса (рис.3.3)

Рисунок
3.3. Формирование аллильного комплекса
При исследовании реакционного раствора, продуктов аллилирования обнаружено не было. Это может быть связанно с отсутствием непрочной связи О-Н в простом эфире, что затрудняет образование аллильного фрагмента. По-видимому, в образующиеся комплексе связи палладия достаточно прочные.Т. о., в образовавшемся комплексе невозможно встраивание молекулы СО и координации молекулы НБД, что, как было показано выше, вызывает η3 – η1 – изомеризацию аллильного лиганда и образование аллильного фрагмента.
Следует отметить, что при анализе газовой фазы, не было обнаружено диоксида углерода, что также косвенно подтверждает невозможность протекания реакции аллилирования НБД при использования в качестве аллилирующего агента диаллилового эфира.
Проведен литературный анализ реакции аллилирования НБД в присутствии различных каталитических систем и различных аллилирующих агентов.
Разработана методика проведения каталитического аллилирования НБД в безкислородных условиях, освоены физико-химические методы анализа строения продуктов реакции и кинетического контроля за протеканием процесса.
Изучено взаимодействие НБД с аллилформиатом в присутствии комплексов палладия. Идентифицированы продукты реакции аллилирования и двойного аллилирования НБД, предложен непроворичивый механихм протекания процесса. Показано, что побочным продуктом реакции является диоксид углерода, не оказывающий дезактивирующего воздействия на устойчивость каталитической системы.
Предложены новые аллилирующие агенты, которые представляют собой системы аллиловый спирт – монооксид углерода и аллиловый спирт – диоксид углерода. Предложены механизмы генерирования ключевых интермедиатов.
Список
использованной литературы
1. Catellani M., Chiusoli G. P., Dradi E., Salerno G. Nickel-catalysed allilation of norborne. // . / Organomet. Chem., 1979, 177, р. С29-С31.
2. Catellani M., Chiusoli G. P., Mari A. Palladium – or nickel-catalysed sequential reaction of organic bromides, bicycle [2.2.1.] hept – 2 – ene or bicycle [2.2.1.] hepta – 2,5 – di and alkynes. // . / Organomet. Chem., 1984, 275, р.129 – 138.
3. Джемилев У.М., Хуснутдинов Р.И., Галеев Д.К., Нефедов О.М., Толстиков Г.А. Катализируемая комплексами никеля содимеризация аллиловых эфиров карбоновых кислот с соединениями норборненового ряда. // Изв. АН СССР, Сер. хим., 1987, № l,c,138-148.
4. Джемилева Г.А., одинокое В.Н., Джемилев У.М. Катализированное комплексами переходных металлов окисление непредельных линейных и циклических углеводородов молекулярным кислородом. II Изв. АН СССР, Сер. хим., 1987, № 1, с.149-154.
5. Джемилев У.М., Хуснутдинов Р.И., Галеев Д.К., Толстиков Г, А. Катализируемая комплексами никеля соолигомеризация аллилацетата с норборнадиеном и его производными. И Изв. АН СССР, Сер. Хим, № 1, с.154-160.
6. Халилов Л.М., Султанова B. C., Панасенко А.А., Хуснутдинов Р.И., Галеев Д.К., Толстяков Г.А., Джемилев У.М. Спектры ЯМР 13С поли циклических соединений и стереохимия непредельных производных бицикло [2.2.1. гепт(ен) ана и родственных структур. II Изв. АН СССР, Сер, хим., 1987, № 4, с.1018-1024.
7. Флид В. Р., Манулик О.С., Белов А.П., Григорьев А.А. Аллилироваяие норборнадиена-2,5 гомолигандными η3-аллильными комплексами переходных металлов. // Металлоорганическая химия 1991, 4, №4, с,864-871.
8. Flid V. R., Belozerov V. E., Belov A. P. p-Hydride transfer - a key step of homogeneous catalytic allylation of norbornadiene. // 10th Internat. Symp. on Homogeneous Catalysis. Princeton, NJ, USA, 1996. Abstracts. p. A-61.
9. Флид В. Р., Кацман Е.А., Манулик О.С., Белов АЛ. Кинетика и механизм реакции кислотного распада бис(η3-аллил) никеля. // Кинетика и катализ, 1992, 33, N2, с.288-291.
10. Флид В.Р. Физико-химические основы каталитических синтезов с участием норборнадиена и аллильных производных. Диссертация на соискание ученой степени доктора химических наук. М. 2000.
11. Миначев Х.М., Кондратьев Д.А. Свойства и применение в катализе цеолитов типа пентасила. И Успехи химии, 1983, 52, N12, с. 1921-1973.
12. Миначев Х.М., Исаков Я.И. Цеолитные катализаторы в нефтехимии. // Нефтехимия, 1976,16, N3, с.384-410.
13. Chiusoli G. P. New Aspects of Organic Syntheses Catalyzed by Group VIII Metal Complexes. // Pure & Appl. Chem., 52, p.635-648.
14. Yamamoto T., Osamu S., Yamamoto A. Oxidative Addition of Acetate to Pd(0) Complexes. // J. Am. Soc. 1981, 103, p.5600 – 5602.
15. Bersellini U., Catellani M., Chiusoli G. P., Giroldini W., Salerno G. Some Cooperative Effects in Catalysis of Carbon – Carbon Bond Formation by Metal Comlexes. // Fund. Res. Homogen. Cat. 1979, 5076, p.893 – 908.
16. Tsukada N., Sato T., Inoue Y. // Tetrahedron Lett. 2000. V.41. P 4181.
17. Евстегнеева Е.М., Манулик О.С., Флид В.Р. // Нетрадиционное Аллилирование Нрборнадиена, Катализируемое Комплексами Палладия. Кин. и Кат., 2004, том 45, №2, с.188 – 191.
18. Flid V., Evstigneeva E., Efros I., Manulic O. Common Features and Specifics of Nickel and Palladium Complexes in Regio/Stereoselectiv Catalytic Norbornadien Allylation. // 14th Internat. Symposium on Homog. Cat. Munich, Germany, 2004. Abstracts., P.0345.
19. Geyer C., Schindler S. *; Kinetic Analysis of the Reaction of Isoprene with Carbon Dioxide and a Nickel(O) Complex. // Organometallics; 1998,17, No. 20, p.4400-4405.
20. Fu P-f, Khan M. A., Nicholas K. M. Carbon Dioxide complexes via aerobic oxidation of transition metal carbonyls. // J. Am. Chem. Soc., 1992,114, No.16, p.6579-6580
21. Holzhey N., Fitter S., Dinjus, E. Die heterogen katalysirte Co-oligomerisation von 1,3 - Butadien und CO2 mit immobilisierten Palladiumkomplexen. // J. Organomet. Chem. 1997, 541, No.1-2, p.243-248.
22. Флид В. Р., Манулик О.С., Грундель Л.М., Белов А.П. Парамагнитные комплексы никеля (I), стабилизированные норборнадиеном. // Теорет. эксперим. химия, 1990, 26, N4,c.490-493.
23. Perrin D. D., Armaredo W. L. F. Purification of Laboratory Chemicals.3rd, // Pergamon, Oxford, 1988, 605р.
|