Реферат на тему:
Методы экстракции в исследовании равновесий
Выполнила студентка 5го курса
Кекало Екатерина
Минск
Содержание:
Экстракция………………………………………………………….…..….3
1. Распределение лиганда………………………………………….6
2. Распределение комплексов металлов………………………….6
3. Синергизм………………………………………………………..9
4. Конкурирующие реакции ……………………………………..10
Список литературы………………………………………………….……11
Экстракция.
Экстракцией называют процесс распределения растворенного вещества между двумя несмешивающимися жидкими фазами и основанное на этом выделение и разделение веществ.
Процесс экстракции характеризуют следующими основнымивеличинами;
константа экстракции
Кекс
— константа равновесия реакцииэкстракции;
константа распределения Р
— отношение концентрации вещества в строго определенной форме в органической фазе к его концентрации в той же форме в водной фазе в условиях равновесия;
коэффициент распределения Е
— отношение аналитической (общей) концентрации вещества в органической фазе к его аналитической концентрации в водной фазе (обычно в условияхравновесия);
степень извлечения
R
— доля экстрагированного в фазу органического растворителя вещества от общего количества вещества при данных условиях в процентах;
фактор разделения
S
— отношение коэффициентов распределения двух разделяемых элементов.
Разделение веществ методом экстракции основано на различной растворимости их в несмешивающихся растворителях. Если какое-либо вещество способно растворяться (не диссоциируя и не ассоциируя при этом) в двух несмешивающихся растворителях, например в воде и в каком-нибудь органическом растворителе, то оно распределяется между этими двумя растворителями и устанавливается равновесие:
Авода
↔Ар-тель
По закону распределения, если распределяемое вещество в обеих фазах находится в одной и той же форме, то концентрации его в этих фазах связаны зависимостью:
[Ар-тель
]/[ Авода
] = E
где Е -
коэффициент распределения.
Коэффициент распределения зависят от температуры, свойств вещества и свойств фаз. Зависимость коэффициента распределения от температуры может быть самой разнообразной. В одних случаях с повышением температуры коэффициент распределения увеличивается — экстрагирование улучшается, в других коэффициент распределения уменьшается — экстрагирование ухудшается.
Реклама

На экстракцию внутрикомплексных соединений оказывают влияние большие количества солей-электролитов, присутствующих в водной фазе. Влияние солей-электролитов на экстрацию внутрикомплексных соединений очень разнообразно — оно зависит от реагента, природы экстрагируемого соединения, растворителя, природы соли.
Большое влияние, особенно на распределение органических комплексных соединений, оказывает кислотность среды.
В ряде случаев на экстракцию существенное влияние оказывает природа растворителя. На практике руководствуются в основном следующим: а) растворитель по возможности не должен смешиваться с водой; б) плотность растворителя должна в достаточной степени отличаться от плотности воды, так чтобы была четкой граница раздела между фазами; в) желательно, чтобы применяемые растворители имели не слишком низкую температуру кипения, так как интенсивное испарение растворителя мешает работе; г) растворитель должен быть в достаточно чистом виде.
К числу важных факторов, влияющих на экстракцию внутрикомплексных соединений, относится время контакта фаз. Практически во многих экстракционных системах равновесие достигается не мгновенно. Скорость экстракции зависит от скорости химических реакций, протекающих в системе, и от скорости массопередачи, т. е. переноса вещества между двумя фазами.
На скорость экстракции влияет также природа металла и реагента, условия экстракции. Изменение их может быть использовано для повышения избирательности экстракции. В ряде случаев различия в скорости экстракции элементов, присутствующих в смеси, настолько велики, что эти различия могут быть использованы для разделения элементов.
Применение экстракции для отделения определяемых ионов от ионов, мешающих определению, хорошо сочетается с физико-химическими (фотоколориметрическим, полярографическим и другими) методами определения отделенного иона в экстракте. В некоторых случаях такие определения могут быть проведены непосредственно в самом растворе после экстракции. Например, индий после экстракции его бензолом из раствора, содержащего родамин, может быть, определен в бензольном растворе по оптической плотности при 530 нм. Тантал, извлеченный циклогексаноном из сернокислого раствора, предложено определять спектральным путем в остатке после испарения циклогексанона.
Реклама

Нередко для дальнейшего определения применяют реэкстрагирование выделенного вещества из органической фазы. В большинстве случаев это осуществляется взбалтыванием органической фазы с кислым раствором или раствором реагентов, разрушающих комплексное соединение, в виде которого данный элемент выделен в органическую фазу. После реэкстрагирования элемент в водном растворе может быть определен полярографически или другим физико-химическим методом.
Экстрагирование проводят в делительных воронках, в этих воронках удобно отделять слои жидкостей.
В некоторых случаях, когда коэффициент распределения невелик, экстракцию проводят несколько раз. При этом каждый раз определенная доля вещества извлекается из водного раствора. Порции экстрагента затем объединяют и анализируют.
В большинстве случаев для аналитических целей бывает достаточно 2—3 экстракций. В особо сложных случаях для разделения многих компонентов приходится применять многократную противоточную экстракцию. Экстрагирование в сочетании с физико-химическими методами определения в настоящее время широко применяется в практике научно-исследовательских и заводских лабораторий. Применение экстракции позволяет извлекать вещества из очень разбавленных растворов, при этом экстрагируемое вещество количественно выделяется в чистом виде. Кроме того, экстракция дает возможность выделять и разделять вещества трудно или вовсе не разделяемые, другими методами.
Предложены способы экстракции большинства элементов и многих классов соединений. В качестве факторов, влияющих на процесс извлечения, широко используют комплексообразование и регулирование рН.
Варьирование условий экстракции открывает широкие возможности для аналитического применения ее с целью разделения и отделения различных ионов друг от друга. Здесь указано несколько примеров влияния условий экстракции на ее результат:
а) алюминий может быть отделен от железа и титана экстракцией хлороформом оксихинолятных комплексов этих металлов (при рН = 5 в хлороформный слой экстрагируется только оксихинолят алюминия);
б) никель и кобальт могут быть отделены от всех других металлов экстракцией хлороформом их комплексов с α-бензоил-диоксимом в широком интервале рН;
в) медь от многих металлов может быть отделена экстракцией гексанолом при рН = 7 в виде комплекса с батокупроионом;
г) титан от железа и алюминия можно отделить экстракцией хлороформом при рН = 5,3 его комплекса с 8-оксихинальдином, от ниобия и -тантала - титан можно отделить экстракцией изоамиловым спиртом из раствора, содержащего тартрат аммония, купферонатного комплекса титана при рН = 5.
Распределение вещества между двумя несмешивающимися жидкостями можно использовать для исследования равновесий комплексообразования. Распределяющимся веществом может быть лнганд или металлсодержащее соединение. Требование, чтобы две жидкие фазы, одной из которых обычно бывает вода или водный раствор, не смешивались, нередко выполняется частично. Если взаимная растворимость двух жидкостей значительна, то необходимо учитывать изменение среды и влияние этого изменения на константы комплексообразования. При изучении равновесий комплексообразования в водных растворах в качестве второй жидкости используют органический растворитель. Экстракцию соединений можно контролировать рядом методов. Наиболее общим является использование радиоактивных изотопов. Этот метод позволяет работать с очень низкими концентрациями металлов, что позволяет изучать моноядерные комплексы таких металлов, для которых характерно образование полиядерных комплексов.
Экспериментальная техника экстракции очень проста. Очень важно, чтобы обе жидкости были взаимно насыщены до экстракции. Для оценки константы равновесия распределение вещества должно быть определено в зависимости от изменения концентрации компонентов реакции экстракции. Каждое значение этой функции, т. е. каждая точка кривой распределения, определяется отдельным экспериментом. Недавно Рейнгард и Ридберг создали «прибор для непрерывного измерения экстракционных коэффициентов распределения». Этот прибор в настоящее время коммерчески доступен под наименованием AKUFVE — название прибора — начальные буквы слов, составляющих приведенную выше фразу в кавычках на шведском языке.
Прибор является одним из тех, который обладает исключительно большими возможностями для изучения равновесий комплексообразования, можно сказать, что создание автоматической аппаратуры для исследования экстракции представляет собой очень важное достижение.
Число работ по различным аспектам применения экстракции в химии растворов огромно, но здесь можно напомнить только о некоторых классических и наиболее важных.
1. Распределение лиганда
Если экстрагируется нейтральный лиганд или сопряженная ему кислота, в то время как комплекс металла не экстрагируется, то об образовании комплекса можно судить по изменению распределения лиганда в зависимости от концентрации иона металла (или лиганда).
Доусон и Мак-Грей уже в 1900 г. изучили образование аммиачных комплексов меди(II), исследуя распределение аммиака между водным раствором и органическими растворителями. Позднее этот же метод был использован для исследования комплексов гидразина, пиридина, анилина, ненасыщенных углеводородови комплексов (С2
Н5
0)2
РООН.
2. Распределение комплексов металлов
Экстрагируемость ионов металлов и комплексов металлов различными растворителями определяется многими условиями. Если лиганд заряжен и в процессе последовательного комплексообразования образуется электронейтральный комплекс, то этот комплекс может извлекаться органическим растворителем с низкой диэлектрической постоянной. Иногда этот незаряженный комплекс является последним в серии последовательно образующихся комплексов, но отмечены случаи, когда имеет место даль-
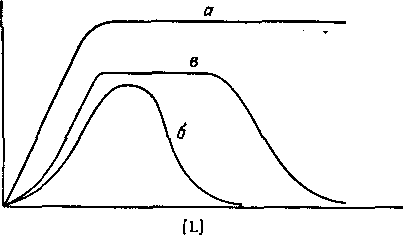
Рис. 1. Зависимость коэффициента распределения q
экстрагируемого соединения от концентрации свободного лиганда.
а —
образуется координационно насыщенный электроне игральны и комплекс;
6 -- а системе образуется анионный комплекс; в — образуется очень устойчивый электроне игральный комплекс с последующим образованием анионного комплекса.
нейшее присоединение лигандов с последующим образованием комплексных анионов.
В большинстве случаев анионные комплексы не экстрагируются, так что вид кривой распределения комплекса от концентрации лиганда будет разным в зависимости от того, образуется ли в системе анионный комплекс или нет. Коэффициент распределения представляет собой отношение общей концентрации металлсодержащих частиц в обеих фазах:
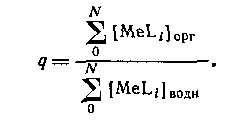
Если MeLm
является единственным комплексом, присутствующим в значительных количествах в органической фазе, то
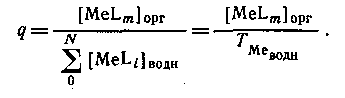
Следовательно, если m
=
N
,
то q([L]) представляет собой монотонную функцию, в то время как при N>m эта функция имеет максимум. Если устойчивость нейтрального комплекса достаточно велика, то функция q
от [L] имеет отчетливо выраженное плато. Учитывая, что константа распределения соединения MeLm
определяется уравнением
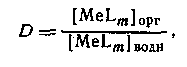
концентрацию MeLm
в водной фазе можно определить, вводя константу устойчивости:
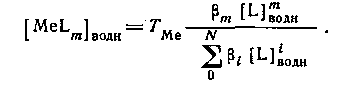
Следовательно,
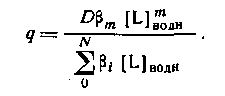
Из уравнения следует, что для расчета N неизвестных констант устойчивости необходимо по крайней мере N+1 экспериментов по распределению. Если кривая распределения имеет длинный горизонтальный отрезок, то значение D
непосредственно определяется значением qmax
.
D
=
qmax
Константы устойчивости наиболее просто определяются в том случае, когда функция q
от [L] имеет максимум, так как в этом случае образование катионных и анионных комплексов можно рассматривать отдельно.
Этот принцип впервые был использован Морзе при изучении галогенидных комплексов ртути(П); фундаментальные проблемы определения и расчета констант устойчивости были рассмотрены Ридбергом, Дирсеном и Ирвингом.
Если при изучении данной системы комплексов используются различные органические растворители, то, как следуетиз уравнения, должны быть получены одни и те же константы устойчивости. Если разность между константами устойчивости превышает ошибку эксперимента, то это свидетельствует о взаимодействии между экстрагируемым комплексом и молекулами растворителя. Такое взаимодействие приводит к изменению значения q
.
В соответствии с рис. 2 отношение qCHCl
3
/qC
6
H
6
при экстракции ацетилацетоната тория (IV) остается постоянным при одинаковых концентрациях свободного лиганда, но отношение qC
6
H
6
/qC
4
H
9
COCH
3
существенно меняется. Такое поведение было количественно объяснено образованием смешанного комплекса тория с ацетилацетоном и метилизобутилкетоном.
При использовании органических растворителей с низкой диэлектрической проницаемостью предположение, что в органической фазе присутствует только нейтральный комплекс, является очень хорошим приближением. Это отнюдь не значит, что в органической фазе находятся комплексы только одного типа. Отрицательный заряд (или заряды) анионного комплекса может компенсироваться присоединением протона. Хорошо известно, что целый ряд галогенидов металлов можно извлечь в протонированной форме НМеХ4
. Описание экстракции становятся гораздо более сложным, если используются органические растворители с достаточно высокой диэлектрической проницаемостью. Эти системы могут найти очень важные практические приложения, но для оценки констант устойчивости комплексов в водных растворах они не очень удобны.
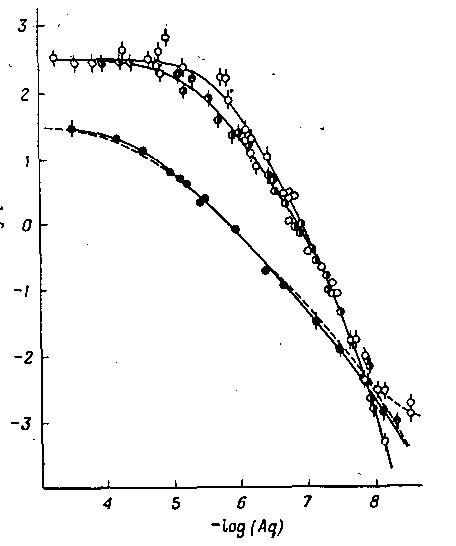
Рис. 2. Распределение Th(IV) между водной и органической фазами в зависимости от концентрации ацетилацетонат-иона прииспользовании различных растворителей: изобутилмегилкетон; бензол; хлороформ.
В последние годы было тщательно исследовано большое число экстракционных систем. Особенно эффективными органическими растворителями являются алкилфосфорные эфиры, которые часто применяют для экстракции металлов.
3. Синергизм
Этот термин вначале был использован для описания явления возрастания экстракции металлов в системе, содержащей два разных лиганда, при этом один из лигандов представлял собой кислоту и нейтрализовал заряд иона металла, а другой нейтральную донорноактивную молекулу. Вначале казалось, что это явление ограничено очень небольшим числом металлов и систем лигандов, но последующие работы показали, что оно чрезвычайно распространено. Хотя при обсуждении синергетической экстракции необходимо учитывать большое число факторов, однако работы Ирвинга, Хили, Ньюмана, Ли, Таубе и других авторов ясно показали, что решающим является образование смешанного комплекса. Образование смешанного комплекса может повысить долю металла, связанного в комплекс, и в результате привести к повышению экстрагируемости комплекса металла. Характерное поведение металла при синергетической экстракции показано на примере системы кобальт(II) —теноилтрифторацтон—пиридин; аналогичным образом ведет себя кобальт в системах, содержащих вместо пиридина другие, подобные пиридину основания. Синергизм в этом случае объясняется тем, что две молекулы пиридина или другого основания координируются в экваториальные положения октаэдрической молекулы. Другой тип синергизма был обнаружен Ирвингом, который использовал два типа оснований.
4. Конкурирующие реакции
Экстракция как метод исследования очень удобна для изучения конкурирующих реакций. Хотя в принципе, по-видимому, можно исследовать конкурирующие реакции двух металлов с одним лигандом, но до сих пор экстракционными методами изучали только конкурирующие реакции двух разных лигандов с одним металлом. Конник и МакВей определили константы устойчивости большого числа комплексов циркония (1У), исследовав мешающее влияние неорганических ионов на экстракцию бензолом теноилтрифторацетоната циркония(1У). Аналогичные исследования были выполнены с сульфатными комплексами нептуния(1У) Салливаном и Хиндманом. Многие исследователи изучили гидролитические реакции, рассмотрев влияние гидроксоионов на экстракцию различных хелатов металлов.
Недавно Стары рассмотрел возможность применения конкурирующих реакций для определения экстракционным методом констант устойчивости комплексов большого числа металлов.
Список литературы:
1. Бек Н. Химия равновесия реакций комплексообразования. М.Мир. 1973.
2. Белеванцев В.Н., Пещевицкий Б.Н. Исследование сложных равновесий в растворе. Новосибирск.Наука, 1978.
3. Россотти Ф,, Россотти X. Определение констант устойчивости и других констант равновесия врастворах. М. Мир. 1965.
4. Новоселова А.В. Методы исследования гетерогенных равновесий.М., Высшая школа. 1980.
|