ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Химическая кинетика -
это наука о скоростях и механизмах химических превращений, о явлениях, сопровождающих эти превращения, и о факторах, влияющих на них.
Механизм реакции
- это последовательность стадий, предлагаемая на основании экспериментально установленных данных о скорости реакции и на экспериментально обнаруженных интер-медиатах
реакции (промежуточных продуктах).
Кинетика по способу описания химических реакции делится на два раздела. В формальной
или феноменологической
кинетике сформулированы закономерности, позволяющие описывать химическую реакцию макроскопически на основе экспериментальных данных. Молекулярная
кинетика изучает превращение на основе молекулярных данных о свойствах частиц.
Теоретическую основу химической кинетики составляют теории столкновений
и переходного состояния.
Теория столкновений позволяет объяснить влияние концентрации и температуры на скорости реакций.
Теория переходного состояния рассматривает изменение в геометрическом расположении атомов реагирующих молекул как единой системы.
Переходным состоянием или активированным комплексом называется критическая конфигурация, которой соответствует максимум потенциальной энергии вдоль координаты реакции.
Реагирующие молекулы, которые достигают этой критической конфигурации, образуют молекулы продуктов.
Кинетические исследования позволяют определить порядок и константу скорости реакции, число и характер промежуточных продуктов, энергию активации реакции, выяснить влияние природы растворителя, установить характер и число связей, разрываемых в ходе реакции и т.п.
Рассмотрим основные понятия химической кинетики.
1.1 Скорость, константа скорости, порядок
и молекулярность химической реакции
С течением времени в процессе химической реакции происходит изменение количеств исходных веществ и продуктов реакции. Эти изменения могут быть различными из-за разных стехиометрических коэффициентов у веществ, принимающих участие в химической реакции. Поэтому, при рассмотрении скорости реакции введены два понятия: скорость реакции по данному веществуи скорость реакции в целом (просто скорость реакции).
Реклама

Скоростью реакции называется
изменение количества i-того вещества (в молях) в единицу времени в единице реакционного пространства R:
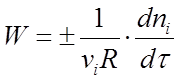 (1) (1)
где ni
- число молей i-го вещества, израсходованное или полученное в ходе реакции.
Это определение скорости является наиболее общим. Оно справедливо для любых условий, в том числе и для неизотермических.
Если реакция гетерогенная и протекает на границе раздела фаз, то реакционным пространством является поверхность (R = S), и изменение количества вещества относится к единице поверхности. Если реакция гомогенная и протекает в объеме, то реакционным пространством является объем (R = V). Изменение количества вещества рассматривается в единице объема. При условии V = const выражение (1) принимает вид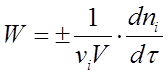 (2) (2)
Если учесть, что ni
/V = Сi
, тогда вместо (2) получим
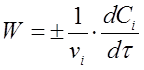 (3) (3)
где vi
- стехиометрический коэффициент перед i-тым веществом в уравнении химической реакции;
Сi
- концентрация i-того вещества, моль/л;
τ -
время реакции, с.
В данном случае скорость химической реакции численно равна изменению концентрации одного из реагирующих веществ в единицу времени.
Из уравнения (3) следует, что скорость реакции всегда положительна. Производная d Сi
/d τ характеризует скорость реакции по данному веществу. Она имеет отрицательное значение для исходных веществ веществ, так как их концентрация в ходе реакции уменьшается, и по
ложительное для продуктов реакции. Их количествов течение времени возрастает.
Основным законом химической кинетики является закон действующих масс
,
выражающий зависимость скорости химической реакции от концентрации реагирующих (исходных) веществ, который записывают в виде
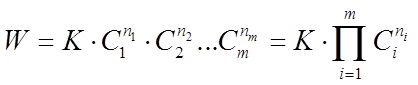 (3)
(3)
где К - коэффициент пропорциональности или константа скорости химической реакции, численно равная скорости данной реакции при равенстве единице концентраций всех исходных веществ;
n1
, n2
, .... nm
- показатели степени - порядки реакции по индивидуальным веществам;
C1
, С2
,....Сm
- концентрации веществ, принимающих участие в данной реакции;
П - произведение.
Константа скорости химической реакции зависит от природы реагирующих веществ, температуры и факторов, влияющих на протекание реакции.
Сумму
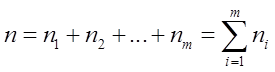
называют порядком химической реакции,
т.е. порядок химической реакции равен сумме показателей степени концентраций реагентов в кинетическом уравнении реакции и является экспериментальной величиной.
Порядок по данному веществу (частный порядок)
определяется как показатель степени концентрации этого вещества в уравнении для скорости реакции.
Реклама

М
o
лекулярность химической реакции
равна числу исходных молекул (или других частиц), принимающих участие в элементарном акте этой реакции. При этом число молекул продуктов реакции не имеет значения. В зависимости от числа исходных молекул различают мономолекулярные, бимолекулярные и тримолекулярные реакции. Молекулярность реакции - понятие теоретическое.
Порядок и молекулярностъ реакции совпадают
только для простых реакций, протекающих в полном соответствии с их стехиометрическим равнением и законом действующих масс.
Порядок и молекулярностъ реакции не совпадают,
если:
- один из компонентов находится в большом избытке;
- реакция имеет сложный механизм;
- на ее протекание оказывают воздействие катализаторы или ингибиторы.
1.2 Типы химических реакций
В химической кинетике рассматривается несколько типов химических реакций.
Необратимыми (односторонними)
называют реакции, которые идут только в одном направлении. В таких реакциях продукты представляют осадок, газы или мало диссоциируемые химические соединения.
Двусторонними (обратимыми)
реакциями называются реакции, которые протекают одновременно в противоположных направлениях.
Параллельными
называют реакции, идущие одновременно по нескольким направлениям (стадиям) с образованием различных продуктов.
Скорость процесса из параллельных стадий определяется самой быстрой стадией.
Последовательные
реакции состоят из нескольких стадий, следующих друг за другом. Скорость процесса из последовательных стадий определяется самой медленной.
Цепные реакции
- это самоподдерживающиеся химические реакции, при которых первоначально появляющиеся продукты принимают участие в образовании новых продуктов. Цепные реакции проходят три главные стадии: зарождения (инициирования), развития и обрыва цепи.
Фотохимические реакции
связаны с воздействием света на вещество (например, фотосинтез). Отношение числа молекул продукта к числу квантов света, инициирующих реакцию, называется квантовым выходом.
1.3 Влияние температуры на скорость химической реакции
Скорости большинства реакций с повышением температуры увеличиваются. Существует приближенное правило Вант-Гоффа: при повышении температуры на каждые
10° скорость реакции увеличивается в 2-4 раза.
В соответствии с этим правилом повышение температуры на 100 К приводит к повышению скорости реакции примерно в З10
≈ 60 тысяч раз. Большинство простых реакций подчиняются этому правилу, но имеются исключения. Например, для гидролиза метилацетата константа скорости при 308 К в 1,82 раза больше константы скорости при 298 К, а для гидролиза сахарозы при том же увеличении температуры скорость возрастает в 4,13 раза.
Температурная зависимость константы скорости выражается уравнением Аррениуса:
К = Ко
exp
(-
Ea
/
RT
) = Ко
e
–Еа /
RT
,(5)
где К
- предэкспоненциальный множитель, который не зависит или почти не зависит от температуры;
Еа
- энергия активации
- это минимальная энергия (в расчете на 1 моль или 1 кмолъ), которой должны обладать реагирующие (исходные) частицы, чтобы столкновение между ними привело к реакции.
До последнего времени энергию активации рассматривали в теории химической кинетики как эмпирическую постоянную. Но в настоящее время появилась возможность ее приближенной оценки с помощью квантовой химии.
За величину энергии активации приближенно принимают превышение средней энергии активированного комплекса над средним уровнем энергии исходных веществ.
Она зависит от природы реагирующих (исходных) веществ и характеризует изменение скорости реакции от температуры. Чем больше энергия активации,тем быстрее увеличивается с ростом температуры скорость реакции.
Если уравнение (5) прологарифмировать, то получим:
1пК = 1пК0
- Еа /
RT
.(6)
В системе координат 1пК - 1/Т
соотношение (6) - прямая линия. Это так называемый аррениусовский график, и считается, что реакции, дающие в этих координатах прямую линию, проявляют аррениусовское поведение.
Уравнение Аррениуса достаточно хорошо выполняется для простых гомогенных и многих гетерогенных реакций. Отклонение от этого закона указывает на сложный характер протекающей реакции. Форма аррениусовского выражения может быть получена из следующих рассуждений.
Предположим, что константа скорости реакции второго порядка является результатом бимолекулярной реакции. Для ее протекания необходимы два условия.
Прежде всего молекулы должны встретиться друг с другом, т.е. должно произойти их соударение. Обозначимчерез Z скорость, с которой происходят эти соударения в единице объема в газовой фазе. В газе при атмосферном давлении частотастолкновений равна приблизительно 1028
1/с см3
даже прикомнатной температуре. Если бы наличие столкновений было быединственным фактором, необходимым для протекания реакции,
то все газовые реакции заканчивались бы за 10 -9
с (происходил бы взрыв), но это не так. Более того, частота столкновений зависит от квадратного корня из температуры. Следовательно, если учитывать только число столкновений молекул, то получается абсурдно большая скорость реакции и абсурдно невероятная еезависимость от температуры.
Другим необходимым условием для осуществления реакции является то, что молекулы при столкновении должны обладать достаточной энергией. Слабое столкновение не ведет к реакции, столкновение должно быть сильным. Если предположить, что для осуществления реакции столкнувшиеся молекулы должны иметь, по крайней мере, энергию Еа
, то частота столкновений должна быть умножена на долю молекул, сталкивающихся с энергией Еа
. Эта доля определяется уравнением Больцмана и равна exp(-Ea
/RT) для данной системы при температуре Т. Из этого следует, что температурная зависимость скорости реакции может быть выражена уравнением:
W = Z*exp(-Ea/RT),(7)
где Z - число соударений.
При обычных температурах доля энергетически достаточных столкновений очень мала, поэтому приведенное выражение предсказывает скорость, которая значительно меньше, чем величина Z. Более того, оно предсказывает экспоненциальную температурную зависимость скорости реакции, поскольку доля энергетически достаточных столкновений экспоненциально увеличивается с температурой.
Таким образом, уравнение (7) качественно схоже с уравнением Аррениуса, но дает меньшее значение скорости химической реакции. Связано это с тем, что в реакции могут участвовать частицы с энергией, не только равной Еа
, но и с большей энергией. Фактически экспериментальная температурная зависимость скорости реакции значительно сильнее, чем зависимость Z от корня квадратного из температуры.
Например, для типичных энергий активации (около 50-100 кДж/моль) скорость удваивается при повышении температуры на 10° , но частота столкновений изменяется только в (308/298)1/2
= 1,02 раза при этом же повышении температуры. С ростом температуры влияние этого фактора уменьшается.
Опытные данные показывают, что энергия активации, как правило, значительно меньше энергии разрывающихся при данной реакции химических связей, т.е. энергии диссоциации реагирующих молекул. Это можно объяснить тем, что затрата энергии на разрушение старых связей сопровождается выделением энергии при образовании новых химических связей в продуктах реакции, т.е. происходит частичная компенсация энергетических затрат. Для количественной оценки этого явления российским ученым Г.К. Боресковым была предложена величина % названная степенью компенсации:
χ = (ЕД
-Еа)/Ед
,(8)
где Ед
- энергия диссоциации реагирующих молекул;
Еа
- энергия активации реакции.
При полном разрыве связей, без компенсации образования новых связей, энергия активации совпадает с Е д
и χ =0. Уменьшение энергии активации соответствует все большей компенсации и при Еа =0 величина χ =1 компенсация полная. Для некаталитических реакций со стабильными молекулами степень компенсации обычно не превышает 70%.
1.4. Каталитические реакции
Каталитическими
называются реакции, протекающие с участием веществ-катализаторов, не входящих в состав конечных продуктов. Катализаторы вступают во взаимодействие с участниками данной реакции, образуют с ними те или иные промежуточные вещества, включаются в состав активного комплекса, а после реакции вновь выделяются. Различают положительный катализ (ускорение реакции) и отрицательный катализ (замедление реакции, или ингибирование).
В некоторых случаях катализатором является один из продуктов реакции. Такая реакция называется автокаталитической.
При гомогенном катализе
катализатор и все реагирующие вещества составляют одну фазу. Различают следующие типы гомогенного катализа: кислотно-основной катализ органических реакций, катализ
d
-переходными ионами
и катализ металлорганическими комплексами.
При гетерогенном катализе
реагирующие вещества и катализатор находятся в различных фазах, а каталитическая реакция протекает на поверхности раздела фаз. Гетерогенный катализ включает пять обратимых стадий: диффузию
реагентов, адсорбцию
(сначала физическую, затем химическую), химическую реакцию, десорбцию
продуктов и их диффузию.
Все гетерогенные катализаторы можно подразделить на четыре класса: d
-переходные металлы, полупроводниковые оксиды, изоляторы (диэлектрики)
и кислотные катализаторы.
Особым видом катализаторов являются ферменты
-
белковые молекулы с молекулярной массой от 105
до 107
г/моль.
Эти катализаторы характеризуются следующими свойствами:
-фермент способен катализировать только одну специфическую реакцию или реакцию одного типа;
-обладают высокой эффективностью даже в очень небольших количествах;
-наибольшей активностью обладают при температуре 310 К (температуре человеческого тела, при температуре выше 323-333 К разрушаются;
-ферменты очень чувствительны к присутствию каталитических ядов.
Каталитические реакции характеризуются следующими общими особенностями:
1) Катализатор не влияет на термодинамическое равновесие.
Он изменяет лишь скорость достижения состояния равновесия.
2) Действие катализатора специфично.
Из всех возможных реакций данных реагирующих веществ определенный катализатор избирательно усиливает лишь некоторые.
3) Скорость гомогенной каталитической реакции чаще всего пропорциональна концентрации катализатора.
4) Действие катализатора зависит от его физического состояния и от присутствия посторонних веществ.
Промоторы усиливают действие катализатора, а каталитические яды снижают активность катализатора.
5) Смесь катализаторов часто действует значительно сильнее,
чем отдельные катализаторы.
1.5 Сущность каталитического действия
Если энергия активации высока, то лишь небольшая доля сталкивающихся молекул имеет энергию, достаточную для того, чтобы произошла реакция, а если она низка, то реагирует большая часть молекул, и поэтому константа скорости будет большой. Из этого следует, что если каким-либо образом можно снизить энергию активации, то реакция должна протекать с более высокой скоростью.
Катализатор
- это вещество, которое заставляет реакцию протекать быстрее, снижая энергию активации лимитирующей стадии. Некоторая мера эффективности катализаторов может быть получена при рассмотрении изменений энергии активации различных реакций, которые обусловлены наличием катализаторов. При разложении перекиси водорода в отсутствие катализатора энергия активации равна 76 кДж/моль, и при комнатной температуре разложение протекает очень медленно. Если добавить небольшое количество иодида, происходит та же самая реакция, но с энергией активации 57 кДж/моль, и, таким образом, при комнатной температуре (когда RT = 2,5 кДж/моль) константа скорости лимитирующей стадии увеличивается в
К(катализатор)/К(без катализатора) = е7,6
≈ 2000 раз.
Более существенное изменение энергии активации происходит при добавлении ферментов к биохимическим системам.
Фермент является биологической молекулой, которая обладает большой эффективностью. Это иллюстрируется изменением энергии активации в реакции гидролиза сахарозы от 107 кДж/моль в присутствии иона гидрооксония до 36 кДж/моль при добавлении небольшого количества фермента сахаразы. Такое изменение энергии активации соответствует изменению значения скорости на 22 порядка.
1.6 Методы расчета энергии активации и предэкспоненциального множителя
В большинстве случаев для расчета энергии активации Еа
по экспериментальным данным используют интегральную форму уравнения Вант-Гоффа-Аррениуса (6) или его запись в виде:
lgK
=
lgKo
- Е а/2,303
RT
(9)
Следовательно, lgK линейно зависит от обратной абсолютной температуры (см. рисунок)
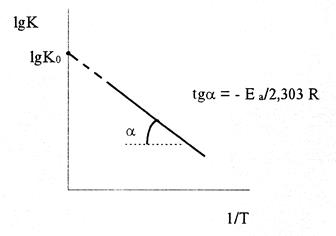
Значение Еа
находят по тангенсу угла наклона прямой, проходящей через экспериментальные точки: Е а
= -2,303Rtgα.
Предэкспоненциальный множитель К0
определяется отрезком, отсекаемым продолжением прямой на оси ординат при 1/Т = 0.
Если имеются значения константы скорости химической реакции при двух температурах, то из уравнения (9) можно получить:
Еа
=(2,303RT1
T2
lgK2
/K1
)/(T2
-T1
) (10)
Энергия активации Еа
имеет размерность энергия/моль и измеряется в единицах Дж/моль. Размерность К0
совпадает с размерностью константы скорости. Теория и экспериментальные данные (для широкого температурного интервала) показывают, что Еа
и К зависят от температуры. Однако эту зависимость можно не учитывать, если реакции исследуются в достаточно узком температурном интервале.
Изложенный выше метод расчета Еа
предполагает, что константы скорости реакций при различных температурах известны.
Однако, есть способ расчета Еа
, так называемый метод трансформации, который не требует знания K=f(T).
Пусть при температурах T1
и T2
в смесях одного и того же начального состава протекает химическая реакция. Если к моментам времени τ1
и τ2
реакция прошла на одну и ту же глубину, то есть изменения концентраций исходных веществ или продуктов реакции одинаковы, то отношение скоростей реакции равно:
W1
/ W2
= (dC/dτ1
) /(dC/dτ2
) = dτ2
/ dτ1
.(11)
Заменим в уравнении (11) скорости реакций при заданных температурах соотношением (4)
 .(11а)
.(11а)
Таким образом, отношение K1
/K2
можно заменить отношением τ1
/ τ2
Подставим в отношение (11а) значения констант скорости при температурах T1
и Т2
, используя уравнение Аррениуса (5):
K0
exp(-Ea
/RT1
)/ K0
exp(-Ea/RT2
) = d τ2
/ d τ1
.
Полагая, что для узкого температурного интервала К0
и Еа
= const находим
ехр[-Ea/R(l/T1
- 1/Т2)] = dτ2
/ dτ1
.(12)
Разделение переменных и интегрирование дают:
ехр[-Еа(Т2
– T1
)/RT1
T2 ] = τ2
/ τ1
.(13)
Следовательно, при заданных T1
и Т2
отношение τ2
/ τ1
для реакций, протекающих на одну и ту же глубину, постоянно и называется коэффициентом трансформации. Если этот коэффициент известен, то значение энергии активации рассчитывается по формуле:
Еа
= R[T1
T2
/(Т2
– T1
)]-ln(τ2
/ τ1
).(14)
Реакция иодирования ацетона
Вкачестве объекта исследования в данной работе выбрана реакция иодирования ацетона. Реакция
СНзСОСНз +
I
2
= СНзСОС
H
2
I
+
HI
(15)
катализируется кислотами Бренстеда(донорами протонов). Эта реакция катализируется сильной минеральной кислотой.
Как видно из уравнения, один из продуктов реакции - иодоводородная кислота (катализатор). Поэтому концентрация катализатора в ходе опыта возрастает. Такие процессы называются автокаталитическими.
Можно выделить две стадии реакции. На первой происходит таутомерное превращение кетона в енол, катализатор - ионы оксония:
СНзСОСНз—> СНзС(ОН)=СН2
; К1
(16)
Затем (вторая стадия ) енол реагирует с иодом:
СНзС
(
ОН
)=
СН
2
+ I2
= CH3
COCH2
I + HI;
К
2
(17)
Вторая стадия очень быстрая, а первая - скорость лимитирующая. Поэтому скорость реакции равна скорости енолизации ацетона:
dc/dτ = К1
Са
сH
O
(18)
где Са
- концентрация ацетона;
С H
3
O
+
-
концентрация ионов оксония (ионов водорода). От концентрации иода скорость реакции не зависит. Обозначим через а и b - числа моль ацетона и оксоний-ионов в начальный
момент времени в колбе объемом V; х - количество прореагировавших ацетона и иода,
равное количеству вновь образовавшихся оксоний-ионов.
Тогда:
Са
= (a-x)/V; С
H
3
O
+
= (
b+x)/V.(l 9)
Подставляя (19) в (18), находим:
dx/dτ = (K1
/V)(a-x)(b+x).
После интегрирования этогоуравнения в пределах от х=0 до х и от τ=0 до х, разрешения относительно K1
получим выражение:
K1
= V/(a+b)
τ*In a(b+x)/(a-x)b,
(20)
в котором числа моль а и b - заданыусловиями приготовления рабочей смеси, а х в зависимости от τопределяют путем титрования иода тиосульфатом натрия.
Если перейти к концентрациям веществ, участвующих в реакции, то уравнение (20) приобретет вид:
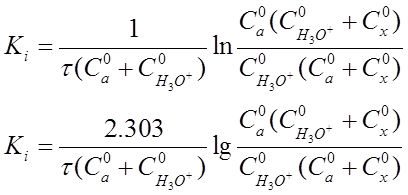 (21) (21)
где С°а - начальная концентрация ацетона, моль-экв/л;
С H
3
O
+
- начальная концентрация ионов оксония (ионов водорода), моль-экв/л;
Сх
- количество прореагировавшего ацетона за время
реакции т, моль-экв/л;
τ - время протекания реакции.
По уравнениям (20) и (21) можно рассчитать константу скорости реакции, используя данные о концентрации веществ, участвующих в реакции.
|