Современное содержание термина «активация»
План.
1. Современное содержание термина «активация»
2. Теория Вернера
2. Координационная связь (Теория Льюиса. Правило эффективног атомного номера ЭАН (Правило Сиджвика). Электронная структура атома)
3. Номенклатура комплексов
4. Классификация комплексов
4.1 Моноядерные и полиядерные комплексы.
4.2. Нейтральные, анионные и катионные комплексы.
4.3. Координационное число КЧ (т.е. количеству координированных лигандов).
4.4. Форма координационного полиэдра комплексов.
4.5. Классификация комплексов по химической специфике лигандов.
4.6. Классификация комплексов по специфике электронной конфигурации лигандов
Все теории катализа старались ответить на следующие вопросы:
1. Каким образом катализатор меняет реакционную способность реагентов, обеспечивая их превращение в нужном направлении?
2. Как найти катализатор для желаемой реакции?
Ответ на второй вопрос связан с ответом на первый. Современный взгляд на проблему активации имеет в основе химический подход, учитывающий особенности гетерогенного катализа: влияние носителя (коллективные свойства), особенности образования и превращения промежуточных соединений на поверхности гетерогенного катализатора, диффузия адсорбированных молекул в подповерхностные слои катализатора, изменение катализатора под воздействием реакционной среды (реагенты, продукты) и т. д..
Первым четко сформулировал идею «оптимального» взаимодействия между реагентами и катализатором Пьер Сабатье в кн. «Катализ в органической химии». Энергия образования интермедиата должна быть не слишком мала и не слишком велика. Если реакция образования интермедиата эндотермична, а энтропия в реакции его образования понижается, то концентрация интермедиата будет очень мала, а следовательно, скорость стадии его превращения будет низка из-за низкой концентрации. Если образование интермедиата будет очень выгодно, то его концентрация будет велика, скорость его дальнейшего превращения также будет низка из-за низкой реакционной способности, поскольку он очень прочный. И энергия активации стадии его превращения будет велика.
Т.к. любой интермедиат в каталитическом процессе – это частица, в которой субстрат связан с активным центром катализатора, то фактически мы имеем дело с промежуточно образующимся координационным соединением. Такому соединению присущи все основные свойства, характеризующие обычные координационные соединения. И поэтому о прочности связи катализатор-субстрат, и об активации субстрата можно судить с тех же позиций, которые применяются в координационной химии для связи металл-лиганд, для характеристики изменений свойств лиганда (т.е. его активации).
Реклама

Основные понятия координационной химии
В основе современных представлении о природе комплексов лежит координационная теория Вернера (1893 г.). Основные положения теории А. Вернер вывел, рассматривая соединения, которые либо являются аддуктами солей с нейтральными молекулами, либо двойными солями:
Видно, что в таких соединениях число нейтральных молекул, присоединяющихся к соли металла, чаще всего равно 4 или 6. Из рассмотрения этих рядов Вернер вывел следующие положения:
1. Большинство элементов проявляют два типа валентности:
(а) - главную валентность и (б) - побочную валентность. В современной терминологии (а) соответствует степени окисления и (б) – координационному числу.
2. Каждый элемент стремится насытить как главную, так и побочную валентности.
3. Побочная валентность направлена к точно фиксированным положениям в пространстве.
Итак, в координационной химии мы имеем дело с металлом-комплексообразователем (или группой металлов – это уже кластерная химия). Атомы, окружающие металл-комплексообразователь, называются лигандами. Лиганды, связанные с комплексообразователем, образуют внутреннюю координационную сферу комплекса (эта часть молекулы записывают в квадратных скобках). Все остальное в комплексном соединении представляет собой внешнюю координационную сферу (записывают за квадратными скобками).
Примеры: в [Co(NH3
)6
]Cl3
, K2
[PtCl4
] и т.д.
Важно отметить: комплексы не теряют своих свойств при переходе из одной фазы в другую, например, при растворении соединения внутренняя координационная сфера остается без изменений.
КООРДИНАЦИОННАЯ СВЯЗЬ
Природу координационной связи рассматривают, исходя из теории Льюиса о двухэлектронной связи.
1. Двухэлектронная связь
1916 г., Льюис постулировал: Связь между двумя атомами А и В осуществляется в результате совместного обладания парой электронов.
Если каждый атом отдает в общее пользование 1 электрон, эта связь называется ковалентной связью.
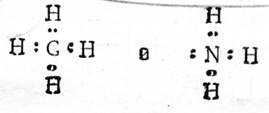
Если связь осуществляется также парой электронов, но при этом пару электронов поставляет один атом (донор), а второй атом (акцептор) принимает эту пару на свободную орбиталь, то такая связь называется координационной.
Реклама

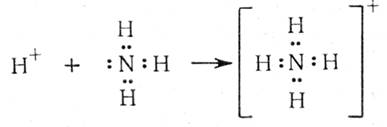
Льюис ввел понятие кислот и оснований в зависимости от способности вещества принимать или отдавать пару электронов.
Кислотами называют вещества, молекулы которых способны принимать электронные пары, а основаниями – вещества, способные их отдавать. В результате кислотно-основной реакции происходит образование координационных связей и координационного соединения:
А + :В → А:В
Кислота Основание Координационное
(акцептор) (донор) соединение
В соответствии с кислотно-основной теорией Льюиса к кислотам относятся ионы металлов, а также такие соединения, как BF3
, AlCl3
, SO3
и SiF4
, которые могут принимать электронные пары.
Лиганды отдают свои электронные пары в общее пользование с металлами и, таким образом, по Льюису сами являются основаниями.
Примеры:
Молекулы :
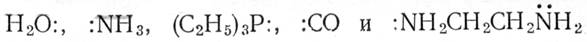
Ионы:
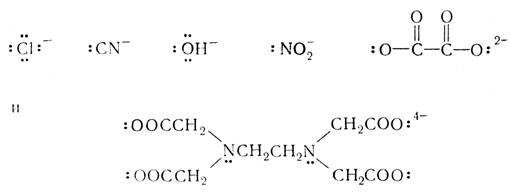
Из картинок ясно, что en и EDTAспособны реагировать как соответственно бидентатный и гексадентатный лиганды. Атом, содержащий более одной неподеленной пары электронов, может служить мостиковым лигандом:
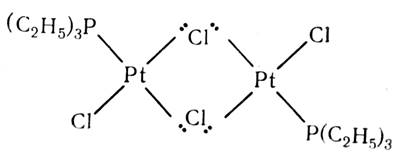
ПРАВИЛО ЭФФЕКТИВНОГО АТОМНОГО НОМЕРА ЭАН
(ПРАВИЛО СИДЖВИКА)
Правило: В комплексных соединениях центральный атом металла будет окружать себя таким числом лигандов, что общее число электронов в атоме металла будет таким же, как и в атоме ближайшего инертного газа. Число электронов в атоме металла-комплексообразователя называют эффективным атомным номером (ЭАН).
Пример: ЭАН для Co(III) в [Co(NH3
)6
]3+
равен:
Co- атомный номер 27, имеет 27 электронов
Co(III): 27-3 = 24; 6(:NH3
) 2x6 = 12; 24+12 = 36 (ЭАН для Co(III) в [Co(NH3
)6
]3+
Другая трактовка: В комплексных соединениях центральный атом металла будет окружать себя таким числом лигандов, чтобы число электронов во внешней электронной оболочке было равно 18.
Для описания природы связи в комплексах в настоящее время используют три теории:
1) метод валентных связей (МВС);
2) теория кристаллического поля (ТКП);
3) метод молекулярных орбиталей (ММО).
Ни одна из этих теорий не является всеобъемлющей, поэтому возможно использование той, которая наилучшим образом описывает строение того или иного комплексного соединения.
Номенклатура комплексов
1.Порядок перечисления ионов:
В русскоязычной литературе сначала называют анион, а затем – катион; в англоязычной литературе – наоборот:
K2
[PtCl6
] – гексахлороплатинат (IV) калия (potassiumhexachloroplatinate).
Неионные (молекулярные) соединения называют одним словом:
[Co(NH3
)3
(NO2
)3
] – тринитротриамминкобальт(III).
2. Названия лигандов
Нейтральные лиганды называют так же, как и соответствующую молекулу; к лигандам-анионам добавляют на конце суффикс –о-.
Имеется два исключения из этого правила – вода и аммиак:
H2
O –акво,
NH3
–аммин (следует указать, что это название пишется с двумя «м»; другие амины пишутся с одним «м»).
3. Порядок перечисления лигандов в комплексе.
Лиганды в комплексе называют в следующем порядке:
1) отрицательные, 2) нейтральные, 3) положительные, не разделяя их дефисами. Внутри каждой из этих категорий лиганды перечисляются в порядке увеличения их сложности:
[Pt(NH3
)4
(NO2
)Cl]SO2
– сульфат хлоронитротетраамминплатины (IV).
2) Числовые приставки
Приставки ди-, три-, тетра- и так далее применяют перед названием простых лигандов: бромо, нитро, оксалато. Приставки бис-, трис-, тетракис- и так далее применяют перд сложными наименованиями лигандов:
[Co(en)2
Cl2
]2
SO4
– сульфат дихлоро-бис-(этилендиамин)кобальта(III), где en = H2
NCH2
CH2
NH2
- этилендиамин.
3) Окончания названий.
Названия анионных комплексов оканчиваются на «ат». В катионных или нейтральных комплексах металл называют без какого-либо специфического окончания:
Ca2
[Fe(CN)6
] – гексацианоферрат((II) кальция,
[Fe(H2
O)6
]SO4
– сульфат гексааквожелеза(II)
[Ni(DMG)2
] – бис-(диметилглиоксимато)никель(II), где
DMG = CH3
(HO-N=)C-C(=N-OH)CH3
– диметилглиоксимат-ион.
4) Место присоединения лиганда.
Если необходимо указать место присоединения лиганда, после названия группы курсивом ставят обозначение присоединяемого элемента, которое отделяют дефисом:
(NH4
)3
[Cr(NCS)6
] – гексатиоцианато-N-хромат(III) аммония,
(NH4
)2
[Pt(SCN)6
] – гексатиоцианато-S-платинат(IV)/
Для тиоциана- и нитрат-ионов используют также следующие названия:
-SCN-
- тиоцианато, -NO2
-
- нитро,
-NCS-
- изотиоцианато, -ONO-
- нитрито.
Классификация комплексов
Возможны различные виды классификации комплексных соединений.
1. Комплексы могут быть моноядерными и полиядерными.
В первом случае в координационную сферу всходит один металл-комплексообразователь, во втором – несколько металлов.
Примеры: K2
[PtCl6
], [Co(NH3
)3
(NO2
)3
] , K3
[Co(NO2
)6
]– моноядерные комплексы;
Pt4
(OCOCH3
)8
– тетраядерный (полиядерный) комплекс.
2. Комплексы могут быть нейтральными, анионными или катионными.
Примеры: K2
[PtCl6
] –анионный комплекс,
[Co(NH3
)3
(NO2
)3
] – нейтральный комплекс
[Co(NH3
)6
]Cl2
.- катионный комплекс.
3. Комплексы можно классифицировать по координационному числу КЧ (т.е. количеству координированных лигандов). КЧ бывают равными 1,2,3,4,5,6,7,8 и9.
Для моноядерных соединений наиболее часто встречаются КЧ 4 и 6.
4. Комплексы можно классифицировать по координационному полиэдру.
Координационный полиэдр – это геометрическая фигура, которая образуется после соединения прямыми линиями всех лигандов (их первых атомов). В центре такой фигуры располагается ион металла. Для моноядерных соединений характерны полиэдры в виде плоского квадрата, тетраэдра и октаэдра.
Примеры:
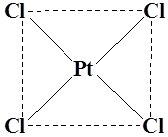
K2
[PtCl4
] (плоскийквадрат)
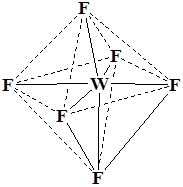 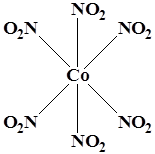 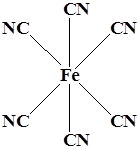
WF6
K3
[Co(NO2
)6
] K3
[Fe(CN)6
]
Октаэдр
3. Комплексы можно классифицировать, исходя из химической природы лигандов.
.
Координационная емкость лигандов (или дентатность) – это число координационных мест, которое занимает у центрального атома данный лиганд.
Примеры: монодентатные лиганды – аммиак, галогены, халькогены, и т.д.
Полидентатные лиганды – с.22 и далее
Бидентатные: карбонат, оксалат, этилендиамин
Тридентатные: диэтилентриамин
Тетрадентатные: этилендиаминтетрауксусная кислота .
Полидентатные лиганды, содержащие электронодонорные функциональные группы различного типа –кислотные и основные – называют комплексонами.
Пример: соль Цейзе – атомы этилена расположены на одинаковом расстоянии от атома платины и координационную емкость этилена можно было бы считать равной 2. Однако координационная емкость лиганда определяется числом монодентатных лигандов, которые могут заместить данный лиганд или которые замещаются данным лигандом. Поэтому для этилена КЕ = 1.
Классификация комплексов по химической специфике лигандов
1. Атомы элементов в качестве лигандов (H, O, N, C, S, Se, F, Cl и др.). Некоторые из них – координируются в виде одно- или двухзарядных анионов, другие не существуют в индивидуальном состоянии в мягких условиях (N, O, S).
ПРИМЕРЫ КОМПЛЕКСОВ
А) гидридные комплексы (например, гидриды рения). В комплексе рения [ReH9
]2-
шесть атомов водорода находятся в вершинах тригональной призмы, а три атома водорода образуют правильный треугольник, лежащий на одинаковых расстояниях от обоих оснований призмы. Металл-комплексообразователь находится в центре этого треугольника.
б) галогенидные комплексы:
Например, соединение K2
PdCl4
является анионным комплексом и содержит тетрахлоропалладат-анион (PdCl4
)2-
(см. рис. выше).
В) Халькогенидные комплексы, т.е. содержащие серу, селен, теллур, связанные с центральным атомом. Примеры:

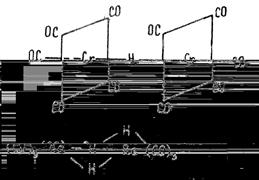
Как правило, комплексы содержат лиганды разного типа или лиганды, состоящие из разных атомов. Например, карбонилгидридные комплексы содержат одновременно и карбонильные (СО), и гидридные (Н-
) лиганды, как это видно на примере карбонилгидридов хрома [(CO)5
Cr]2
(μ-H) или рения (CO)3
Re(μ-H)3
Re(CO)3
.
: 
В связи с вышесказанным такая классификация употребима главным образом для галогенидных или халькогенидных комплексов.
2. В качестве лигандов часто выступают отрицательно заряженные группы атомов – анионные лиганды –
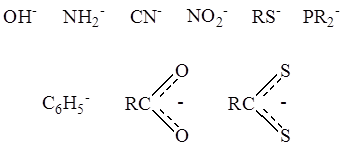
Примером может служить кластерный комплекс платины состава Pt4
(OCOCH3
)8
:
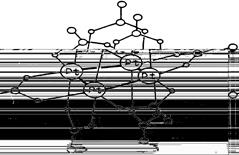
В кластере четыре атома платины образуют квадрат с коротким расстоянием металл-металл. По каждой стороне квадрата координированы по две мостиковых ацетатных группы. В координации каждой ацетатной группы участвуют в одинаковой мере оба карбоксилатных атома кислорода, поставляя для образования донорно-акцепторной связи пару электронов с каждого атома кислорода, а еще один электрон делокализован между этими двумя атомами кислорода.
3. Лигандами могут быть устойчивые двухатомные и многоатомные молекулы:
N2
, O2
, CO, NO, NH3
, NR3
, H2
O, R2
O, SO2
, CS2
, PR3
, RCN, C6
H6
ПРИМЕРЫ:
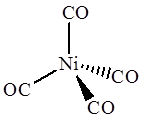 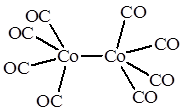
Ni(CO)4
Co2
(CO)8
В тетракарбониле никеля Ni(CO)4
атом металла помещен в центр тетраэдра, образуемого 4 атомами углерода карбонильных групп, поэтому комплекс имеет тетраэдрическое строение. В иядерном дикобальтоктакарбониле Co2
(CO)8
каждый атом кобальта имеет квадратно-пирамидальное окружение, причем основание квадратной пирамиды образуют 4 атома углерода карбонильных групп, а вершину этой пирамиды – второй атом кобальта.
В сэндвичевых соединениях – дибензолхроме (C6
H6
)2
Cr и ферроцене (C5
H5
)2
Feатом металла располагается между двумя плоскими ароматическими молекулами, каждая из которых связана с атомом металла по π-типу:
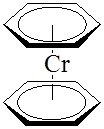 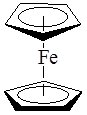
4. Лигандами могут служить молекулы или фрагменты молекул, которые не существуют в свободном состоянии или являются чрезвычайно неустойчивыми (карбены, карбины, нитрены и т.д.)
Карбеновые комплексы:
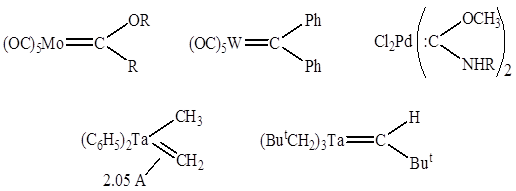
Карбиновые комплексы
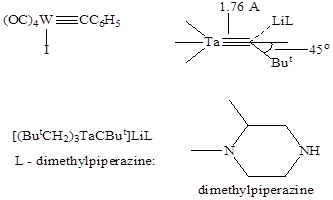
Нитреновые комплексы – это фактически азотсодержащие аналоги карбенов, где нитреновый лиганд связывается с центральным атомом за счет кратной связи металл-азот, как, например, в комплексе рения:
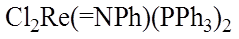
Классификация комплексов по специфике электронной конфигурации лигандов.
Этот тип классификации уже в какой-то мере отражает особенности химической связи металл-лиганд.
1. σ-лиганды – лиганды с одной или несколькими неподеленными парами электронов, локализованными на одном донорном атоме. Эти лиганды при взаимодействии с металлами образуют σ-комплексы. Их можно разделить на две группы:
а) лиганды, имеющие одну или несколько неподеленных σ-пар электронов и не имеющие энергетически доступных вакантных орбиталей – F-
, H2
O, ROH, NH3
, H-
,
б) ?
2. π-лиганды – лиганды, донорные пары которых делокализованы на двух или более центрах и являются π-электронными парами. К таким лигандам относятся производные этилена, диенов, ацетилена, бензола и других ациклических и циклических ненасыщенных соединений.
ПРИМЕРЫ
Так, например, в анионе соли K[PtCl3
(C2
H4
)] атом платины имеет плоско-квадратное окружение, в котором π-координированная молекула этилена занимает одно координационное место:
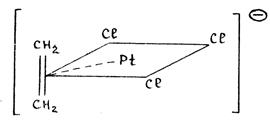
Или, например, в биc-π-аллильном комплексе никеля (см. рис.) каждый аллильный лиганд занимает 3 места в координационной сфере металла

|