Классификации катализаторов
Существуют различные типы классификации катализаторов, в основе которых лежит определенная совокупность свойств или характеристик. Наиболее широко используется классификация по типу веществ, которые являются катализаторами. Она включает следующие группы катализаторов:
1. Металлы (массивные, чистые, сплавы, скелетные, нанесенные) – гетерогенные катализаторы.
Так, например, металлы VIII группы (Fe, Ni, Co, Pt, Pd) используются в качестве катализаторов гидрирования ненасыщенных соединений (главным образом алкенов и алкинов). Серебро является катализатором окисления и окислительного дегидрирования (напр., синтез формальдегида из метанола).
Металлические катализаторы могут быть компактными, скелетными, нанесенными.
Pt-сетка (компактный металл в виде переплетенных нитей) – Кт окисления диоксида серы в триоксид (получение серной кислоты). Или известный катализатор гидрирования – Никель Ренея (это скелетный катализатор, который получается при выщелачивании сплава никель-алюминий).
Нанесенные катализаторы – палладий на угле (Pd/C), палладий на оксиде алюминия (Pd/Al2
O3
) и т.д.
2. Твердые бинарные соединения металлов Мm
Эn
, где Э – О, S, Se, Te, As, P, C, N, Si, B, гетерогенные катализаторы. Из этой группы чаще всего используются оксиды или халькогениды металлов полупроводникового типа. Примерами служат оксиды MgO, ZnO, Fe2
O3
, Cr2
O3
, WO3
, MoO3
, V2
O5
и др.
Так, в синтезе серной кислоты в настоящее время используется V
2
O
5
.
Катализаторы этого типа широко применяются в процессах гидрирования. Например в синтезе метанола из СО и водорода по реакции:
CO
+
H
2
→
CH
3
OH
катализатором служит смесь оксидов:
Cr2
O3
+ZnO (IKt, суммарное давление газов 250-300 атм, температура 300-4000
С ), Cr2
O3
+ZnO+CuO (IIKt, условия более мягкие: суммарное давление 50-100 атм., температура 220-2700
С, однако, в отличие от предыдущего, катализатор чрезвычайно чувствителен к наличию серосодержащих примесей в исходных газах).
Смесь оксидов молибдена, висмута и фосфора состава MoO3
∙Bi2
O3
∙P2
O5
– катализатор окислительного аммонолиза пропилена в акрилонитрил:
Реклама

CH2
=CH-CH3
+ NH3
+ 1.5 O2
→ CH2
=CH-CN + 3H2
O
Сульфиды молибдена и вольфрама состава Mox
Sy
+Wx
Sy
являются хорошими катализаторами в процессах гидроочистки (обессеривания) нефтяных фракций –– в присутствии этих катализаторов происходит восстановление серосодержащих органических соединений до элементарной серы или сероводорода.
3. Кислоты и основания (гомогенные и гетерогенные катализаторы) – протонные кислоты Бренстеда (НА) в водных и неводных средах, апротонные кислоты Льюиса – Усановича (BF3
, RI), протонные и апротонные центры твердых оксидов (оксиды алюминия, алюмосиликаты), любые типы оснований (в том числе твердые – МgO, CaCO3
, ионообменные смолы).
На таких катализаторах протекают реакции кислотно-основного катализа, а именно крекинг нефтяных фракций (на алюмосиликатах и цеолитах), дегидратация и гидратация, синтез аминов из спиртов (на Al2
O3
), этерификация спиртов и кислот, конденсация альдегидов и кетонов.
3. Комплексы металлов, включая соли (гомогенные и гетерогенные катализаторы). Следует отметить, что соли переходных металлов – это, как правило, комплексные соединения.
Рассмотрим, например, Вакер-процесс (окисление этилена в ацетальдегид), который протекает в присутствии катализатора PdCl2
/CuCl2
. На самом деле PdCl2
является линейным полимером, в котором атомы металла связаны хлоридными мостиками:
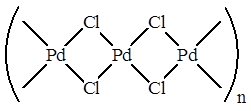
В растворе к присутствии хлорид-ионов, он деполимеризуется с образованием плоско-квадратных анионных комплексов палладия
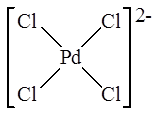
и именно эти анионные комплексы являются составной частью катализатора и участвуют в каталитическом цикле.
В гидрировании алкинов и алкенов катализатором служат фосфиновые комплексы родия состава RhCl(PPh3
)3.
В процессе карбонилирования метанола в уксусную кислоту (процесс фирмы Монсанто) в качестве предшественника катализатора используют смесь карбонильных комплексов Rh(I) и иодистого метила (MeI).
Катализаторы реакции Реппе (карбонилирование алкинов в присутствии воды (гидрокарбоксилирование), спиртов или аминов) является тетракарбонил никеля состава Ni(CO)4
– довольно лабильный комплекс, имеющий тетраэдрическое строение.
4. Ферменты (гомогенные и гетерогенные).
Ферменты (энзимы) – биологические катализаторы обладают уникальными свойствами: высокой производительностью в расчете на один реакционный центр и селективностью, связанной со специфичностью действия. Работают ферменты в очень мягких условиях, при атмосферном давлении и температуре до 40о
. В биологических системах отсутствуют неводные растворители и сильные кислоты и основания ( рН ≈ 7 ). Например фермент уреаза гидролизует только молекулы мочевины, не обращая внимания на другие амиды, и делает это гораздо эффективнее обычных кислотных катализаторов (табл. ).
Реклама

Таблица
| Реакция и субстрат |
Катализатор |
Константа ско-рости второго по-рядка, моль-1
∙с-1
|
Температура, о
С |
Гидролиз сложных эфиров
Этилбензоат
Этиловый эфир N-бензоил-L-тирозина
|
Н3
О+
Химотрипсин
|
9,0∙10-5
1,9∙104
|
54
25
|
| Гидролиз аденозин-трифосфата (АТФ ) |
Н3
О+
Миозин
|
4,7∙10-6
8,2∙106
|
40
25
|
Гидролиз амидов
Бензамид
Амид N-бензоил- L-тирозина
Мочевина
|
Н3
О+
Химотрипсин
Н3
О+
Уреаза
|
2,4∙10-6
14,9
7,4∙10-6
5,0∙106
|
52
25
62
21
|
II
. Классификация катализаторов по степени дискретности и коллективности действия
Взаимодействие катализатора с реагентами в газовой и жидкой фазе носит в основном дискретный характер (взаимодействие с одним реакционным центром катализатора) (гомогенный катализ). Взаимодействие реагентов с активными центрами на поверхности гетерогенного катализатора подвергается влиянию специфических эффектов твердого тела (большое количество ядер и электронов). Здесь главную роль играют коллективные эффекты. Поэтому катализаторы можно классифицировать по степени дискретности.
Коллективные эффекты выражены сильно в: а) массивных металлах, б) твердых растворах (сплавах).
Коллективные эффекты выражены слабее в: а) полупроводниковых оксидах, б) солях металлов в кристаллическом состоянии (HgCl2
, MoS2
, PdCl2
, CuCl).
Дискретные свойства выражены сильно в: а) кислотных катализаторах в растворах, б) комплексах металлов в растворах, в) комплексах металлов, химически связанных с поверхностью носителя.
Фактически в ряду металлы → оксиды металлов → кислотные катализаторы и комплексные соединения происходит уменьшение влияния коллективных эффектов и увеличение влияния дискретных свойств. Такое деление не полностью совпадает с делением на гомогенные и гетерогенные катализаторы.
III
. Классификация по специфике электронного строения
1. d–Катализаторы – катализаторы на основе переходных металлов, имеющие d–электроны и энергетически выгодные d–орбитали.
2. s,p-Катализаторы – катализаторы, в активном центре которых находится элемент, имеющий валентные S и P – орбитали(электроны). Это протонные и апротонные кислоты (НХ, RX, R+
, BF3
, оксиды алюминия, алюмосиликаты), а также основания Бренстеда (O, N, S, P, Hal – содержащие ионы и молекулы.
Металлы побочных подгрупп I и II групп Периодической системы относятся к промежуточному типу.
Группа d–катализаторов обладает несомненно более широким спектром каталитического действия из-за большего числа энергетически доступных орбиталей:
(n-1) d, ns, np и электронов, участвующих в элементарных стадиях каталитических процессов.
Из группы d-катализаторов особенно широким спектром каталитических свойств обладают металлокомплексные катализаторы (как в растворах, так и на поверхности). Именно исследование металлокомплексных катализаторов позволило установить механизм многих каталитических процессов на “молекулярном уровне”.
Особенно следует отметить, что появление металлокластерных катализаторов позволило "перебросить мостик" между металлокомплексными катализаторами в растворе и гетерогенными катализаторами на носителе.
Фактически кластерные катализаторы сочетают в себе
- с одной стороны – свойства дискретной молекулы, дополненные взаимодействием между металлами на молекулярном уровне,
- с другой стороны – свойства ансамбля из атомов металла, ограниченные рамками одной молекулы.
Представления о том, как происходит превращение субстрата (или нескольких субстратов) на поверхности катализатора и является главным подходом к пониманию механизма каталитических процессов.
Но, фактически, такие превращения – это превращения, протекающие в координационной сфере атома металла и они подчиняются всем закономерностям, которые наблюдаются в координационной химии.
Поэтому, прежде чем обсуждать механизмы активации молекул катализатором (что, собственно говоря, и является “интимным” механизмом катализа), необходимо вспомнить основные понятия координационной химии
|