Квантовые числа – это энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. Квантовые числа необходимы для описания состояния каждого электрона в атоме. Всего 4-ре квантовых числа. Это: главное квантовое число –
n
, орбитальное квантовое число –
l
, магнитное квантовое число –
ml
и спиновое квантовое число – ms
.
Главное квантовое число –
n
.
Главное квантовое число – n – определяет энергетический уровень электрона, удалённость энергетического уровня от ядра и размер электронного облака. Главное квантовое число принимает любые целочисленные значения, начиная с
n
=1 (
n
=1,2,3,…) и соответствует номеру периода.
Орбитальное квантовое число –
l
.
Орбитальное квантовое число –
l
– определяет геометрическую форму атомной орбитали. Орбитальное квантовое число принимает любые целочисленные значения, начиная с
l
=0 (
l
=0,1,2,3,…
n
-1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. “Набор” таких орбиталей с одинаковыми значениями главного квантового числа называется энергетическим уровнем. Каждому значению орбитального квантового числа соответствует орбиталь особой формы. Значению орбитального квантового числа
l
=0 соответствует
s
-орбиталь (1-ин тип). Значению орбитального квантового числа
l
=1 соответствуют
p
-орбитали (3-ри типа). Значению орбитального квантового числа
l
=2 соответствуют
d
-орбитали (5-ть типов). Значению орбитального квантового числа
l
=3 соответствуют
f
-орбитали (7-мь типов).
| Значение орбитального квантового числа – l.
|
Типы орбитали.
|
Количество типов орбитали.
|
| l
=0
|
s-
орбиталь
|
1
|
| l
=1
|
p-
орбитали
|
3
|
| l
=2
|
d-
орбитали
|
5
|
| l
=3
|
f-
орбитали
|
7
|
 
 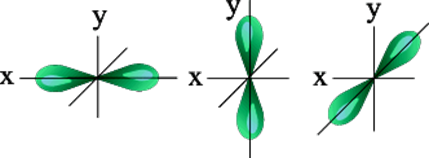


f-орбитали имеют ещё более сложную форму. Каждый тип орбитали – это объём пространства, в котором вероятность нахождения электрона – максимальна.
Магнитное квантовое число – ml
.
Магнитное квантовое число – ml
– определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Магнитное квантовое число принимает любые целочисленные значения от –l до +l, включая 0. Это означает, что для каждой формы орбитали существует 2l+1 энергетически равноценных ориентаций в пространстве – орбиталей.
Для s-орбитали:
l=0, m=0 – одна равноценная ориентация в пространстве (одна орбиталь).
Для p-орбитали:
l=1, m=-1,0,+1 – три равноценные ориентации в пространстве (три орбитали).
Для d-орбитали:
l=2, m=-2,-1,0,1,2 – пять равноценных ориентаций в пространстве (пять орбиталей).
Для f-орбитали:
l=3, m=-3,-2,-1,0,1,2,3 – семь равноценных ориентаций в пространстве (семь орбиталей).
Реклама

Спиновое квантовое число – ms
.
Спиновое квантовое число – ms
– определяет магнитный момент, возникающий при вращении электрона вокруг своей оси. Спиновое квантовое число может принимать лишь два возможных значения +1/2 и –1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона – спинам. Для обозначения электронов с различными спинами используются символы: 5
и 6
.
|