Министерство образования и науки Украины
Донбасский государственный технический университет
Кафедра ОМД
ЛЕКЦИЯ
по дисциплине Металловедение
на тему
«Атомно-кристаллическое строение металлов»
Ст.преп. Горецкий Ю.В.
Алчевск 2009
«Атомно-кристаллическое строение металлов»
1. Строение металлов в твердом состоянии
Все металлы и металлические сплавы – тела кристаллические, атомы (ионы) расположены в металле закономерно в отличие от аморфных тел, в которых атомы расположены хаотично.
Металлическое состояние возникает в комплексе атомов, когда при их сближении внешние электроны теряют связь с отдельными атомами, становятся общими, т.е. коллективизируются и свободно перемещаются между положительно заряженными и периодически расположенными ионами.
Устойчивость металла определяется электрическим притяжением между положительно заряженными ионами и обобщенными электронами (такое взаимодействие получило название металлической связи).
Сила связи в металлах определяется силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии друг от друга, чтобы энергия взаимодействия была минимальной (рис. 1)
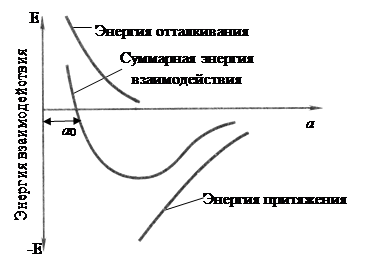
Рисунок 1. Энергетические условия взаимодействия атомов в кристаллической решетке вещества
Величина а соответствует расстояние между атомами в кристаллической решетке, а а0
соответствует равновесному расстоянию между атомами. В связи с этим в металле атомы располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов.
Металлические состояния характеризуются высокой энергией связи между атомами. Мерой ее служит теплота сублимации (сумма энергии необходимой для перехода твердого металла к парообразному состоянию, для металла – от 20 до 200 ккал/(г·атом)).
2. Атомно-кристаллическое строение металлов
Под атомно-кристаллической структурой понимают взаимное расположение атомов, существующее в кристалле. Атомы в кристалле расположены в определенном порядке, который периодически повторяется в трех измерениях.
Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки.
Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узле которой располагаются атомы (ионы), образующие металл.
Реклама

Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, получил название элементарной кристаллической ячейки (решетки).
Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки a, b, c и три угла между ними α, β, γ. Эти величины называют параметрами кристаллической решетки.
Кристаллические решетки бывают простыми (атомы только в вершинах решетки) и сложными.
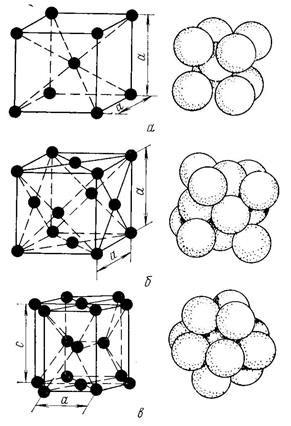
Металлы образуют одну из следующих высокосимметричных сложных решеток с плотной упаковкой атомов: кубическую объемноцентрированную (ОЦК), кубическую гранецентрированную (ГЦК) и гексагональную (ГПУ) (рис. 2).
ОЦК: Rb, K, Na, Li, Tiβ
, Tlβ
, Zrβ
, Ta, W, V, Feα
, Cr, Nb, Ba, и др.
ГЦК: Cu, Al, Pt, Pb, Ni, Ag, Au, Pd, Rh, Ir, Feγ
, Coα
, Caα
, Ce, Srα
, Th, Sc и др.
ГПУ: Mg, Cd, Re, Os, Ru, Zn, Be, Coβ
, Caα
, Zrα
, Laα
, Tiα
и др.
Рисунок 2. Кристаллические решетки металлов и схемы упаковки атомов
Расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку, называют периодом решетки, измеряется в нанометрах (1нм = 10-9
см = Å= 10-8
см).
Периоды решетки металлов находятся в пределах 0,2 – 0,7 нм.
ДляОЦК: a, b, c; a = b = c.
ДляГЦК: a, b, c; a = b = c.
Для ГПУ: а, с; с/а = 1,633 (к Zn не относится)
Число атомов в каждой элементарной ячейке (плотность упаковки – равняется числу атомов, приходящихся на одну элементарную ячейку):
ОЦК: ПУ (плотноупакованная) = 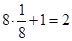 ; ;
ГЦК: ПУ = 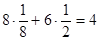 ; ;
ГПУ: ПУ = 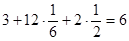 . .
Координационное число – под ним понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки атомов:
ОЦК: расстояние (min) между атомами 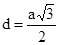 , на этом расстоянии от рассматриваемого атома находится 8 соседей – К8 . , на этом расстоянии от рассматриваемого атома находится 8 соседей – К8 .
ГЦК: 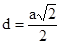 , К12. , К12.
ГПУ: Г12 (с/а = 1,633).
Коэффициент заполнения ячейки (плотность укладки) – определяется как отношение объема, занятого атомами к объему ячейки:
ОЦК: 68%
ГЦК: 74%
ГПУ: 74%
Для характеристики величины атома служит атомный радиус, под которым понимается половина расстояния между ближайшими соседними атомами. Атомный радиус возрастает при уменьшении координационного числа.
3. Полиморфные (аллотропические) превращения
Атомы металла – исходя из геометрических соображений, могут образовать любую кристаллическую решетку.
Реклама

Однако устойчивым, а, следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах (т.н. полиморфных (аллотропических) модификациях). В результате полиморфного превращения атомы кристаллического тела, имеющего решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа.
Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой α, при более высокой температуре β, затем γ и т.д.
Полиморфное превращение протекает при постоянной температуре (например, при нагреве идет поглощение теплоты).
Известные полиморфные превращения: Feα
↔ Feβ
; Coα
↔ Coβ
; Tiα
↔ Tiβ
; Mnα
↔ Mnβ
↔ Mnγ
↔ Mnδ
; Snα
↔ Snβ
, а также для Ca, Li, N, Cs, Sr, Te, Zr, V и др.
Металл с данной кристаллической решеткой должен обладать меньшим запасом свободной энергии.
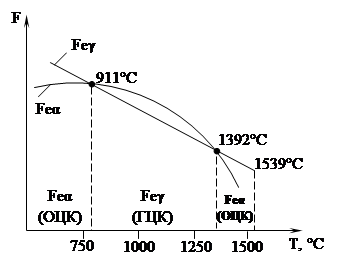
Рисунок 3. Полиморфизм железа и его связь со свободной энергией системы
Полиморфизм железа. Из рис. 3, видно, что в интервале температур 911 – 1392°С устойчивым является γ-железо (К 12) (имеет min свободную энергию), а при температурах ниже 911°С и выше 1392°С устойчиво α-железо (К 8).
В твердом металле полиморфные превращения происходят в результате зарождения и роста кристаллов аналогично кристаллизации из жидкого состояния. Зародыши новой модификации наиболее часто возникают на границах зерна исходных кристаллов.
В результате полиморфного превращения образуется новые кристаллические зерна, имеющие другой размер и форму, поэтому превращение также называют перекристаллизацией.
Полиморфное превращение сопровождается скачкообразным изменением всех свойств металлов и сплавов: удельного объема, теплоемкости, теплопроводности, электропроводности, магнитных свойств, механических и химических свойств и т.д.
Высокотемпературная модификация имеет высокую пластичность.
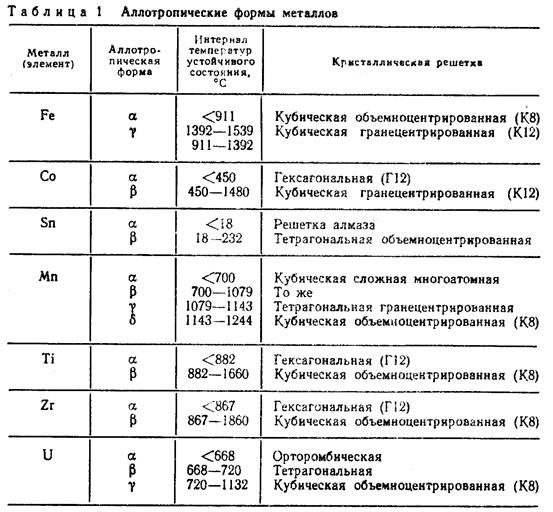
В таблице № 1 показан интервал температур существования различных аллотропических форм некоторых, имеющих практическое значение металлов, у которых обнаружена температурная аллотропия.
4. Анизотропия свойств металлов
Из атомно-кристаллического строения металлов видно, что плотность расположения атомов по различным плоскостям в кристаллических решетках неодинакова (рис. 4).
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решетки многие свойства (химические, физические, механические) каждого кристалла зависят от направления решетки. Подобная неодинаковость свойств монокристалла в разных кристаллографических направлениях называется анизотропией.
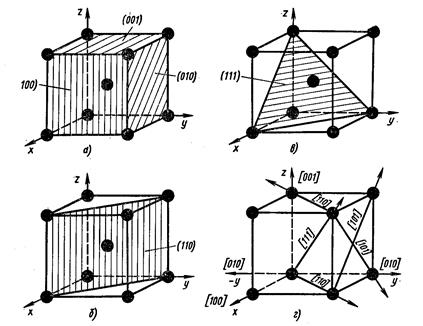
Рисунок 4. Расположение атомов в различных плоскостях и направлениях в кубической решетке (ОЦК)
Кристалл – тело анизотропное в отличие от аморфных тел (стекло, пластмассы и т.д.), свойства которых не зависят от направления.
Технические металлы являются поликристаллами, т.е. состоят из большого числа анизотропных кристаллов. В большинстве случаев, как уже указывалось выше, кристаллы статистически неупорядоченно ориентированы один по отношению к другому, поэтому во всех направлениях свойства более или менее одинаковы, т.е. поликристаллическое тело является изотропным (вернее – квазиизотропным (ложная изотропия)). Такая мнимая изотропность не будет наблюдаться, если кристаллы имеют одинаковую преимущественную ориентировку в каких-то направлениях. Эта ориентированность, или текстура, создается в известной степени, но не полностью в результате значительной холодной деформации; в этом случае поликристаллический металл приобретает анизотропию свойств.
Литература
1. Лахтин Ю.М., Леонтьева В.П. Материаловедение. М., 1972, 1980.
2. Гуляев А.П. Металловедение. М., 1986.
3. Новиков И.И. Дефекты кристаллического строения металлов. М., 1983.
4. Антикайн П.А. Металловедение. М., 1972.
|