МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Государственное общеобразовательное учреждение
высшего профессионального образования
«Мичуринский государственный педагогический институт»
Факультет биологии
Кафедра химии
Студент 12 группы
Попов Дмитрий Иванович
Алюминий и основные его соединения
Реферат
Руководитель:
Околелов О.С.
МИЧУРИНСК
2009
Оглавление
Введение
Глава
I
. Свойства алюминия
1.1. Получение
1.2. Химические свойства
1.3. Нахождение в природе и применение
Глава
II
. Основные соединения
2.1. Оксиды алюминия
2.2. Гидроксиды алюминия
2.3. Алюминаты. Алюминатные растворы
Заключение
Список литературы
Введение
Алюминий был открыт Х. Эрстедом в 1825 году. Этот элемент относится к p
-элементам главной подгруппы III группы Периодической системы химических элементов Д.И. Менделеева.
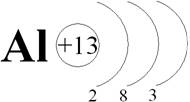
Радиус атома равен 0,143 нм. Запишем это. Почти во всех соединениях алюминий трёхвалентен и имеет окисление +3. Это тоже запишите.
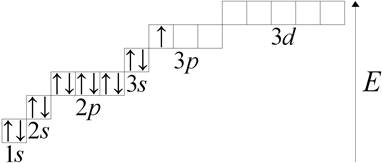
Рассмотрим строение атома алюминия:
1s
2
2s
2
2p
6
3s
2
3p
1
3d
0
В простом виде алюминий – металл серебристо-белого цвета. Он относится к лёгким и легкоплавким, обладает большой электрической проводимостью и теплопроводимостью. На воздухе изделия из алюминия покрываются тонкой оксидной плёнкой. Температура плавления у этого металла 659°С, а плотность 2,7 г/см3
.
Алюминий один из самых активных металлов, т.е. он является сильным восстановителем.
Глава
I
. Свойства алюминия
1.1. Получение
Впервые этот металл получили восстановлением его хлорида металлическим калием или натрием без доступа воздуха:
AlCl3
+ 3Na = Al + 3NaCl.
В промышленности алюминий получают электролизом раствора глинозёма (техн. Al2
O3
) в расплаве криолита Na3
AlF6
с добавкой CaF2
. Криолит используется как растворитель оксида алюминия, а добавка фторида кальция позволяет поддерживать температуру плавления в электролитической ванне не выше 1000°С.
1.2. Химические свойства
1. Алюминий легко окисляется кислородом воздуха, покрываясь прочной защитной плёнкой оксида алюминия Al2
O3
. Подобная реакция протекает при горении раскалённого алюминия в чистом кислороде:
4Al + 3O2
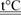 2Al2
O3
. 2Al2
O3
.
Данную реакцию мы можем наблюдать при горении бенгальских огней.
Реклама

2. Если плёнку оксида алюминия разрушить, то этот металл будет активно взаимодействовать с водой при обычной температуре:
2Al + 6H2
O = 2Al(OH)2
+ H2
↑.
3. Лишённый оксидной плёнки алюминий легко растворяется в щелочах с образованием алюминатов:
2Al + 2NaOH + 2H2
O = 2NaAlO2
+ 3H2
↑.
4. Лишённый оксидной плёнки алюминий легко растворяется в разбавленных кислотах с выделением водорода:
2Al + 6HCl(разб.)
= 2AlCl3
+ 3H2
↑,
2Al + 3H2
SO4 (
разб
.)
= Al2
(SO4
)3
+ 3H2
↑.
5. Сильно разбавленная и концентрированная азотная кислота пассивирует алюминий, поэтому для хранения и перевозки азотной кислоты используются алюминиевые ёмкости. Но при нагревании алюминий растворяется в азотной кислоте:
Al + 6HNO3 (
конц
.)
= Al(NO3
)3
+ 3NO2
↑ + 3H2
O.
6. Алюминий взаимодействует с галогенами:
2Al + 3Br2
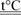 2AlBr3
. 2AlBr3
.
7. При высоких температурах алюминий взаимодействует с другими неметаллами (серой, азотом, углеродом):
2Al + 3S 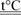 Al2
S3
(сульфидалюминия), Al2
S3
(сульфидалюминия),
2Al + N2
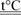 2AlN (нитридалюминия), 2AlN (нитридалюминия),
4Al + 3C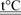 Al4
C3
(карбид алюминия). Al4
C3
(карбид алюминия).
Реакции протекают с выделением большого количества тепла.
8. Для алюминия характерны реакции алюминотермии – восстановления металлов из их оксидов алюминием.
Алюминотермия используется для получения редких металлов, образующих прочную связь с кислородом: ниобия Nb, тантала Та, молибдена Мо, вольфрама W и др.
2Al + 3WO3
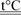 3W + Al2
O3
. 3W + Al2
O3
.
Смесь мелкого порошка Al и магнитного железняка Fe3
O4
называется термитом, при поджоге которого выделяется большое количество тепла, и температура смеси повышается до 3500°С. Этот процесс используется при термитной сварке:
8Al + 3Fe3
O4
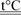 9Fe + 4Al2
O3
. 9Fe + 4Al2
O3
.
1.3. Нахождение в природе и применение
Алюминий – третий по распространённости элемент после кислорода и кремния в земной коре. В природе встречается в основном в виде:
1) алюмосиликатов;
2) бокситов;
3) корунды;
4) глинозёма.

Природные соединения алюминия:а – боксит; б – корунд; в – рубин; г – сапфир.

Основные области применения алюминия и его сплавов
Алюминий используется в производстве зеркал оптических телескопов, в электротехнике, для производства сплавов (дюралюмин, силумин) в самолёто- и автомобилестроении, для алитирования чугунных и стальных изделий с целью повышения их коррозионной стойкости, для термической сварки, для получения редких металлов в свободном виде, в строительной промышленности, для изготовления контейнеров, фольги и т.п.
Реклама

Глава
II
. Основные соединения
2.1. Оксиды алюминия
Оксид алюминия образует несколько полиморфных разновидностей, или форм, имеющих одинаковый химический состав, различное строение кристаллической решетки и, следовательно, различные свойства. При производстве глинозема наибольшее значение имеют две из этих разновидностей: α–Al2
O3
(альфа-глинозем или корунд) и γ–Al2
O3
(гамма-глинозём).
Корунд – наиболее устойчивая форма глинозёма; встречается в природе в виде бесцветных или окрашенных примесями кристаллов, а также получается искусственным путем: при кристаллизации расплавленного глинозема или нагревании гидроксидов алюминия до высокой температуры. Кристаллизуется α–Al2
O3
в тригональной системе. Корунд химически стоек но отношению к многим химическим реагентам и расплавам. Он очень медленно реагирует с растворами щелочей и кислот даже при высоких температурах. Корунд обладает высокой твердостью (9 по шкале Мооса), практически не гигроскопичен, т.е. не поглощает влаги при хранении. Плотность α–Al2
O3
4г/см3
, температура плавления 2050°С, температура кипения около 3500°С. Теплота образования α–Al2
O3
по реакции:
2Alтв+1,5O2 газ
= α–Al2
O3
составляет примерно 1675 кДж/моль, теплота плавления 25 кДж/моль, теплота испарения примерно 630 кДж/моль.
Гамма-глинозём имеет кристаллическую решётку кубической системы. В зависимости от температуры получения γ–Аl2
O3
кристаллизуется как в скрытокристаллической (высокодисперсной), так и в явнокристаллической формах. В природе γ–Al2
O3
не встречается, а образуется при нагревании одноводного гидроксида алюминия (бемита) до 500 °С. При дальнейшем нагревании γ–Al2
O3
превращается в α–Al2
O3
. Температура превращения γ–Al2
O3
в корунд зависит от химической природы стабилизирующего оксида. Если стабилизирующим оксидом является вода, то превращение происходит в температурном интервале 850–1050 °С; в присутствии оксида лития γ–Al2
O3
превращается в α–Al2
O3
при температуре выше 1500°С. Превращение γ–Al2
O3
в α–Al2
O3
сопровождается уменьшением объема иа 14,3 % и выделением 92 кД ж/моль тепла.
В отличие от α–Al2
O3
, γ–Al2
O3
хорошо растворяется как в кислотах, так и в щелочах. При 400–500 °С γ–Al2
O3
легко взаимодействует c фтористым водородом, образуя AlF3
. Скрытокристаллический γ–Al2
O3
обладает большой способностью поглощать влагу (сильно гигроскопичен), а также другие вещества. Плотность γ–Al2
O3
3,42 г/см3
, теплота образования 1583 кДж/моль.
При кристаллизации расплавленного глинозема, содержащего примеси соединении щелочных и щелочноземельных металлов, может быть получена β – разновидность оксида алюминия. Исследованиями установлено, что β–Al2
O3
не является чистым оксидом алюминия, а представляет собой химическое соединение Al2
O3
с оксидами щелочных и щелочноземельных металлов (Na2
O•11Al2
O3
, CaO•6Al2
O3
, BaO•6Al2
O3
). Твердость и плотность β–Al2
O3
меньше, чем корунда. При нагревании до температуры 1600–1700 °С происходит разложение β–Al2
O3
и превращение его в α–Al2
O3
.
В литературе имеются также указания о существовании промежуточных разновидностей оксида алюминия, которые образуются при прокаливании гидроксидов алюминия.
Технический глинозем практически представляет собой смесь α– и βглинозема. Кристаллическая решетка глинозема имеет ионное строение – построена из нонов Аl3+
и О2-
. Известны соединения алюминия с кислородом низшей валентности, в которых алюминии является одно- и двухвалентным: Al2
O и АlO. Их получают при высоких температурах восстановлением глинозема или при его термическом разложении.
2.2.
Гидроксиды алюминия
Существует несколько разновидностей гидроксидов алюминия: диаспор, бемит, гиббсит, байерит, норстрандит.
Диаспор и бемит Al2
O3
•Н2
О или AlO(OH) – полиморфные разновидности одноводного оксида алюминия, встречаются в природе в составе бокситов, кристаллизуются и ромбической системе и могут находиться в бокситах в кристаллической и скрытокристаллической формах. Элементарная ячейка кристаллической решетки диаспора и бемита состоит из ионов Al3+
, ОH-
, О2-
. Плотность диаспора 3,3 – 3,5 г/см3
, бемита 3 г/см3
. При температуре около 500 °С диаспор и бемит теряют кристаллизационную воду, превращаясь в безводный глинозем. При этом диаспор превращается в α–Al2
O3
, а бемит – в γ–Al2
O3
:
Al2
O3
•H2
O (бемит) +147,8 кДж = γ–Al2
O3
+H2
O, Al2
O3
•H2
O (диаспор) +133кДж = α–Al2
O3
+ H2
O.
В щелочных растворах диаспор и бемит растворяются только при высоких температурах, при этом диаспор растворяется значительно хуже бемита.
Гиббсит (гидраргиллит) – трехводный оксид алюминия Al2
O3
•3H2
O, или Al(OH)3
встречается в природе в составе бокситов и является промежуточным продуктом при производстве глинозема щелочными способами. В бокситах гиббсит находится в трех модификациях: аморфной, скрытокристаллической и кристаллической.
Кристаллизуется гиббсит в моноклинной системе; кристаллическая решетка его построена из ионов Al3+
и ОН-
. Плотность гиббсита 2,3–2,4 г/см3
.
В обыкновенных условиях гиббсит – наиболее устойчивая форма гидроксида алюминия.
При нагревании до 200–250 °С гиббсит теряет две молекулы кристаллизационной воды и превращается в бемит
Al2
O3
•3H2
O +152 кДж = Al2
O3
•H2
O (бемит) + 2H2
O .
При дальнейшем нагревании бемит, как мы знаем, переходит в γ-Al2
O3
, который в свою очередь переходит в α-Al2
O3
. По мнению многих исследователей, превращение гиббсита в α-Al2
O3
– более сложный процесс, и происходит он через ряд других промежуточных фаз. Гиббсит хорошо растворяется в щелочах и кислотах.
Банерит имеет такую же химическую формулу, что и гиббсит. В природе байерит не встречается. Оп может быть получен, например, при медленном пропускании углекислого газа через алюминатный раствор или при самопроизвольном разложении раствора при комнатной температуре. Плотность баиерита 2,55 г/см3
.
Байерит – неустойчивое метастабильное соединение и при обыкновенной температуре превращается в гиббсит. С повышением температуры, а также степени дисперсности стойкость байерита уменьшается. В щелочных растворах байерит растворяется лучше гиббсита.
Известна еще третья модификация трехводного оксида алюминия – нордстрандит, которая впервые была синтезирована в 1956 г. Нордстрандит представляет собой прозрачные кристаллы моноклинной системы. Плотность нордстрандита 2,436 г/см3
.
При быстром осаждении гидроксида алюминия из солевых растворов образуется студенистый осадок – алюмогель, не имеющий кристаллического строения, содержащий большое количество воды и обладающий высокой химической активностью. Алюмогель, как и банерит, неустойчив и с течением времени превращается в гиббсит. Кристаллизация алюмогеля происходит медленно и сопровождается обезвоживанием. Этот процесс называют старением алюмогеля. Высушенный при 300–400 °С алюмогель обладает хорошими адсорбционными свойствами.
2.3. Алюминаты. Алюминатные растворы
Оксид алюминия – соединение амфотерное, т.е. обладающее одновременно основными и кислотными свойствами. Поэтому оксид, а также его гидроксиды растворяются как в кислотах, так и в щелочах. При растворении гидроксида алюминия в кислотах образуются алюминиевые соли соответствующих кислот, например,
2Al(ОН)3
+3Н2
SО4
= Al2
(SO4
)3
+ 6H2
O.
При растворении гидроксида алюминия в щелочах образуются соли метаалюминиевой кислоты HAlO2
, которые носят название алюминатов, например,
Al(OH)3
+NaOH = NaA1O2
+2H2
O .
Алюмииаты образуются также при нагревании смеси оксида или гидроксида алюминия с соединениями щелочных или щелочноземельных металлов до 800°С и выше, например Аl2
O3
+ Na2
CO3
= 2NaAlO2
+CO2
. Часто формулу алюмината пишут иначе: Na2
O•Al2
O3
.
Как мы знаем, скорость растворения гндроксидов алюминия в щелочах и кислотах неодинакова. Наиболее быстро растворяется гиббсит, медленнее бемит и наиболее медленно диаспор. Активность гидроксидов алюминия зависит не только от их природы, но и от условия получения и степени дисперсности. С повышением степени дисперсности увеличивается поверхность соприкосновения гидроксида с растворителем, т. е. активная поверхность вещества, и скорость растворения гидроксида возрастает. Растворы алюминатов в щелочном растворе получили название алюминатных растворов. В производстве глинозема приходится иметь дело с растворами алюмината натрия, а в некоторых случаях и калия.
На природу алюминатных растворов существует несколько взглядов. Согласно наиболее распространенному из них, алюминатный раствор представляет собой раствор алюмината натрия (или калия) как химического соединения NaAlO2
, т.е. является истинным (ионным) раствором. Значит, алюминат натрия можно рассматривать как соль, образованную слабой кислотой (гидроксид алюминия) и сильным основанием (едкий натр).
Гидроксид алюминия переходит в раствор в виде катиона Al3+
при рН<4 и в виде аниона [Al(ОН)4
]-
при рН>12. Следовательно, для растворения гидроксида алюминия необходимо добавлять кислоту до тех пор, пока рH раствора не станет меньше 4, или добавлять щелочь до достижения рН больше 12.
Алюминат же натрия находится в растворе в виде катионов Na+
и алюминатных анионов, состав которых точно не известен.
Чаще всего состав этих анионов выражают следующими формулами: [Al(ОН)4
]-
, АlO2-
, АlO(ОН)2
-
. Ряд исследователей допускает образование в алюминатных растворах многозарядных анионов.
Из сказанного следует, что уравнения процессов растворения алюмината натрия н его гидролиза точнее было бы писать в ионной форме. Однако ввиду того, что состав анионов точно еще не установлен и зависит от концентрации раствора, мы в дальнейшем будем принимать для алюмината натрия в растворе формулу NaAlO2
. По мнению ряда исследователей, в алюминатном растворе в незначительном количестве могут присутствовать также коллоидные частицы гидроксида алюминия.
Одним из характерных свойств алюминатных растворов является их способность самопроизвольно разлагаться с выделением в осадок гидроксида алюминия. Поэтому промышленные алюминатные растворы содержат некоторое количество свободной щелочи, которая делает алюминатный раствор более стойким. Состав алюминатных растворов прежде всего характеризуется концентрацией глинозема Al2
O3
и щелочи Na2
O. Кроме этих основных компонентов, алюминатные растворы содержат в виде различных химических соединений примеси кремнезема, серы, хлора, железа, фтора, галлия, ванадия, органических веществ и др.
Различают следующие виды щелочи в алюминатных растворах: титруемая, карбонатная, каустическая, сульфатная и общая. Концентрация титруемой щелочи Na2
Оt
определяется титрованием раствора соляной кислотой: при этом оттитровывается (определяется) оксид натрия, находящийся в растворе в виде каустика NaOH, алюмината натрия NaA1O2
, соды Na2
CO3
, силиката натрия Na2
SiO3
, сульфита натрия Na2
SO3
и частично фторида натрия NaF и тиосульфата натрия Na2
S2
O3
. Карбонатная (углекислая) щелочь Na2
Oy
находится в алюминатных растворах в виде соды. Концентрация каустической щелочи Na2
Oк
; определяется как разность между титруемой щелочью и карбонатной. Сульфатная щелочь Na2
Oc
находится в растворе в виде сульфата натрия Na2
SO4
.
В алюминатных растворах наряду с натриевой может присутствовать калиевая щелочь. Сумму концентраций натриевой и калиевой щелочи обычно обозначают через R2
O, причем К2
O в этой сумме пересчитывается на Na2
O.
Концентрацию отдельных компонентов в алюмииатиых растворах обычно выражают в граммах на литр раствора (г/л), реже в процентах. Для перехода от концентрации в процентах (с) к концентрации в граммах на литр (a) пользуются формулой а = 10ср, где р – плотность раствора, г/см3
.
Заключение
В заключении надо сказать, что алюминий содержится в любой природной воде. Попадает в воду естественным путем (растворение глины и алюмосиликатов) и из вредных выбросов производств. Соединения алюминия используются при водоподготовке на водоканалах и крупных производствах. Содержание алюминия в поверхностных водах колеблется в пределах от 1 до 100 мкг/дм3
и сильно зависит от степени закисления почв. В некоторых кислых вода его концентрация может достигать нескольких граммов на дм3
.
Присутствие в воде алюминия в концентрациях, превышающих 0,2 мг/л способно вызвать выпадение в осадок хлопьев гидрохлорида алюминия, а также изменение цветности воды. Иногда такие проблемы могут возникать уже при концентрациях алюминия в 0,1 мг/л.
Алюминий попадет в организм человека в основном с пищей. Например, в чае содержание алюминия в 200 раз больше, чем в воде в которой он заварен. Другие источники попадания алюминия в организм: вода, воздух, лекарства, посуда, дезодоранты. Из воды поступает 5-8%. Эксперты ФАО/ВОЗ установили величину переносимого суточного потребления (ПСП) алюминия на уровне 1мг/кг веса.
Метаболизм алюминия у человека изучен недостаточно, однако известно, что неорганический алюминий плохо всасывается и большая часть его выводится с мочой. Алюминий обладает низкой токсичностью для лабораторных животных. Тем не менее, отдельные исследования показывают, что токсичность алюминия проявляется во влиянии на обмен веществ, в особенности минеральный, на функцию нервной системы, в способности действовать непосредственно на клетки - их размножение и рост. Избыток солей алюминия снижает задержку кальция в организме, уменьшает адсорбцию фосфора, одновременно в 10-20 раз увеличивается содержание алюминия в костях, печени, семенниках, мозге и в паращитовидной железе. К важнейшим клиническим проявлениям нейротоксического действия относят нарушение двигательной активности, судороги, снижение или потерю памяти, психопатические реакции. В некоторых исследованиях алюминий связывают с поражениями мозга, характерными для болезни Альцгеймера (в волосах больных наблюдается повышенное содержание алюминия). Однако имеющиеся на данный момент у Всемирной Организации Здравоохранения эпидемиологические и физиологические данные не подтверждают гипотезу о причинной роли алюминия в развитии болезни Альцгеймера. Поэтому ВОЗ не устанавливает величины концентрации алюминия по медицинским показателям, но в то же время наличие в питьевой воде до 0,2 мг/л алюминия обеспечивает компромисс между практикой применения солей алюминия в качестве коагулянтов и органолептическими параметрами питьевой воды.
Алюминий является постоянной составной частью клеток и тканей организма. В среднем его содержание в теле человека составляет 70 - 190 мг%, в цельной крови - 0,5 - 0,7 мг/л, в плазме - 85,24 моль/л.
В основном алюминий поступает в организм человека с растительной пищей, незначительные количества вдыхаются с естественной пылью и промышленными выбросами. Всасывание его зависит от присутствия в пище ионов фтора, что делает алюминий более растворимым.
Больше всего алюминия содержится в легких, печени, костях, головном мозге. Выводится он через желудочно-кишечный тракт. В малых концентрациях алюминий участвует в реакциях образования фосфатных и белковых комплексов, а также в построении эпителиальной и соединительной ткани, в процессах регенерации костной ткани, воздействуют на активность пищеварительных желез и ферментов.
Алюминий входит в состав таких ферментов как щелочная фосфотаза, холиннэстераза. Кроме того, он может вытеснять из металлопротеидов и некоторых ферментов магний, кальций, натрий, железо и, тем самым, изменять функцию многих метаболических систем - замедлять развитие тканей, тормозить синтез гемоглобина, нарушать функции центральной нервной системы.
Одним из возможных механизмов нейротоксического действия алюминия является его влияние на метаболический эффект кальция и гомеостаз последнего в нейронах головного мозга. Увеличение концентрации кальция в синаптоплазме деполяризованных нервных окончаний сопровождается повышением проницаемости митохондриальной мембраны для ацетил-КоА. Этот процесс обеспечивает поддержание высокого уровня ацетил-КоА в синаптоплазме, что необходимо для синтеза ацетилхолина.
Алюминий-дефицитных состояний у человека не зарегистрировано.
Список литература
1. Ахметов Н.С. Химия 9 класс: учеб. для общеобразоват. учеб. заведений. – 2-е изд. – М.: Просвещение, 1999. – 175 с.: ил.
2. Габриелян О.С. Химия 9 класс: учеб. для общеобразоват. учеб. заведений. – 4-е изд. – М.: Дрофа, 2001. – 224 с.: ил.
3. Габриелян О.С. Химия 8-9 классы: метод. пособие. – 4-е изд. – М.: Дрофа, 2001. – 128 с.
4. Кременчугская М. Химия: Справочник школьника. – М.: Филол. общ-во «СЛОВО»: ООО «Изд-во АСТ», 2001. – 478 с.
5. Крицман В.А. Книга для чтения по неорганической химии. – М.: Просвещение, 1986. – 273 с.
6. Протасов П.В. Элементы в клетках организма. – М.: Просвещение, 1999. – 687 с.
7. Тарасова Л.И., Нестеров В.А. Металлургия в жизни человека. – М.: Просвещение, 1990. – 465 с.
|